化学人教版(2019)必修第二册5.3无机非金属材料(共78张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.3无机非金属材料(共78张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-28 21:05:47 | ||
图片预览









文档简介
(共78张PPT)
人教版必修第二册
第三节 无机非金属材料
思考与交流:
同学们想一想这些地标建筑可能会用到哪些材料,
材料是人类赖以生存和发展的物质基础,
人类使用的材料除了金属材料,还有无机非金属材料等。
从组成上看,许多无机非金属材料含有硅、氧等元素,具有耐高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。
随着工业生产和社会发展对材料性能要求的提高,一批新型无机非金属材料相继诞生,成为航空、航天、信息和新能源等高技术领域必需的材料。
陶瓷
玻璃
水泥
一、传统无机非金属材料
以含硅物质为原料,经加工制得硅酸盐产品的工业称为硅酸盐工业。
如制造水泥、玻璃、陶瓷等产品的工业都属硅酸盐工业。
硅酸盐工业的特点:
(1)原料:
(2)反应条件:
(3)反应原理:
(4)生成物:
含硅的物质。
高温。
复杂的物理、化学变化。
硅酸盐。
一、传统无机非金属材料
1、硅酸盐材料
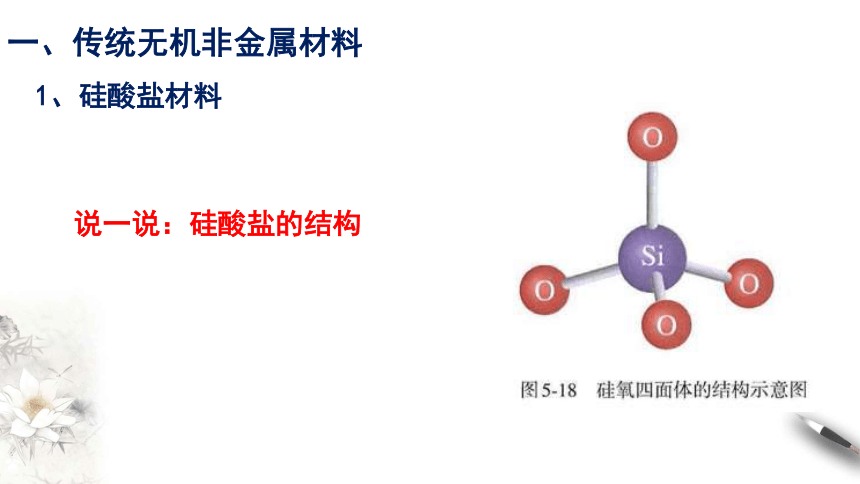
说一说:硅酸盐的结构
一、传统无机非金属材料
1、硅酸盐材料
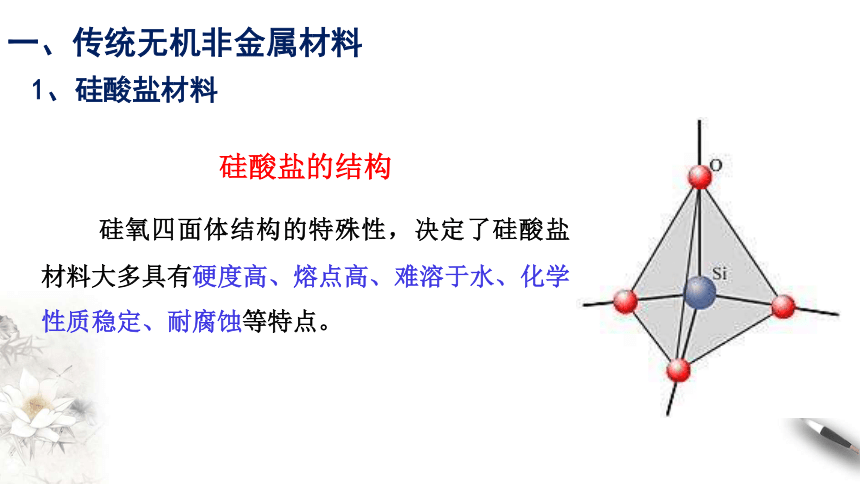
硅酸盐的结构
在硅酸盐中,Si 和 O 构成了硅氧四面体。
每个Si 结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。
一、传统无机非金属材料
1、硅酸盐材料
硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。
硅酸盐的结构
1、硅酸盐材料
一、传统无机非金属材料
硅酸盐是由硅、氧和金属元素组成的化合物的总称。
(1)硅酸盐概述
硅酸盐是一类结构复杂的物质,一般都不溶于水,化学性质很稳定
1、硅酸盐材料
一、传统无机非金属材料
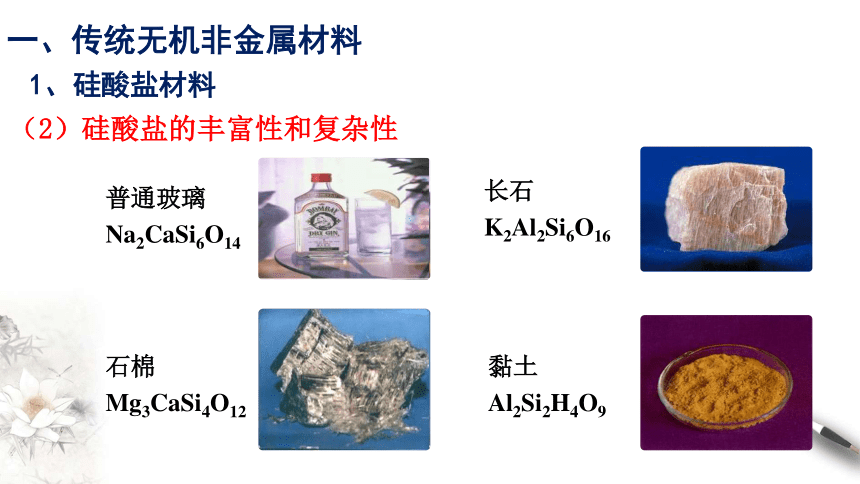
(2)硅酸盐的丰富性和复杂性
普通玻璃
Na2CaSi6O14
长石
K2Al2Si6O16
石棉
Mg3CaSi4O12
黏土
Al2Si2H4O9
1、硅酸盐材料
一、传统无机非金属材料
(3)硅酸盐的表示方法:
①化学式法(表示组成简单的硅酸盐):
如:硅酸钠:Na2SiO3
②氧化物法(表示复杂的硅酸盐):
用二氧化硅和金属氧化物的形式来表示其组成
如:硅酸钠:Na2O · SiO2
硅酸钙: CaO · SiO2
1、硅酸盐材料
一、传统无机非金属材料
硅酸钙:CaSiO3
氧化物法书写原则
各元素原子总个数比符合原来的组成;
如:CaMg3Si4O12:
CaO·3MgO·4SiO2
Al2(Si2O5)(OH)4:
Al2O3·2SiO2·2H2O
KAlSi3O8:
K2O·Al2O3·6SiO2
1、硅酸盐材料
一、传统无机非金属材料
(3)硅酸盐的表示方法:
分数化整;
金属氧化物、二氧化硅、水;
按金属活动顺序表依次排列。
(4)最简单的硅酸盐——Na2SiO3
①物理性质
白色固体,可溶于水,其水溶液俗称水玻璃,有黏性。
多数硅酸盐难溶于水,常见易溶于水的硅酸盐有Na2SiO3、K2SiO3等。
1、硅酸盐材料
一、传统无机非金属材料
②化学性质
---------易与酸反应。
与强酸反应:
Na2SiO3+2HCl === 2NaCl+H2SiO3↓
与CO2反应:
CO2不足,
Na2SiO3+CO2+H2O === Na2CO3+H2SiO3↓
CO2过量,
Na2SiO3+2CO2+2H2O === 2NaHCO3+H2SiO3↓
(4)最简单的硅酸盐——Na2SiO3
1、硅酸盐材料
一、传统无机非金属材料
③用途:制备硅胶和防火剂的原料
注意
1. Na2SiO3 硅酸钠 ——俗称 泡花碱
——纯净物
2. Na2SiO3 硅酸钠的水溶液 ——俗称水玻璃
——混合物
3.浓硝酸和浓盐酸以体积比3:1的比例混合而成的溶液,
可以使金溶解——王水
——混合物
口诀:三言(盐)一笑(硝)
硅酸钠溶液加热失水后会变成白色发泡状固体,
另外硅酸钠溶液呈碱性
泡花碱不是碱,是盐,但它的水溶液呈碱性。
一、传统无机非金属材料
2、硅酸
(1)物理性质
硅酸是一种白色粉末状的固体,不溶于水。
一、传统无机非金属材料
2、硅酸
(2)化学性质
硅酸是一种难溶于水的弱酸,酸性比碳酸 H2CO3 弱,
①H2SiO3的弱酸性:
酸性太弱,不能使指示剂变色,只能与强碱发生中和反应。
一、传统无机非金属材料
2、硅酸
(2)化学性质
②H2SiO3的不稳定性:
不稳定(比 H2CO3 稳定),受热易分解。
H2SiO3 ==== SiO2 + H2O
思考与交流
我们知道二氧化碳与水反应生成碳酸,
但是SiO2不能与水直接化合成H2SiO3,这是一个特例。
SiO2不能直接和水化合成H2SiO3,那怎样制备H2SiO3呢?
③硅酸的制备(强酸制弱酸):
Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓
Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3 ↓
一、传统无机非金属材料
2、硅酸
(2)化学性质
注意:如果有特殊注明说是胶体
↓改为(胶体)
SiO32- + 2H+ === H2SiO3↓
SiO32- + H2O + CO2 === CO32- + H2SiO3↓
↓改为(胶体)
硅胶可做干燥剂
硅胶干燥剂主要有硅胶颗粒组成的,
其特点是运用硅胶本身所具有的多个细孔
小孔吸附空气中的水分,以达到除湿的目的。而且可以重复使用。
——属于物理吸附
唐三彩
陶瓷
原料
历史
应用
黏土(主要成分为含水的铝硅酸盐)
青花瓷、唐三彩
生产建筑材料、
绝缘材料、
日用器皿、
卫生洁具等
China
反应条件
高温烧结
瓷都
(Al2O3·2SiO2·2H2O )
反应原理:复杂的物理、化学变化
(1)陶瓷
一、传统无机非金属材料
古代陶瓷工艺流程:
混合-成型-干燥-烧结-冷却
机场出口处的蓝色玻璃隔离墙
红色玻璃产品
玻璃
原料
工业设备
应用
纯碱、石灰石和石英砂
玻璃窑
主要成分
生产建筑材料、
光学仪器、
各种器皿,
制造玻璃纤维用于高强度复合材料等
Na2SiO3 、CaSiO3、SiO2
(2)玻璃
主要特性:混合物,无固定的熔点
(Na2CO3、CaCO3、SiO2)
一、传统无机非金属材料
普通玻璃是以纯碱、石灰石和石英砂为原料,经混合、粉碎,
在玻璃窑中熔融,发生复杂的物理变化和化学变化而制得。
你能写出发生反应的化学方程式吗
【思考与交流】
高温
SiO2 + Na2CO3 Na2SiO3 + CO2↑
SiO2 + CaCO3 CaSiO3 + CO2↑
高温
制备玻璃过程的化学方程式为?
微思考
1.制造玻璃时发生以下反应:Na2CO3+SiO2 ==== Na2SiO3+CO2↑。
该反应能否说明H2SiO3的酸性比H2CO3强?为什么?
提示 不能。SiO2与Na2CO3反应,是在高温下,且生成的产物是CO2气体,可以脱离反应体系,并不能说明H2SiO3酸性强于H2CO3。
强酸制弱酸都是在溶液中进行的
高温
【资料卡片】
生产中采用不同的原料和工艺,可以制得多种具有不同性能和用途的玻璃。
例如,用含有铅的原料制造的光学玻璃,透光性好,折射率高,可以用来制造眼镜、照相机和光学仪器的透镜;加入硼酸盐制成耐化学腐蚀、耐温度急剧变化的玻璃,可用于实验室使用的玻璃仪器;加入一些金属氧化物或盐可以得到彩色玻璃,常用于建筑和装饰。
拓展延伸
1.石英玻璃——成分为SiO2,以纯净的石英为主要原料制成。
用途比如化学仪器
几种常见玻璃
2.钢化玻璃——普通玻璃在电炉中加热软化,然后急速冷却而成,机械强度是普通玻璃的4~6倍。用途比如汽车,火车窗玻璃等
3.有色玻璃——普通玻璃中加入一些金属氧化物,
如Cu2O:红色玻璃,CuO:蓝绿色玻璃,
Co2O3:蓝色玻璃,MnO2:紫色玻璃等。
4.光学玻璃——透光性能好,有折光和色散性。
用途比如眼镜片,照相机,显微镜,望远镜用凸凹透镜等光学仪器
水泥是最常用的建筑材料下图是1949—1998年我国水泥产量示意图
水泥
水泥
原料
工业设备
黏土和石灰石
水泥回转窑
混凝土
水泥、沙子和碎石等与水混合
适量石膏的作用
条件
高温煅烧
调节水泥硬化速率
(3)水泥
( Al2O3·2SiO2·2H2O 、 CaCO3 )
主要成分:
一、传统无机非金属材料
硅酸二钙(2CaO SiO2)
铝酸三钙(3CaO Al2O3)等
硅酸三钙(3CaO SiO2)、
归纳总结
都在高温下,发生了复杂的物理和化学变化。
玻璃、水泥、陶瓷生产的共同点:
原料都有含硅元素的物质,
产品都含有硅酸盐,且都是混合物。
一、传统无机非金属材料
1.传统的硅酸盐材料有什么优、缺点?
2.新型无机非金属材料有哪些特性?
优点:抗腐蚀、耐高温; 缺点:质脆、经不起热冲击。
① 承受高温,强度高。 ② 具有光学特性。
③ 具有电学特性。 ④ 具有生物功能。
二、新型无机非金属材料
1 、硅
说一说:根据元素周期表中硅的位置,
为什么硅能成为应用最为广泛的半导体材料
第三周期、第IV A族
请画出碳和硅的原子结构示意图
分析:既不易失去电子,又不易得到电子,主要形成四价的化合物。
Si位于元素周期表第三周期,第ⅣA族,
处于金属与非金属过渡位置,为半导体材料
二、新型无机非金属材料
1 、硅
自然界中的硅:
硅酸盐矿石
水晶( SiO2 )
玛瑙( SiO2 )
二、新型无机非金属材料
1、硅
(1)硅的含量及存在
硅在自然界的存在形态:
氧化物
和硅酸盐
没有游离态,只有化合态
-----二氧化硅
硅在地壳中含量仅次于氧,居第2位,
硅的氧化物和硅酸盐构成了地壳中大部分的岩石、沙子、土壤,约占地壳质量的90%以上。
硅是一种亲氧元素,在自然界它总是与氧相互化合的。
(2)硅的物理性质
硅单质:灰黑色、有金属光泽、硬而脆的固体,是很好的半导体材料!
二、新型无机非金属材料
1、硅
二、新型无机非金属材料
1、硅
(3)硅的化学性质
①与非金属单质反应
Si + 2F2 === SiF4
Si + 2Cl2 ==== SiCl4
Si + O2 ==== SiO2
Si + C ==== SiC
硅在常温下不活泼,加热条件下能与 O2 , Cl2 等反应:
与 O2:
与 Cl2:
与 C:
与 F2:
高温
常温下为无色,有毒,有刺激性臭味的气体。
碳化硅,俗名金刚砂
二、新型无机非金属材料
1、硅
(3)硅的化学性质
②与酸、碱反应
非金属单质一般不与非氧化性酸反应,但 Si 能与 HF 反应:
硅与强碱溶液反应生成氢气:
Si + 4HF === SiF4↑ + 2H2↑
Si + 2NaOH + H2O === Na2SiO3 + 2H2↑
常见单质中能与NaOH溶液反应产生H2的有金属Al,非金属Si。
二、新型无机非金属材料
1、硅
(4)单质 Si 的制备
SiO2 +2C ==== Si + 2CO↑
高温
粗硅
SiCl4+2H2 ===== Si+4HCl
高温
(高纯硅 99.9999999%)
提纯硅
Si + 2Cl2 === SiCl4
高温
粗硅
制粗硅
在高温下让粗硅(Si)与氯气(Cl2)反应,
其产物在高温下被氢气(H2)还原而得到较纯的硅
【资料卡片】
高纯硅的制备
工业上制备高纯硅,一般需要先制得纯度为98%左右的粗硅,
再以其为原料制备高纯硅。
例如,可以将粗硅转化为三氯硅烷(SiHCl3),再经氢气还原得到高纯硅。
工业上高纯硅的制备:
写一写:根据高纯硅的制备流程,写一写相应的化学方程式。
工业上高纯硅的制备:
SiHCl3+H2 ======= Si+3HCI
1100℃
三氯硅烷
SiO2+2C ======= Si+2CO
1800~2000℃
Si+3HCl ======= SiHCl3+H2
300℃
H2 和 HCl 可以循环利用
三氯硅烷
2.单质硅在常温下化学性质不活泼,所以硅在自然界中以游离态存在,这种说法是否正确?
提示 错误。硅是一种亲氧元素,在自然界中总是与氧相互化合,
以熔点很高的氧化物及硅酸盐的形式存在。
所以自然界中无游离态的硅存在。
微思考
SiO2是自然界中沙子、石英的主要成分。
天然二氧化硅叫硅石;
结晶的二氧化硅叫石英。
二氧化硅( 硅石 )存在
硅石
结晶形(石英晶体)
无定形——硅藻土
水晶
玛瑙
无色透明
彩色环带或层状
二氧化硅中没有单个分子,用SiO2来表示二氧化硅的组成,
表示Si 原子与O原子个数比为1:2,所以不是分子式而是化学式。
[SiO2]四面体结构
立体网状结构决定了SiO2具有优良的物理和化学性质
[ 资料卡片 ]
SiO2
SiO2晶体中没有SiO2分子存在,只存在硅氧原子。因此性质稳定
SiO2是不溶于水的固体,熔、沸点高,硬度大。
(1)物理性质
(2)化学性质
SiO2虽然不溶于水,但它是一种酸性氧化物
二、新型无机非金属材料
2、二氧化硅
①不溶于水,不能与水反应得到硅酸
②与碱性氧化物反应: 比如与CaO
SiO2 + CaO ==== CaSiO3
③与 NaOH 反应:
SiO2 + 2NaOH === Na2SiO3 + H2O
NaOH 保存不用玻璃塞,
而用橡胶塞。
玻璃成分中含有二氧化硅,易于氢氧化钠溶液反应生成硅酸钠溶液,从而使瓶塞与瓶壁黏合在一起而难以打开。
所以盛NaOH溶液的试剂瓶一般是玻璃瓶,橡胶塞。
二、新型无机非金属材料
2、二氧化硅
④与盐反应
SiO2 + Na2CO3 Na2SiO3 + CO2↑
高温
SiO2 + CaCO3 CaSiO3 + CO2↑
高温
二、新型无机非金属材料
2、二氧化硅
(3)二氧化硅的特性
与 HF 反应:
SiO2 + 4HF === SiF4↑+ 2H2O
除氢氟酸外,SiO2一般不与其他酸反应。
玻璃中含有SiO2 ,所以HF可以用来刻蚀玻璃。
二、新型无机非金属材料
2、二氧化硅
半导体材料
(1) 硅的应用
集成电路、晶体管、硅整流器、太阳能电池,计算机芯片等
二、新型无机非金属材料
3、硅和二氧化硅的用途
二氧化硅可用来生产光导纤维。
光导纤维的通信容量大,抗干扰性能好,
传输的信号不易衰减,能有效提高通信效率。
二、新型无机非金属材料
3、硅和二氧化硅的用途
(2) 二氧化硅的应用
用石英、玛瑙制作饰物。
二、新型无机非金属材料
3、硅和二氧化硅的用途
(2) 二氧化硅的应用
制作玻璃及光学仪器
玛瑙研钵
石英坩埚
玻璃仪器
二、新型无机非金属材料
3、硅和二氧化硅的用途
(2) 二氧化硅的应用
硅和二氧化硅的用途:
硅太阳能电池板
计算机芯片
二氧化硅制光导纤维
结构
性能
高温抗氧化性能
碳原子和硅原子通过共价键连接
硬度大
砂纸和砂轮的磨料
耐高温结构材料
耐高温半导体材料
碳化硅陶瓷
二、新型无机非金属材料
4、新型陶瓷
碳化硅(SiC)俗称金刚砂,
几种典型的新型无机非金属材料
①高温结构陶瓷特点:耐高温、耐腐蚀、耐磨蚀、抗氧化等,用于火箭发动机,汽车发动机和高温电极材料,如氮化硅(Si3N4)和碳化硅(SiC--金刚砂)。
②压电陶瓷特点:主要有钛酸盐和锆酸盐,可实现机械能和电能的相互转化,用于滤波器、扬声器、超声波探伤器和但火气等。
③透明陶瓷:氧化铝、氧化钇、氮化铝、氟化钙等类型;
特点:耐高温、绝缘性好,用于高压钠灯,激光器和高温探窗。
④超导陶瓷:特点为某临界温度下电阻为0,具有超导性,可用于电力、交通、医疗等。
科学、技术、社会
透明陶瓷
新 型 陶 瓷 材 料
习惯上把陶瓷(ceramics)分为传统陶瓷和特种陶瓷。
传统陶瓷是以粘土、长石、石英等天然矿物为原料经烧结而成的。
特种陶瓷是以人工合成的氧化物、氮化物、碳化物、硅化物、硼化物超细微粒为原料特制而成。又称精细陶瓷、精密陶瓷。
氧化铝陶瓷
二氧化锆
结构陶瓷
氮化硅陶瓷
几种新型陶瓷
二、新型无机非金属材料
4、新型陶瓷
碳纳米材料是近年来人们十分关注的一类新型无机非金属材料,主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广阔的应用前景。
二、新型无机非金属材料
5、碳纳米材料
——富勒烯
富勒烯是由碳原子构成的一系列笼形分子的总称,其中的C60是富勒烯的代表物。C60的发现为纳米科学提供了重要的研究对象,开启了碳纳米材料研究和应用的新时代。
二、新型无机非金属材料
5、碳纳米材料
——碳纳米管
碳纳米管可以看成是由石墨片层卷成的管状物,具有纳米尺度的直径。碳纳米管的比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
二、新型无机非金属材料
5、碳纳米材料
——石墨烯
石墨烯是只有一个碳原子直径厚度的单层石墨,其独特的结构使其电阻率低、热导率高,具有很高的强度。作为一种具有优异性能的新型材料,石墨烯在光电器件、超级电容器、电池和复合材料等方面的应用研究正在不断深入。
二、新型无机非金属材料
5、碳纳米材料
二、新型无机非金属材料
5、碳纳米材料
富 勒 烯-------笼形分子,以C60为代表.
碳纳米管-------石墨片层管状物,比表面积大,具有高强度和电学性能,用于生产复合材料,电池、传感器。
石 墨 烯-------单层石墨,电阻率低,热导率高,强度高用于光电器元件、超级电容器、电池和复合材料等。
碳纳米汽车
二、新型无机非金属材料
5、碳纳米材料
1.下列叙述错误的是( )
A.硅在自然界中主要以单质形式存在 B.硅是应用最广泛的半导体材料
C.高纯度的硅可用于制造计算机芯片 D.二氧化硅可用于生产玻璃
课堂练习
A
课堂练习
2.有下列物品或设备:①陶瓷餐具②砖瓦③混凝土桥墩④门窗玻璃
⑤水晶镜片⑥石英钟⑦水晶项链⑧硅太阳能电池⑨光导纤维⑩计算机芯片
(1)使用了硅单质的是______.(用序号填写,下同)
(2)使用了SiO2的是_________.
(3)使用了硅酸盐材料的是____________.
⑧⑩
③④⑤⑥⑦⑨
①②③④
3.氢氟酸是HF的水溶液,可与SiO2发生反应成SiF4和H2O。
请写出该反应的化学方程式。
想一想为什么可以用氢氟酸溶蚀玻璃生产磨砂玻璃。
答案:SiO2+4HF=SiF4↑+2H2O。
玻璃种含有二氧化硅,所以可以用来制造磨砂玻璃
课堂练习
4.SiO2是一种酸性氧化物,能与强碱溶液反应。
例如,SiO2与NaOH反应可生成Na2SiO3。
Na2SiO3的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,
可以用作粘合剂和防火剂。实验室盛放碱溶液的试剂瓶应使用橡胶塞,
而不用玻璃塞。请解释原因,并写出相关反应的化学方程式。
课堂练习
答案:用玻璃塞会导致瓶塞瓶口黏结在一起SiO2+2NaOH=Na2SiO3+H2O
5.氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,
电绝缘性好,化学性质稳定,但生产成本较高。
(1)根据以上描述,氮化硅可能有哪些用途:_____(填字母)
a.制作坩埚 b.用作建筑陶瓷 c.制作耐高温轴承 d.制作切削刀具
(2)请写出氮和硅的原子结构示意图,并根据元素周期律知识,写出氮化硅的化学式。
课堂练习
答案:(1)a,c,d;(2) N: Si: Si3N4
(3)氮化硅在19世纪已经被化学家合成出来,但直到100多年后才逐
渐应用于工业领域。材料的基础研究和实际应用之间存在着一定距
离,你认为二者之间的关系是怎样的?请查阅相关资料,与同学交
流你的观点。
课堂练习
答案:①二者作用是相辅相成的;
②基础研究的成果指导着应用研究的进行;
③实际需要和应用研究是基础研究的推动力;
④应用研究的结果会丰富已有的理论。
人教版必修第二册
第三节 无机非金属材料
思考与交流:
同学们想一想这些地标建筑可能会用到哪些材料,
材料是人类赖以生存和发展的物质基础,
人类使用的材料除了金属材料,还有无机非金属材料等。
从组成上看,许多无机非金属材料含有硅、氧等元素,具有耐高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。
随着工业生产和社会发展对材料性能要求的提高,一批新型无机非金属材料相继诞生,成为航空、航天、信息和新能源等高技术领域必需的材料。
陶瓷
玻璃
水泥
一、传统无机非金属材料
以含硅物质为原料,经加工制得硅酸盐产品的工业称为硅酸盐工业。
如制造水泥、玻璃、陶瓷等产品的工业都属硅酸盐工业。
硅酸盐工业的特点:
(1)原料:
(2)反应条件:
(3)反应原理:
(4)生成物:
含硅的物质。
高温。
复杂的物理、化学变化。
硅酸盐。
一、传统无机非金属材料
1、硅酸盐材料
说一说:硅酸盐的结构
一、传统无机非金属材料
1、硅酸盐材料
硅酸盐的结构
在硅酸盐中,Si 和 O 构成了硅氧四面体。
每个Si 结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。
一、传统无机非金属材料
1、硅酸盐材料
硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。
硅酸盐的结构
1、硅酸盐材料
一、传统无机非金属材料
硅酸盐是由硅、氧和金属元素组成的化合物的总称。
(1)硅酸盐概述
硅酸盐是一类结构复杂的物质,一般都不溶于水,化学性质很稳定
1、硅酸盐材料
一、传统无机非金属材料
(2)硅酸盐的丰富性和复杂性
普通玻璃
Na2CaSi6O14
长石
K2Al2Si6O16
石棉
Mg3CaSi4O12
黏土
Al2Si2H4O9
1、硅酸盐材料
一、传统无机非金属材料
(3)硅酸盐的表示方法:
①化学式法(表示组成简单的硅酸盐):
如:硅酸钠:Na2SiO3
②氧化物法(表示复杂的硅酸盐):
用二氧化硅和金属氧化物的形式来表示其组成
如:硅酸钠:Na2O · SiO2
硅酸钙: CaO · SiO2
1、硅酸盐材料
一、传统无机非金属材料
硅酸钙:CaSiO3
氧化物法书写原则
各元素原子总个数比符合原来的组成;
如:CaMg3Si4O12:
CaO·3MgO·4SiO2
Al2(Si2O5)(OH)4:
Al2O3·2SiO2·2H2O
KAlSi3O8:
K2O·Al2O3·6SiO2
1、硅酸盐材料
一、传统无机非金属材料
(3)硅酸盐的表示方法:
分数化整;
金属氧化物、二氧化硅、水;
按金属活动顺序表依次排列。
(4)最简单的硅酸盐——Na2SiO3
①物理性质
白色固体,可溶于水,其水溶液俗称水玻璃,有黏性。
多数硅酸盐难溶于水,常见易溶于水的硅酸盐有Na2SiO3、K2SiO3等。
1、硅酸盐材料
一、传统无机非金属材料
②化学性质
---------易与酸反应。
与强酸反应:
Na2SiO3+2HCl === 2NaCl+H2SiO3↓
与CO2反应:
CO2不足,
Na2SiO3+CO2+H2O === Na2CO3+H2SiO3↓
CO2过量,
Na2SiO3+2CO2+2H2O === 2NaHCO3+H2SiO3↓
(4)最简单的硅酸盐——Na2SiO3
1、硅酸盐材料
一、传统无机非金属材料
③用途:制备硅胶和防火剂的原料
注意
1. Na2SiO3 硅酸钠 ——俗称 泡花碱
——纯净物
2. Na2SiO3 硅酸钠的水溶液 ——俗称水玻璃
——混合物
3.浓硝酸和浓盐酸以体积比3:1的比例混合而成的溶液,
可以使金溶解——王水
——混合物
口诀:三言(盐)一笑(硝)
硅酸钠溶液加热失水后会变成白色发泡状固体,
另外硅酸钠溶液呈碱性
泡花碱不是碱,是盐,但它的水溶液呈碱性。
一、传统无机非金属材料
2、硅酸
(1)物理性质
硅酸是一种白色粉末状的固体,不溶于水。
一、传统无机非金属材料
2、硅酸
(2)化学性质
硅酸是一种难溶于水的弱酸,酸性比碳酸 H2CO3 弱,
①H2SiO3的弱酸性:
酸性太弱,不能使指示剂变色,只能与强碱发生中和反应。
一、传统无机非金属材料
2、硅酸
(2)化学性质
②H2SiO3的不稳定性:
不稳定(比 H2CO3 稳定),受热易分解。
H2SiO3 ==== SiO2 + H2O
思考与交流
我们知道二氧化碳与水反应生成碳酸,
但是SiO2不能与水直接化合成H2SiO3,这是一个特例。
SiO2不能直接和水化合成H2SiO3,那怎样制备H2SiO3呢?
③硅酸的制备(强酸制弱酸):
Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓
Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3 ↓
一、传统无机非金属材料
2、硅酸
(2)化学性质
注意:如果有特殊注明说是胶体
↓改为(胶体)
SiO32- + 2H+ === H2SiO3↓
SiO32- + H2O + CO2 === CO32- + H2SiO3↓
↓改为(胶体)
硅胶可做干燥剂
硅胶干燥剂主要有硅胶颗粒组成的,
其特点是运用硅胶本身所具有的多个细孔
小孔吸附空气中的水分,以达到除湿的目的。而且可以重复使用。
——属于物理吸附
唐三彩
陶瓷
原料
历史
应用
黏土(主要成分为含水的铝硅酸盐)
青花瓷、唐三彩
生产建筑材料、
绝缘材料、
日用器皿、
卫生洁具等
China
反应条件
高温烧结
瓷都
(Al2O3·2SiO2·2H2O )
反应原理:复杂的物理、化学变化
(1)陶瓷
一、传统无机非金属材料
古代陶瓷工艺流程:
混合-成型-干燥-烧结-冷却
机场出口处的蓝色玻璃隔离墙
红色玻璃产品
玻璃
原料
工业设备
应用
纯碱、石灰石和石英砂
玻璃窑
主要成分
生产建筑材料、
光学仪器、
各种器皿,
制造玻璃纤维用于高强度复合材料等
Na2SiO3 、CaSiO3、SiO2
(2)玻璃
主要特性:混合物,无固定的熔点
(Na2CO3、CaCO3、SiO2)
一、传统无机非金属材料
普通玻璃是以纯碱、石灰石和石英砂为原料,经混合、粉碎,
在玻璃窑中熔融,发生复杂的物理变化和化学变化而制得。
你能写出发生反应的化学方程式吗
【思考与交流】
高温
SiO2 + Na2CO3 Na2SiO3 + CO2↑
SiO2 + CaCO3 CaSiO3 + CO2↑
高温
制备玻璃过程的化学方程式为?
微思考
1.制造玻璃时发生以下反应:Na2CO3+SiO2 ==== Na2SiO3+CO2↑。
该反应能否说明H2SiO3的酸性比H2CO3强?为什么?
提示 不能。SiO2与Na2CO3反应,是在高温下,且生成的产物是CO2气体,可以脱离反应体系,并不能说明H2SiO3酸性强于H2CO3。
强酸制弱酸都是在溶液中进行的
高温
【资料卡片】
生产中采用不同的原料和工艺,可以制得多种具有不同性能和用途的玻璃。
例如,用含有铅的原料制造的光学玻璃,透光性好,折射率高,可以用来制造眼镜、照相机和光学仪器的透镜;加入硼酸盐制成耐化学腐蚀、耐温度急剧变化的玻璃,可用于实验室使用的玻璃仪器;加入一些金属氧化物或盐可以得到彩色玻璃,常用于建筑和装饰。
拓展延伸
1.石英玻璃——成分为SiO2,以纯净的石英为主要原料制成。
用途比如化学仪器
几种常见玻璃
2.钢化玻璃——普通玻璃在电炉中加热软化,然后急速冷却而成,机械强度是普通玻璃的4~6倍。用途比如汽车,火车窗玻璃等
3.有色玻璃——普通玻璃中加入一些金属氧化物,
如Cu2O:红色玻璃,CuO:蓝绿色玻璃,
Co2O3:蓝色玻璃,MnO2:紫色玻璃等。
4.光学玻璃——透光性能好,有折光和色散性。
用途比如眼镜片,照相机,显微镜,望远镜用凸凹透镜等光学仪器
水泥是最常用的建筑材料下图是1949—1998年我国水泥产量示意图
水泥
水泥
原料
工业设备
黏土和石灰石
水泥回转窑
混凝土
水泥、沙子和碎石等与水混合
适量石膏的作用
条件
高温煅烧
调节水泥硬化速率
(3)水泥
( Al2O3·2SiO2·2H2O 、 CaCO3 )
主要成分:
一、传统无机非金属材料
硅酸二钙(2CaO SiO2)
铝酸三钙(3CaO Al2O3)等
硅酸三钙(3CaO SiO2)、
归纳总结
都在高温下,发生了复杂的物理和化学变化。
玻璃、水泥、陶瓷生产的共同点:
原料都有含硅元素的物质,
产品都含有硅酸盐,且都是混合物。
一、传统无机非金属材料
1.传统的硅酸盐材料有什么优、缺点?
2.新型无机非金属材料有哪些特性?
优点:抗腐蚀、耐高温; 缺点:质脆、经不起热冲击。
① 承受高温,强度高。 ② 具有光学特性。
③ 具有电学特性。 ④ 具有生物功能。
二、新型无机非金属材料
1 、硅
说一说:根据元素周期表中硅的位置,
为什么硅能成为应用最为广泛的半导体材料
第三周期、第IV A族
请画出碳和硅的原子结构示意图
分析:既不易失去电子,又不易得到电子,主要形成四价的化合物。
Si位于元素周期表第三周期,第ⅣA族,
处于金属与非金属过渡位置,为半导体材料
二、新型无机非金属材料
1 、硅
自然界中的硅:
硅酸盐矿石
水晶( SiO2 )
玛瑙( SiO2 )
二、新型无机非金属材料
1、硅
(1)硅的含量及存在
硅在自然界的存在形态:
氧化物
和硅酸盐
没有游离态,只有化合态
-----二氧化硅
硅在地壳中含量仅次于氧,居第2位,
硅的氧化物和硅酸盐构成了地壳中大部分的岩石、沙子、土壤,约占地壳质量的90%以上。
硅是一种亲氧元素,在自然界它总是与氧相互化合的。
(2)硅的物理性质
硅单质:灰黑色、有金属光泽、硬而脆的固体,是很好的半导体材料!
二、新型无机非金属材料
1、硅
二、新型无机非金属材料
1、硅
(3)硅的化学性质
①与非金属单质反应
Si + 2F2 === SiF4
Si + 2Cl2 ==== SiCl4
Si + O2 ==== SiO2
Si + C ==== SiC
硅在常温下不活泼,加热条件下能与 O2 , Cl2 等反应:
与 O2:
与 Cl2:
与 C:
与 F2:
高温
常温下为无色,有毒,有刺激性臭味的气体。
碳化硅,俗名金刚砂
二、新型无机非金属材料
1、硅
(3)硅的化学性质
②与酸、碱反应
非金属单质一般不与非氧化性酸反应,但 Si 能与 HF 反应:
硅与强碱溶液反应生成氢气:
Si + 4HF === SiF4↑ + 2H2↑
Si + 2NaOH + H2O === Na2SiO3 + 2H2↑
常见单质中能与NaOH溶液反应产生H2的有金属Al,非金属Si。
二、新型无机非金属材料
1、硅
(4)单质 Si 的制备
SiO2 +2C ==== Si + 2CO↑
高温
粗硅
SiCl4+2H2 ===== Si+4HCl
高温
(高纯硅 99.9999999%)
提纯硅
Si + 2Cl2 === SiCl4
高温
粗硅
制粗硅
在高温下让粗硅(Si)与氯气(Cl2)反应,
其产物在高温下被氢气(H2)还原而得到较纯的硅
【资料卡片】
高纯硅的制备
工业上制备高纯硅,一般需要先制得纯度为98%左右的粗硅,
再以其为原料制备高纯硅。
例如,可以将粗硅转化为三氯硅烷(SiHCl3),再经氢气还原得到高纯硅。
工业上高纯硅的制备:
写一写:根据高纯硅的制备流程,写一写相应的化学方程式。
工业上高纯硅的制备:
SiHCl3+H2 ======= Si+3HCI
1100℃
三氯硅烷
SiO2+2C ======= Si+2CO
1800~2000℃
Si+3HCl ======= SiHCl3+H2
300℃
H2 和 HCl 可以循环利用
三氯硅烷
2.单质硅在常温下化学性质不活泼,所以硅在自然界中以游离态存在,这种说法是否正确?
提示 错误。硅是一种亲氧元素,在自然界中总是与氧相互化合,
以熔点很高的氧化物及硅酸盐的形式存在。
所以自然界中无游离态的硅存在。
微思考
SiO2是自然界中沙子、石英的主要成分。
天然二氧化硅叫硅石;
结晶的二氧化硅叫石英。
二氧化硅( 硅石 )存在
硅石
结晶形(石英晶体)
无定形——硅藻土
水晶
玛瑙
无色透明
彩色环带或层状
二氧化硅中没有单个分子,用SiO2来表示二氧化硅的组成,
表示Si 原子与O原子个数比为1:2,所以不是分子式而是化学式。
[SiO2]四面体结构
立体网状结构决定了SiO2具有优良的物理和化学性质
[ 资料卡片 ]
SiO2
SiO2晶体中没有SiO2分子存在,只存在硅氧原子。因此性质稳定
SiO2是不溶于水的固体,熔、沸点高,硬度大。
(1)物理性质
(2)化学性质
SiO2虽然不溶于水,但它是一种酸性氧化物
二、新型无机非金属材料
2、二氧化硅
①不溶于水,不能与水反应得到硅酸
②与碱性氧化物反应: 比如与CaO
SiO2 + CaO ==== CaSiO3
③与 NaOH 反应:
SiO2 + 2NaOH === Na2SiO3 + H2O
NaOH 保存不用玻璃塞,
而用橡胶塞。
玻璃成分中含有二氧化硅,易于氢氧化钠溶液反应生成硅酸钠溶液,从而使瓶塞与瓶壁黏合在一起而难以打开。
所以盛NaOH溶液的试剂瓶一般是玻璃瓶,橡胶塞。
二、新型无机非金属材料
2、二氧化硅
④与盐反应
SiO2 + Na2CO3 Na2SiO3 + CO2↑
高温
SiO2 + CaCO3 CaSiO3 + CO2↑
高温
二、新型无机非金属材料
2、二氧化硅
(3)二氧化硅的特性
与 HF 反应:
SiO2 + 4HF === SiF4↑+ 2H2O
除氢氟酸外,SiO2一般不与其他酸反应。
玻璃中含有SiO2 ,所以HF可以用来刻蚀玻璃。
二、新型无机非金属材料
2、二氧化硅
半导体材料
(1) 硅的应用
集成电路、晶体管、硅整流器、太阳能电池,计算机芯片等
二、新型无机非金属材料
3、硅和二氧化硅的用途
二氧化硅可用来生产光导纤维。
光导纤维的通信容量大,抗干扰性能好,
传输的信号不易衰减,能有效提高通信效率。
二、新型无机非金属材料
3、硅和二氧化硅的用途
(2) 二氧化硅的应用
用石英、玛瑙制作饰物。
二、新型无机非金属材料
3、硅和二氧化硅的用途
(2) 二氧化硅的应用
制作玻璃及光学仪器
玛瑙研钵
石英坩埚
玻璃仪器
二、新型无机非金属材料
3、硅和二氧化硅的用途
(2) 二氧化硅的应用
硅和二氧化硅的用途:
硅太阳能电池板
计算机芯片
二氧化硅制光导纤维
结构
性能
高温抗氧化性能
碳原子和硅原子通过共价键连接
硬度大
砂纸和砂轮的磨料
耐高温结构材料
耐高温半导体材料
碳化硅陶瓷
二、新型无机非金属材料
4、新型陶瓷
碳化硅(SiC)俗称金刚砂,
几种典型的新型无机非金属材料
①高温结构陶瓷特点:耐高温、耐腐蚀、耐磨蚀、抗氧化等,用于火箭发动机,汽车发动机和高温电极材料,如氮化硅(Si3N4)和碳化硅(SiC--金刚砂)。
②压电陶瓷特点:主要有钛酸盐和锆酸盐,可实现机械能和电能的相互转化,用于滤波器、扬声器、超声波探伤器和但火气等。
③透明陶瓷:氧化铝、氧化钇、氮化铝、氟化钙等类型;
特点:耐高温、绝缘性好,用于高压钠灯,激光器和高温探窗。
④超导陶瓷:特点为某临界温度下电阻为0,具有超导性,可用于电力、交通、医疗等。
科学、技术、社会
透明陶瓷
新 型 陶 瓷 材 料
习惯上把陶瓷(ceramics)分为传统陶瓷和特种陶瓷。
传统陶瓷是以粘土、长石、石英等天然矿物为原料经烧结而成的。
特种陶瓷是以人工合成的氧化物、氮化物、碳化物、硅化物、硼化物超细微粒为原料特制而成。又称精细陶瓷、精密陶瓷。
氧化铝陶瓷
二氧化锆
结构陶瓷
氮化硅陶瓷
几种新型陶瓷
二、新型无机非金属材料
4、新型陶瓷
碳纳米材料是近年来人们十分关注的一类新型无机非金属材料,主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广阔的应用前景。
二、新型无机非金属材料
5、碳纳米材料
——富勒烯
富勒烯是由碳原子构成的一系列笼形分子的总称,其中的C60是富勒烯的代表物。C60的发现为纳米科学提供了重要的研究对象,开启了碳纳米材料研究和应用的新时代。
二、新型无机非金属材料
5、碳纳米材料
——碳纳米管
碳纳米管可以看成是由石墨片层卷成的管状物,具有纳米尺度的直径。碳纳米管的比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
二、新型无机非金属材料
5、碳纳米材料
——石墨烯
石墨烯是只有一个碳原子直径厚度的单层石墨,其独特的结构使其电阻率低、热导率高,具有很高的强度。作为一种具有优异性能的新型材料,石墨烯在光电器件、超级电容器、电池和复合材料等方面的应用研究正在不断深入。
二、新型无机非金属材料
5、碳纳米材料
二、新型无机非金属材料
5、碳纳米材料
富 勒 烯-------笼形分子,以C60为代表.
碳纳米管-------石墨片层管状物,比表面积大,具有高强度和电学性能,用于生产复合材料,电池、传感器。
石 墨 烯-------单层石墨,电阻率低,热导率高,强度高用于光电器元件、超级电容器、电池和复合材料等。
碳纳米汽车
二、新型无机非金属材料
5、碳纳米材料
1.下列叙述错误的是( )
A.硅在自然界中主要以单质形式存在 B.硅是应用最广泛的半导体材料
C.高纯度的硅可用于制造计算机芯片 D.二氧化硅可用于生产玻璃
课堂练习
A
课堂练习
2.有下列物品或设备:①陶瓷餐具②砖瓦③混凝土桥墩④门窗玻璃
⑤水晶镜片⑥石英钟⑦水晶项链⑧硅太阳能电池⑨光导纤维⑩计算机芯片
(1)使用了硅单质的是______.(用序号填写,下同)
(2)使用了SiO2的是_________.
(3)使用了硅酸盐材料的是____________.
⑧⑩
③④⑤⑥⑦⑨
①②③④
3.氢氟酸是HF的水溶液,可与SiO2发生反应成SiF4和H2O。
请写出该反应的化学方程式。
想一想为什么可以用氢氟酸溶蚀玻璃生产磨砂玻璃。
答案:SiO2+4HF=SiF4↑+2H2O。
玻璃种含有二氧化硅,所以可以用来制造磨砂玻璃
课堂练习
4.SiO2是一种酸性氧化物,能与强碱溶液反应。
例如,SiO2与NaOH反应可生成Na2SiO3。
Na2SiO3的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,
可以用作粘合剂和防火剂。实验室盛放碱溶液的试剂瓶应使用橡胶塞,
而不用玻璃塞。请解释原因,并写出相关反应的化学方程式。
课堂练习
答案:用玻璃塞会导致瓶塞瓶口黏结在一起SiO2+2NaOH=Na2SiO3+H2O
5.氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,
电绝缘性好,化学性质稳定,但生产成本较高。
(1)根据以上描述,氮化硅可能有哪些用途:_____(填字母)
a.制作坩埚 b.用作建筑陶瓷 c.制作耐高温轴承 d.制作切削刀具
(2)请写出氮和硅的原子结构示意图,并根据元素周期律知识,写出氮化硅的化学式。
课堂练习
答案:(1)a,c,d;(2) N: Si: Si3N4
(3)氮化硅在19世纪已经被化学家合成出来,但直到100多年后才逐
渐应用于工业领域。材料的基础研究和实际应用之间存在着一定距
离,你认为二者之间的关系是怎样的?请查阅相关资料,与同学交
流你的观点。
课堂练习
答案:①二者作用是相辅相成的;
②基础研究的成果指导着应用研究的进行;
③实际需要和应用研究是基础研究的推动力;
④应用研究的结果会丰富已有的理论。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
