重庆市南开中学2023-2024学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 重庆市南开中学2023-2024学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-29 09:22:59 | ||
图片预览



文档简介
重庆南开中学高2025级高二(上)期末考试
化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。第Ⅰ卷和第Ⅱ卷都答在答题卷上。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 K-39 Zn-65
第Ⅰ卷(选择题 共50分)
本卷共20题,1-10题每题2分,11-20题每题3分,共50分。每小题只有一个选项符合题意。
1.“化学,让生活更美好”,下列叙述与涉及原理均正确且有对应关系的是( )
选项 叙述 原理
A. 不锈钢的抗腐蚀性更好 牺牲阳极法
B. 节日燃放焰火 金属电负性小
C. 臭氧用作净水剂 臭氧是极性分子
D. 氨容易液化,用作冷库中的制冷剂 氨分子间存在氢键
2.下列说法不正确的是( )
A.和轨道形状均为哑玲形
B.分于晶体中,分于间作用力越大,对应的物质越稳定
C.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别”
D.测定某一固体是否是晶体可用X射线衍射仪进行实验
3.下列过程或事实不涉及电子转移的是( )
A.钢铁部件表面进行发蓝处理 B.硫酸铜溶液导电
C.用二氧化硅作原料制单晶硅 D.氯化银溶解于浓氨水中
4.新型光催化剂具有较高的催化活性。下列有关其组成元素的说法正确的是( )
A.处于元素周期表中的d区
B.晶体锗的熔点和硬度都高于晶体硅
C.基态O原子中成对电子数是未成对电子数的2倍
D.第一电离能:
5.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
A.碘和干冰升华 B.和红磷熔化
C.氮化钠和蔗糖熔化 D.和熔化
6.光气是一种重要的有机中间体,其制备原理为:
。
下列叙述正确的是( )
A.是含有极性共价键的非极性分子 B.中氧原子的杂化方式为杂化
C.的VSEPR模型为三角锥形 D.的沸点是同族氢化物中最低的
7.下列反应对应的方程式不正确的是( )
A.粉在干冰中点燃:
B.用铁电极电解溶液:
C.将浓盐酸加入饱和氯化钠溶液中,存在溶解平衡:
D.用铁氰化钾溶液检验
8.表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金、染料、皮革、电镀等工业,其晶胞如图所示。硫化钠的一种制备方法是。下列有关说法正确的是( )
A.溶液中键总数为
B.晶胞中含有的离子数目为
C.通常状况下,中含有的键数目为
D.石墨中含有六元环数为
9.下列实验不能达到实验目的的是( )
A B C D
加热融化硫固体 减缓水体中钢铁设施的腐蚀 制备硫酸四氨合铜晶体 制备明矾晶体
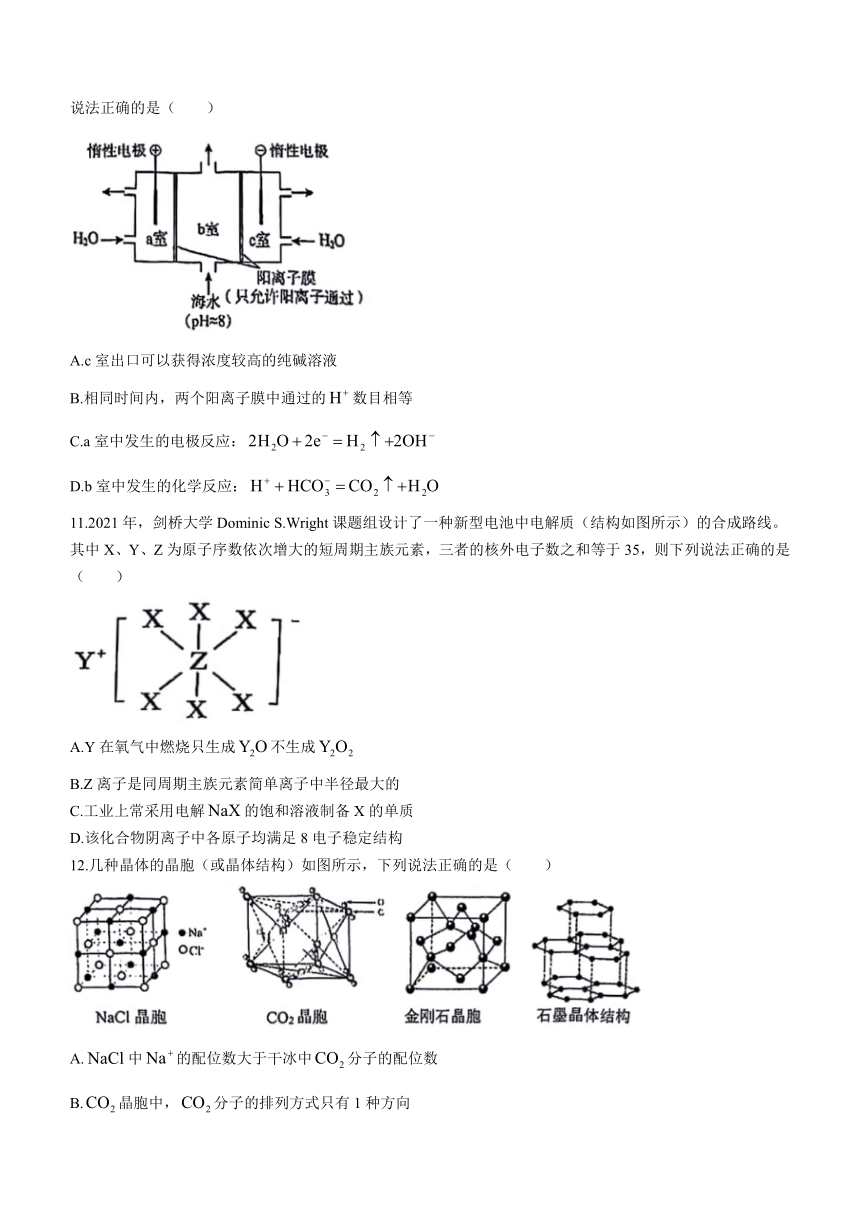
10.海水中含有等离子,值约为8。有研究提出,可用下图所示方法从海水中提取二氧化碳。下列说法正确的是( )
A.c室出口可以获得浓度较高的纯碱溶液
B.相同时间内,两个阳离子膜中通过的数目相等
C.a室中发生的电极反应:
D.b室中发生的化学反应:
11.2021年,剑桥大学Dominic S.Wright课题组设计了一种新型电池中电解质(结构如图所示)的合成路线。其中X、Y、Z为原子序数依次增大的短周期主族元素,三者的核外电子数之和等于35,则下列说法正确的是( )
A.Y在氧气中燃烧只生成不生成
B.Z离子是同周期主族元素简单离子中半径最大的
C.工业上常采用电解的饱和溶液制备X的单质
D.该化合物阴离子中各原子均满足8电子稳定结构
12.几种晶体的晶胞(或晶体结构)如图所示,下列说法正确的是( )
A.中的配位数大于干冰中分子的配位数
B.晶胞中,分子的排列方式只有1种方向
C.若金刚石的晶胞边长为,其中两个最近的碳原子之间的距离为
D.石墨晶体层内是共价键,层间是范德华力,所以石量是一种混合型晶体
13.将溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
A.液滴中的由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:
C.液滴下的因发生还原反应而被腐蚀,生成的由a区向b区迁移,与b区的形成,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加溶液,则负极发生的电极反应为
14.高铁酸钾是一种环保、高效、多功能饮用水处理剂,制备流程如图所示。
下列叙述不正确的是( )
A.用作水处理剂时,既能杀菌消毒又能净化水
B.反应I中尾气可用溶液吸收再利用
C.反应II中氧化剂与还原剂的物质的基之比为
D该条件下,物质的溶解性:
15.某温度下,两种一元弱酸和的电离常数分别为和。将和体积均相同的两种酸溶液分别稀释,其随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线I代表HA溶液
B.溶液中水的电离程度:b点点
C.从c点到d点,溶液中保持不变(其中、分别代表相应的酸和酸根离子)
D.a点的两溶液分别与恰好中和后,溶液中相同
16.向盛有少量蒸馏水的试管里滴加2滴溶液,然后再滴加2滴硫氰化钾溶液。
下列说法正确的是( )
A.溶液颜色由黄色变为红色
B.中由提供孤电子对,提供空轨道
C.和与的配位能力:
D.中含键的物质的量为
17.一种新型的高比能量锌—碘溴液流电池工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述正确的是( )
A.放电时,a电极反应为
B.放电时,溶液中离子的数目会逐渐减少
C.充电时,b电极每增重,溶液中有被氧化
D.充电时,a电极接外电源负极
18.煤的间接液化的途径之一是先将媒转化为和,之后在催化剂作用下合成,其反应历程如图所示,吸附在催化剂表面上的物种用*标注。,下列说法正确的是( )
A.煤的间接液化和氯气的液化过程中,所克服的作用力相同
B.该反应历程中的决速步骤为
C.温度升高,的平衡转化率将升高
D.在催化剂上的脱附或吸附是物理过程,无能量变化
19.在温度分别为、、的恒容密闭容器I、II、III中各充入和,保持其它条件相同,发生反应: ,测得时X的物质的量如图所示。下列说法正确的是( )
A.逆反应速率:
B.b点一定满足:
C.向容器III中再充入和,Y的转化率不变
D.从容器III中移走,X的体积分数减小
20.由下列实验及现象不能推出相应结论的是( )
选项 实验 现象 结论
A 向含有浓度相同的和的混合溶液中滴入少量溶液 先产生黑色沉淀
B 某钾盐晶体中滴加浓盐酸,产生的气体通入品红溶液中 品红溶液褪色 产生的气体可能是
C 将通入溶液 出现白色沉淀 是酸性氧化物
D 向盛有的试管中加入足量溶液,充分振荡后滴入3滴淀粉溶液 固体由黑色变为白色,溶液变为黄色,滴入淀粉后溶液变蓝 既体现了还原性又体现了酸性
第Ⅱ卷(非选择题 共50分)
本卷共4题,共50分。
21.(12分)锰酸锂离子电池是第二代锂离子动力电池,性能优良。工业上以软锰矿浆(主要成分为,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂,工业流程如下图所示:
(1)基态原子的价电子排布式为______。
(2)“精制”过程中,实际加入的量比理论用量多,主要原因是______;是含有______键(填“极性”或“非极性”,下同)和______键的______分子:能与水混溶,却不能溶于,请予以解释______。
(3)“沉锰”过程得到的是和,二者均可以被氧化为,若“控温、氧化”过程中溶液的随时间变化关系如下图所示,其中溶液的明显下降的原因是______(用化学方程式表示)。
(4)“锂化”过程是将和按的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是______。
22.(13分)硫氰化钾俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氮化钾的实验装置如下图所示:
已知:①不溶于水,密度比水的大;
②不溶于;
③三颈烧瓶内盛放有、水和催化剂。
回答下列问题:
(1)制备溶液:
①实验前,经检验装置的气密性良好。其中装置B中的试剂是______(填试剂名称)。将导气管口伸入三颈烧瓶下层溶液中,目的是______。
②实验开始时,打开,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应(该反应比较缓慢)至消失。
(2)制备溶液:
①熄灭A处的酒精灯,关闭,移开水浴,改用油浴将装置D继续加热至105℃,当完全分解后,打开,继续保持105℃,绶缓滴入适量的溶液,发生反应的化学方程式为______。
②使用溶液会使产品固体中混有较多的,工业上用相同浓度的溶液替换溶液,除了原料成本因素外,优点是______。
③装置E的作用是______。
(3)制备晶体:先滤去三颈烧瓶中的固体催化剂,再减压、______、______、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中的含量:称取样品,配成溶液。取溶液于锥形瓶中,加入适量稀硝酸,再加入几滴溶液作指示剂,用标准溶液滴定,达到滴定终点时消耗标准溶液。
①滴定时发生的反应:。则判断到达滴定终点的方法是______。
②晶体中的质量分数为______。
23.(12分)X、Y、R、Q为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液呈碱性;Y的一种单质中分子为正四面体结构:R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:
(1)Q元素在周期表中的位置是______。
(2)价层的轨道表示式是______。
(3)与的键角大小为:______(填“大于”“小于”或“等于”)。
(4)可用于安全气囊的产气药剂,离子中中心原子的杂化方式为______杂化。
(5)如下图所示Y可形成多种含氧酸根:
这类酸根离子的化学式可用通式表示为______(用n代表Y原子数)。
(6)已知R元素形成的配合物中心原子配位数为6,向含的溶液中滴加溶液,反应完全后消耗溶液,则该配离子的化学式为______。
(7)已知晶体结构单元如下图所示。离H最近且等距的H的个数为______。
24.(13分)良好生态环境是实现中华民族永续发展的内在要求,是增进民生福祉的优先领域,是建设美丽中国的重要基础。硫氧化物和氮氧化物是引起大气环境污染的主要污染物。
(1)氨气可作为脱硝剂。在绝热恒容密闭容器中充入一定量的和,在一定条件下发生反应:。
能说明该反应已达到平衡状态标志的是______(填字母序号)。
a.体系温度不变
b.反应速率
c.容器内压强不再随时间而发生变化
d.容器内的物质的量分数不再随时间而发生变化
e.容器内
(2)一定温度下,在恒容密闭容器内发生反应,随时间的变化如表:
时间/s 0 1 2 3 4 5
0.040 0.020 0.010 0.005 0.005 0.005
①内,该反应的平均速率______。
②该温度下,反应的平衡常数______。
(3)对于反应,用平衡时各组分压强关系表达的平衡常数。在一定条件下与的消耗速率与自身压强间存在关系:,。其中、是与反应及温度有关的常数。相应的消耗速率与压强的关系如图所示:
一定温度下,、与平衡常数的关系是______。在上图标出的点中,指出能表示反应达到平衡状态的点并说明理由______。
(4)用电化学法模拟工业处理。将硫酸工业尾气中的通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能(忽略气体溶解)。
①质子交换膜右侧的溶液在反应后______(填“增大”、“减小”或“不变”)。
②当外电路通过时,质子交换膜左侧的溶液质量______(填“增大”或“减小”)______g。
重庆南开中学高2025级高二(上)期末考试 化学参考答案
1-5:DBDDA 6-10:DBCCD 11-15;BDBDC 16-20;DCBCC
21.(12分)
(1)(1分)
(2)在催化作用下部分分解(2分) 极性(1分) 非极性(1分) 极性(1分)
和都是极性分子,而是非极性分子,根据相似相溶原理,更易溶于水;且和能形成分子间空键。(2分)
(3)(2分)
(4)、(写不扣分)(2分)
22.(13分)
(1)①碱石灰(1分) 使反应物和充分接触,并防止发生倒吸(1分)
(2)①(2分)
②加热时能与反应产生更多和,有利于将残留在装置中的排出(2分)
③除去反应过程中产生的和,以免污染环境(1分)
(3)蒸发浓缩(1分) 冷却结晶(1分)
(4)①滴入最后半滴溶液时,红色恰好褪去,且半分钟内颜色不恢复(2分)
(2)97.0%(2分)
23.(12分)
(1)第四周期,第IB族(2分)
(2)(2分)
(3)大于(1分)
(4)(1分)
(5)(2分)
(6)(2分)
(7)12(2分)
24.(13分)
(1)a、c、d(2分)
(2)①0.0075(1分) ②1400(2分)
(3)(2分) B点与D点,平衡时(2分)
(4)①增大(1分) ②增大(1分) 6.2(2分)
化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。第Ⅰ卷和第Ⅱ卷都答在答题卷上。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 K-39 Zn-65
第Ⅰ卷(选择题 共50分)
本卷共20题,1-10题每题2分,11-20题每题3分,共50分。每小题只有一个选项符合题意。
1.“化学,让生活更美好”,下列叙述与涉及原理均正确且有对应关系的是( )
选项 叙述 原理
A. 不锈钢的抗腐蚀性更好 牺牲阳极法
B. 节日燃放焰火 金属电负性小
C. 臭氧用作净水剂 臭氧是极性分子
D. 氨容易液化,用作冷库中的制冷剂 氨分子间存在氢键
2.下列说法不正确的是( )
A.和轨道形状均为哑玲形
B.分于晶体中,分于间作用力越大,对应的物质越稳定
C.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别”
D.测定某一固体是否是晶体可用X射线衍射仪进行实验
3.下列过程或事实不涉及电子转移的是( )
A.钢铁部件表面进行发蓝处理 B.硫酸铜溶液导电
C.用二氧化硅作原料制单晶硅 D.氯化银溶解于浓氨水中
4.新型光催化剂具有较高的催化活性。下列有关其组成元素的说法正确的是( )
A.处于元素周期表中的d区
B.晶体锗的熔点和硬度都高于晶体硅
C.基态O原子中成对电子数是未成对电子数的2倍
D.第一电离能:
5.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
A.碘和干冰升华 B.和红磷熔化
C.氮化钠和蔗糖熔化 D.和熔化
6.光气是一种重要的有机中间体,其制备原理为:
。
下列叙述正确的是( )
A.是含有极性共价键的非极性分子 B.中氧原子的杂化方式为杂化
C.的VSEPR模型为三角锥形 D.的沸点是同族氢化物中最低的
7.下列反应对应的方程式不正确的是( )
A.粉在干冰中点燃:
B.用铁电极电解溶液:
C.将浓盐酸加入饱和氯化钠溶液中,存在溶解平衡:
D.用铁氰化钾溶液检验
8.表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金、染料、皮革、电镀等工业,其晶胞如图所示。硫化钠的一种制备方法是。下列有关说法正确的是( )
A.溶液中键总数为
B.晶胞中含有的离子数目为
C.通常状况下,中含有的键数目为
D.石墨中含有六元环数为
9.下列实验不能达到实验目的的是( )
A B C D
加热融化硫固体 减缓水体中钢铁设施的腐蚀 制备硫酸四氨合铜晶体 制备明矾晶体
10.海水中含有等离子,值约为8。有研究提出,可用下图所示方法从海水中提取二氧化碳。下列说法正确的是( )
A.c室出口可以获得浓度较高的纯碱溶液
B.相同时间内,两个阳离子膜中通过的数目相等
C.a室中发生的电极反应:
D.b室中发生的化学反应:
11.2021年,剑桥大学Dominic S.Wright课题组设计了一种新型电池中电解质(结构如图所示)的合成路线。其中X、Y、Z为原子序数依次增大的短周期主族元素,三者的核外电子数之和等于35,则下列说法正确的是( )
A.Y在氧气中燃烧只生成不生成
B.Z离子是同周期主族元素简单离子中半径最大的
C.工业上常采用电解的饱和溶液制备X的单质
D.该化合物阴离子中各原子均满足8电子稳定结构
12.几种晶体的晶胞(或晶体结构)如图所示,下列说法正确的是( )
A.中的配位数大于干冰中分子的配位数
B.晶胞中,分子的排列方式只有1种方向
C.若金刚石的晶胞边长为,其中两个最近的碳原子之间的距离为
D.石墨晶体层内是共价键,层间是范德华力,所以石量是一种混合型晶体
13.将溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
A.液滴中的由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:
C.液滴下的因发生还原反应而被腐蚀,生成的由a区向b区迁移,与b区的形成,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加溶液,则负极发生的电极反应为
14.高铁酸钾是一种环保、高效、多功能饮用水处理剂,制备流程如图所示。
下列叙述不正确的是( )
A.用作水处理剂时,既能杀菌消毒又能净化水
B.反应I中尾气可用溶液吸收再利用
C.反应II中氧化剂与还原剂的物质的基之比为
D该条件下,物质的溶解性:
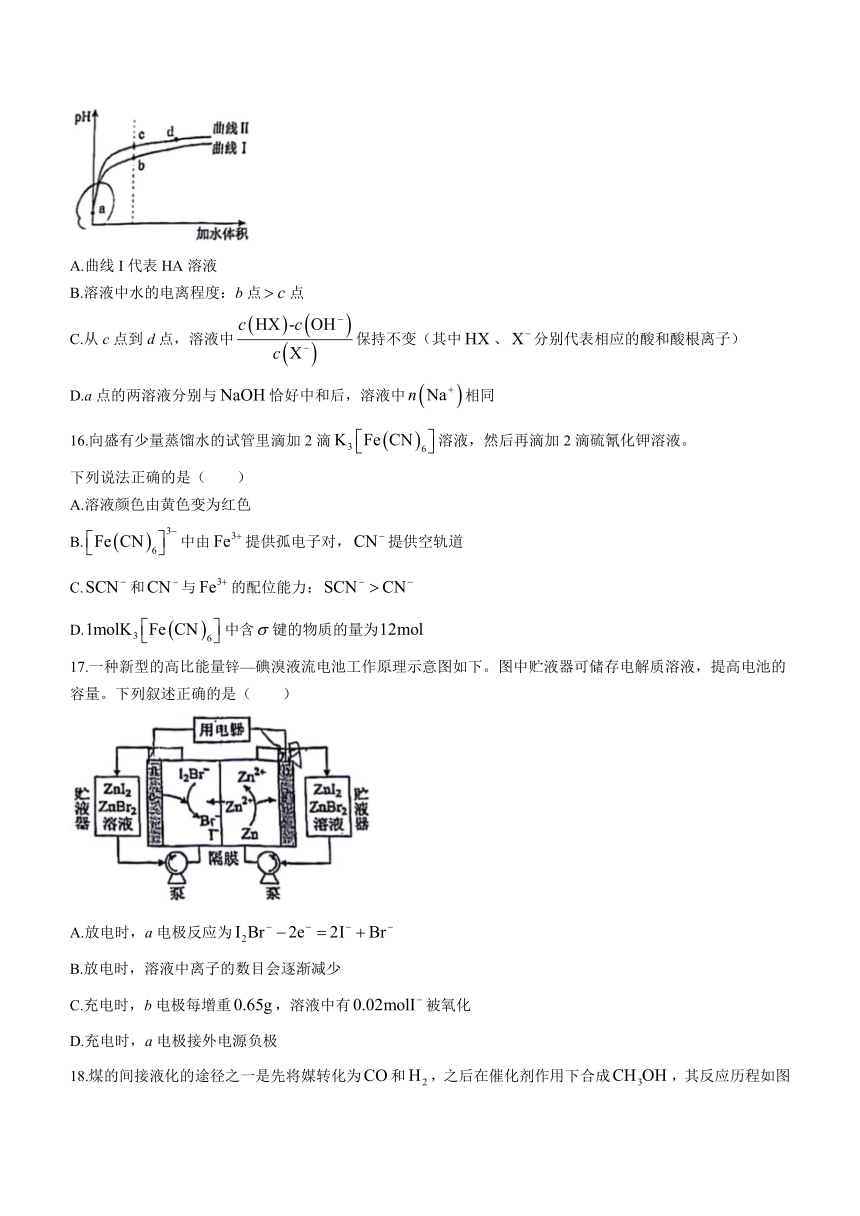
15.某温度下,两种一元弱酸和的电离常数分别为和。将和体积均相同的两种酸溶液分别稀释,其随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线I代表HA溶液
B.溶液中水的电离程度:b点点
C.从c点到d点,溶液中保持不变(其中、分别代表相应的酸和酸根离子)
D.a点的两溶液分别与恰好中和后,溶液中相同
16.向盛有少量蒸馏水的试管里滴加2滴溶液,然后再滴加2滴硫氰化钾溶液。
下列说法正确的是( )
A.溶液颜色由黄色变为红色
B.中由提供孤电子对,提供空轨道
C.和与的配位能力:
D.中含键的物质的量为
17.一种新型的高比能量锌—碘溴液流电池工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述正确的是( )
A.放电时,a电极反应为
B.放电时,溶液中离子的数目会逐渐减少
C.充电时,b电极每增重,溶液中有被氧化
D.充电时,a电极接外电源负极
18.煤的间接液化的途径之一是先将媒转化为和,之后在催化剂作用下合成,其反应历程如图所示,吸附在催化剂表面上的物种用*标注。,下列说法正确的是( )
A.煤的间接液化和氯气的液化过程中,所克服的作用力相同
B.该反应历程中的决速步骤为
C.温度升高,的平衡转化率将升高
D.在催化剂上的脱附或吸附是物理过程,无能量变化
19.在温度分别为、、的恒容密闭容器I、II、III中各充入和,保持其它条件相同,发生反应: ,测得时X的物质的量如图所示。下列说法正确的是( )
A.逆反应速率:
B.b点一定满足:
C.向容器III中再充入和,Y的转化率不变
D.从容器III中移走,X的体积分数减小
20.由下列实验及现象不能推出相应结论的是( )
选项 实验 现象 结论
A 向含有浓度相同的和的混合溶液中滴入少量溶液 先产生黑色沉淀
B 某钾盐晶体中滴加浓盐酸,产生的气体通入品红溶液中 品红溶液褪色 产生的气体可能是
C 将通入溶液 出现白色沉淀 是酸性氧化物
D 向盛有的试管中加入足量溶液,充分振荡后滴入3滴淀粉溶液 固体由黑色变为白色,溶液变为黄色,滴入淀粉后溶液变蓝 既体现了还原性又体现了酸性
第Ⅱ卷(非选择题 共50分)
本卷共4题,共50分。
21.(12分)锰酸锂离子电池是第二代锂离子动力电池,性能优良。工业上以软锰矿浆(主要成分为,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂,工业流程如下图所示:
(1)基态原子的价电子排布式为______。
(2)“精制”过程中,实际加入的量比理论用量多,主要原因是______;是含有______键(填“极性”或“非极性”,下同)和______键的______分子:能与水混溶,却不能溶于,请予以解释______。
(3)“沉锰”过程得到的是和,二者均可以被氧化为,若“控温、氧化”过程中溶液的随时间变化关系如下图所示,其中溶液的明显下降的原因是______(用化学方程式表示)。
(4)“锂化”过程是将和按的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是______。
22.(13分)硫氰化钾俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氮化钾的实验装置如下图所示:
已知:①不溶于水,密度比水的大;
②不溶于;
③三颈烧瓶内盛放有、水和催化剂。
回答下列问题:
(1)制备溶液:
①实验前,经检验装置的气密性良好。其中装置B中的试剂是______(填试剂名称)。将导气管口伸入三颈烧瓶下层溶液中,目的是______。
②实验开始时,打开,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应(该反应比较缓慢)至消失。
(2)制备溶液:
①熄灭A处的酒精灯,关闭,移开水浴,改用油浴将装置D继续加热至105℃,当完全分解后,打开,继续保持105℃,绶缓滴入适量的溶液,发生反应的化学方程式为______。
②使用溶液会使产品固体中混有较多的,工业上用相同浓度的溶液替换溶液,除了原料成本因素外,优点是______。
③装置E的作用是______。
(3)制备晶体:先滤去三颈烧瓶中的固体催化剂,再减压、______、______、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中的含量:称取样品,配成溶液。取溶液于锥形瓶中,加入适量稀硝酸,再加入几滴溶液作指示剂,用标准溶液滴定,达到滴定终点时消耗标准溶液。
①滴定时发生的反应:。则判断到达滴定终点的方法是______。
②晶体中的质量分数为______。
23.(12分)X、Y、R、Q为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液呈碱性;Y的一种单质中分子为正四面体结构:R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:
(1)Q元素在周期表中的位置是______。
(2)价层的轨道表示式是______。
(3)与的键角大小为:______(填“大于”“小于”或“等于”)。
(4)可用于安全气囊的产气药剂,离子中中心原子的杂化方式为______杂化。
(5)如下图所示Y可形成多种含氧酸根:
这类酸根离子的化学式可用通式表示为______(用n代表Y原子数)。
(6)已知R元素形成的配合物中心原子配位数为6,向含的溶液中滴加溶液,反应完全后消耗溶液,则该配离子的化学式为______。
(7)已知晶体结构单元如下图所示。离H最近且等距的H的个数为______。
24.(13分)良好生态环境是实现中华民族永续发展的内在要求,是增进民生福祉的优先领域,是建设美丽中国的重要基础。硫氧化物和氮氧化物是引起大气环境污染的主要污染物。
(1)氨气可作为脱硝剂。在绝热恒容密闭容器中充入一定量的和,在一定条件下发生反应:。
能说明该反应已达到平衡状态标志的是______(填字母序号)。
a.体系温度不变
b.反应速率
c.容器内压强不再随时间而发生变化
d.容器内的物质的量分数不再随时间而发生变化
e.容器内
(2)一定温度下,在恒容密闭容器内发生反应,随时间的变化如表:
时间/s 0 1 2 3 4 5
0.040 0.020 0.010 0.005 0.005 0.005
①内,该反应的平均速率______。
②该温度下,反应的平衡常数______。
(3)对于反应,用平衡时各组分压强关系表达的平衡常数。在一定条件下与的消耗速率与自身压强间存在关系:,。其中、是与反应及温度有关的常数。相应的消耗速率与压强的关系如图所示:
一定温度下,、与平衡常数的关系是______。在上图标出的点中,指出能表示反应达到平衡状态的点并说明理由______。
(4)用电化学法模拟工业处理。将硫酸工业尾气中的通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能(忽略气体溶解)。
①质子交换膜右侧的溶液在反应后______(填“增大”、“减小”或“不变”)。
②当外电路通过时,质子交换膜左侧的溶液质量______(填“增大”或“减小”)______g。
重庆南开中学高2025级高二(上)期末考试 化学参考答案
1-5:DBDDA 6-10:DBCCD 11-15;BDBDC 16-20;DCBCC
21.(12分)
(1)(1分)
(2)在催化作用下部分分解(2分) 极性(1分) 非极性(1分) 极性(1分)
和都是极性分子,而是非极性分子,根据相似相溶原理,更易溶于水;且和能形成分子间空键。(2分)
(3)(2分)
(4)、(写不扣分)(2分)
22.(13分)
(1)①碱石灰(1分) 使反应物和充分接触,并防止发生倒吸(1分)
(2)①(2分)
②加热时能与反应产生更多和,有利于将残留在装置中的排出(2分)
③除去反应过程中产生的和,以免污染环境(1分)
(3)蒸发浓缩(1分) 冷却结晶(1分)
(4)①滴入最后半滴溶液时,红色恰好褪去,且半分钟内颜色不恢复(2分)
(2)97.0%(2分)
23.(12分)
(1)第四周期,第IB族(2分)
(2)(2分)
(3)大于(1分)
(4)(1分)
(5)(2分)
(6)(2分)
(7)12(2分)
24.(13分)
(1)a、c、d(2分)
(2)①0.0075(1分) ②1400(2分)
(3)(2分) B点与D点,平衡时(2分)
(4)①增大(1分) ②增大(1分) 6.2(2分)
同课章节目录
