湖北省新高考联考协作体2023-2024学年高二上学期1月期末考试化学试题B(PDF版无答案)
文档属性
| 名称 | 湖北省新高考联考协作体2023-2024学年高二上学期1月期末考试化学试题B(PDF版无答案) |  | |
| 格式 | |||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-29 21:29:21 | ||
图片预览


文档简介
2023-2024 学年度上学期高二年级期末考试
高二化学 B 试卷
2024 1 28 试卷满分:100分考试时间: 年 月 日下午 14:30-17:05
注意事项:
1. 答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准
考证号条形码粘贴在答题卡上的指定位置。
2. 选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。写
在试卷、草稿纸和答题卡上的非答题区域均无效。
3. 非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸
和答题卡上的非答题区域均无效。
可能用到的相对原子质量: H 1 C 12 O 16 Na 23 Cl 35.5
一、选择题:本题共 15 小题,每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一项是
符合题目要求的。
1. 生产生活中处处有化学,下列有关说法正确的是
A. 天然硬水呈碱性的原因是其中含有较多的 Mg2+、Ca2+等离子
B. 使用合适催化剂能改变反应历程,降低反应的焓变
C. 明矾中的铝离子可在水中形成胶体,用于水体净化与消毒
D. 金属焊接时用 NH4Cl 溶液除锈,运用了盐类的水解原理
2. 下列化学用语的表达错误的是
A.基态 N 原子的价层电子排布图
B.乙烯的空间填充模型
C.Cl-Cl 的 p p 键的电子云图形:
D NO . 3 的 VSEPR 模型为平面三角形
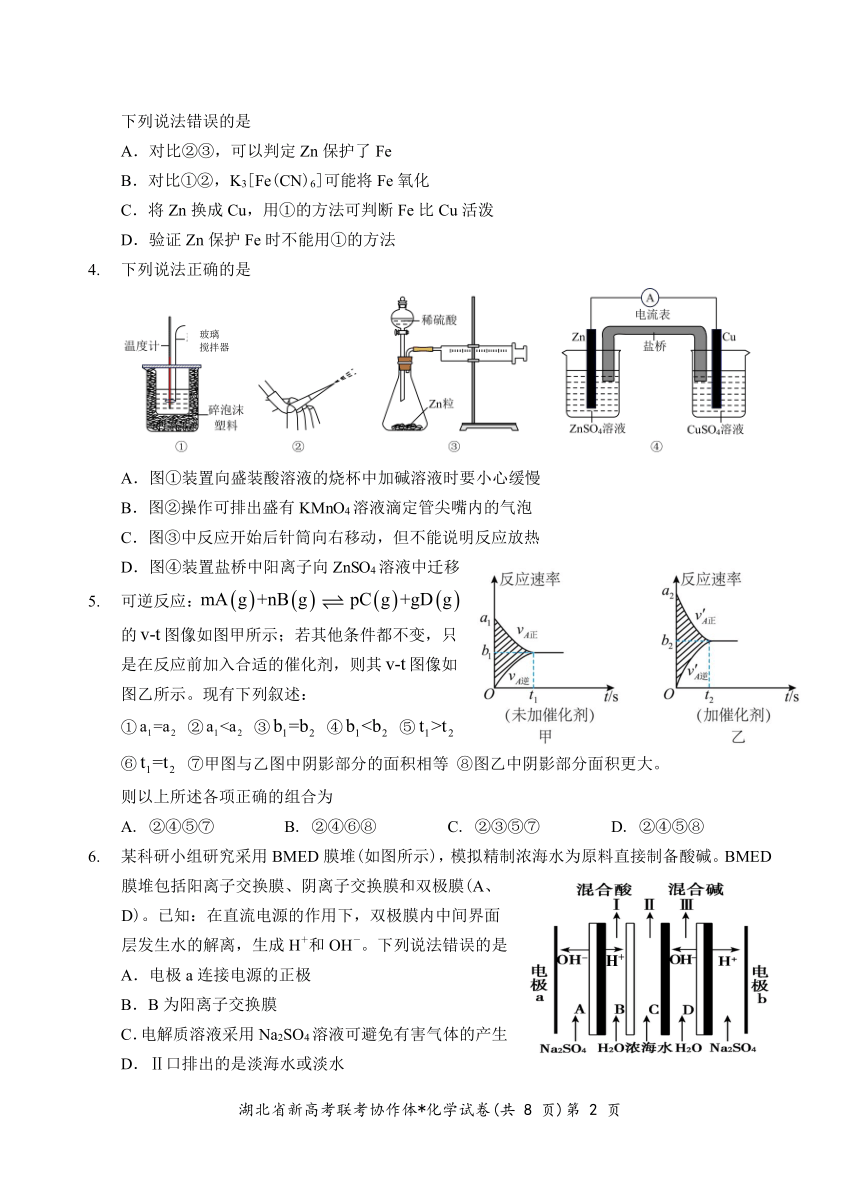
3. 验证牺牲阳极法,实验操作及现象如下(烧杯内均为经过酸化的 3%NaCl 溶液)。
① ② ③
在 Fe 表面生成蓝色沉淀 试管内无明显变化 试管内生成蓝色沉淀
湖北省新高考联考协作体*化学试卷(共 8 页)第 1 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
下列说法错误的是
A.对比②③,可以判定 Zn 保护了 Fe
B.对比①②,K3[Fe(CN)6]可能将 Fe 氧化
C.将 Zn 换成 Cu,用①的方法可判断 Fe 比 Cu 活泼
D.验证 Zn 保护 Fe 时不能用①的方法
4. 下列说法正确的是
玻璃
搅拌器
A.图①装置向盛装酸溶液的烧杯中加碱溶液时要小心缓慢
B.图②操作可排出盛有 KMnO4 溶液滴定管尖嘴内的气泡
C.图③中反应开始后针筒向右移动,但不能说明反应放热
D.图④装置盐桥中阳离子向 ZnSO4溶液中迁移
5. 可逆反应:mA g +nB g pC g +gD g
的 v-t 图像如图甲所示;若其他条件都不变,只
是在反应前加入合适的催化剂,则其 v-t图像如
图乙所示。现有下列叙述:
① a1=a2 ② a1t2
⑥ t1=t2 ⑦甲图与乙图中阴影部分的面积相等 ⑧图乙中阴影部分面积更大。
则以上所述各项正确的组合为
A. ②④⑤⑦ B. ②④⑥⑧ C. ②③⑤⑦ D. ②④⑤⑧
6. 某科研小组研究采用 BMED 膜堆(如图所示),模拟精制浓海水为原料直接制备酸碱。BMED
膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、
D)。已知:在直流电源的作用下,双极膜内中间界面
层发生水的解离,生成 H+和 OH-。下列说法错误的是
H+
A.电极 a 连接电源的正极
B.B 为阳离子交换膜
C.电解质溶液采用 Na2SO4溶液可避免有害气体的产生
D.Ⅱ口排出的是淡海水或淡水
湖北省新高考联考协作体*化学试卷(共 8 页)第 2 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
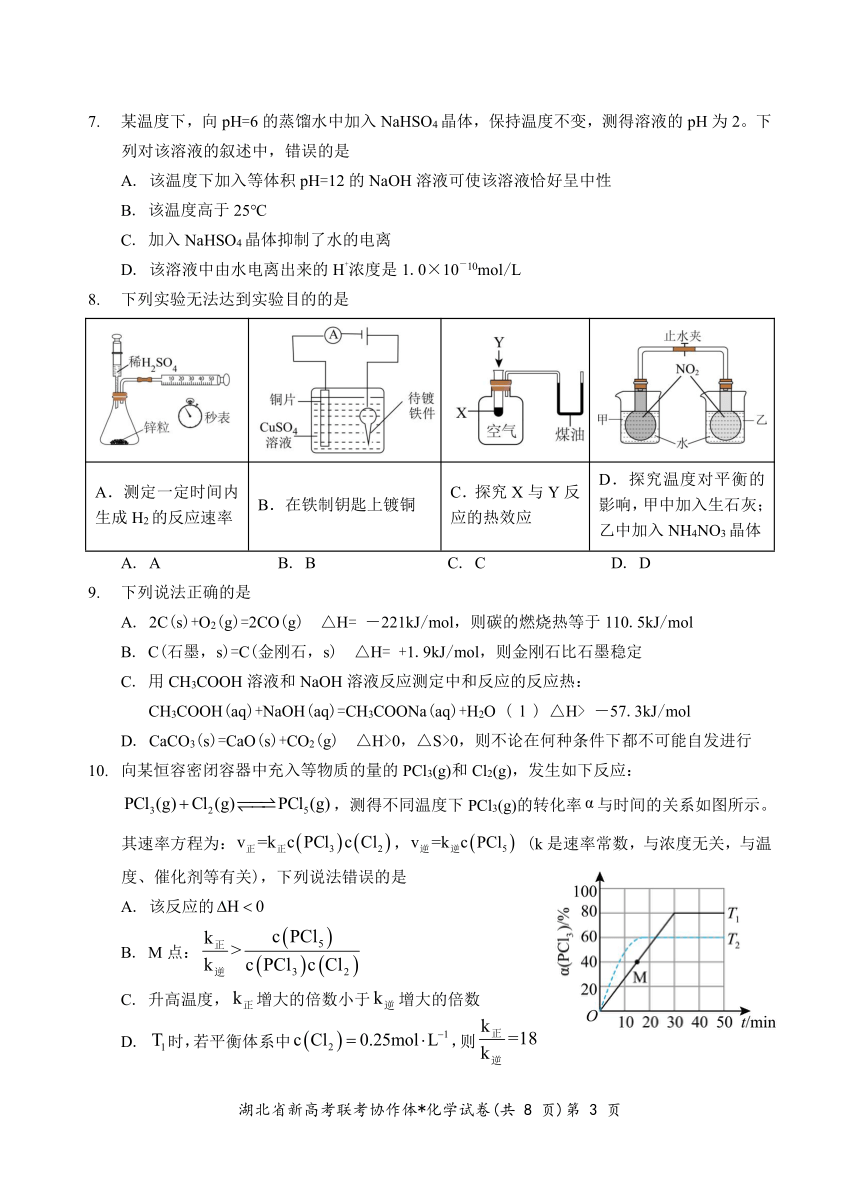
7. 某温度下,向 pH=6 的蒸馏水中加入 NaHSO4 晶体,保持温度不变,测得溶液的 pH 为 2。下
列对该溶液的叙述中,错误的是
A. 该温度下加入等体积 pH=12 的 NaOH 溶液可使该溶液恰好呈中性
B. 该温度高于 25℃
C. 加入 NaHSO4 晶体抑制了水的电离
D + -. 该溶液中由水电离出来的 H 浓度是 1.0×10 10mol/L
8. 下列实验无法达到实验目的的是
D.探究温度对平衡的
A.测定一定时间内 C.探究 X 与 Y 反
B.在铁制钥匙上镀铜 影响,甲中加入生石灰;
生成 H2的反应速率 应的热效应
乙中加入 NH4NO3晶体
A. A B. B C. C D. D
9. 下列说法正确的是
A. 2C(s)+O2(g)=2CO(g) △H= -221kJ/mol,则碳的燃烧热等于 110.5kJ/mol
B. C(石墨,s)=C(金刚石,s) △H= +1.9kJ/mol,则金刚石比石墨稳定
C. 用 CH3COOH 溶液和 NaOH 溶液反应测定中和反应的反应热:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O ( l ) △H> -57.3kJ/mol
D. CaCO3(s)=CaO(s)+CO2(g) △H>0,△S>0,则不论在何种条件下都不可能自发进行
10. 向某恒容密闭容器中充入等物质的量的 PCl3(g)和 Cl2(g),发生如下反应:
PCl3(g) Cl2(g) PCl5(g),测得不同温度下 PCl3(g)的转化率 α 与时间的关系如图所示。
其速率方程为:v正=k正c PCl3 c Cl2 ,v逆=k逆c PCl5 (k 是速率常数,与浓度无关,与温
度、催化剂等有关),下列说法错误的是
A. 该反应的 H 0
k c PCl正 > 5 B. M 点:
k逆 c PCl3 c Cl2
C. 升高温度, k正增大的倍数小于 k逆 增大的倍数
k
D. T1时,若平衡体系中 c Cl2 0.25mol L 1 正,则 =18k逆
湖北省新高考联考协作体*化学试卷(共 8 页)第 3 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
11. 草酸(H2C2O4 )是二元弱酸。某小组做如下两组实验:
实验 I:往 20 mL 0.1 mol L-1 NaHC2O4 溶液中滴加0.1 mol L-1NaOH 溶液。
实验Ⅱ:往 20 mL 0.10 mol L-1NaHC2O4 溶液中滴加0.10 mol L
-1CaCl2 溶液。
[已知:H2C2O4 的电离常数Kal =5.4 10
-2 ,Ka2 =5.4 10
-5 ,Ksp CaC2O4 =2.4 10-9 ,溶液混合后体
积变化忽略不计],下列说法正确的是
A.实验 I 可选用甲基橙作指示剂,指示反应终点
B 2- -.实验 I 中V(NaOH)=10 mL 时,存在 c C2O4C.实验Ⅱ中 V CaCl 2- -8 -12 =80 mL时,溶液中 c C2O4 =4.0 10 mol L
D - 2+ +.实验Ⅱ中,刚开始发生反应 HC2O4 +Ca CaC2O4 +H
12. 锶(Sr)为第五周期 IIA 族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,
工业上常以天青石(主要成分为 SrSO4,含少量 BaSO4) 为原料制备,生产流程如下:
下列叙述错误的是
A.工业上天青石焙烧前先研磨粉碎目的是增大反应物接触面积,提高化学反应速率
B.高温焙烧时,若 0.5mol SrSO4 完全反应转移了 4mol 电子,该反应的化学方程式为:
高温
SrSO4+4C SrS+4CO
C.加入适量 1mol/LH2SO4目的是除去溶液中 Ba2+杂质
D.工业上常电解熔融 SrCl2制锶单质,则 SrCl2·6H2O 制取无水 SrCl2一定要在无水氯化氢
气流中加热 SrCl2·6H2O 失水至恒重
13. CO 用于处理大气污染物 N2O,在催化剂作用下该反应的具体过程如图 1 所示,反应过程中
能量变化情况如图 2 所示。下列说法错误的是
湖北省新高考联考协作体*化学试卷(共 8 页)第 4 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
A. 总反应为 CO(g) +N2O(g) CO2(g) +N2(g)
B. 总反应的决速步为反应②
C +. 该反应催化剂为 Zn ,中间产物为 ZnO+
D. 该总反应的ΔH =-361.22kJ mol 1
14. T℃ 时 , 在 一 固 定 容 积 的 密 闭 容 器 中 发 生 反 应 :
A g B g C s H 0,按照不同配比充入 A、B,
达到平衡时容器中 A、B 浓度变化如图中曲线(实线)所示,
下列判断正确的是
A. T℃时,该反应的平衡常数值为 4
B. c 点没有达到平衡,此时反应向逆向进行
C. 若 c 点为平衡点,则此时容器内的温度高于 T℃
D. T℃时,直线 cd 上的点均为平衡状态
15. 常温下 H3PO4在水中各级电离的过程如图所示。已知: pK= -lgK。
下列相关说法正确的是
A. 反应 H3PO4+2PO3 4 3HPO2 4 pK=16
B. Na2HPO4溶液中: c(PO3 )>2c(H PO )+c(H PO-4 3 4 2 4)
C. 用 NaOH 溶液滴定 NaH2PO4溶液时宜选用甲基橙做
指示剂
D. H3PO4和 Na3PO4组成的混合溶液 pH=6 时,溶液中:
c(H2PO-4)>c(HPO2 4 )>c(H3PO4)
二、非选择题:本题共 4 小题,共 55 分。
16. (14 分)
(1) 现有常温下 pH=2 的盐酸(甲)、pH=2 的醋酸溶液(乙)和 0.1mol/LNH3 H2O(丙),请根据下
列操作回答:
①常温下,将丙溶液加水稀释,下列数值变大的是_____(填字母)。
c NH3 H O c OH 2
A n NH
c NH4
. c H c OH B. c C. D.H 4 c NH3 H2O
②已知 Ka (CH3COOH) =1.75×10-5 ,则醋酸溶液(乙)的浓度为_____mol/L(结果保留三
位有效数字)。
③常温下,取甲、乙各 1mL 分别稀释至 100mL,稀释后,溶液的 pH:甲_____乙(填“>”
“<”或“=”)。
(2) ①相同条件下,取体积、等 pH 的 Ba(OH)2、NaOH 和 NH3 H2O 三种碱溶液,分别滴加等浓
度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2 、V3,则三者的大小关系为_____。
湖北省新高考联考协作体*化学试卷(共 8 页)第 5 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
②某温度下, = 1.0 × 10-12,将 Va L pH=4 的 HCl 溶液和 Vb L pH=9 的 Ba(OH)2 溶液混
合均匀,测得溶液的 pH=7,则 Va:Vb=_____。
(3) 已知:在 25℃,有关弱电解质的电离平衡常数如下表:
弱电解质 H2SO3 H2CO3 HClO NH3 H2O
Ka1 1.54 10
2 Ka1 4.2 10
7
8 5
电离平衡常数 7 11 Ka 4.7 10 Kb 1.8 10Ka 2 1.02 10 Ka 2 5.6 10
c SO2
- - - 3
①将 SO2通入氨水中,当 c(OH )降至 1.0×10 6mol L 1 时,溶液中的
c HSO =_____。3
②下列微粒在溶液中不能大量共存的是_____。
A SO2 HClO B ClO 2 . 3 、 . 、HCO3 C.HClO、HCO 3 D.HSO3 、CO3
17. (14 分)分析化学滴定法有酸碱中和滴定、沉淀滴定、氧化还原滴定等。沉淀滴定法可用于
NaCl 溶液中 c(Cl-)的测定。实验过程包括准备标准溶液和滴定待测溶液。
已知: ①Ag2CrO 是一种砖红色沉淀;
②已知 sp AgCl = 1.56 × 10
10 sp Ag CrO = 1.1 × 10
12
Ⅰ.准备标准溶液: 准确称取 AgNO 基准物 4.2468g(0.0250mol)后, 配制成 250mL 标准
溶液,放在棕色试剂瓶中避光保存,备用。
Ⅱ.滴定待测溶液。其主要步骤如下:
a.取待测 NaCl 溶液 25.00 mL 于锥形瓶中;
b.加入 1mL5% K2CrO 溶液;
c.在不断摇动下用 AgNO 标准溶液滴定,当接近终点时,需逐滴加入 AgNO 溶液,并用
力振荡。记下终点时消耗 AgNO 标准溶液的体积;
d.重复上述操作两次。三次测定数据如下表:
实验序号 1 2 3
消耗 AgNO 标准溶液体积/mL 20.45 20.02 19.98
e.数据处理。
回答下列问题:
(1) ①滴定前,装有 AgNO 标准液的滴定管排气泡时,
应选择右图中的________ (填对应字母)。
②读取盛装标准 AgNO 的滴定管初始读数。若液面
位置如图所示,则此时读数为_________mL。
(2) 将称得的 AgNO 配制成标准溶液时,所使用的仪器除烧杯和玻璃棒外还有
______________________________。
湖北省新高考联考协作体*化学试卷(共 8 页)第 6 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
(3) 滴定终点的现象是__________________________________________ 。
(4) 测得 c(Cl-)=_________mol·L-1。
(5) 滴定时需控制溶液的 pH 在一定范围内,若 pH 过小对实验的影响是______________________。
(结合离子方程式说明)
(6) 下列关于实验的说法合理的是_______________(填对应字母)。
A. 滴定过程中滴定管尖嘴不得接触锥形瓶内壁
B. 若在配制 AgNO 标准溶液时,烧杯中的溶液有少量溅出,则最终测定结果偏高
C. 为使终点现象更加明显,可改加 5 5%K CrO 溶液
D. 滴定过程中可用蒸馏水将锥形瓶内壁上粘附的溶液冲下
18. (14 分)水钴矿主要成分为 CoOOH,同时含有少量 Fe、Al、Mn、Mg、Ca、Ni 的氧化物及其
他杂质。用水钴矿制取 Co 的工艺流程如图甲所示:
已知:加萃取剂目的是除锰和除镍,部分阳离子形成氢氧化物沉淀时,溶液 pH 见下表:
沉淀物 Fe(OH)2 Fe(OH)3 Co(OH)2 Mn(OH)2 Al(OH)3
开始沉淀时的 pH 7.0 2.7 7.6 7.7 4.0
沉淀完全时的 pH 9.6 3.7 9.2 9.8 5.2
请回答下列问题:
(1) 基态 Mn 原子的价层电子排布式为_______。
(2) “还原酸浸”中主要发生的氧化还原反应的化学方程式是__________。浸出液中加入 NaClO
溶液的目的:_________________________________________。
(3) 浸出过程中加入 Na2CO3调 pH 的范围是_______________。
(4) 如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。
萃取剂合适的 pH 为_____(填对应字母)。
A.2~3 B.3~4
C.6~7 D.7~8
(5) Co 能与强酸反应产生 H2,工业上采用惰性电极电解 CoCl2 溶液制取钴,不能用 CoSO4 溶液
代替 CoCl2溶液的理由是_________。
湖北省新高考联考协作体*化学试卷(共 8 页)第 7 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
2 5
(6) 一定温度下,向滤液Ⅰ中 NaF溶液,若所得滤液Ⅱ中 c Mg 1.0 10 mol / L ,则滤液Ⅱ
c Ca 2 11中 为___________(保留 2 位有效数字)[已知该温度下 Ksp CaF2 3.4 10 ,
Ksp MgF2 7.1 10 11 ]。
19. (13 分)CO2 氢化合成甲醇技术的工业化量产研究,利用反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) H ,可减少 CO2 排放并合成清洁能源,实现可持
续发展。
(1) 一般认为该反应通过如下两个步骤反应来实现:
反应①CO2 g H2 g H2O g CO g ΔH1 41.4kJ / mol
反应②CO g 2H2 g CH3OH g ΔH2 90.5kJ / mol
总反应的ΔH __________ kJ / mol ;若反应①为决速步,下列示意图中能体现上述反应能
量变化的是__________
(2) 在一定温度和恒容条件下,下列叙述能表明总反应达到平衡状态的是________(填对应字母)
A. 正 H2 3 CH OH CH OH H逆 3 B. 容器中 3 浓度与 2 浓度之比为 1∶3
C. 容器中气体压强保持不变 D. 混合气体的密度保持不变
n H2
(3) 合成总反应在起始物 3n CO 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为2
x CH3OH ,在 T=250℃下的 x CH3OH p、在 p 5 105 Pa 下的x CH3OH T如图所示。
①图中对应等温过程的曲线是__________(填写 a 或 b)。
②从反应初始到平衡点 M 耗时 2min,计算H2 分压的平均变化率为_________Pa·min-1
③有关工业合成甲醇条件选择的说法错误的是
__________(填对应字母)
A.温度越低,越有利于工业生产 CH3OH
B.适当增大 CO2 的浓度,可以提高 H2的平衡
转化率
C.增大压强既加快反应速率又提高转化率,
所以压强越大越好
D.使用选择性高的催化剂可以减少副反应的
发生,提高产率
T/℃
湖北省新高考联考协作体*化学试卷(共 8 页)第 8 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
2023-2024学年度上学期高二年级期末考试
高二化学 B参考答案
一、选择题:每小题 3分,共 45分,每小题只有一个正确选项。
1. D 2. C 3. C 4. C 5. A 6. B 7. A 8. B
9. C 10. D 11. C 12. D 13. B 14. C 15. D
二、填空题:共 55分
16. (共 14分)
(1) ①.CD(2 分,漏选得 1 分) ②5.72(或 5.71或 5.73)(2 分)③>(2 分)
(2) ①.V1=V2<V3(2 分) ②.9:1(或 9,2 分)
(3) ①.10.2(2 分) ②.AD(2 分,漏选得 1 分)
17. (共 14分)
(1) ①b(2分) ②0.60(2 分,答 0.6不得分)
(2) 250mL(棕色)容量瓶、胶头滴管(2 分,每个 1 分,“棕色”可不写,容量瓶不写规格不得分)
(3) 最后半滴 AgNO3溶液加入时,锥形瓶中出现砖红色沉淀,且半分钟不变(2 分,答“出现砖
红色沉淀”可得分)
(4) 0.0800(2 分,答 0.08 得 1 分)
(5) 若 pH过小,发生反应:2CrO -42 +2H+ Cr2O - -72 +H2O使 CrO42 浓度减小,影响滴定终点判
断(2 分,方程式正确,答案合理即可得分)
(6) BD(2 分,漏选得 1 分)
18. (14分)
(1) 3d54s2(2 分)
(2) 8CoOOH+Na2S2O3+7H2SO4=8CoSO4+Na2SO4+11H2O(2 分)
将 Fe2+氧化为 Fe3+便于后续调节 pH除铁,ClO-+2Fe2++2H+=Cl-+2Fe2++H2O(2 分,不写方程式
不扣分)
(3) 5.2~7.6(或 5.2≤pH<7.6或 5.2(4) B(2 分)
(5) 若用CoSO4代替CoCl2,OH-在阳极放电,溶液酸性增强,H+与Co反应,导致Co产率降低(2 分)
(6) 4.8 10 6mol / L (2分)
19. (13分)
(1) -49.1(2 分) D(2 分)
(2) AC(2 分,漏选得 1 分)
(3) ①. a(2 分)②. 3.75×104(3 分)③. AC(2 分,漏选得 1 分)
1
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
高二化学 B 试卷
2024 1 28 试卷满分:100分考试时间: 年 月 日下午 14:30-17:05
注意事项:
1. 答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准
考证号条形码粘贴在答题卡上的指定位置。
2. 选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。写
在试卷、草稿纸和答题卡上的非答题区域均无效。
3. 非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸
和答题卡上的非答题区域均无效。
可能用到的相对原子质量: H 1 C 12 O 16 Na 23 Cl 35.5
一、选择题:本题共 15 小题,每小题 3 分,共 45 分。在每小题给出的四个选项中,只有一项是
符合题目要求的。
1. 生产生活中处处有化学,下列有关说法正确的是
A. 天然硬水呈碱性的原因是其中含有较多的 Mg2+、Ca2+等离子
B. 使用合适催化剂能改变反应历程,降低反应的焓变
C. 明矾中的铝离子可在水中形成胶体,用于水体净化与消毒
D. 金属焊接时用 NH4Cl 溶液除锈,运用了盐类的水解原理
2. 下列化学用语的表达错误的是
A.基态 N 原子的价层电子排布图
B.乙烯的空间填充模型
C.Cl-Cl 的 p p 键的电子云图形:
D NO . 3 的 VSEPR 模型为平面三角形
3. 验证牺牲阳极法,实验操作及现象如下(烧杯内均为经过酸化的 3%NaCl 溶液)。
① ② ③
在 Fe 表面生成蓝色沉淀 试管内无明显变化 试管内生成蓝色沉淀
湖北省新高考联考协作体*化学试卷(共 8 页)第 1 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
下列说法错误的是
A.对比②③,可以判定 Zn 保护了 Fe
B.对比①②,K3[Fe(CN)6]可能将 Fe 氧化
C.将 Zn 换成 Cu,用①的方法可判断 Fe 比 Cu 活泼
D.验证 Zn 保护 Fe 时不能用①的方法
4. 下列说法正确的是
玻璃
搅拌器
A.图①装置向盛装酸溶液的烧杯中加碱溶液时要小心缓慢
B.图②操作可排出盛有 KMnO4 溶液滴定管尖嘴内的气泡
C.图③中反应开始后针筒向右移动,但不能说明反应放热
D.图④装置盐桥中阳离子向 ZnSO4溶液中迁移
5. 可逆反应:mA g +nB g pC g +gD g
的 v-t 图像如图甲所示;若其他条件都不变,只
是在反应前加入合适的催化剂,则其 v-t图像如
图乙所示。现有下列叙述:
① a1=a2 ② a1
⑥ t1=t2 ⑦甲图与乙图中阴影部分的面积相等 ⑧图乙中阴影部分面积更大。
则以上所述各项正确的组合为
A. ②④⑤⑦ B. ②④⑥⑧ C. ②③⑤⑦ D. ②④⑤⑧
6. 某科研小组研究采用 BMED 膜堆(如图所示),模拟精制浓海水为原料直接制备酸碱。BMED
膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、
D)。已知:在直流电源的作用下,双极膜内中间界面
层发生水的解离,生成 H+和 OH-。下列说法错误的是
H+
A.电极 a 连接电源的正极
B.B 为阳离子交换膜
C.电解质溶液采用 Na2SO4溶液可避免有害气体的产生
D.Ⅱ口排出的是淡海水或淡水
湖北省新高考联考协作体*化学试卷(共 8 页)第 2 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
7. 某温度下,向 pH=6 的蒸馏水中加入 NaHSO4 晶体,保持温度不变,测得溶液的 pH 为 2。下
列对该溶液的叙述中,错误的是
A. 该温度下加入等体积 pH=12 的 NaOH 溶液可使该溶液恰好呈中性
B. 该温度高于 25℃
C. 加入 NaHSO4 晶体抑制了水的电离
D + -. 该溶液中由水电离出来的 H 浓度是 1.0×10 10mol/L
8. 下列实验无法达到实验目的的是
D.探究温度对平衡的
A.测定一定时间内 C.探究 X 与 Y 反
B.在铁制钥匙上镀铜 影响,甲中加入生石灰;
生成 H2的反应速率 应的热效应
乙中加入 NH4NO3晶体
A. A B. B C. C D. D
9. 下列说法正确的是
A. 2C(s)+O2(g)=2CO(g) △H= -221kJ/mol,则碳的燃烧热等于 110.5kJ/mol
B. C(石墨,s)=C(金刚石,s) △H= +1.9kJ/mol,则金刚石比石墨稳定
C. 用 CH3COOH 溶液和 NaOH 溶液反应测定中和反应的反应热:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O ( l ) △H> -57.3kJ/mol
D. CaCO3(s)=CaO(s)+CO2(g) △H>0,△S>0,则不论在何种条件下都不可能自发进行
10. 向某恒容密闭容器中充入等物质的量的 PCl3(g)和 Cl2(g),发生如下反应:
PCl3(g) Cl2(g) PCl5(g),测得不同温度下 PCl3(g)的转化率 α 与时间的关系如图所示。
其速率方程为:v正=k正c PCl3 c Cl2 ,v逆=k逆c PCl5 (k 是速率常数,与浓度无关,与温
度、催化剂等有关),下列说法错误的是
A. 该反应的 H 0
k c PCl正 > 5 B. M 点:
k逆 c PCl3 c Cl2
C. 升高温度, k正增大的倍数小于 k逆 增大的倍数
k
D. T1时,若平衡体系中 c Cl2 0.25mol L 1 正,则 =18k逆
湖北省新高考联考协作体*化学试卷(共 8 页)第 3 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
11. 草酸(H2C2O4 )是二元弱酸。某小组做如下两组实验:
实验 I:往 20 mL 0.1 mol L-1 NaHC2O4 溶液中滴加0.1 mol L-1NaOH 溶液。
实验Ⅱ:往 20 mL 0.10 mol L-1NaHC2O4 溶液中滴加0.10 mol L
-1CaCl2 溶液。
[已知:H2C2O4 的电离常数Kal =5.4 10
-2 ,Ka2 =5.4 10
-5 ,Ksp CaC2O4 =2.4 10-9 ,溶液混合后体
积变化忽略不计],下列说法正确的是
A.实验 I 可选用甲基橙作指示剂,指示反应终点
B 2- -.实验 I 中V(NaOH)=10 mL 时,存在 c C2O4
D - 2+ +.实验Ⅱ中,刚开始发生反应 HC2O4 +Ca CaC2O4 +H
12. 锶(Sr)为第五周期 IIA 族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,
工业上常以天青石(主要成分为 SrSO4,含少量 BaSO4) 为原料制备,生产流程如下:
下列叙述错误的是
A.工业上天青石焙烧前先研磨粉碎目的是增大反应物接触面积,提高化学反应速率
B.高温焙烧时,若 0.5mol SrSO4 完全反应转移了 4mol 电子,该反应的化学方程式为:
高温
SrSO4+4C SrS+4CO
C.加入适量 1mol/LH2SO4目的是除去溶液中 Ba2+杂质
D.工业上常电解熔融 SrCl2制锶单质,则 SrCl2·6H2O 制取无水 SrCl2一定要在无水氯化氢
气流中加热 SrCl2·6H2O 失水至恒重
13. CO 用于处理大气污染物 N2O,在催化剂作用下该反应的具体过程如图 1 所示,反应过程中
能量变化情况如图 2 所示。下列说法错误的是
湖北省新高考联考协作体*化学试卷(共 8 页)第 4 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
A. 总反应为 CO(g) +N2O(g) CO2(g) +N2(g)
B. 总反应的决速步为反应②
C +. 该反应催化剂为 Zn ,中间产物为 ZnO+
D. 该总反应的ΔH =-361.22kJ mol 1
14. T℃ 时 , 在 一 固 定 容 积 的 密 闭 容 器 中 发 生 反 应 :
A g B g C s H 0,按照不同配比充入 A、B,
达到平衡时容器中 A、B 浓度变化如图中曲线(实线)所示,
下列判断正确的是
A. T℃时,该反应的平衡常数值为 4
B. c 点没有达到平衡,此时反应向逆向进行
C. 若 c 点为平衡点,则此时容器内的温度高于 T℃
D. T℃时,直线 cd 上的点均为平衡状态
15. 常温下 H3PO4在水中各级电离的过程如图所示。已知: pK= -lgK。
下列相关说法正确的是
A. 反应 H3PO4+2PO3 4 3HPO2 4 pK=16
B. Na2HPO4溶液中: c(PO3 )>2c(H PO )+c(H PO-4 3 4 2 4)
C. 用 NaOH 溶液滴定 NaH2PO4溶液时宜选用甲基橙做
指示剂
D. H3PO4和 Na3PO4组成的混合溶液 pH=6 时,溶液中:
c(H2PO-4)>c(HPO2 4 )>c(H3PO4)
二、非选择题:本题共 4 小题,共 55 分。
16. (14 分)
(1) 现有常温下 pH=2 的盐酸(甲)、pH=2 的醋酸溶液(乙)和 0.1mol/LNH3 H2O(丙),请根据下
列操作回答:
①常温下,将丙溶液加水稀释,下列数值变大的是_____(填字母)。
c NH3 H O c OH 2
A n NH
c NH4
. c H c OH B. c C. D.H 4 c NH3 H2O
②已知 Ka (CH3COOH) =1.75×10-5 ,则醋酸溶液(乙)的浓度为_____mol/L(结果保留三
位有效数字)。
③常温下,取甲、乙各 1mL 分别稀释至 100mL,稀释后,溶液的 pH:甲_____乙(填“>”
“<”或“=”)。
(2) ①相同条件下,取体积、等 pH 的 Ba(OH)2、NaOH 和 NH3 H2O 三种碱溶液,分别滴加等浓
度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2 、V3,则三者的大小关系为_____。
湖北省新高考联考协作体*化学试卷(共 8 页)第 5 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
②某温度下, = 1.0 × 10-12,将 Va L pH=4 的 HCl 溶液和 Vb L pH=9 的 Ba(OH)2 溶液混
合均匀,测得溶液的 pH=7,则 Va:Vb=_____。
(3) 已知:在 25℃,有关弱电解质的电离平衡常数如下表:
弱电解质 H2SO3 H2CO3 HClO NH3 H2O
Ka1 1.54 10
2 Ka1 4.2 10
7
8 5
电离平衡常数 7 11 Ka 4.7 10 Kb 1.8 10Ka 2 1.02 10 Ka 2 5.6 10
c SO2
- - - 3
①将 SO2通入氨水中,当 c(OH )降至 1.0×10 6mol L 1 时,溶液中的
c HSO =_____。3
②下列微粒在溶液中不能大量共存的是_____。
A SO2 HClO B ClO 2 . 3 、 . 、HCO3 C.HClO、HCO 3 D.HSO3 、CO3
17. (14 分)分析化学滴定法有酸碱中和滴定、沉淀滴定、氧化还原滴定等。沉淀滴定法可用于
NaCl 溶液中 c(Cl-)的测定。实验过程包括准备标准溶液和滴定待测溶液。
已知: ①Ag2CrO 是一种砖红色沉淀;
②已知 sp AgCl = 1.56 × 10
10 sp Ag CrO = 1.1 × 10
12
Ⅰ.准备标准溶液: 准确称取 AgNO 基准物 4.2468g(0.0250mol)后, 配制成 250mL 标准
溶液,放在棕色试剂瓶中避光保存,备用。
Ⅱ.滴定待测溶液。其主要步骤如下:
a.取待测 NaCl 溶液 25.00 mL 于锥形瓶中;
b.加入 1mL5% K2CrO 溶液;
c.在不断摇动下用 AgNO 标准溶液滴定,当接近终点时,需逐滴加入 AgNO 溶液,并用
力振荡。记下终点时消耗 AgNO 标准溶液的体积;
d.重复上述操作两次。三次测定数据如下表:
实验序号 1 2 3
消耗 AgNO 标准溶液体积/mL 20.45 20.02 19.98
e.数据处理。
回答下列问题:
(1) ①滴定前,装有 AgNO 标准液的滴定管排气泡时,
应选择右图中的________ (填对应字母)。
②读取盛装标准 AgNO 的滴定管初始读数。若液面
位置如图所示,则此时读数为_________mL。
(2) 将称得的 AgNO 配制成标准溶液时,所使用的仪器除烧杯和玻璃棒外还有
______________________________。
湖北省新高考联考协作体*化学试卷(共 8 页)第 6 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
(3) 滴定终点的现象是__________________________________________ 。
(4) 测得 c(Cl-)=_________mol·L-1。
(5) 滴定时需控制溶液的 pH 在一定范围内,若 pH 过小对实验的影响是______________________。
(结合离子方程式说明)
(6) 下列关于实验的说法合理的是_______________(填对应字母)。
A. 滴定过程中滴定管尖嘴不得接触锥形瓶内壁
B. 若在配制 AgNO 标准溶液时,烧杯中的溶液有少量溅出,则最终测定结果偏高
C. 为使终点现象更加明显,可改加 5 5%K CrO 溶液
D. 滴定过程中可用蒸馏水将锥形瓶内壁上粘附的溶液冲下
18. (14 分)水钴矿主要成分为 CoOOH,同时含有少量 Fe、Al、Mn、Mg、Ca、Ni 的氧化物及其
他杂质。用水钴矿制取 Co 的工艺流程如图甲所示:
已知:加萃取剂目的是除锰和除镍,部分阳离子形成氢氧化物沉淀时,溶液 pH 见下表:
沉淀物 Fe(OH)2 Fe(OH)3 Co(OH)2 Mn(OH)2 Al(OH)3
开始沉淀时的 pH 7.0 2.7 7.6 7.7 4.0
沉淀完全时的 pH 9.6 3.7 9.2 9.8 5.2
请回答下列问题:
(1) 基态 Mn 原子的价层电子排布式为_______。
(2) “还原酸浸”中主要发生的氧化还原反应的化学方程式是__________。浸出液中加入 NaClO
溶液的目的:_________________________________________。
(3) 浸出过程中加入 Na2CO3调 pH 的范围是_______________。
(4) 如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。
萃取剂合适的 pH 为_____(填对应字母)。
A.2~3 B.3~4
C.6~7 D.7~8
(5) Co 能与强酸反应产生 H2,工业上采用惰性电极电解 CoCl2 溶液制取钴,不能用 CoSO4 溶液
代替 CoCl2溶液的理由是_________。
湖北省新高考联考协作体*化学试卷(共 8 页)第 7 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
2 5
(6) 一定温度下,向滤液Ⅰ中 NaF溶液,若所得滤液Ⅱ中 c Mg 1.0 10 mol / L ,则滤液Ⅱ
c Ca 2 11中 为___________(保留 2 位有效数字)[已知该温度下 Ksp CaF2 3.4 10 ,
Ksp MgF2 7.1 10 11 ]。
19. (13 分)CO2 氢化合成甲醇技术的工业化量产研究,利用反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) H ,可减少 CO2 排放并合成清洁能源,实现可持
续发展。
(1) 一般认为该反应通过如下两个步骤反应来实现:
反应①CO2 g H2 g H2O g CO g ΔH1 41.4kJ / mol
反应②CO g 2H2 g CH3OH g ΔH2 90.5kJ / mol
总反应的ΔH __________ kJ / mol ;若反应①为决速步,下列示意图中能体现上述反应能
量变化的是__________
(2) 在一定温度和恒容条件下,下列叙述能表明总反应达到平衡状态的是________(填对应字母)
A. 正 H2 3 CH OH CH OH H逆 3 B. 容器中 3 浓度与 2 浓度之比为 1∶3
C. 容器中气体压强保持不变 D. 混合气体的密度保持不变
n H2
(3) 合成总反应在起始物 3n CO 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为2
x CH3OH ,在 T=250℃下的 x CH3OH p、在 p 5 105 Pa 下的x CH3OH T如图所示。
①图中对应等温过程的曲线是__________(填写 a 或 b)。
②从反应初始到平衡点 M 耗时 2min,计算H2 分压的平均变化率为_________Pa·min-1
③有关工业合成甲醇条件选择的说法错误的是
__________(填对应字母)
A.温度越低,越有利于工业生产 CH3OH
B.适当增大 CO2 的浓度,可以提高 H2的平衡
转化率
C.增大压强既加快反应速率又提高转化率,
所以压强越大越好
D.使用选择性高的催化剂可以减少副反应的
发生,提高产率
T/℃
湖北省新高考联考协作体*化学试卷(共 8 页)第 8 页
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
2023-2024学年度上学期高二年级期末考试
高二化学 B参考答案
一、选择题:每小题 3分,共 45分,每小题只有一个正确选项。
1. D 2. C 3. C 4. C 5. A 6. B 7. A 8. B
9. C 10. D 11. C 12. D 13. B 14. C 15. D
二、填空题:共 55分
16. (共 14分)
(1) ①.CD(2 分,漏选得 1 分) ②5.72(或 5.71或 5.73)(2 分)③>(2 分)
(2) ①.V1=V2<V3(2 分) ②.9:1(或 9,2 分)
(3) ①.10.2(2 分) ②.AD(2 分,漏选得 1 分)
17. (共 14分)
(1) ①b(2分) ②0.60(2 分,答 0.6不得分)
(2) 250mL(棕色)容量瓶、胶头滴管(2 分,每个 1 分,“棕色”可不写,容量瓶不写规格不得分)
(3) 最后半滴 AgNO3溶液加入时,锥形瓶中出现砖红色沉淀,且半分钟不变(2 分,答“出现砖
红色沉淀”可得分)
(4) 0.0800(2 分,答 0.08 得 1 分)
(5) 若 pH过小,发生反应:2CrO -42 +2H+ Cr2O - -72 +H2O使 CrO42 浓度减小,影响滴定终点判
断(2 分,方程式正确,答案合理即可得分)
(6) BD(2 分,漏选得 1 分)
18. (14分)
(1) 3d54s2(2 分)
(2) 8CoOOH+Na2S2O3+7H2SO4=8CoSO4+Na2SO4+11H2O(2 分)
将 Fe2+氧化为 Fe3+便于后续调节 pH除铁,ClO-+2Fe2++2H+=Cl-+2Fe2++H2O(2 分,不写方程式
不扣分)
(3) 5.2~7.6(或 5.2≤pH<7.6或 5.2
(5) 若用CoSO4代替CoCl2,OH-在阳极放电,溶液酸性增强,H+与Co反应,导致Co产率降低(2 分)
(6) 4.8 10 6mol / L (2分)
19. (13分)
(1) -49.1(2 分) D(2 分)
(2) AC(2 分,漏选得 1 分)
(3) ①. a(2 分)②. 3.75×104(3 分)③. AC(2 分,漏选得 1 分)
1
{#{QQABZQSEggCIAABAAQhCQwHKCkIQkACACCoGxFAEMAAAiAFABAA=}#}
同课章节目录
