1.3.3氧化还原反应的表示方法 课件 (共29页) 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.3氧化还原反应的表示方法 课件 (共29页) 高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-30 10:14:33 | ||
图片预览




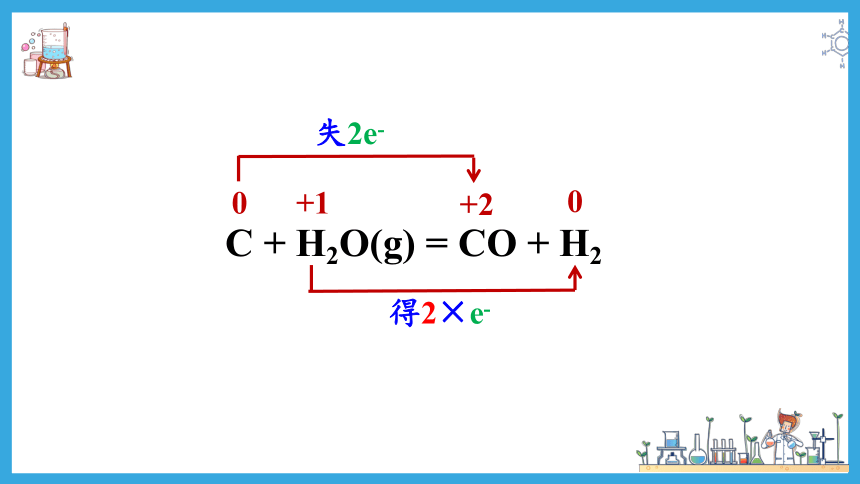
文档简介
(共29张PPT)
第一章 物质及其变化
第三节 氧化还原反应
1. 3. 3 氧化还原反应的表示方法
学习目标
能从电子转移的角度理解氧化剂和还原剂的关系,会用双线桥法、单线桥法表示氧化还原反应中电子转移的方向和数目,培养学生的变化观念与平衡思想。
2Na + Cl2 = 2NaCl
点燃
失2×e-,化合价升高,被氧化
得2×e-,化合价降低,被还原
0
+1
-1
0
反应中每个Na失去1个电子,一共有2个Na失电子,表示为失去2×e-;
反应中每个Cl得到1个电子,一共有2个Cl得电子,表示为得到2×e-。
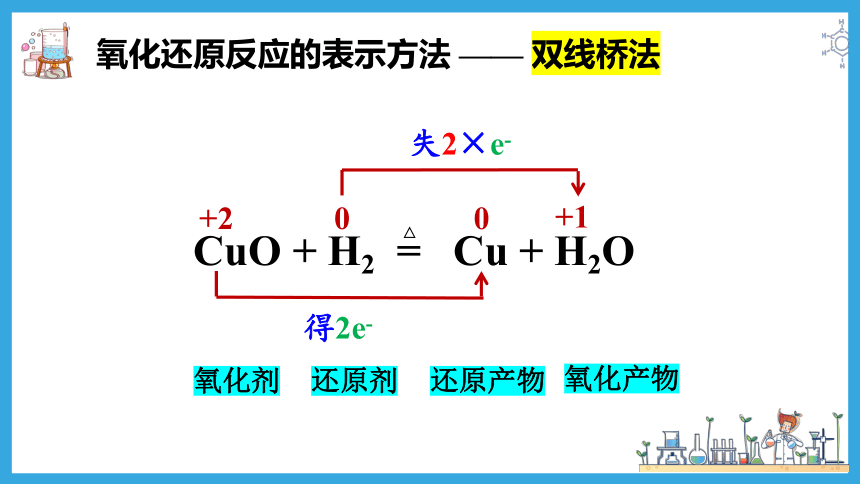
氧化还原反应的表示方法 —— 双线桥法
还原剂
氧化剂
氧化产物
还原产物
+2
失2×e-
得2e-
0
0
+1
CuO + H2 = Cu + H2O
△
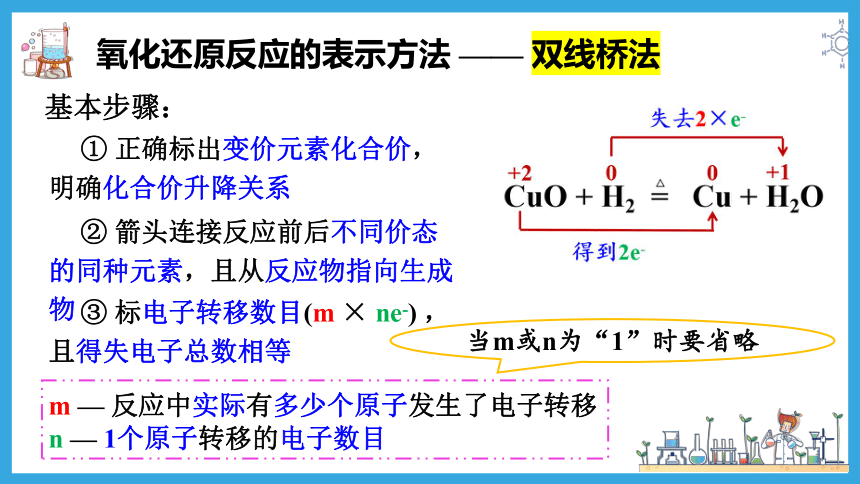
氧化还原反应的表示方法 —— 双线桥法
还原剂
氧化剂
氧化产物
还原产物
氧化还原反应的表示方法 —— 双线桥法
③ 标电子转移数目(m × ne-) ,且得失电子总数相等
② 箭头连接反应前后不同价态的同种元素,且从反应物指向生成物
m — 反应中实际有多少个原子发生了电子转移
n — 1个原子转移的电子数目
基本步骤:
① 正确标出变价元素化合价,明确化合价升降关系
当m或n为“1”时要省略
【练习】用双线桥法表示下列氧化还原反应?
① C + H2O(g) = CO + H2
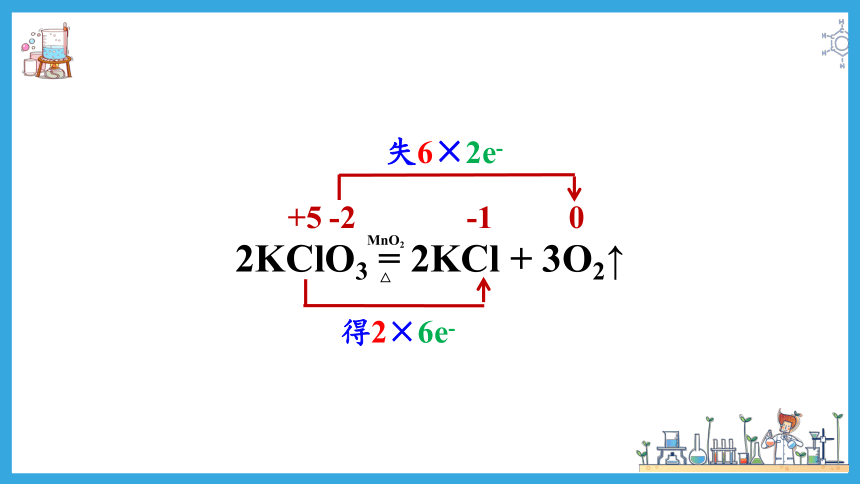
② 2KClO3 = 2KCl + 3O2↑
③ 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
④ NO + NO2 + 2NaOH = 2NaNO2 + H2O
⑤ 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
高温
△
MnO2
C + H2O(g) = CO + H2
0
+2
+1
0
失2e-
得2×e-
2KClO3 = 2KCl + 3O2↑
△
MnO2
-2
0
+5
-1
失6×2e-
得2×6e-
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0
+2
失3×2e-
+5
+2
得2×3e-
该反应中HNO3体现 、 性,其中 个HNO3体现 性, 个HNO3体现 性;氧化剂与还原剂的分子个数比 ,生成2个H2O时共转移了 个电子。
酸性
氧化
6
酸
2
氧化
2 : 3
3
NO + NO2 + 2NaOH = 2NaNO2 + H2O
+2
+3
失e-
得e-
+4
该反应是归中反应,不同反应物中氮原子化合价既升高又降低,发生氧化反应和还原反应的氮原子个数比为 ,氧化产物与还原产物的分子个数比是 。
1 : 1
1 : 1
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
0
+5
失5e-
-1
得5×e-
该反应是歧化反应,同一反应物中氯原子化合价既升高又降低,发生氧化反应和还原反应的氯原子个数比为 。
1 : 5
氧化还原反应的表示方法 —— 单线桥法
还原剂 + 氧化剂 = 氧化产物 + 还原产物
e-
有失电子能力
有得电子能力
CuO + H2 = Cu + H2O
△
2e-
① 箭头由失电子元素指向得电子元素
② 只须标明电子转移总数
基本步骤:
【练习】用双线桥法表示下列氧化还原反应?
① 3S + 4HNO3 = 3SO2↑ + 4NO↑ + 2H2O
② MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O
③ 2H2S + SO2 = 3S↓ + 2H2O
④ 3S + 6KOH = K2SO3 + 2K2S + 3H2O
⑤ 6HCl + KClO3 = KCl + 3Cl2↑ + 3H2O
⑥ CaH2 + 2H2O = Ca(OH)2 + 2H2↑
△
3S + 4HNO3 = 3SO2↑ + 4NO↑ + 2H2O
0
+4
失3×4e-
+5
+2
得4×3e-
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O
+4
+2
0
-1
失2×e-
得2e-
该反应中HCl体现 、 性,其中 个HCl体现 性, 个HCl体现 性;氧化剂与还原剂的分子个数比 ,生成1个Cl2时共转移了
个电子。
酸性
还原
2
酸
2
还原
1 : 2
2
2H2S + SO2 = 3S↓ + 2H2O
-2
0
+4
失2×2e-
得4e-
发生氧化反应和还原反应的硫原子个数比为 。
2 : 1
3S + 6KOH = K2SO3 + 2K2S + 3H2O
0
+4
失4e-
-2
得2×2e-
发生氧化反应和还原反应的硫原子个数比为 。
1 : 2
6HCl + KClO3 = KCl + 3Cl2↑ + 3H2O
-1
0
失5×e-
+5
得5e-
该反应中HCl体现 、 性,其中 个HCl体现 性, 个HCl体现 性;氧化剂与还原剂的分子个数比 ,生成1个Cl2时共转移了
个电子。
酸性
还原
1
酸
5
还原
1 : 5
5
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
0
-1
失2×e-
得2×e-
+1
【练习】用双线桥法和单线桥法表示下列氧化还原反应?
① 2P + 5Cl2 = 2PCl5
② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
③ 6NO + 4NH3 = 5N2 + 6H2O
④ 3NO2 + H2O = 2HNO3 + NO
⑤ H2O2 + 2H+ + 2Fe2+ = 2Fe3+ + 2H2O
⑥ S + 2KNO3 + 3C = N2↑ + K2S + 3CO2↑
⑦ 4FeS2 + 11O2 = 8SO2 + 2Fe2O3
点燃
2P + 5Cl2 = 2PCl5
点燃
0
+5
失2×5e-
0
-1
得10×e-
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
-1
0
失10×e-
+7
+2
得2×5e-
6NO + 4NH3 = 5N2 + 6H2O
-3
0
失4×3e-
+2
得6×2e-
3NO2 + H2O = 2HNO3 + NO
+4
+5
失2×e-
+2
得2e-
H2O2 + 2H+ + 2Fe2+ = 2Fe3+ + 2H2O
+2
+3
失2×e-
-1
-2
得2×e-
S + 2KNO3 + 3C = N2↑ + K2S + 3CO2↑
0
+4
失3×4e-
0
-2
得2e-
+5
0
得2×5e-
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
-1
+4
失去8×5e-
+2
+3
失去4×e-
0
-2
得到16×2e-
-2
得到6×2e-
1、下列氧化还原反应中电子转移的表示方法正确的是( )
B. 2Na + 2H2O = 2NaOH + H2↑
C. Cl2 + 2FeCl2 = 2FeCl3
A. 2KClO3 2KCl + 3O2↑
失去6e-
得到6e-
2e-
失去2e-
得到2e-
D. 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
6e-
B
2、下列氧化还原反应中电子转移的表示方法正确的是( )
A.
B.
C.
D.
B
第一章 物质及其变化
第三节 氧化还原反应
1. 3. 3 氧化还原反应的表示方法
学习目标
能从电子转移的角度理解氧化剂和还原剂的关系,会用双线桥法、单线桥法表示氧化还原反应中电子转移的方向和数目,培养学生的变化观念与平衡思想。
2Na + Cl2 = 2NaCl
点燃
失2×e-,化合价升高,被氧化
得2×e-,化合价降低,被还原
0
+1
-1
0
反应中每个Na失去1个电子,一共有2个Na失电子,表示为失去2×e-;
反应中每个Cl得到1个电子,一共有2个Cl得电子,表示为得到2×e-。
氧化还原反应的表示方法 —— 双线桥法
还原剂
氧化剂
氧化产物
还原产物
+2
失2×e-
得2e-
0
0
+1
CuO + H2 = Cu + H2O
△
氧化还原反应的表示方法 —— 双线桥法
还原剂
氧化剂
氧化产物
还原产物
氧化还原反应的表示方法 —— 双线桥法
③ 标电子转移数目(m × ne-) ,且得失电子总数相等
② 箭头连接反应前后不同价态的同种元素,且从反应物指向生成物
m — 反应中实际有多少个原子发生了电子转移
n — 1个原子转移的电子数目
基本步骤:
① 正确标出变价元素化合价,明确化合价升降关系
当m或n为“1”时要省略
【练习】用双线桥法表示下列氧化还原反应?
① C + H2O(g) = CO + H2
② 2KClO3 = 2KCl + 3O2↑
③ 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
④ NO + NO2 + 2NaOH = 2NaNO2 + H2O
⑤ 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
高温
△
MnO2
C + H2O(g) = CO + H2
0
+2
+1
0
失2e-
得2×e-
2KClO3 = 2KCl + 3O2↑
△
MnO2
-2
0
+5
-1
失6×2e-
得2×6e-
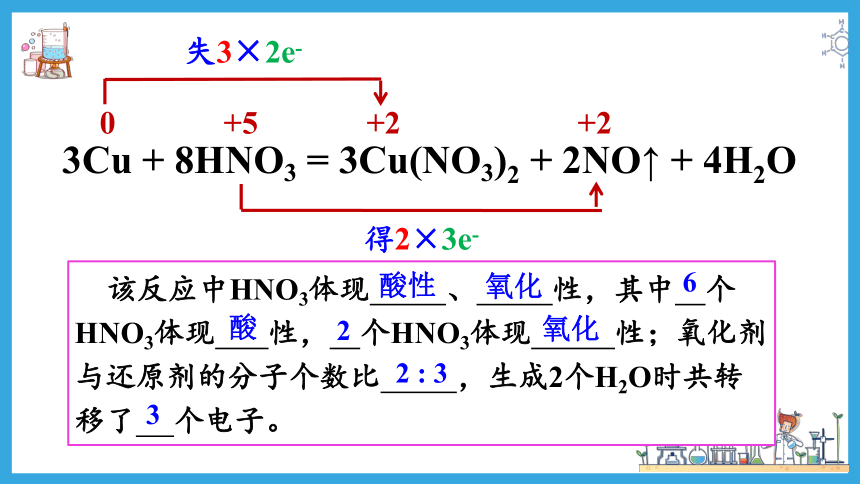
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0
+2
失3×2e-
+5
+2
得2×3e-
该反应中HNO3体现 、 性,其中 个HNO3体现 性, 个HNO3体现 性;氧化剂与还原剂的分子个数比 ,生成2个H2O时共转移了 个电子。
酸性
氧化
6
酸
2
氧化
2 : 3
3
NO + NO2 + 2NaOH = 2NaNO2 + H2O
+2
+3
失e-
得e-
+4
该反应是归中反应,不同反应物中氮原子化合价既升高又降低,发生氧化反应和还原反应的氮原子个数比为 ,氧化产物与还原产物的分子个数比是 。
1 : 1
1 : 1
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
0
+5
失5e-
-1
得5×e-
该反应是歧化反应,同一反应物中氯原子化合价既升高又降低,发生氧化反应和还原反应的氯原子个数比为 。
1 : 5
氧化还原反应的表示方法 —— 单线桥法
还原剂 + 氧化剂 = 氧化产物 + 还原产物
e-
有失电子能力
有得电子能力
CuO + H2 = Cu + H2O
△
2e-
① 箭头由失电子元素指向得电子元素
② 只须标明电子转移总数
基本步骤:
【练习】用双线桥法表示下列氧化还原反应?
① 3S + 4HNO3 = 3SO2↑ + 4NO↑ + 2H2O
② MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O
③ 2H2S + SO2 = 3S↓ + 2H2O
④ 3S + 6KOH = K2SO3 + 2K2S + 3H2O
⑤ 6HCl + KClO3 = KCl + 3Cl2↑ + 3H2O
⑥ CaH2 + 2H2O = Ca(OH)2 + 2H2↑
△
3S + 4HNO3 = 3SO2↑ + 4NO↑ + 2H2O
0
+4
失3×4e-
+5
+2
得4×3e-
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O
+4
+2
0
-1
失2×e-
得2e-
该反应中HCl体现 、 性,其中 个HCl体现 性, 个HCl体现 性;氧化剂与还原剂的分子个数比 ,生成1个Cl2时共转移了
个电子。
酸性
还原
2
酸
2
还原
1 : 2
2
2H2S + SO2 = 3S↓ + 2H2O
-2
0
+4
失2×2e-
得4e-
发生氧化反应和还原反应的硫原子个数比为 。
2 : 1
3S + 6KOH = K2SO3 + 2K2S + 3H2O
0
+4
失4e-
-2
得2×2e-
发生氧化反应和还原反应的硫原子个数比为 。
1 : 2
6HCl + KClO3 = KCl + 3Cl2↑ + 3H2O
-1
0
失5×e-
+5
得5e-
该反应中HCl体现 、 性,其中 个HCl体现 性, 个HCl体现 性;氧化剂与还原剂的分子个数比 ,生成1个Cl2时共转移了
个电子。
酸性
还原
1
酸
5
还原
1 : 5
5
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
0
-1
失2×e-
得2×e-
+1
【练习】用双线桥法和单线桥法表示下列氧化还原反应?
① 2P + 5Cl2 = 2PCl5
② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
③ 6NO + 4NH3 = 5N2 + 6H2O
④ 3NO2 + H2O = 2HNO3 + NO
⑤ H2O2 + 2H+ + 2Fe2+ = 2Fe3+ + 2H2O
⑥ S + 2KNO3 + 3C = N2↑ + K2S + 3CO2↑
⑦ 4FeS2 + 11O2 = 8SO2 + 2Fe2O3
点燃
2P + 5Cl2 = 2PCl5
点燃
0
+5
失2×5e-
0
-1
得10×e-
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
-1
0
失10×e-
+7
+2
得2×5e-
6NO + 4NH3 = 5N2 + 6H2O
-3
0
失4×3e-
+2
得6×2e-
3NO2 + H2O = 2HNO3 + NO
+4
+5
失2×e-
+2
得2e-
H2O2 + 2H+ + 2Fe2+ = 2Fe3+ + 2H2O
+2
+3
失2×e-
-1
-2
得2×e-
S + 2KNO3 + 3C = N2↑ + K2S + 3CO2↑
0
+4
失3×4e-
0
-2
得2e-
+5
0
得2×5e-
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
-1
+4
失去8×5e-
+2
+3
失去4×e-
0
-2
得到16×2e-
-2
得到6×2e-
1、下列氧化还原反应中电子转移的表示方法正确的是( )
B. 2Na + 2H2O = 2NaOH + H2↑
C. Cl2 + 2FeCl2 = 2FeCl3
A. 2KClO3 2KCl + 3O2↑
失去6e-
得到6e-
2e-
失去2e-
得到2e-
D. 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
6e-
B
2、下列氧化还原反应中电子转移的表示方法正确的是( )
A.
B.
C.
D.
B
