1.3.5氧化还原反应的配平-氧化还原反应 课件 (共21页)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.5氧化还原反应的配平-氧化还原反应 课件 (共21页)高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 54.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-30 10:18:23 | ||
图片预览





文档简介
(共21张PPT)
第一章 物质及其变化
第三节 氧化还原反应
1. 3. 5 氧化还原反应方程式的配平
氧化还原反应方程式的配平
一、配平三大原则
得失电子守恒
元素化合价升高总数 = 元素化合价降低总数
还原剂失电子总数 = 氧化剂得电子总数
质量守恒
反应前后原子的种类和个数不变
电荷守恒
在离子反应方程式中,反应前后的阴、阳离子所带的电荷总数相等
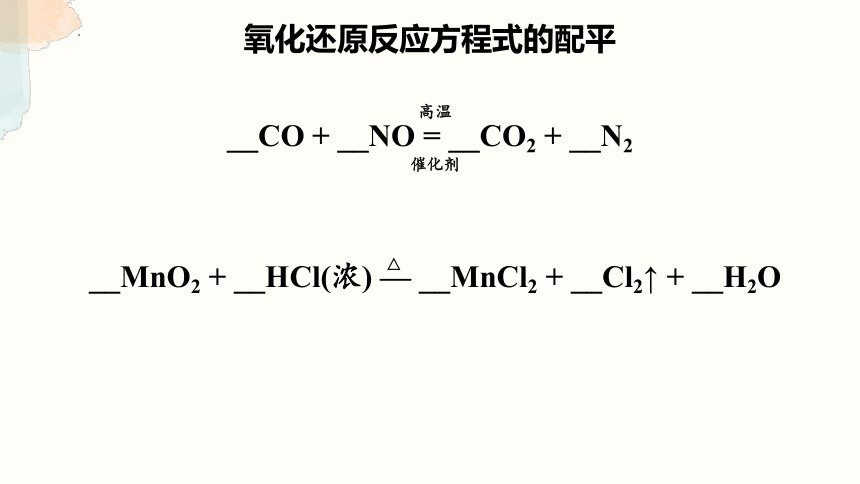
氧化还原反应方程式的配平
__CO + __NO = __CO2 + __N2
催化剂
高温
__MnO2 + __HCl(浓) — __MnCl2 + __Cl2↑ + __H2O
△
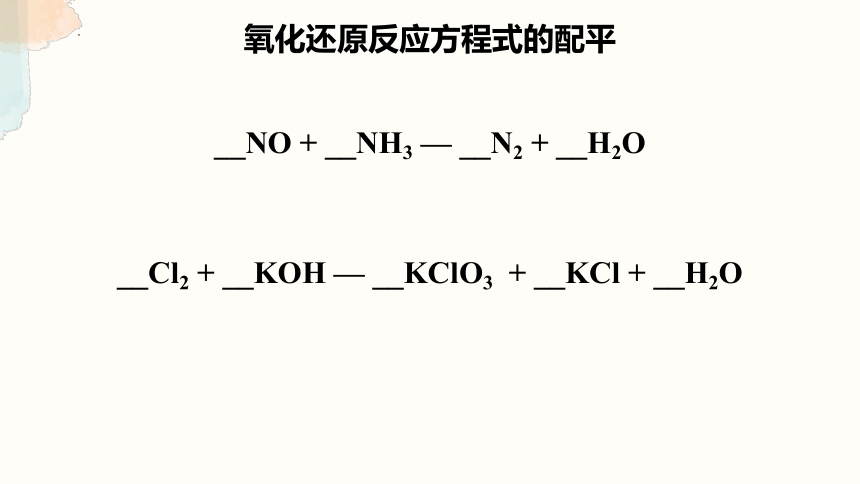
氧化还原反应方程式的配平
__NO + __NH3 — __N2 + __H2O
__Cl2 + __KOH — __KClO3 + __KCl + __H2O
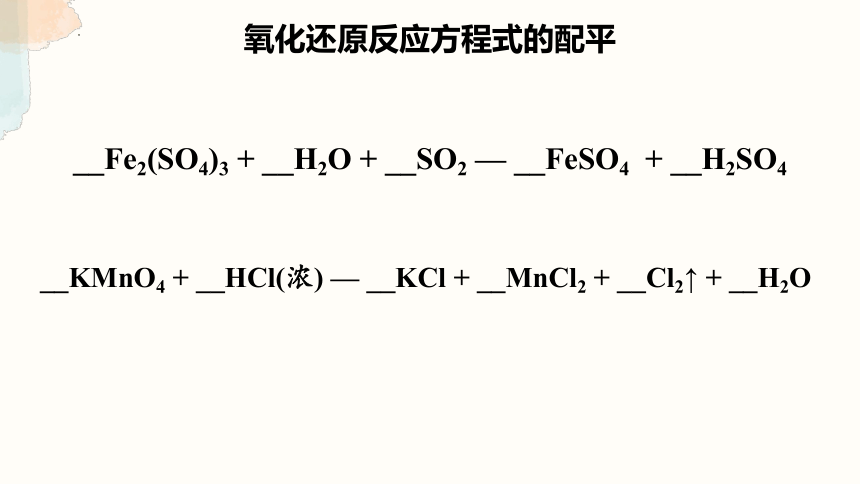
氧化还原反应方程式的配平
__Fe2(SO4)3 + __H2O + __SO2 — __FeSO4 + __H2SO4
__KMnO4 + __HCl(浓) — __KCl + __MnCl2 + __Cl2↑ + __H2O
氧化还原反应方程式的配平
二、基本步骤
“一标 二等 三定 四查”
1、标变价:标出反应中发生了变化的元素的化合价,并列出化合价的变化
2、求总数:通过求最小公倍数使化合价升降总数相等
3、定系数:确定氧化剂、还原剂、氧化产物和还原产物的化学计量数。用观察法配平其他各物质的化学计量数
4、查守恒:检查反应前后是否满足得失电子守恒、质量守恒和电荷守恒
氧化还原反应方程式的配平
1、标化合价
2、选升、降基准物,其原则为:化合价全升或全降
① 完全氧化还原反应,选 的物质做基准物;
② 部分氧化还原反应,选变价部分对应的 做基准物;
③ 归中反应,选 做基准物;歧化反应,选 做基准物;
④ 几升一降反应,选 做基准物。
3、根据基准物中变价元素的原子个数,标升的总数和降的总数
4、由升降总数约分,交叉反写,得基准物的系数再用观察法得其它物质的系数
5、最后,常用O原子是否守恒来检查
氧化剂、还原剂或氧化产物、还原产物
右边
左边
右边
所有变价元素
氧化还原反应方程式的配平
_FeSO4 + _KMnO4 + _H2SO4 — _Fe2(SO4)3 + _K2SO4 + _MnSO4 + _H2O
__KI + __KIO3 + __H2SO4 — __I2 + __K2SO4 + __H2O
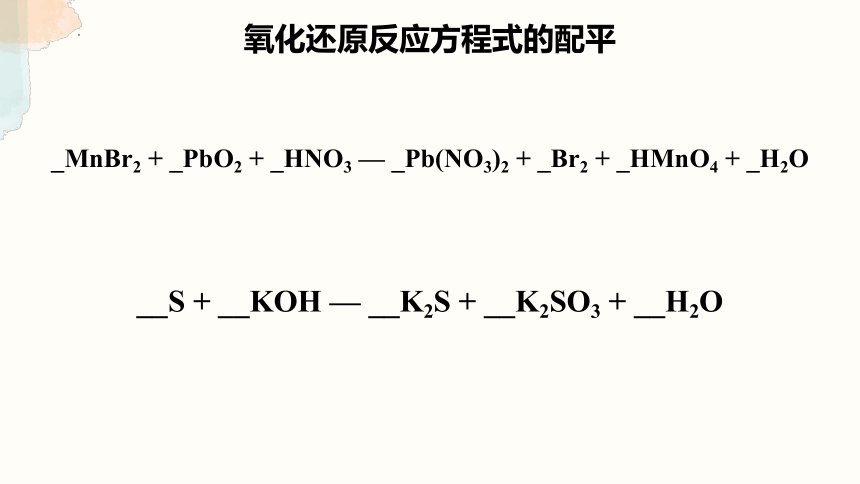
__S + __KOH — __K2S + __K2SO3 + __H2O
氧化还原反应方程式的配平
_MnBr2 + _PbO2 + _HNO3 — _Pb(NO3)2 + _Br2 + _HMnO4 + _H2O
氧化还原反应方程式的配平
特殊方程式的配平(设“ 1 ”法)或(设“ 0 ”法)
_Fe3C4 + _HNO3 — _Fe(NO3)3 + _NO↑ + _CO2↑ + _H2O
_CuFeS2 + _H+ + _NO3- — _Cu2+ + _Fe3+ + _SO42- + _NO↑ + _H2O
氧化还原反应方程式的配平
缺项配平
Cr2O72- + Fe2+ + ( ) → Cr3+ + Fe3+ + H2O
【注意】配平检查时,应注意质量守恒和电荷守恒!
缺项:一般为H+或OH-或H2O
氧化还原反应方程式的配平
缺项配平
【练习】请配平以下离子方程式:
(1)在酸性条件下,SO2通入FeCl3溶液中反应离子方程式为:
__Fe3+ + __SO2 + __H2O = __Fe2+ + __SO42- + __( )
氧化还原反应方程式的配平
缺项配平
【练习】请配平以下离子方程式:
(2)
__ClO- + __Fe(OH)3 + __( ) = __Cl- + __FeO42- + __H2O
氧化还原反应方程式的配平
缺项配平
【练习】请配平以下离子方程式:
(3)
__MnO4- + __I- + __(___) = __Mn2+ + __IO3- + __H2O
生活中常用ClO2、KMnO4、O3、H2O2这些物质杀菌消毒,这是利用它们的什么性质?
【实验探究1】生活中常用双氧水(H2O2溶液)杀菌消毒,是利用了过氧化氢的强氧化性,请你设计实验方案证明过氧化氢具有强氧化性?
(可供选择的实验试剂:H2O2溶液、酸性KMnO4溶液、稀硫酸、NaOH溶液、淀粉KI溶液)
分析:KMnO4是常见的氧化剂,KI中碘元素处于最低价,具有比较强的还原性
【实验探究2】从价态上分析,过氧化氢中氧元素处于中间价态,除了体现出氧化性,还能体现出一定的还原性,请你设计实验方案证明过氧化氢具有还原性?
(可供选择的实验试剂:H2O2溶液、酸性KMnO4溶液、氢硫酸(H2S溶液)、盐酸、氢氧化钠溶液,淀粉KI溶液)
H2O2 + 2KI + H2SO4 = 2H2O + I2 + K2SO4
5H2O2 + 2KMnO4 + 3H2SO4= K2SO4 + 2MnSO4 + 5O2↑ + 8H2O
1、人体正常的血红蛋白中应含有Fe2+。若误食亚硝酸钠,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒,服用维生素C可解除亚硝酸钠中毒。下列叙述中正确的是( )
A. 亚硝酸钠表现还原性
B. 维生素C表现还原性
C. 亚硝酸钠被氧化
D. 维生素C作为氧化剂
B
2、关于物质氧化性及还原性的强弱,下列说法中正确的是( )
A. 物质越易失电子,还原性越强
B. 原子失电子越多,还原性越强
C. 元素化合价降低越多,氧化性越强
D. 物质越易被氧化,氧化性越强
A
3、已知三个氧化还原反应:
①2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
②2FeCl2 + Cl2 = 2FeCl3
③2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是( )
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
C
第一章 物质及其变化
第三节 氧化还原反应
1. 3. 5 氧化还原反应方程式的配平
氧化还原反应方程式的配平
一、配平三大原则
得失电子守恒
元素化合价升高总数 = 元素化合价降低总数
还原剂失电子总数 = 氧化剂得电子总数
质量守恒
反应前后原子的种类和个数不变
电荷守恒
在离子反应方程式中,反应前后的阴、阳离子所带的电荷总数相等
氧化还原反应方程式的配平
__CO + __NO = __CO2 + __N2
催化剂
高温
__MnO2 + __HCl(浓) — __MnCl2 + __Cl2↑ + __H2O
△
氧化还原反应方程式的配平
__NO + __NH3 — __N2 + __H2O
__Cl2 + __KOH — __KClO3 + __KCl + __H2O
氧化还原反应方程式的配平
__Fe2(SO4)3 + __H2O + __SO2 — __FeSO4 + __H2SO4
__KMnO4 + __HCl(浓) — __KCl + __MnCl2 + __Cl2↑ + __H2O
氧化还原反应方程式的配平
二、基本步骤
“一标 二等 三定 四查”
1、标变价:标出反应中发生了变化的元素的化合价,并列出化合价的变化
2、求总数:通过求最小公倍数使化合价升降总数相等
3、定系数:确定氧化剂、还原剂、氧化产物和还原产物的化学计量数。用观察法配平其他各物质的化学计量数
4、查守恒:检查反应前后是否满足得失电子守恒、质量守恒和电荷守恒
氧化还原反应方程式的配平
1、标化合价
2、选升、降基准物,其原则为:化合价全升或全降
① 完全氧化还原反应,选 的物质做基准物;
② 部分氧化还原反应,选变价部分对应的 做基准物;
③ 归中反应,选 做基准物;歧化反应,选 做基准物;
④ 几升一降反应,选 做基准物。
3、根据基准物中变价元素的原子个数,标升的总数和降的总数
4、由升降总数约分,交叉反写,得基准物的系数再用观察法得其它物质的系数
5、最后,常用O原子是否守恒来检查
氧化剂、还原剂或氧化产物、还原产物
右边
左边
右边
所有变价元素
氧化还原反应方程式的配平
_FeSO4 + _KMnO4 + _H2SO4 — _Fe2(SO4)3 + _K2SO4 + _MnSO4 + _H2O
__KI + __KIO3 + __H2SO4 — __I2 + __K2SO4 + __H2O
__S + __KOH — __K2S + __K2SO3 + __H2O
氧化还原反应方程式的配平
_MnBr2 + _PbO2 + _HNO3 — _Pb(NO3)2 + _Br2 + _HMnO4 + _H2O
氧化还原反应方程式的配平
特殊方程式的配平(设“ 1 ”法)或(设“ 0 ”法)
_Fe3C4 + _HNO3 — _Fe(NO3)3 + _NO↑ + _CO2↑ + _H2O
_CuFeS2 + _H+ + _NO3- — _Cu2+ + _Fe3+ + _SO42- + _NO↑ + _H2O
氧化还原反应方程式的配平
缺项配平
Cr2O72- + Fe2+ + ( ) → Cr3+ + Fe3+ + H2O
【注意】配平检查时,应注意质量守恒和电荷守恒!
缺项:一般为H+或OH-或H2O
氧化还原反应方程式的配平
缺项配平
【练习】请配平以下离子方程式:
(1)在酸性条件下,SO2通入FeCl3溶液中反应离子方程式为:
__Fe3+ + __SO2 + __H2O = __Fe2+ + __SO42- + __( )
氧化还原反应方程式的配平
缺项配平
【练习】请配平以下离子方程式:
(2)
__ClO- + __Fe(OH)3 + __( ) = __Cl- + __FeO42- + __H2O
氧化还原反应方程式的配平
缺项配平
【练习】请配平以下离子方程式:
(3)
__MnO4- + __I- + __(___) = __Mn2+ + __IO3- + __H2O
生活中常用ClO2、KMnO4、O3、H2O2这些物质杀菌消毒,这是利用它们的什么性质?
【实验探究1】生活中常用双氧水(H2O2溶液)杀菌消毒,是利用了过氧化氢的强氧化性,请你设计实验方案证明过氧化氢具有强氧化性?
(可供选择的实验试剂:H2O2溶液、酸性KMnO4溶液、稀硫酸、NaOH溶液、淀粉KI溶液)
分析:KMnO4是常见的氧化剂,KI中碘元素处于最低价,具有比较强的还原性
【实验探究2】从价态上分析,过氧化氢中氧元素处于中间价态,除了体现出氧化性,还能体现出一定的还原性,请你设计实验方案证明过氧化氢具有还原性?
(可供选择的实验试剂:H2O2溶液、酸性KMnO4溶液、氢硫酸(H2S溶液)、盐酸、氢氧化钠溶液,淀粉KI溶液)
H2O2 + 2KI + H2SO4 = 2H2O + I2 + K2SO4
5H2O2 + 2KMnO4 + 3H2SO4= K2SO4 + 2MnSO4 + 5O2↑ + 8H2O
1、人体正常的血红蛋白中应含有Fe2+。若误食亚硝酸钠,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒,服用维生素C可解除亚硝酸钠中毒。下列叙述中正确的是( )
A. 亚硝酸钠表现还原性
B. 维生素C表现还原性
C. 亚硝酸钠被氧化
D. 维生素C作为氧化剂
B
2、关于物质氧化性及还原性的强弱,下列说法中正确的是( )
A. 物质越易失电子,还原性越强
B. 原子失电子越多,还原性越强
C. 元素化合价降低越多,氧化性越强
D. 物质越易被氧化,氧化性越强
A
3、已知三个氧化还原反应:
①2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
②2FeCl2 + Cl2 = 2FeCl3
③2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是( )
A. Cl2 B. KMnO4 C. FeCl3 D. HCl
C
