2.1.2键参数 课件 (共19页) 高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.1.2键参数 课件 (共19页) 高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-30 10:25:03 | ||
图片预览






文档简介
(共19张PPT)
第1节 共价键模型 课时2
共价键的强弱用什么来衡量?
我们如何用化学语言来描述不同分子的空间结构和稳定性?
联想 · 质疑
联想 · 质疑
1.知道键能、键长、键角可以用来描述键的强弱和分子的空间结构。
一、键参数
1.键长
两个成键原子的原子核间的距离(简称核间距)。
一般而言,化学键的键长愈短,化学键就愈强,键就愈牢固。
键长
Cl2
199pm
可通过晶体的X射线衍射实验测定
(1)含义:
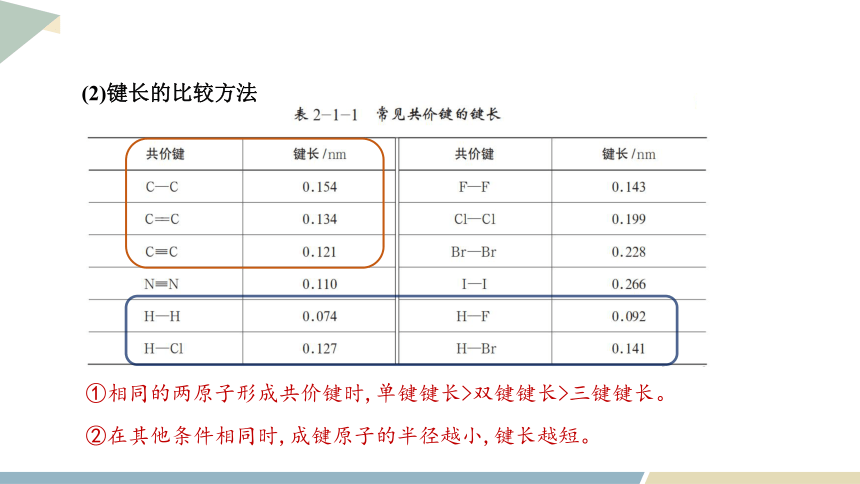
②在其他条件相同时,成键原子的半径越小,键长越短。
(2)键长的比较方法
①相同的两原子形成共价键时,单键键长>双键键长>三键键长。
2.键能
(1)含义:
在298 K、1×105 Pa条件下
断开1 mol AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能,常用EA-B表示。
原子半径:F则键能:H—F>H—Cl>H—Br>H—I。
[思考]比较HF、HCl、HBr、HI分子中键能的大小。
键能愈大,断开时需要的能量就愈多,化学键就愈牢固。
某些共价键的键能(kJ·mol-1)
键 键能
H-H 436.0
Cl-Cl 242.7
Br-Br 193.7
I-I 152.7
H-Cl 431.8
H-Br 366
H-I 298.7
Ⅱ.从计算结果看 HCl 和 HBr 哪个更容易分解呢?
ΔH = 反应物总键能 - 生成物总键能
ΔH (HCl) = [ ( 436 + 242.7 ) - 2×431.8 ] kJ/mol = - 184.9 kJ/mol
ΔH (HBr) = [ ( 436 + 193.7 ) - 2×366 ] kJ/mol = - 102.3 kJ/mol
Ⅰ.利用数据计算,1 mol H2 分别与1 mol Cl2、1mol Br2 (蒸气)反应,分别形成 2 mol HCl 和 2 mol HBr ,哪一个反应释放的能量更多?
HBr 分解需吸收能量少,更易分解。
思考与交流
思考与交流
键 键能
C-C 347
C=C 614
C≡C 839
N-N 193
N=N 418
N≡N 945
某些共价键的键能(kJ·mol-1)
Ⅲ.碳碳单键、碳碳双键和碳碳三键之间键能关系?
碳碳单键<碳碳双键<碳碳三键
Ⅳ.为何碳碳双键的键能不是碳碳单键的二倍,碳碳
三键的键能不是碳碳单键的三倍?
碳碳单键:1个σ键
碳碳双键:1个σ键,1个π键
σ键与π 键强度不同
乙烯分子中σ 键强于π 键
键能越大,共价键越牢固
氮分子中π键强于σ键
键能:定量地表示化学键的强弱
①由原子半径和共用电子对数判断:
[注意]由分子构成的物质,其熔、沸点与共价键的键能和键长无关,
而分子的稳定性由键长和键能大小决定。
成键原子的原子半径越小,两原子间共用电子对数越多,一般共价键越牢固。
共价键的键能越大,共价键越牢固。
共价键的键长越小,共价键越牢固。
元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键一般越稳定。
②由键能判断:
④由电负性判断:
③由键长判断:
归纳
共价键强弱的判断
3.键角
在多原子分子中,两个化学键的夹角称为键角。
(1)含义:
三角锥形
角形
直线形
键角:描述分子空间结构的参数
可通过晶体的X射线衍射实验测定
键能
键长
键角
决定
决定
分子的稳定性
分子空间结构
决定
分子的性质
键的
强弱
决定
晶体X射线衍射实验
归纳
键参数对物质性质的影响
分子光谱
CO分子轨道能级图
能量
(1)概念:分子从一种能级改变到另一种能级时
吸收或发射的光谱。
(2)影响因素:键长、键角和电荷分布等。
(3)应用:测定和鉴别分子结构。
化学与技术
分子光谱
分子光谱和分子内部的运动密切相关,
涉及分子运动方式主要为:①分子的转动,
吸收或发射的光处在远红外区或微波区,称
为远红外光谱或微波谱;②分子中原子间的
振动,通常振动光谱在近红外区和中红外区,
一般称为红外光谱;③分子中电子在不同能级的分子轨道间跃迁,得到紫外一可见光谱。
化学与技术
例如,C-C键、C=C键、C≡C键的键长依次缩短、键能依次加强,化学键的伸缩振动频率升高,在红外光谱中对应吸收峰值的频率依次增加。
因此,基于红外光谱中吸收峰值的频率可以推测分子中存在的官能团,进而为推测分子结构提供证据。
1.下列分子最难断裂为原子的是( )
A.HCl B.HI C.H2S D.PH3
2.下列说法正确的是( )
A.键角决定了分子的结构
B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C.CCl4中键长相等,键角不同
D.C==C键的键能是C—C键键能的两倍
【练一练】
A
B
3.下列事实不能用键能的大小来解释的是( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
4.下列说法中正确的是( )
A.在分子中,两个原子间的距离叫键长
B.非极性键的键能大于极性键的键能
C.键能越大,表示该分子越容易受热分解
D.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可说明HCl分子比HI分子稳定
D
5.用“>”或“<”填空。
(1)比较键长大小:
①C—H N—H H—O;
②H—F H—Cl。
(2)比较键能大小:
①C—H N—H H—O;
②H—F H—Cl。
(3)比较键角大小:
①CO2 NH3;②H2O NH3。
>
>
<
<
<
>
>
<
键参数
键能:反应物总键能-反应产物总键能
键长:键长越短,键能越大,化学键越牢固
键角:描述多原子分子空间结构的重要参数
第1节 共价键模型 课时2
共价键的强弱用什么来衡量?
我们如何用化学语言来描述不同分子的空间结构和稳定性?
联想 · 质疑
联想 · 质疑
1.知道键能、键长、键角可以用来描述键的强弱和分子的空间结构。
一、键参数
1.键长
两个成键原子的原子核间的距离(简称核间距)。
一般而言,化学键的键长愈短,化学键就愈强,键就愈牢固。
键长
Cl2
199pm
可通过晶体的X射线衍射实验测定
(1)含义:
②在其他条件相同时,成键原子的半径越小,键长越短。
(2)键长的比较方法
①相同的两原子形成共价键时,单键键长>双键键长>三键键长。
2.键能
(1)含义:
在298 K、1×105 Pa条件下
断开1 mol AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能,常用EA-B表示。
原子半径:F
[思考]比较HF、HCl、HBr、HI分子中键能的大小。
键能愈大,断开时需要的能量就愈多,化学键就愈牢固。
某些共价键的键能(kJ·mol-1)
键 键能
H-H 436.0
Cl-Cl 242.7
Br-Br 193.7
I-I 152.7
H-Cl 431.8
H-Br 366
H-I 298.7
Ⅱ.从计算结果看 HCl 和 HBr 哪个更容易分解呢?
ΔH = 反应物总键能 - 生成物总键能
ΔH (HCl) = [ ( 436 + 242.7 ) - 2×431.8 ] kJ/mol = - 184.9 kJ/mol
ΔH (HBr) = [ ( 436 + 193.7 ) - 2×366 ] kJ/mol = - 102.3 kJ/mol
Ⅰ.利用数据计算,1 mol H2 分别与1 mol Cl2、1mol Br2 (蒸气)反应,分别形成 2 mol HCl 和 2 mol HBr ,哪一个反应释放的能量更多?
HBr 分解需吸收能量少,更易分解。
思考与交流
思考与交流
键 键能
C-C 347
C=C 614
C≡C 839
N-N 193
N=N 418
N≡N 945
某些共价键的键能(kJ·mol-1)
Ⅲ.碳碳单键、碳碳双键和碳碳三键之间键能关系?
碳碳单键<碳碳双键<碳碳三键
Ⅳ.为何碳碳双键的键能不是碳碳单键的二倍,碳碳
三键的键能不是碳碳单键的三倍?
碳碳单键:1个σ键
碳碳双键:1个σ键,1个π键
σ键与π 键强度不同
乙烯分子中σ 键强于π 键
键能越大,共价键越牢固
氮分子中π键强于σ键
键能:定量地表示化学键的强弱
①由原子半径和共用电子对数判断:
[注意]由分子构成的物质,其熔、沸点与共价键的键能和键长无关,
而分子的稳定性由键长和键能大小决定。
成键原子的原子半径越小,两原子间共用电子对数越多,一般共价键越牢固。
共价键的键能越大,共价键越牢固。
共价键的键长越小,共价键越牢固。
元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键一般越稳定。
②由键能判断:
④由电负性判断:
③由键长判断:
归纳
共价键强弱的判断
3.键角
在多原子分子中,两个化学键的夹角称为键角。
(1)含义:
三角锥形
角形
直线形
键角:描述分子空间结构的参数
可通过晶体的X射线衍射实验测定
键能
键长
键角
决定
决定
分子的稳定性
分子空间结构
决定
分子的性质
键的
强弱
决定
晶体X射线衍射实验
归纳
键参数对物质性质的影响
分子光谱
CO分子轨道能级图
能量
(1)概念:分子从一种能级改变到另一种能级时
吸收或发射的光谱。
(2)影响因素:键长、键角和电荷分布等。
(3)应用:测定和鉴别分子结构。
化学与技术
分子光谱
分子光谱和分子内部的运动密切相关,
涉及分子运动方式主要为:①分子的转动,
吸收或发射的光处在远红外区或微波区,称
为远红外光谱或微波谱;②分子中原子间的
振动,通常振动光谱在近红外区和中红外区,
一般称为红外光谱;③分子中电子在不同能级的分子轨道间跃迁,得到紫外一可见光谱。
化学与技术
例如,C-C键、C=C键、C≡C键的键长依次缩短、键能依次加强,化学键的伸缩振动频率升高,在红外光谱中对应吸收峰值的频率依次增加。
因此,基于红外光谱中吸收峰值的频率可以推测分子中存在的官能团,进而为推测分子结构提供证据。
1.下列分子最难断裂为原子的是( )
A.HCl B.HI C.H2S D.PH3
2.下列说法正确的是( )
A.键角决定了分子的结构
B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C.CCl4中键长相等,键角不同
D.C==C键的键能是C—C键键能的两倍
【练一练】
A
B
3.下列事实不能用键能的大小来解释的是( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
4.下列说法中正确的是( )
A.在分子中,两个原子间的距离叫键长
B.非极性键的键能大于极性键的键能
C.键能越大,表示该分子越容易受热分解
D.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可说明HCl分子比HI分子稳定
D
5.用“>”或“<”填空。
(1)比较键长大小:
①C—H N—H H—O;
②H—F H—Cl。
(2)比较键能大小:
①C—H N—H H—O;
②H—F H—Cl。
(3)比较键角大小:
①CO2 NH3;②H2O NH3。
>
>
<
<
<
>
>
<
键参数
键能:反应物总键能-反应产物总键能
键长:键长越短,键能越大,化学键越牢固
键角:描述多原子分子空间结构的重要参数
