5.1 金属的性质和利用 第1课时 课件(共30张PPT) 2023-2024学年初中化学沪教版九年级上册
文档属性
| 名称 | 5.1 金属的性质和利用 第1课时 课件(共30张PPT) 2023-2024学年初中化学沪教版九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 32.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-30 00:00:00 | ||
图片预览











文档简介
(共30张PPT)
第1节 金属的性质和应用
第1课时
金属(metal)是一类重要的材料,人类的生活和生产都离不开金属。
了解金属的性质,对科学地利用金属材料是十分重要的。
1.能概括金属的主要物理性质。
2.能举例说明常见金属的化学性质。
3.能正确判断置换反应。
你已经知道什么
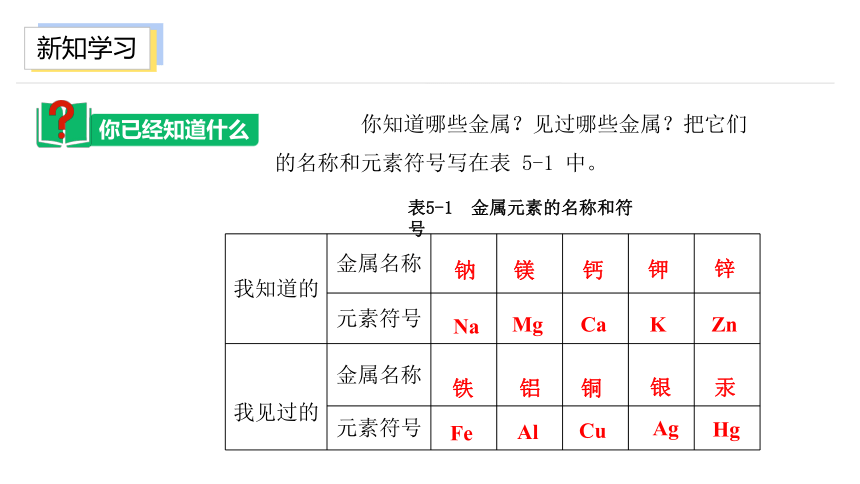
你知道哪些金属?见过哪些金属?把它们的名称和元素符号写在表 5-1 中。
我知道的 金属名称
元素符号
我见过的 金属名称
元素符号
Na
钠
Mg
镁
K
钾
Ca
钙
锌
Zn
铁
铝
Hg
汞
银
Ag
Fe
Al
铜
Cu
表5-1 金属元素的名称和符号
一、金属的性质
交流与讨论
1.金属的物理性质
金属在生活、生产中的应用十分广泛。请与同学交流讨论,总结金属的主要物理性质。
表 5-2 金属的某些物理性质及其应用
金属的应用 说明金属具有的物理性质
共性:常温下金属都是固体(汞除外),有金属光泽,密度、硬度较大,熔、沸点较高,具有良好的导电、导热性、延展性。
特性:汞常温下呈液态,铜为紫红色,金呈黄色,不同金属的导电性、密度、熔点、硬度等物理性质差别也比较大。
金属的物理性质
讨论1:铁、铝常用作锅、铲等炊具,是利用了金属的哪种物理性质。
导热性
讨论2:金、银、铂做成各种首饰等,是利用了金属的哪种物理性质。
金属光泽
讨论3:铜、铝能加工成导线、能压成薄片,是利用了金属的哪些物理性质。
导电性
延展性
1. 为什么铁制锅铲需要加上木柄或塑料柄?
2. 银的导电性比铜好,一般情况下为什么不用银制造电线、电缆?
3. 选择铸造硬币的金属材料需要考虑哪些因素?
联想与启示
1.防止烫手。因为铁具有良好的导热性,而木柄或塑料的导热 性较差,这样就可以防止手拿锅铲时被烫伤。
2.因为银较稀少,价格昂贵,而铜相对较多,价格便宜。
3.需要考虑价格、硬度、耐磨、耐腐蚀、色泽美观、质轻、易加工、性质稳定、价廉、资源丰富等因素。
通过以上的讨论,说明物质的性质在很大程度上决定了物质的用途,但这不是唯一的决定因素因素呢。还要考虑以下因素:
1
2
3
4
5
6
价格
资源
美观
对环境的影响
废料是否易于回收
使用是否便利
用途
2.常见金属的化学性质
观察与思考
1.回忆并描述镁在空气中燃烧,铁丝在氧气中燃烧的现象。
2.分别把镁条、铁片(或铁丝)、铝片(或铝丝)和铜片(或铜丝) 的表面用砂纸擦亮,然后按下表所列的项目进行实验(已做过的实验可不重复),记录实验现象,写出反应的化学方程式。
实验内容 实验现象 化学方程式
镁条在空气中点燃
铁片(或铁丝)在氧气中点燃
铝片(或铝丝)在空气中加热
铜片(或铜丝)在空气加热
剧烈燃烧,发出耀眼的白光,放热,生成白色固体
剧烈燃烧,火星四射,放热,生成黑色固体
表面由红色变成黑色
表面变暗,失去金属光泽
2Cu+O2 ==2CuO
4Al+3O2==2Al2O3
3Fe+2O2 == Fe3O4
点燃
2Mg+O2==2MgO
点燃
表 5-3 实验记录
在常温下,铝和氧气能发生反应,在铝表面生成一层致密的氧化铝膜。
在点燃或加热的条件下,镁、铁、铜等很多金属都能跟氧气化合生成金属氧 化物。
3Fe+2O2 == Fe3O4
点燃
2Cu+O2 ==2CuO
4Al+3O2==2Al2O3
Δ
交流与讨论
Fe、Mg 、 Al、Cu能与氧气反应,那是不是所有的金属都能与氧气反应呢?请举例说明。
不是所有金属都能与氧气反应,如金。“真金不怕火炼”,指的是金在高温下也不与氧气反应。
1.分别把镁条、铁片和铜片(或铜丝)的表面用砂纸擦亮,放入稀盐 酸(或稀硫酸)中,观察实验现象。若能反应,写出反应的化学方程式。
2. 在试管中加入少量硫酸铜溶液,把 2~3 枚无锈的新铁钉浸入硫 酸铜溶液中,观察实验现象。写出反应的化学方程式。
活动与探究
实验内容 实验现象 化学方程式
表 5-4 实验记录
铜跟稀盐酸(或稀硫酸)不发生反应。镁和铁都能跟稀盐酸(或稀硫酸) 反应,生成氢气和相应的化合物。
不是所有金属都能与稀盐酸(或稀硫酸)反应
单质
化合物
单质
化合物
这些反应都是由一种单质跟一种化合物作用生成另一种单质和另一种化合物,这样的反应叫做置换反应(displacement reaction)。
特征:反应物和生成物都是一种单质和一种化合物。
从反应物和生成物的物质类别的角度分析,有如下特点:
铁单质与硫酸铜溶液作用,生成铜单质和硫酸亚铁溶液的反应也属于置换 反应。我国早在西汉时期,在《淮南万毕术》一书中就写到“曾青得铁则化为铜”,意思是可溶性的铜的化合物与铁发生置换反应得到单质铜。这是现代的湿法冶金的先驱。
CuSO4 + Fe == Cu + FeSO4
联想与启示
在常温下,锌能与稀盐酸(或稀硫酸)发生置换反应生成氢气。 氢气密度比空气小,难溶于水。请设计一个简便的实验,用锌粒与稀 硫酸反应制取少量氢气。
表 5-5 实验记录
反应原理
实验装置
实验步骤
1、盛放油罐车内的石油产品,震荡时可以产生静电而引起火灾,所以油罐车尾部有一条拖地的铁链,这里利用铁的( )
A、延展性 B、导电性 C、硬度小 D、熔点高
B
2、铁可以制成烧菜的铁锅是因为铁具有 性;铁又可以拉成细铁丝或打成铁片,是因为它具有 性。
导热
延展
3、写出下列化学方程式;
镁和稀盐酸反应:_______________________________
铝和稀盐酸反应:_______________________________
锌和稀盐酸反应:_______________________________
金属的性质
物理性质
化学性质
置换反应
与氧气反应
与稀盐酸(或稀硫酸)反应
具有金属光泽,具有良好的导电性、导热性、延展性,密度、硬度较大,熔、沸点较高。
定义:
特征:
一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应
反应物和生成物都是一种单质和一种化合物
第1节 金属的性质和应用
第1课时
金属(metal)是一类重要的材料,人类的生活和生产都离不开金属。
了解金属的性质,对科学地利用金属材料是十分重要的。
1.能概括金属的主要物理性质。
2.能举例说明常见金属的化学性质。
3.能正确判断置换反应。
你已经知道什么
你知道哪些金属?见过哪些金属?把它们的名称和元素符号写在表 5-1 中。
我知道的 金属名称
元素符号
我见过的 金属名称
元素符号
Na
钠
Mg
镁
K
钾
Ca
钙
锌
Zn
铁
铝
Hg
汞
银
Ag
Fe
Al
铜
Cu
表5-1 金属元素的名称和符号
一、金属的性质
交流与讨论
1.金属的物理性质
金属在生活、生产中的应用十分广泛。请与同学交流讨论,总结金属的主要物理性质。
表 5-2 金属的某些物理性质及其应用
金属的应用 说明金属具有的物理性质
共性:常温下金属都是固体(汞除外),有金属光泽,密度、硬度较大,熔、沸点较高,具有良好的导电、导热性、延展性。
特性:汞常温下呈液态,铜为紫红色,金呈黄色,不同金属的导电性、密度、熔点、硬度等物理性质差别也比较大。
金属的物理性质
讨论1:铁、铝常用作锅、铲等炊具,是利用了金属的哪种物理性质。
导热性
讨论2:金、银、铂做成各种首饰等,是利用了金属的哪种物理性质。
金属光泽
讨论3:铜、铝能加工成导线、能压成薄片,是利用了金属的哪些物理性质。
导电性
延展性
1. 为什么铁制锅铲需要加上木柄或塑料柄?
2. 银的导电性比铜好,一般情况下为什么不用银制造电线、电缆?
3. 选择铸造硬币的金属材料需要考虑哪些因素?
联想与启示
1.防止烫手。因为铁具有良好的导热性,而木柄或塑料的导热 性较差,这样就可以防止手拿锅铲时被烫伤。
2.因为银较稀少,价格昂贵,而铜相对较多,价格便宜。
3.需要考虑价格、硬度、耐磨、耐腐蚀、色泽美观、质轻、易加工、性质稳定、价廉、资源丰富等因素。
通过以上的讨论,说明物质的性质在很大程度上决定了物质的用途,但这不是唯一的决定因素因素呢。还要考虑以下因素:
1
2
3
4
5
6
价格
资源
美观
对环境的影响
废料是否易于回收
使用是否便利
用途
2.常见金属的化学性质
观察与思考
1.回忆并描述镁在空气中燃烧,铁丝在氧气中燃烧的现象。
2.分别把镁条、铁片(或铁丝)、铝片(或铝丝)和铜片(或铜丝) 的表面用砂纸擦亮,然后按下表所列的项目进行实验(已做过的实验可不重复),记录实验现象,写出反应的化学方程式。
实验内容 实验现象 化学方程式
镁条在空气中点燃
铁片(或铁丝)在氧气中点燃
铝片(或铝丝)在空气中加热
铜片(或铜丝)在空气加热
剧烈燃烧,发出耀眼的白光,放热,生成白色固体
剧烈燃烧,火星四射,放热,生成黑色固体
表面由红色变成黑色
表面变暗,失去金属光泽
2Cu+O2 ==2CuO
4Al+3O2==2Al2O3
3Fe+2O2 == Fe3O4
点燃
2Mg+O2==2MgO
点燃
表 5-3 实验记录
在常温下,铝和氧气能发生反应,在铝表面生成一层致密的氧化铝膜。
在点燃或加热的条件下,镁、铁、铜等很多金属都能跟氧气化合生成金属氧 化物。
3Fe+2O2 == Fe3O4
点燃
2Cu+O2 ==2CuO
4Al+3O2==2Al2O3
Δ
交流与讨论
Fe、Mg 、 Al、Cu能与氧气反应,那是不是所有的金属都能与氧气反应呢?请举例说明。
不是所有金属都能与氧气反应,如金。“真金不怕火炼”,指的是金在高温下也不与氧气反应。
1.分别把镁条、铁片和铜片(或铜丝)的表面用砂纸擦亮,放入稀盐 酸(或稀硫酸)中,观察实验现象。若能反应,写出反应的化学方程式。
2. 在试管中加入少量硫酸铜溶液,把 2~3 枚无锈的新铁钉浸入硫 酸铜溶液中,观察实验现象。写出反应的化学方程式。
活动与探究
实验内容 实验现象 化学方程式
表 5-4 实验记录
铜跟稀盐酸(或稀硫酸)不发生反应。镁和铁都能跟稀盐酸(或稀硫酸) 反应,生成氢气和相应的化合物。
不是所有金属都能与稀盐酸(或稀硫酸)反应
单质
化合物
单质
化合物
这些反应都是由一种单质跟一种化合物作用生成另一种单质和另一种化合物,这样的反应叫做置换反应(displacement reaction)。
特征:反应物和生成物都是一种单质和一种化合物。
从反应物和生成物的物质类别的角度分析,有如下特点:
铁单质与硫酸铜溶液作用,生成铜单质和硫酸亚铁溶液的反应也属于置换 反应。我国早在西汉时期,在《淮南万毕术》一书中就写到“曾青得铁则化为铜”,意思是可溶性的铜的化合物与铁发生置换反应得到单质铜。这是现代的湿法冶金的先驱。
CuSO4 + Fe == Cu + FeSO4
联想与启示
在常温下,锌能与稀盐酸(或稀硫酸)发生置换反应生成氢气。 氢气密度比空气小,难溶于水。请设计一个简便的实验,用锌粒与稀 硫酸反应制取少量氢气。
表 5-5 实验记录
反应原理
实验装置
实验步骤
1、盛放油罐车内的石油产品,震荡时可以产生静电而引起火灾,所以油罐车尾部有一条拖地的铁链,这里利用铁的( )
A、延展性 B、导电性 C、硬度小 D、熔点高
B
2、铁可以制成烧菜的铁锅是因为铁具有 性;铁又可以拉成细铁丝或打成铁片,是因为它具有 性。
导热
延展
3、写出下列化学方程式;
镁和稀盐酸反应:_______________________________
铝和稀盐酸反应:_______________________________
锌和稀盐酸反应:_______________________________
金属的性质
物理性质
化学性质
置换反应
与氧气反应
与稀盐酸(或稀硫酸)反应
具有金属光泽,具有良好的导电性、导热性、延展性,密度、硬度较大,熔、沸点较高。
定义:
特征:
一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应
反应物和生成物都是一种单质和一种化合物
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
