山东省泰安市2023-2024学年高一上学期1月期末考试化学试题(含答案)
文档属性
| 名称 | 山东省泰安市2023-2024学年高一上学期1月期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1017.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-30 17:48:50 | ||
图片预览




文档简介
泰安市2023-2024学年高一上学期1月期末考试
化学试题 2024.01
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上.
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚.
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效.保持卡面清洁,不折叠、不破损.
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5
一、选择题:本题共10小题,每小题2分,共20分.每小题只有一个选项符合题意.
1.我国科学家为世界科技的发展做出了重要贡献.下列属于我国科学家研究成果的是( )
①新一代抗疟药——双氢青蒿素的合成
②首次蛋白质的人工合成——结晶牛胰岛素
③提出原子理论——为近代化学的发展奠定基础
④发现元素周期律——把元素纳人统一的理论体系
A.①② B.③④ C.①③ D.②③
2.“绿水青山就是金山银山”,化学与环境密切相关.下列说法正确的是( )
A.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,这些颗粒分散在空气中都会形成胶体
B.元素C、N、S的氧化物会使雨水的,我们把的雨水称之为酸雨
C.为了减少煤燃烧废气中的含量,可以在燃煤中加入适量的石灰石
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
3.氧化还原反应与基本反应类型的关系如右图所示:
则下列化学反应属于氧化还原反应但不包含在1、2、4范围内的是( )
A. B.
C. D.
4.同温同压下,等质量的和两种气体相比较,下列叙述正确的是( )
A.密度之比为 B.质子数之比为
C.物质的量之比为 D.原子个数比为
5.实验室采用如图装置制备气体,其中合理的是( )
选项 化学试剂 制备的气体
A 氯酸钾与二氧化锰
B 浓氨水与生石灰
C 铜与浓硝酸
D 锌粒与稀硫酸
6.用表示阿伏加德罗常数的数值.下列说法中正确的是( )
A.晶体溶于足量水,所得溶液中的数目为
B.与水充分反应转移的电子数为
C.常温常压下,水中含有的分子数为
D.若含有的分子数目为,此时一定是在标准状况下
7.向、混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.
则下列离子组在对应的溶液中一定能大量共存的是( )
A.a点对应的溶液中:、、、
B.b点对应的溶液中:、、、
C.c点对应的溶液中:、、、
D.d点对应的溶液中:、、、
8.酸性溶液中分子或离子的还原性强弱顺序为:.据此判断下列反应不可能发生的是( )
A.
B.
C.
D.
9.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. B.
C. D.饱和溶液
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 实验 现象 结论
A 蔗糖中滴加浓硫酸并不断搅拌 产生黑色蓬松多孔固体 浓硫酸具有吸水性
B 加热盛有固体的试管 试管底部固体消失,试管口有晶体凝结 固体受热升华
C 浓硝酸中加入炭粉并加热,生成的气体通入少量澄清石灰水中 红棕色气体产生,石灰水不变浑浊 有和产生
D 向试管中加入3mL稀酸性溶液,通入足量气体 溶液紫红色褪去 具有漂白性
二、选择题:本题共5小题,每小题4分,共20分.每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分.
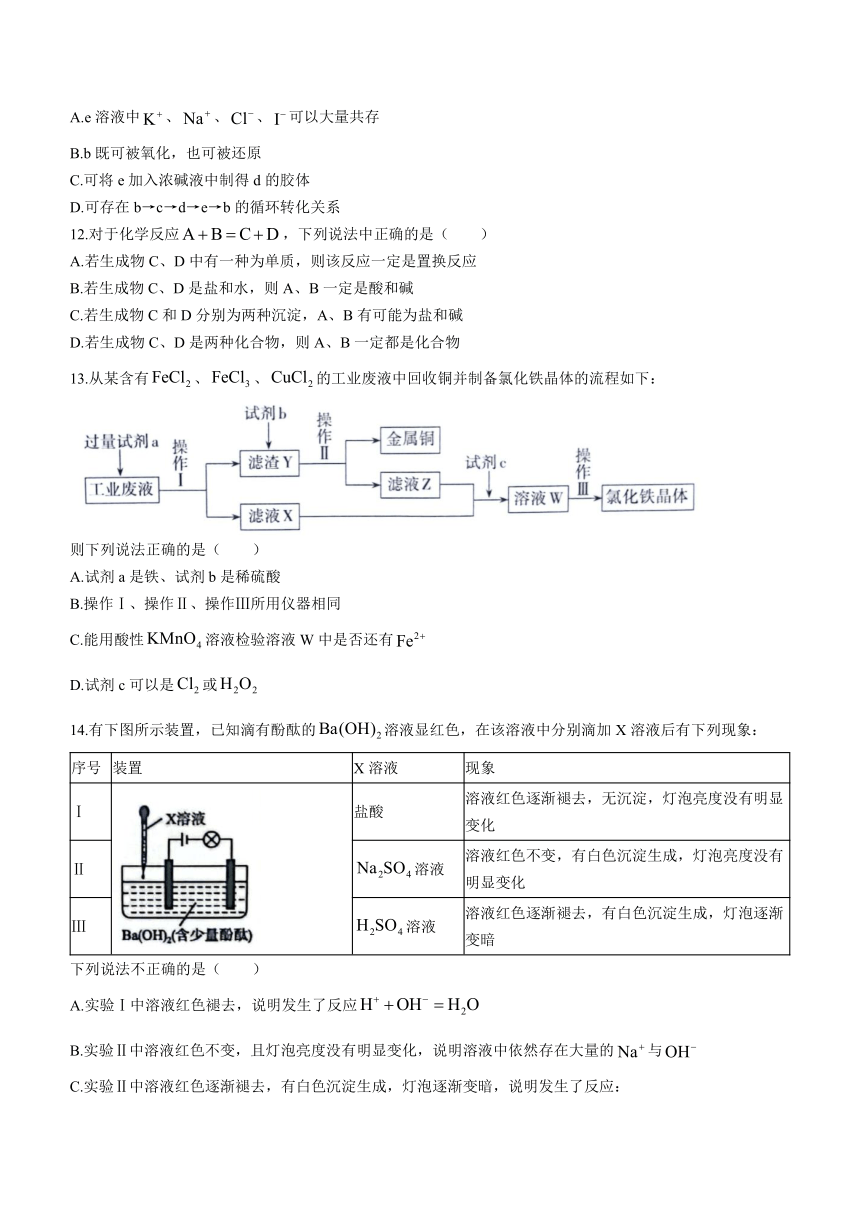
11.部分含铁物质的分类与相应化合价关系如图所示.
下列推断不合理的是( )
A.e溶液中、、、可以大量共存
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
12.对于化学反应,下列说法中正确的是( )
A.若生成物C、D中有一种为单质,则该反应一定是置换反应
B.若生成物C、D是盐和水,则A、B一定是酸和碱
C.若生成物C和D分别为两种沉淀,A、B有可能为盐和碱
D.若生成物C、D是两种化合物,则A、B一定都是化合物
13.从某含有、、的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是( )
A.试剂a是铁、试剂b是稀硫酸
B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C.能用酸性溶液检验溶液W中是否还有
D.试剂c可以是或
14.有下图所示装置,已知滴有酚酞的溶液显红色,在该溶液中分别滴加X溶液后有下列现象:
序号 装置 X溶液 现象
Ⅰ 盐酸 溶液红色逐渐褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ 溶液 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ 溶液 溶液红色逐渐褪去,有白色沉淀生成,灯泡逐渐变暗
下列说法不正确的是( )
A.实验Ⅰ中溶液红色褪去,说明发生了反应
B.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量的与
C.实验Ⅱ中溶液红色逐渐褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应:
D.将实验Ⅱ中溶液换成溶液,现象与原实验Ⅱ中的现象相同
15.某离子反应中涉及、、、、、六种粒子.其中的物质的量随时间变化的曲线如图所示.
下列判断正确的是( )
A.该反应的还原剂是 B.反应消耗还原剂时,转移电子
C.氧化剂与还原剂的物质的量之比为 D.反应后溶液的酸性明显增强
三、非选择题:本题共5小题,共60分.
(12分)利用分类法研究化学物质,可系统、全面地认识物质的性质.
Ⅰ.下列三组物质中,均有一种物质的类别与其他三种不同.
①、、、
②、、、
③、、、
(1)三种物质依次是(填化学式):
①__________;②__________;③__________.
(2)这三种物质相互作用可生成一种新物质,该反应__________(填“是”或“不是”)复分解反应.
Ⅱ.现有以下物质:
①晶体;②液态;③固体;④熔融;⑤蔗糖;
⑥铜;⑦;⑧纯;⑨固体;⑩固体.
(3)以上物质中能导电的是__________(填序号,下同).
(4)以上物质中属于电解质的是__________,属于非电解质的是__________.
(5)以上物质中溶于水,其水溶液能导电的是__________.
17.(12分)下列物质中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是一种酸.它们之间有如下的转化关系(反应条件及其他物质已经略去):
当X是非氧化性强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素.
请回答下列问题:
(1)A物质的化学式为__________,Y物质的化学式为__________,从物质分类角度看,Z物质属于__________.
(2)当X是非氧化性强酸时,E物质的化学式为__________,B生成C的化学方程式为:____________________.
(3)当X是强碱时,E物质的化学式为__________,此时B生成C的化学方程式为:____________________.
18.(12分)硫铁矿烧渣是一种重要的化工产业中间产物,主要成分是、、和二氧化硅等.下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁流程图:
(1)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是____________________.
(2)“酸溶”过程中溶解的离子方程式:____________________.
(3)实验室实现“操作Ⅰ”所用的玻璃仪器有__________、玻璃棒和烧杯等.“操作Ⅲ”系列操作名称依次为:__________、__________、过滤和洗涤.
(4)实验室检验“反应Ⅰ”已经完全的试剂是__________,现象是__________.
(5)流程中加入适量的目的是(用离子方程式表示)______________________________.
19.(12分)化学实验室中使用的浓盐酸的溶质质量分数通常为,密度为.
(1)该盐酸的物质的量浓度为_____________.
(2)现有一种的稀盐酸.关于该溶液下列说法正确的是_____________(填字母:序号).
A.水中含有
B.的稀盐酸中的物质的量浓度也为
C.将气体溶于水所配成的溶液
D.从该溶液中取出,剩余溶液的物质的量浓度仍为
(3)用上述实验室的浓盐酸来配制的稀盐酸.请在下列操作步骤中填写有关的空格:
①用量筒量取_____________mL的浓盐酸;(精确到小数点后一位)
②向盛有少量蒸馏水的烧杯中,沿_____________慢慢注入浓盐酸;
③将已冷却至室温的盐酸溶液沿_____________注入500mL容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1cm~2cm处;
⑥改用_____________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀盐酸转移到试剂瓶中,贴好标签.
(4)操作不当,会引起实验误差.请用“偏高”、“偏低”或“无影响”填写下列情况对所配制的盐酸溶液的物质的量浓度的影响.
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;
③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线_____________.
20.(12分)某小组同学用如图装置进行实验探究(a、b、c表示止水夹).
请评价或完善其方案:
(1)将装置A、C、E相连接,用和浓盐酸制取氯气.
请回答:
①A中反应的离子方程式为________________________;
②用离子方程式表示E中氢氧化钠溶液的作用_________________.
在C中加入适量的水可制得氯水,将所得氯水分成两份进行实验,其实验操作、现象和结论如下:
实验序号 实验操作 现象 结论
Ⅰ 将氯水滴入品红溶液中 品红溶液褪色 氯气有漂白性
Ⅱ 氯水中加入碳酸氢钠粉末 有无色气泡产生 氯气与水反应的产物具有酸性
③实验Ⅰ推出的相应结论是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,无需填写)______________.
④实验Ⅱ推出相应的结论是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,无需填写)______________.
(2)为比较和的氧化性强弱,将A、C、E相连,C中盛放的试剂可以为______________.
(3)①将B、D、E相连,在B中加入浓硝酸和铜片,可制得并进行有关实验.B中反应的化学方程式为____________________________;
②是大气污染物,可以用溶液吸收,生成两种盐.试从氧化还原角度分析并写出吸收反应的离子方程式______________________________________.
试卷类型:A
泰安市2023-2024学年高一上学期1月期末考试
化学试题(A)参考答案及评分标准2024.01
说明:1.每小题若有其它正确答案,可参照评分标准给分.
2.化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分.
3.化学方程式、离子方程式未配平的,都不给分.
一、选择题:本题共10小题,每小题2分,共20分.每小题只有一个选项符合题意.
1.A 2.C 3.D 4.B 5.D 6.A 7.C 8.B 9.D 10.C
二、选择题:本题共5小题,每小题4分,共20分.每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分.
11.AC 12.C 13.D 14.CD 15.BD
三、非选择题:本题共5小题,共60分.
16.(12分)
Ⅰ.(1)①(1分)②(1分)③(1分)
(2)不是(1分)
Ⅱ.(3)④⑥(2分.每个1分,有错误不得分)
(4)①②③④⑧⑨⑩(2分,有错误不得分)⑤⑦(2分.每个1分,有错误不得分)
(5)①②④⑦⑧⑨⑩(2分,有错误不得分)
17.(12分)
(1)(2分)(2分)氧化物(2分)
(2)(1分)(2分)
(3)(1分)(2分)
18.(12分)
(1)增大固体与的接触面积,加快反应速率(2分)
(2)(2分)
(3)漏斗(1分)蒸发浓缩(1分)降温结晶(1分)
(4)溶液(1分)加入试剂后溶液不出现红色(2分)
(5)(2分)
19.(12分)
(1)12.5(2分)
(2)BD(2分.每个1分,有错误不得分)
(3)①40.0(2分)②烧杯内壁(1分)③玻璃棒(1分)⑥胶头滴管(1分)
(4)①无影响(1分)②偏高(1分)③偏低(1分)
20.(12分)
(1)①(1分)
②(2分)
③不合理(1分)没有事先证明干燥的氯气有无漂白性(1分)
④不合理(1分)
制取的氯气中含气体,其溶于水也能与粉末反应产生气泡(1分)
(2)淀粉碘化钾溶液(合理即可)(1分)
(3)①(2分)
②(2分)
化学试题 2024.01
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上.
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚.
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效.保持卡面清洁,不折叠、不破损.
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5
一、选择题:本题共10小题,每小题2分,共20分.每小题只有一个选项符合题意.
1.我国科学家为世界科技的发展做出了重要贡献.下列属于我国科学家研究成果的是( )
①新一代抗疟药——双氢青蒿素的合成
②首次蛋白质的人工合成——结晶牛胰岛素
③提出原子理论——为近代化学的发展奠定基础
④发现元素周期律——把元素纳人统一的理论体系
A.①② B.③④ C.①③ D.②③
2.“绿水青山就是金山银山”,化学与环境密切相关.下列说法正确的是( )
A.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,这些颗粒分散在空气中都会形成胶体
B.元素C、N、S的氧化物会使雨水的,我们把的雨水称之为酸雨
C.为了减少煤燃烧废气中的含量,可以在燃煤中加入适量的石灰石
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
3.氧化还原反应与基本反应类型的关系如右图所示:
则下列化学反应属于氧化还原反应但不包含在1、2、4范围内的是( )
A. B.
C. D.
4.同温同压下,等质量的和两种气体相比较,下列叙述正确的是( )
A.密度之比为 B.质子数之比为
C.物质的量之比为 D.原子个数比为
5.实验室采用如图装置制备气体,其中合理的是( )
选项 化学试剂 制备的气体
A 氯酸钾与二氧化锰
B 浓氨水与生石灰
C 铜与浓硝酸
D 锌粒与稀硫酸
6.用表示阿伏加德罗常数的数值.下列说法中正确的是( )
A.晶体溶于足量水,所得溶液中的数目为
B.与水充分反应转移的电子数为
C.常温常压下,水中含有的分子数为
D.若含有的分子数目为,此时一定是在标准状况下
7.向、混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.
则下列离子组在对应的溶液中一定能大量共存的是( )
A.a点对应的溶液中:、、、
B.b点对应的溶液中:、、、
C.c点对应的溶液中:、、、
D.d点对应的溶液中:、、、
8.酸性溶液中分子或离子的还原性强弱顺序为:.据此判断下列反应不可能发生的是( )
A.
B.
C.
D.
9.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. B.
C. D.饱和溶液
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 实验 现象 结论
A 蔗糖中滴加浓硫酸并不断搅拌 产生黑色蓬松多孔固体 浓硫酸具有吸水性
B 加热盛有固体的试管 试管底部固体消失,试管口有晶体凝结 固体受热升华
C 浓硝酸中加入炭粉并加热,生成的气体通入少量澄清石灰水中 红棕色气体产生,石灰水不变浑浊 有和产生
D 向试管中加入3mL稀酸性溶液,通入足量气体 溶液紫红色褪去 具有漂白性
二、选择题:本题共5小题,每小题4分,共20分.每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分.
11.部分含铁物质的分类与相应化合价关系如图所示.
下列推断不合理的是( )
A.e溶液中、、、可以大量共存
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
12.对于化学反应,下列说法中正确的是( )
A.若生成物C、D中有一种为单质,则该反应一定是置换反应
B.若生成物C、D是盐和水,则A、B一定是酸和碱
C.若生成物C和D分别为两种沉淀,A、B有可能为盐和碱
D.若生成物C、D是两种化合物,则A、B一定都是化合物
13.从某含有、、的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是( )
A.试剂a是铁、试剂b是稀硫酸
B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C.能用酸性溶液检验溶液W中是否还有
D.试剂c可以是或
14.有下图所示装置,已知滴有酚酞的溶液显红色,在该溶液中分别滴加X溶液后有下列现象:
序号 装置 X溶液 现象
Ⅰ 盐酸 溶液红色逐渐褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ 溶液 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ 溶液 溶液红色逐渐褪去,有白色沉淀生成,灯泡逐渐变暗
下列说法不正确的是( )
A.实验Ⅰ中溶液红色褪去,说明发生了反应
B.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量的与
C.实验Ⅱ中溶液红色逐渐褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应:
D.将实验Ⅱ中溶液换成溶液,现象与原实验Ⅱ中的现象相同
15.某离子反应中涉及、、、、、六种粒子.其中的物质的量随时间变化的曲线如图所示.
下列判断正确的是( )
A.该反应的还原剂是 B.反应消耗还原剂时,转移电子
C.氧化剂与还原剂的物质的量之比为 D.反应后溶液的酸性明显增强
三、非选择题:本题共5小题,共60分.
(12分)利用分类法研究化学物质,可系统、全面地认识物质的性质.
Ⅰ.下列三组物质中,均有一种物质的类别与其他三种不同.
①、、、
②、、、
③、、、
(1)三种物质依次是(填化学式):
①__________;②__________;③__________.
(2)这三种物质相互作用可生成一种新物质,该反应__________(填“是”或“不是”)复分解反应.
Ⅱ.现有以下物质:
①晶体;②液态;③固体;④熔融;⑤蔗糖;
⑥铜;⑦;⑧纯;⑨固体;⑩固体.
(3)以上物质中能导电的是__________(填序号,下同).
(4)以上物质中属于电解质的是__________,属于非电解质的是__________.
(5)以上物质中溶于水,其水溶液能导电的是__________.
17.(12分)下列物质中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是一种酸.它们之间有如下的转化关系(反应条件及其他物质已经略去):
当X是非氧化性强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素.
请回答下列问题:
(1)A物质的化学式为__________,Y物质的化学式为__________,从物质分类角度看,Z物质属于__________.
(2)当X是非氧化性强酸时,E物质的化学式为__________,B生成C的化学方程式为:____________________.
(3)当X是强碱时,E物质的化学式为__________,此时B生成C的化学方程式为:____________________.
18.(12分)硫铁矿烧渣是一种重要的化工产业中间产物,主要成分是、、和二氧化硅等.下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁流程图:
(1)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是____________________.
(2)“酸溶”过程中溶解的离子方程式:____________________.
(3)实验室实现“操作Ⅰ”所用的玻璃仪器有__________、玻璃棒和烧杯等.“操作Ⅲ”系列操作名称依次为:__________、__________、过滤和洗涤.
(4)实验室检验“反应Ⅰ”已经完全的试剂是__________,现象是__________.
(5)流程中加入适量的目的是(用离子方程式表示)______________________________.
19.(12分)化学实验室中使用的浓盐酸的溶质质量分数通常为,密度为.
(1)该盐酸的物质的量浓度为_____________.
(2)现有一种的稀盐酸.关于该溶液下列说法正确的是_____________(填字母:序号).
A.水中含有
B.的稀盐酸中的物质的量浓度也为
C.将气体溶于水所配成的溶液
D.从该溶液中取出,剩余溶液的物质的量浓度仍为
(3)用上述实验室的浓盐酸来配制的稀盐酸.请在下列操作步骤中填写有关的空格:
①用量筒量取_____________mL的浓盐酸;(精确到小数点后一位)
②向盛有少量蒸馏水的烧杯中,沿_____________慢慢注入浓盐酸;
③将已冷却至室温的盐酸溶液沿_____________注入500mL容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1cm~2cm处;
⑥改用_____________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀盐酸转移到试剂瓶中,贴好标签.
(4)操作不当,会引起实验误差.请用“偏高”、“偏低”或“无影响”填写下列情况对所配制的盐酸溶液的物质的量浓度的影响.
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;
③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线_____________.
20.(12分)某小组同学用如图装置进行实验探究(a、b、c表示止水夹).
请评价或完善其方案:
(1)将装置A、C、E相连接,用和浓盐酸制取氯气.
请回答:
①A中反应的离子方程式为________________________;
②用离子方程式表示E中氢氧化钠溶液的作用_________________.
在C中加入适量的水可制得氯水,将所得氯水分成两份进行实验,其实验操作、现象和结论如下:
实验序号 实验操作 现象 结论
Ⅰ 将氯水滴入品红溶液中 品红溶液褪色 氯气有漂白性
Ⅱ 氯水中加入碳酸氢钠粉末 有无色气泡产生 氯气与水反应的产物具有酸性
③实验Ⅰ推出的相应结论是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,无需填写)______________.
④实验Ⅱ推出相应的结论是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,无需填写)______________.
(2)为比较和的氧化性强弱,将A、C、E相连,C中盛放的试剂可以为______________.
(3)①将B、D、E相连,在B中加入浓硝酸和铜片,可制得并进行有关实验.B中反应的化学方程式为____________________________;
②是大气污染物,可以用溶液吸收,生成两种盐.试从氧化还原角度分析并写出吸收反应的离子方程式______________________________________.
试卷类型:A
泰安市2023-2024学年高一上学期1月期末考试
化学试题(A)参考答案及评分标准2024.01
说明:1.每小题若有其它正确答案,可参照评分标准给分.
2.化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分.
3.化学方程式、离子方程式未配平的,都不给分.
一、选择题:本题共10小题,每小题2分,共20分.每小题只有一个选项符合题意.
1.A 2.C 3.D 4.B 5.D 6.A 7.C 8.B 9.D 10.C
二、选择题:本题共5小题,每小题4分,共20分.每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分.
11.AC 12.C 13.D 14.CD 15.BD
三、非选择题:本题共5小题,共60分.
16.(12分)
Ⅰ.(1)①(1分)②(1分)③(1分)
(2)不是(1分)
Ⅱ.(3)④⑥(2分.每个1分,有错误不得分)
(4)①②③④⑧⑨⑩(2分,有错误不得分)⑤⑦(2分.每个1分,有错误不得分)
(5)①②④⑦⑧⑨⑩(2分,有错误不得分)
17.(12分)
(1)(2分)(2分)氧化物(2分)
(2)(1分)(2分)
(3)(1分)(2分)
18.(12分)
(1)增大固体与的接触面积,加快反应速率(2分)
(2)(2分)
(3)漏斗(1分)蒸发浓缩(1分)降温结晶(1分)
(4)溶液(1分)加入试剂后溶液不出现红色(2分)
(5)(2分)
19.(12分)
(1)12.5(2分)
(2)BD(2分.每个1分,有错误不得分)
(3)①40.0(2分)②烧杯内壁(1分)③玻璃棒(1分)⑥胶头滴管(1分)
(4)①无影响(1分)②偏高(1分)③偏低(1分)
20.(12分)
(1)①(1分)
②(2分)
③不合理(1分)没有事先证明干燥的氯气有无漂白性(1分)
④不合理(1分)
制取的氯气中含气体,其溶于水也能与粉末反应产生气泡(1分)
(2)淀粉碘化钾溶液(合理即可)(1分)
(3)①(2分)
②(2分)
同课章节目录
