浙江省绍兴会稽联盟2023-2024学年高二上学期期末联考化学试题(含答案)
文档属性
| 名称 | 浙江省绍兴会稽联盟2023-2024学年高二上学期期末联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 551.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-31 11:59:32 | ||
图片预览




文档简介
绝密★考试结束前
绍兴会稽联盟2023-2024学年高二上学期期末联考
化学学科试题
考生须知:
1.本卷共6页满分100分,考试时间90分钟.
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字.
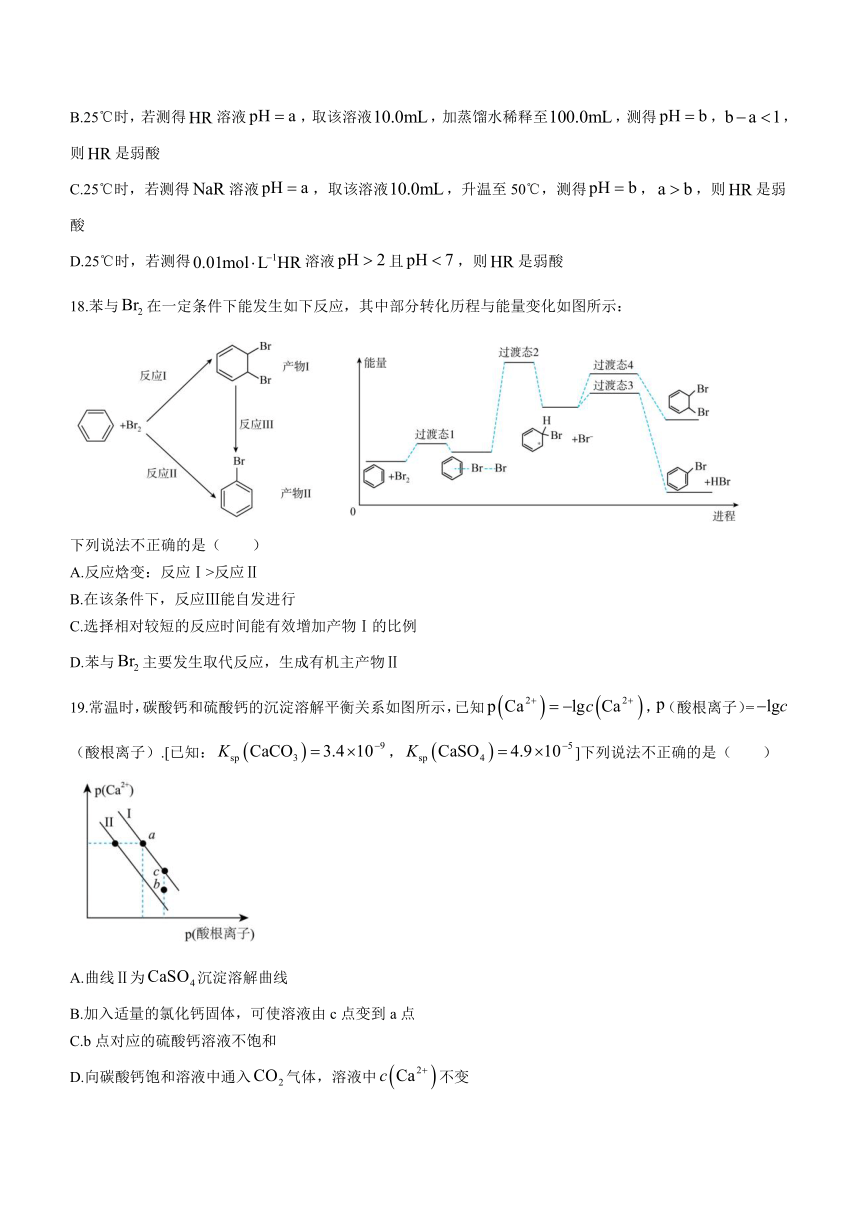
3.所有答案必须写在答题纸上,写在试卷上无效.
4.考试结束后,只需上交答题纸.
可能用到的相对原子质量:H-1、C-12、O-16、Na-23
一、选择题(本大题共20小题,1~10题每小题2分,11~20题每小题3分,共50分.每小题列出的四个选项中只有一个符合题目要求,不选、多选、错选均不得分)
1.25℃,下列物质的水溶液因水解呈酸性的是( )
A. B. C. D.
2.下列能级中轨道数为3的是( )
A.s B.p C.d D.f
3.下列过程中,化学反应速率的增大对人类有益的是( )
A.金属的腐蚀 B.塑料的老化 C.食品的腐败 D.氨的合成
4.下列溶液肯定显酸性的是( )
A.含的溶液 B.的溶液
C.能使酚酞显无色的溶液 D.的溶液
5.下列化学用语表示正确的是( )
A.原子核内有10个中子的氧原子:
B.碳的基态原子轨道表示式:
C.的空间结构:(平面三角形)
D.基态铬原子的价层电子排布式:
6.对于任何一个达到平衡状态的可逆反应,采取以下措施,一定会使化学平衡发生移动的是( )
A.升高温度 B.加入反应物 C.增大压强 D.使用催化剂
7.下列事实可用氢键理论解释的是( )
A.水加热到很高的温度都难以分解 B.氨气极易溶于水
C.氯气易液化 D.HF比HI的酸性弱
8.下列说法不正确的是( )
A.生铁比纯铁容易生锈 B.电解精炼铜用粗铜作阳极,精铜作阴极
C.铁管上镶嵌锌块,铁管不易被腐蚀 D.外加电流法是把被保护的钢铁设备作为阳极
9.下列叙述中正确的是( )
A.、都是极性分子
B.、是含有极性键的非极性分子
C.、、、热稳定性依次增强
D.、都是直线形分子
10.下列变化不能用勒夏特列原理解释的是( )
A.,工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
B.打开汽水瓶,看到有大量的气泡逸出
C.实验室配制氯化铁溶液时,先将晶体溶解在较浓的盐酸中,然后加水稀释到需要的浓度
D.氢气与碘单质反应加压后颜色变深[已知:]
11.常温下,溶液中由水电离产生的,则溶液中一定可以大量共存的离子组是( )
A.、、、 B.、、、
C.、、、 D.、、、
12.中和热测定实验中,用盐酸和进行实验,下列说法不正确的是( )
A.改用盐酸跟溶液进行反应,求出的中和热数值和原来相同
B~测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C.酸碱混合时,量筒中溶液应缓缓倒入小烧杯中,不断用玻璃搅拌器左右搅拌
D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
13.下列反应书写正确的是( )
A.用醋酸溶液处理水垢中的氢氧化镁:
B.钢铁发生电化学腐蚀的负极反应式:
C.溶液中的水解方程式:
D.氯化铁水解的离子方程式:
14.前四周期元素V、W、X、Y、Z原子序数依次增大,V的基态原子有2个未成对电子,X的族序数为周期数的3倍,X、Y、Z均不在同一周期,三者的最外层电子数之和为10,Z的价电子数是Y的3倍.下列说法不正确的是( )
A.第一电离能:W>X B.Y与X形成的化合物中不可能含非极性共价键
C.简单氢化物的稳定性: D.Y和Z两者对应的最高价氧化物的水化物可能会发生反应
15.钠离子电池成本优势明显,有望在大规模储能中取代传统铅酸电池.下图为一种钠离子电池放电的示意图,关于该电池说法正确的是( )
A.a为电池的负极
B.放电时b极反应:
C.充电时a极反应:
D.用该电池给铅酸电池充电时,b电极接铅酸电池的极
16.反应,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开键的数目和生成键的数目相等
D.容器内气体的浓度
17.某同学拟用计测定溶液以探究某酸是否为弱电解质.下列说法正确的是( )
A.25℃时,若测得溶液,则是弱酸
B.25℃时,若测得溶液,取该溶液,加蒸馏水稀释至,测得,,则是弱酸
C.25℃时,若测得溶液,取该溶液,升温至50℃,测得,,则是弱酸
D.25℃时,若测得溶液且,则是弱酸
18.苯与在一定条件下能发生如下反应,其中部分转化历程与能量变化如图所示:
下列说法不正确的是( )
A.反应焓变:反应Ⅰ>反应Ⅱ
B.在该条件下,反应Ⅲ能自发进行
C.选择相对较短的反应时间能有效增加产物Ⅰ的比例
D.苯与主要发生取代反应,生成有机主产物Ⅱ
19.常温时,碳酸钙和硫酸钙的沉淀溶解平衡关系如图所示,已知,(酸根离子)=(酸根离子).[已知:,]下列说法不正确的是( )
A.曲线Ⅱ为沉淀溶解曲线
B.加入适量的氯化钙固体,可使溶液由c点变到a点
C.b点对应的硫酸钙溶液不饱和
D.向碳酸钙饱和溶液中通入气体,溶液中不变
20.下列方案设计、现象和结论都正确的是( )
实验方案 现象 结论
A 往溶液中加入Zn片 短时间内无明显现象 的氧化能力比弱
B 向溶液中加硝酸银溶液至不再产生红棕色沉淀时,滴加稀溶液 红棕色沉淀逐渐转化为白色沉淀
C 向沸水中逐滴加5~6滴饱和溶液,持续煮沸 溶液先变成红褐色再析出沉淀 先水解得胶体再聚集成沉淀
D 比较S与Cl的非金属性强弱 用pH试纸测定的和溶液的pH 若前者的试纸颜色比后者深,说明非金属性:
第Ⅱ卷 非选择题(共50分)
21(14分)A、B、C、D、E、F六种元素的原子序数依次增大,其中A、B、C、D、E为短周期元素,F为第四周期的过渡元素,六种元素的元素性质或原子结构特征如下表:
元素 元素性质或原子结构特征
A 原子s轨道电子数是p轨道电子数的2倍
B 原子p轨道都有电子,且自旋方向相同
C 原子的价层电子排布是
D 原子中只有两种形状的电子云,其最外层只有1个电子
E s轨道与p轨道电子数相同
F 最外层只有1个电子,次外层内的所有轨道的电子均成对
请回答下列问题:
(1)元素A的核外电子排布式为______________;元素F的价层电子的轨道表示式为______________.
(2)B的简单气态氢化物的中心原子杂化轨道类型为______________
(3)A、B、C三种元素的电负性由大到小的顺序为______________(用元素符号回答).
(4)D的基态原子核外电子的空间运动状态有______________种
(5)下列为E原子核形成的四种微粒,电子排布式分别为:
①、②、③、④,
电离最外层一个电子所需能量最大的是______________(填标号);当E从②状态变到③状态,形成的是______________光谱(选填“发射”或“吸收”).
22.(12分)物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,回答下列问题:
表中是常温下、的电离常数和的溶度积常数:
(1)和结合质子能力较强的是___________.
(2)常温下,溶液的约为13,用离子方程式表示溶液显碱性的原因该溶液中__________(填“>、<或=”).
(3)某温度下,水的离子积常数.该温度下,若100体积的溶液与1体积的溶液混合后溶液呈中性,则____________.
(4)常温下,某溶液里,如果要生成沉淀,则应调整溶液大于_____________;若要配制的溶液,为使配制过程中不出现浑浊现象,至少需要滴加的盐酸___________.(加入盐酸后溶液体积变化忽略不计)
23.(14分)科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出).
已知:
则上述流程中第一步反应的__________.
(1)工业上可用和制备甲醇,其反应方程式为:
①已知二氧化碳与氢气生成甲醇的反应能自发进行,则该反应自发进行的条件是____________.
②在300℃、8MPa下,将和通入0.1L体积不变的密闭容器中发生反应生成甲醇,达到平衡时,测得的平衡转化率为50%,则该反应条件下的平衡常数K为___________
(2)经催化可与合成乙烯:
在0.1MPa时,按投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)与温度(T)关系.
①该反应的_________0(填“>”或“<”).
②曲线c表示的物质为_____________.
③为提高的平衡转化率,除改变温度外,还可采取的措施是_________________.
(3)依据甲醇燃烧的反应原理,设计如图所示的原电池装置,该电池负极的电极反应式为___________.
24.(10分)是医药、卫生行业上广泛使用的消毒剂.某课外小组采用滴定法测定某医用消毒剂中的浓度.实验步骤如下:
①标准液的配制和标定:称取一定量固体溶于水,过滤并取滤液经过一系列操作置于滴定管中待用,称取某质量的固体于锥形瓶中,加水溶解,再加酸化,滴定至终点,滴定过程中发生的一个反应为:
.(草酸不稳定,易分解)
根据消耗溶液的体积标定的浓度,得出.
②浓度的测定:取待测样品稀释至,再取于锥形瓶中,加酸化,用上述标准液滴定至终点,平行滴定3次,平均消耗溶液的体积.
回答下列问题:
(1)步骤①酸性高锰酸钾溶液装在_____________滴定管(填“酸式”或“碱式”)
(2)标定标准液时需要控制温度为75℃至85℃,温度不能过低或过高的原因可能是_____________________________________________.
(3)步骤②标准液滴定,直到_________________________,表示已达到滴定终点.
(4)步骤②下列操作会使待测液双氧水的物质的量浓度偏低的是__________.
A.盛标准液的滴定管用蒸馏水洗后未用标准液润洗
B.读取标准液滴定前仰视,滴定后平视
C.盛标准液的滴定管滴定前尖嘴内无气泡,滴定后尖嘴内有气泡
D.锥形瓶用蒸馏水洗后再用待测液润洗
(5)该医用消毒剂中的物质的量浓度为_____________
绍兴会稽联盟2023-2024学年高二上学期期末联考
化学学科参考答案
一、选择题(本大题共20小题,1~10题每小题2分,11~20题每小题3分,共50分.每小题列出的四个选项中只有一个符合题目要求,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B B D D C A B D B D
题号 11 12 13 14 15 16 17 18 19 20
答案 A C D B B A D C B C
二、非选择题(50分,每空2分)
21.(14分)
(1)
(2)
(3)
(4)6
(5)① 吸收
22.(12分)
(1)
(2) >
(3)15
(4)5 0.5
23.(14分)
(缺少单位扣1分)
(1)①低温
②0.04
(2)①< ② ③加压(或不断分离出水蒸气,其他合理答案均给分)
(3)
24.(10分)
(1)酸式
(2)温度过低,反应较慢;温度过高,草酸不稳定,易分解.【温度过低和温度过高两个角度回答,各给1分.】
(3)滴入最后半滴溶液后,锥形瓶中溶液由无色变为浅红色,且半分钟内不变色;【说明:“滴入最后半滴溶液”不写扣1分;“且半分钟内不变色”不写扣1分;锥形瓶中溶液颜色判断错误,得0分】
(4)BC【漏选给1分,多选不给分】
(5)
绍兴会稽联盟2023-2024学年高二上学期期末联考
化学学科试题
考生须知:
1.本卷共6页满分100分,考试时间90分钟.
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字.
3.所有答案必须写在答题纸上,写在试卷上无效.
4.考试结束后,只需上交答题纸.
可能用到的相对原子质量:H-1、C-12、O-16、Na-23
一、选择题(本大题共20小题,1~10题每小题2分,11~20题每小题3分,共50分.每小题列出的四个选项中只有一个符合题目要求,不选、多选、错选均不得分)
1.25℃,下列物质的水溶液因水解呈酸性的是( )
A. B. C. D.
2.下列能级中轨道数为3的是( )
A.s B.p C.d D.f
3.下列过程中,化学反应速率的增大对人类有益的是( )
A.金属的腐蚀 B.塑料的老化 C.食品的腐败 D.氨的合成
4.下列溶液肯定显酸性的是( )
A.含的溶液 B.的溶液
C.能使酚酞显无色的溶液 D.的溶液
5.下列化学用语表示正确的是( )
A.原子核内有10个中子的氧原子:
B.碳的基态原子轨道表示式:
C.的空间结构:(平面三角形)
D.基态铬原子的价层电子排布式:
6.对于任何一个达到平衡状态的可逆反应,采取以下措施,一定会使化学平衡发生移动的是( )
A.升高温度 B.加入反应物 C.增大压强 D.使用催化剂
7.下列事实可用氢键理论解释的是( )
A.水加热到很高的温度都难以分解 B.氨气极易溶于水
C.氯气易液化 D.HF比HI的酸性弱
8.下列说法不正确的是( )
A.生铁比纯铁容易生锈 B.电解精炼铜用粗铜作阳极,精铜作阴极
C.铁管上镶嵌锌块,铁管不易被腐蚀 D.外加电流法是把被保护的钢铁设备作为阳极
9.下列叙述中正确的是( )
A.、都是极性分子
B.、是含有极性键的非极性分子
C.、、、热稳定性依次增强
D.、都是直线形分子
10.下列变化不能用勒夏特列原理解释的是( )
A.,工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
B.打开汽水瓶,看到有大量的气泡逸出
C.实验室配制氯化铁溶液时,先将晶体溶解在较浓的盐酸中,然后加水稀释到需要的浓度
D.氢气与碘单质反应加压后颜色变深[已知:]
11.常温下,溶液中由水电离产生的,则溶液中一定可以大量共存的离子组是( )
A.、、、 B.、、、
C.、、、 D.、、、
12.中和热测定实验中,用盐酸和进行实验,下列说法不正确的是( )
A.改用盐酸跟溶液进行反应,求出的中和热数值和原来相同
B~测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C.酸碱混合时,量筒中溶液应缓缓倒入小烧杯中,不断用玻璃搅拌器左右搅拌
D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
13.下列反应书写正确的是( )
A.用醋酸溶液处理水垢中的氢氧化镁:
B.钢铁发生电化学腐蚀的负极反应式:
C.溶液中的水解方程式:
D.氯化铁水解的离子方程式:
14.前四周期元素V、W、X、Y、Z原子序数依次增大,V的基态原子有2个未成对电子,X的族序数为周期数的3倍,X、Y、Z均不在同一周期,三者的最外层电子数之和为10,Z的价电子数是Y的3倍.下列说法不正确的是( )
A.第一电离能:W>X B.Y与X形成的化合物中不可能含非极性共价键
C.简单氢化物的稳定性: D.Y和Z两者对应的最高价氧化物的水化物可能会发生反应
15.钠离子电池成本优势明显,有望在大规模储能中取代传统铅酸电池.下图为一种钠离子电池放电的示意图,关于该电池说法正确的是( )
A.a为电池的负极
B.放电时b极反应:
C.充电时a极反应:
D.用该电池给铅酸电池充电时,b电极接铅酸电池的极
16.反应,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开键的数目和生成键的数目相等
D.容器内气体的浓度
17.某同学拟用计测定溶液以探究某酸是否为弱电解质.下列说法正确的是( )
A.25℃时,若测得溶液,则是弱酸
B.25℃时,若测得溶液,取该溶液,加蒸馏水稀释至,测得,,则是弱酸
C.25℃时,若测得溶液,取该溶液,升温至50℃,测得,,则是弱酸
D.25℃时,若测得溶液且,则是弱酸
18.苯与在一定条件下能发生如下反应,其中部分转化历程与能量变化如图所示:
下列说法不正确的是( )
A.反应焓变:反应Ⅰ>反应Ⅱ
B.在该条件下,反应Ⅲ能自发进行
C.选择相对较短的反应时间能有效增加产物Ⅰ的比例
D.苯与主要发生取代反应,生成有机主产物Ⅱ
19.常温时,碳酸钙和硫酸钙的沉淀溶解平衡关系如图所示,已知,(酸根离子)=(酸根离子).[已知:,]下列说法不正确的是( )
A.曲线Ⅱ为沉淀溶解曲线
B.加入适量的氯化钙固体,可使溶液由c点变到a点
C.b点对应的硫酸钙溶液不饱和
D.向碳酸钙饱和溶液中通入气体,溶液中不变
20.下列方案设计、现象和结论都正确的是( )
实验方案 现象 结论
A 往溶液中加入Zn片 短时间内无明显现象 的氧化能力比弱
B 向溶液中加硝酸银溶液至不再产生红棕色沉淀时,滴加稀溶液 红棕色沉淀逐渐转化为白色沉淀
C 向沸水中逐滴加5~6滴饱和溶液,持续煮沸 溶液先变成红褐色再析出沉淀 先水解得胶体再聚集成沉淀
D 比较S与Cl的非金属性强弱 用pH试纸测定的和溶液的pH 若前者的试纸颜色比后者深,说明非金属性:
第Ⅱ卷 非选择题(共50分)
21(14分)A、B、C、D、E、F六种元素的原子序数依次增大,其中A、B、C、D、E为短周期元素,F为第四周期的过渡元素,六种元素的元素性质或原子结构特征如下表:
元素 元素性质或原子结构特征
A 原子s轨道电子数是p轨道电子数的2倍
B 原子p轨道都有电子,且自旋方向相同
C 原子的价层电子排布是
D 原子中只有两种形状的电子云,其最外层只有1个电子
E s轨道与p轨道电子数相同
F 最外层只有1个电子,次外层内的所有轨道的电子均成对
请回答下列问题:
(1)元素A的核外电子排布式为______________;元素F的价层电子的轨道表示式为______________.
(2)B的简单气态氢化物的中心原子杂化轨道类型为______________
(3)A、B、C三种元素的电负性由大到小的顺序为______________(用元素符号回答).
(4)D的基态原子核外电子的空间运动状态有______________种
(5)下列为E原子核形成的四种微粒,电子排布式分别为:
①、②、③、④,
电离最外层一个电子所需能量最大的是______________(填标号);当E从②状态变到③状态,形成的是______________光谱(选填“发射”或“吸收”).
22.(12分)物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,回答下列问题:
表中是常温下、的电离常数和的溶度积常数:
(1)和结合质子能力较强的是___________.
(2)常温下,溶液的约为13,用离子方程式表示溶液显碱性的原因该溶液中__________(填“>、<或=”).
(3)某温度下,水的离子积常数.该温度下,若100体积的溶液与1体积的溶液混合后溶液呈中性,则____________.
(4)常温下,某溶液里,如果要生成沉淀,则应调整溶液大于_____________;若要配制的溶液,为使配制过程中不出现浑浊现象,至少需要滴加的盐酸___________.(加入盐酸后溶液体积变化忽略不计)
23.(14分)科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出).
已知:
则上述流程中第一步反应的__________.
(1)工业上可用和制备甲醇,其反应方程式为:
①已知二氧化碳与氢气生成甲醇的反应能自发进行,则该反应自发进行的条件是____________.
②在300℃、8MPa下,将和通入0.1L体积不变的密闭容器中发生反应生成甲醇,达到平衡时,测得的平衡转化率为50%,则该反应条件下的平衡常数K为___________
(2)经催化可与合成乙烯:
在0.1MPa时,按投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)与温度(T)关系.
①该反应的_________0(填“>”或“<”).
②曲线c表示的物质为_____________.
③为提高的平衡转化率,除改变温度外,还可采取的措施是_________________.
(3)依据甲醇燃烧的反应原理,设计如图所示的原电池装置,该电池负极的电极反应式为___________.
24.(10分)是医药、卫生行业上广泛使用的消毒剂.某课外小组采用滴定法测定某医用消毒剂中的浓度.实验步骤如下:
①标准液的配制和标定:称取一定量固体溶于水,过滤并取滤液经过一系列操作置于滴定管中待用,称取某质量的固体于锥形瓶中,加水溶解,再加酸化,滴定至终点,滴定过程中发生的一个反应为:
.(草酸不稳定,易分解)
根据消耗溶液的体积标定的浓度,得出.
②浓度的测定:取待测样品稀释至,再取于锥形瓶中,加酸化,用上述标准液滴定至终点,平行滴定3次,平均消耗溶液的体积.
回答下列问题:
(1)步骤①酸性高锰酸钾溶液装在_____________滴定管(填“酸式”或“碱式”)
(2)标定标准液时需要控制温度为75℃至85℃,温度不能过低或过高的原因可能是_____________________________________________.
(3)步骤②标准液滴定,直到_________________________,表示已达到滴定终点.
(4)步骤②下列操作会使待测液双氧水的物质的量浓度偏低的是__________.
A.盛标准液的滴定管用蒸馏水洗后未用标准液润洗
B.读取标准液滴定前仰视,滴定后平视
C.盛标准液的滴定管滴定前尖嘴内无气泡,滴定后尖嘴内有气泡
D.锥形瓶用蒸馏水洗后再用待测液润洗
(5)该医用消毒剂中的物质的量浓度为_____________
绍兴会稽联盟2023-2024学年高二上学期期末联考
化学学科参考答案
一、选择题(本大题共20小题,1~10题每小题2分,11~20题每小题3分,共50分.每小题列出的四个选项中只有一个符合题目要求,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B B D D C A B D B D
题号 11 12 13 14 15 16 17 18 19 20
答案 A C D B B A D C B C
二、非选择题(50分,每空2分)
21.(14分)
(1)
(2)
(3)
(4)6
(5)① 吸收
22.(12分)
(1)
(2) >
(3)15
(4)5 0.5
23.(14分)
(缺少单位扣1分)
(1)①低温
②0.04
(2)①< ② ③加压(或不断分离出水蒸气,其他合理答案均给分)
(3)
24.(10分)
(1)酸式
(2)温度过低,反应较慢;温度过高,草酸不稳定,易分解.【温度过低和温度过高两个角度回答,各给1分.】
(3)滴入最后半滴溶液后,锥形瓶中溶液由无色变为浅红色,且半分钟内不变色;【说明:“滴入最后半滴溶液”不写扣1分;“且半分钟内不变色”不写扣1分;锥形瓶中溶液颜色判断错误,得0分】
(4)BC【漏选给1分,多选不给分】
(5)
同课章节目录
