1.3.2氧化剂与还原剂 课件 (共57张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2氧化剂与还原剂 课件 (共57张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-31 15:24:08 | ||
图片预览










文档简介
(共57张PPT)
|C|C_______________________氧 化 剂 与 还 原 剂C|C—C—ФC + O2 = CO2
0
0
+4
-2
H2 + CuO = H2O + Cu
氧化剂:得电子→化合价降低的物质。具有氧化性。
还原剂:失电子→化合价升高的物质。具有还原性。
得 氧
失 还
化合价升高,失电子,氧化反应
化合价降低, 得电子,还原反应
0
+2
0
+1
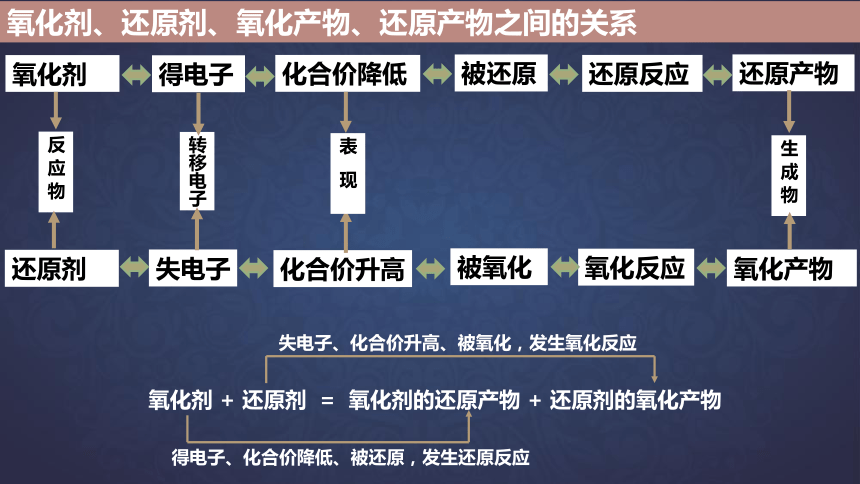
氧化剂
还原剂
化合价升高,失电子,氧化反应
化合价降低, 得电子,还原反应
氧化剂
还原剂
氧化产物
还原产物
氧化产物
还原产物
反 应 物
氧化剂
还原剂
被还原
还原反应
还原产物
被氧化
氧化反应
氧化产物
生 成 物
得电子
失电子
化合价降低
化合价升高
转移电子
表 现
氧化剂、还原剂、氧化产物、还原产物之间的关系
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
失电子、化合价升高、被氧化,发生氧化反应
得电子、化合价降低、被还原,发生还原反应
4FeS2 + 11O2 =2Fe2O3 + 8SO2
2HNO3+3BaSO3=H2O + 2NO↑ + 3BaSO4
+5
+2
+4
+6
化合价降低, 得电子,还原反应
化合价升高,失电子,氧化反应
氧化剂
还原剂
还原产物
氧化产物
+2
-1
+3
+4
0
—2
-2
化合价降低, 得电子,还原反应
化合价升高,失电子,氧化反应
氧化剂
还原剂
还原产物
还原产物
氧化产物
氧化产物
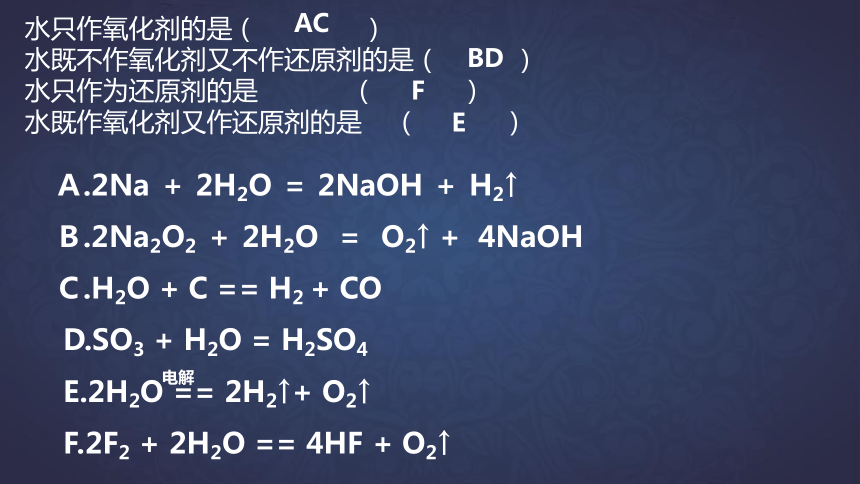
A.2Na + 2H2O = 2NaOH + H2↑
B.2Na2O2 + 2H2O = O2↑ + 4NaOH
C.H2O + C == H2 + CO
D.SO3 + H2O = H2SO4
E.2H2O == 2H2↑+ O2↑
F.2F2 + 2H2O == 4HF + O2↑
AC
BD
E
F
电解
水只作氧化剂的是( )
水既不作氧化剂又不作还原剂的是( )
水只作为还原剂的是 ( )
水既作氧化剂又作还原剂的是 ( )
+2
+4
+3
0
化合价升高,失 e—,氧化反应
化合价降低,得 e—,还原反应
6
6
步骤:
1:标变价
2:画线桥
3:标电子得失数
a:箭头方向指向生成物
b:线桥的两端连接同一种元素
c:线桥两端指元素符号的正中间
a:电子得失数相等
转移电子数=
化合价改变的绝对值×化合价改变的原子数
(1)用双线桥法表示氧化还原反应中电子的转移
3CO+Fe2O3=3CO2+2Fe
H2+CuO === H2O+Cu
△
2KClO3 === 2KCl + 3O2 ↑
△
注意:A、箭头由失电子元素指向得电子元素 。
B、只须标明电子转移总数。不写“得” “ 失”。
(2)“单线桥”法
2e—
12e—
Fe的化合价
+3
+5
+2
+1
0
-1
Fe3+
只氧化性
只有还原性
Fe2+
兼有氧化性和还原性
Fee
S的化合价
+6
+5
+4
0
0
-2
只有氧化性
兼有氧化性和还原性
只有还原性
兼有氧化性和还原性
兼有氧化性和还原性
S2—
S2— 、HS— 、H2S
S
SO2 、HSO3— 、SO32—
SO3 、 H2SO4
O的化合价
0
+5
-1
+1
-2
-1
Fe3+
只氧化性
只有还原性
Fe2+
兼有氧化性和还原性
Fee
O2 、 O3
H2O2、Na2O2
H2O
专题1:常见的氧化剂、还原剂
氧化剂:得电子→化合价降低的物质。
还原剂:失电子→化合价升高的物质。
得 氧
失 还
元素的化合价可以继续降低,则具有氧化性。
元素的化合价可以继续升高,则具有还原性。
思考:
1物质中所含元素的化合价可以降低,该物质就一定适合做常见的氧化剂吗?
2物质中所含元素的化合价可以升高,该物质就一定适合做常见的还原剂吗?
因为NaCl中的阴、阳离子是稳定的价态,不容易变价,所以NaCl不适合做常见的氧化剂或还原剂。
常见元素的相对稳定的价态,不容易变价,通常就不适合从该元素入手分析此物质的性质:
K 、 Ca 、 Na 、 Mg 、 Al 、O 、 F、Cl 、 、
+1 —1
不一定
+1 +2 +1 +2 +3 —2 —1 —1
1)活泼的非金属单质:O3 、 O2 、 Cl2 、 Br2 、 I2
2)高价的氧化物:CuO 、 Fe2O3
3)高价的含氧酸及盐: KMnO4 、K2Cr2O7 、
浓H2SO4 、 HNO3 、
4)某些阳离子:Fe3+ 、 H+
常见强氧化剂:
O2 、 Cl2 、ClO— 、Br2、MnO4— 、Cr2O72— 、
H2O2 、Na2O2 、HNO3 、浓H2SO4 、Fe3+
专题1:常见的氧化剂: 具有氧化性,易得电子,高价态物质。
(1)活泼的金属单质:K、 Na 、 Mg 、 Al、Zn 、 Fe 、、
(2)某些非金属单质:H2 、 C 、、、、、
(3)变价元素的低价态物质:CO 、 Cu+ 、、、、
(4)某些阴离子: I— 、 S2— 、、、、、
常见强还原剂:
H2S 、S2— 、HS— 、 SO2、SO32— 、HSO3— 、I— 、Fe2+
思考:
强氧化剂与强还原剂混合,是否一定反应呢?
专题1:常见的还原剂: 具有还原性,失电子,低价态物质
思考:Na2SO3、Na2S2O3、FeSO4、H2O2、KI、FeCl3、KMnO4,从化合价角度分析,这些物质可能有哪些性质?它们之间反应吗?如何验证?
设计如下实验方案:
①:取适量酸性高锰酸钾溶液于试管中,滴加双氧水溶液。
②:取适量酸性碘化钾溶液于试管中,滴加双氧水溶液。
③:取适酸性高锰酸钾溶液于试管中,滴加硫酸亚铁溶液。
④:取适量酸性高锰酸钾溶液于试管中,滴加碘化钾溶液。
⑤:取适量酸性高锰酸钾溶液于试管中,滴加亚硫酸钠溶液。
⑥:取FeCl3溶液于试管中,滴加碘化钾溶液。
⑦:取适量硫代硫酸钠溶液于试管中,滴加稀硫酸溶液。
②:H2O2 + I—+ H+ = H2O + I2
⑥:I— + Fe3+ = I2 + Fe2+
①:H2O2 + MnO4— + H+ = O2 ↑ + Mn2+ + H2O
⑤:SO32— +MnO4—+ H+ = SO42— + Mn2+ + H2O
③:MnO4—+ Fe2+ + H+ = Mn2+ + Fe3+ + H2O
④:I— +MnO4—+ H+ = I2 + Mn2+ + H2O
⑦:H2SO4 + Na2S2O3 = Na2SO4 + S ↓+ SO2↑+ H2O
小结:氧化还原反应方程式的配平
1: 判断主要的反应物和生成物
2: 得失电子守恒
3: 电荷守恒
依 据
步骤:
①确定氧化剂、还原产物;还原剂、氧化产物的化合价
②用观察法找出元素化合价的变化值
③用得失电子数相等的原则确定化学计量数
④检查是否符合3个守恒
4: 质量守恒
物质的化学式
各元素的化合价
核心元素的化合价
预测氧化性/还原性
方法总结:研究分析未知物质性质的一般程序
实验验证
①Cu2(OH)2CO3与酸能否反应?
特性
SiO2+H2O = H2SiO3
≠
两种思路
②NaHSO3与烧碱、盐酸、硝酸能否反应?产物是?
氧化性越强:得电子越容易
还原性越强:失电子越容易
得电子的是氧化剂
失电子的是还原剂
得 氧
失 还
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
阳离子的氧化性逐渐增强,得电子能力增强
单质的还原性逐渐减弱,失电子能力减弱
氧化性、还原性的强弱只取决于得到或失去电子的难易,
与得失电子的多少没有直接关系。
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+ Pt Au
专题2:氧化性、还原性的强弱比较及规律、应用
氧化剂的氧化性强于氧化产物的氧化性
还原剂的还原性强于还原产物的还原性
② Mg+ H2SO4 = MgSO4 + H2↑
③ 2Al+ 3H2SO4 =Al2(SO4)3+3H2↑
④ Cu+ H2SO4 (稀) =
①Fe+CuSO4 =FeSO4 +Cu
规律1:
强 的 在 前
弱 的 在 后
还原性:Fe>Cu;氧化性:Cu2+>Fe2+
还原性:Mg>H2;氧化性:H+ > Mg2+
还原性:Mg>Al>Cu;
速 率:② > ③ > ④
规律2:
越强越容易
越弱越困难
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
失电子、化合价升高、被氧化,发生氧化反应
得电子、化合价降低、被还原,发生还原反应
专题2:氧化性、还原性的强弱比较及规律、应用
Fe的化合价
+3
+5
+2
+1
0
-1
Fe3+
只氧化性
只有还原性
Fe2+
兼有氧化性和还原性
Fee
S2-、HS-、H2S
S
SO2 、HSO3-、SO32-
SO3 、 H2SO4
氯元素的化合价
+7
+5
+3
+1
0
-1
只有氧化性
兼有氧化性和还原性
只有还原性
兼有氧化性和还原性
兼有氧化性和还原性
兼有氧化性和还原性
特
例
氧化性:HClO> HClO2 > HClO3 > HClO4
判断氧化性强弱: Fe3+与Fe2+;
KMnO4与MnO2
还原性强弱:S2— 、S 与 SO2
专题2:根据元素化合价高低来判断氧化性强弱
氧化性: Fe3+>Fe2+
KMnO4>MnO2 ;
还原性: S2— >S > SO2
S的化合价
+6
+5
+4
0
0
-2
只有氧化性
兼有氧化性和还原性
只有还原性
兼有氧化性和还原性
兼有氧化性和还原性
S2—
规律3:通常
化合价越高,氧化性越强
化合价越低,还原性越强
MnO2+4HCl (浓) = MnCl2+Cl2↑ + 2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
3Fe+2O2 = Fe3O4
Fe + S = FeS
2Fe+3Cl2 = 2FeCl3
点燃
点燃
氧化性强弱顺序的是?
Cl2 > O2> S
专题2:根据与同一种物质反应的情况判断氧化性强弱
同是将浓盐酸氧化为Cl2,MnO2必须在加热条件下才能进行,
而KMnO4在常温下即可进行,说明氧化能力KMnO4>MnO2 >Cl2
氧化性: MnO2 > Cl2
氧化性: KMnO4 > Cl2
思考:①同时将 铁片、铜片、金片放在室外,生锈的先后顺序是?
②如果圆底烧瓶中同时有: MnO2 和 KMnO4 ,哪个优先与盐酸反应?
规律4:
强 的 优 先
弱 的 靠 后
(1)物质的浓度越高,氧化性或还原性越强。
(2)酸性越强,氧化性越强;碱性越强,还原性越强。
浓HNO3的氧化性强于稀HNO3;
H2SO4(浓) > H2SO4(稀)
KMnO4氧化性:酸性 > 中性 > 碱性
专题2:外界条件对某些物质氧化性或还原性强弱的影响
专题2:氧化性、还原性的强弱规律总结
规律1:
强 的 在 前
弱 的 在 后
规律3:
越强越容易
越弱越困难
规律2:
强 的 优 先
弱 的 靠 后
规律4:通常
化合价越高,氧化性越强
化合价越低,还原性越强
思考:浓硫酸与二氧化硫/硫化氢反应吗?
☆ 稀硝酸溶液滴入Na2SO3溶液中
☆ Br2水滴入FeSO4溶液中
☆ 酸性双氧水溶液和FeSO4溶液混合
1.判断下列反应能否发生?若能,则写出离子方程式,并比较氧化性强弱。
☆ 3SO32-+ 2NO3-+ 2H+ = 3SO42- + 2NO↑ + H2O
☆ 2Fe2+ + Br2 = 2Fe3+ + 2Br-
☆ H2O2 + 2Fe2++ 2H+ = 2Fe3+ + 2H2O
氧化性:HNO3 > H2SO4 ; Br2 > Fe3+ ; H2O2 > Fe3+
氧化性: MnO4- > MnO2 > Cl2 > Br2 > Fe3+ > I2
思考:①在无色溶液中加入稀盐酸酸化的Ba(NO3)2溶液得到白色沉淀。能否说明原溶液存在SO42-?②能否用稀硝酸酸化?
2.根据下列三个方程式:
I2+SO2+2H2O = H2SO4+2HI; 2FeCl2+Cl2 = 2FeCl3;
2FeCl3+2HI = 2FeCl2+2HCl+I2有关物质的还原性强弱顺序是
A I— > Fe2+ > Cl— > SO2 B Cl— > Fe2+ > SO2 > I—
C Fe2+ > I— > SO2 D SO2 > I— > Fe2+ > Cl—
D
3. 已知I—、Fe2+、和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为: H2O2 < Fe2+ < I— < SO2。下列反应不能发生的是( )
A. 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42— + 4H+
B. H2O2 + H2SO4 = SO2 + O2 + 2H2O
C. I2 + SO2 + 2H2O = H2SO4 + 2HI
D. 2Fe3+ + 2I— = 2Fe2+ + I2
B
4.已知:Cu+2FeCl3 = CuCl2+2FeCl2,在FeCl3和CuCl2混合液中加铁粉。
①:如固体有剩余,则溶液中肯定没有的离子: Fe3+
肯定有的离子:Fe2+ 、Cl— 。可能有的离子:Cu2+
②:若固体全部为铜,则溶液中肯定没有的离子: Fe3+
肯定有的离子:Fe2+ 、Cl— 。 可能有的离子:Cu2+
③:若固体为混合物,则溶液中肯定没有离子: Cu2+、Fe3+
肯定有的离子:Fe2+ 、Cl—
④:若固体没有剩余,肯定有的离子:Cl—、Fe2+、Cu2+
可能有的离子:Fe3+
7.下列各组离子可以大量共存的是( )
A:遇石蕊变红的透明溶液 H+、 Fe2+、 MnO4-、 SO42-
B:遇石蕊变蓝的溶液中 OH-、 Ba2+、 Fe3+、 HSO3-
C:可以使酚酞不变色的溶液 H+、 Fe2+、NO3- 、Cl-
D:可以使酚酞变红的溶液 ClO-、S2-、Na+、 SO42-
E:Fe2+、 Cl-、 NO3-、 Fe3+、 SO42-
F:Fe3+、 I-、 H2O2、 H+、 Cl-、 K+
G:遇石蕊变红的溶液中, OH-、 Ba2+、 ClO-、 HCO3-
E
8.下列各组离子因氧化还原反应而不能共存的是( )
A:遇石蕊变红的透明溶液 Fe2+、 NO3-、 K+
B:OH-、K+ 、Ba2+、 SO42-
C: H+、 Ag+、NO3- 、Cl-
D: Cu2+、Br-、Na+、 OH-
5.已知:2FeCl3+2Kl = 2FeCl2+2KCl+l2 、
2FeCl2+Cl2 = 2FeCl3
2KMnO4 +16HCl=2MnCl2 + 2KCl+5Cl2↑+8 H2O 。若某溶液中有Fe2+和I—,要除去I—而不影响Fe2+和Cl—,可以选择的试剂是( ) A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
6. Li2NH是一种储氢材料其原理:Li2NH + H2 = LiNH2 + LiH
下列说法正确的是( )
A.Li2NH中N的化合价为—1
B.H2既是氧化剂,又是还原剂
C.每消耗2molH2 ,转移4NA个电子
D.此法储氢与钢瓶储氢原理相同
B
1:G、Q、X、Y、Z均为氯的含氧化合物,他们有如下转化关系:G→Q+NaCl, Q+H2O→X+H2, Y+NaOH→G+Q+H2O, Z+NaOH→X+Q+H2O
则G、Q、X、Y、Z中氯元素的化合价由高到低顺序:
2:已知:3Cu+2NO3— +xH+ =3Cu2+ +2R+yH2O
①参加反应的Cu与消耗的硝酸的数量之比为:
氧化剂与还原剂的数量之比:
③当1.5molCu被氧化时,转移的电子的量为:
此时被还原的硝酸的量为:
1.5mol
4mol
1mol
3mol
3mol
3:汽车安全气囊中的反应:10NaN3+2KNO3 =16N2↑+5Na2O+K2O 若氧化产物比还原产物多1.75mol,下列判断正确的是( )
A.转移电子数为1.25NA B.有0.25mol KNO3被氧化
C.产生氮气44.80L D.被氧化的氮原子的量为1.25mol
15a mol
10a mol
10a mol
10a mol
a mol
2a mol
15a - a = 1.75
a = 0.125
还原剂
氧化剂
A
歧
化
反
应
NO2 + H2O = NO + HNO3
NO2 + NaOH = NaNO3 + NaNO2 + H2O
H2SO4 + Cu2O = CuSO4 + Cu + H2O
S + KOH = K2S + K2SO3 + H2O
I2 + NaOH = NaIO3 + NaI + H2O
Cl2 + NaOH = NaCIO + NaCI + H2O
H2O2 = O2↑ + H2O
H2SO4 + Na2S2O3 = Na2SO4 + S ↓+ SO2↑ + H2O
归
中
反
应
Fe + Fe2(SO4)3 = FeSO4
H2S + SO2 = H2O + S↓
H2SO4 + H2S = SO2 + S↓ + H2O
C + CO2 = CO
KClO3 + HCl = KCl+ Cl2↑+ H2O
NH3 + NO2 = N2 + H2O
NH4H + H2O = H2↑ + NH3 H2O
N2H4 + N2O4 = N2↑ + H2O
FeS2 + O2 = SO2 + Fe2O3
Cu2S + O2 = Cu + SO2
H2S + O2F2 = O2↑ + HF+ SF6
P +CuSO4+H2O =Cu3P+ H3PO4 + H2SO4
As2S3 + HNO3 + = H3AsO4 + H2SO4 + NO
将1.1mol I2加入烧碱溶液中,得到NaI,NaIO,NaIO3,且后两产物的量之比为2:3
NaClO + Ag +H2O = AgCI + NaOH + O2
整体分析法的运用
Fe3P+ HNO3——Fe(NO3)3+ NO+ H3PO4+ H2O
ClO2 + CN— =Cl— + N2+CO2
ne―
谢
谢
观
看
n e―
ne―
时间就是金钱
效率就是生命
CH3-(CH2)n- -SO3Na
(2017·全国卷Ⅲ,27题节选)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质:
步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3 — Na2CrO4+Fe2O3+CO2+NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为____________。
[强化1] (1)(天津卷,9题节选)酸性条件下,MnO(OH)2将I-氧化为I2:
MnO(OH)2+I-+H+―→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学 计量数依次为__________________。
(2)(安徽卷,27题节选)请配平下列反应的化学方程式:
1, 2, 4, 1, 1, 3
1NaBO2+2SiO2+4Na+2H2=1NaBH4+2Na2SiO3。
(浙江卷,27题节选)完成以下氧化还原反应的离子方程式:
( )MnO4—+( )C2O42-+______===( )Mn2++( )CO2↑+________
通电
当Na2S2O3与足量稀硫酸反应时,溶液变浑浊,且有刺激性气体产生,则氧化产物与还原产物的物质的量之比为____________。
(5)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为____________(填化学式)。
(6)联氨(N2H4,常温下是液体)是航天飞船常用的高能燃料,联氨可以用尿素[CO(NH2)2]为原料制取,方法是在KMnO4催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、NaOH溶液反应生成联氨、Na2CO3、另一种钠盐和水,写出该反应的化学方程式:
MnO2+MnS+2H2SO4===2MnSO4+S+2H2O
7.(2020·广东湛江调研)将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中进行四组实验,探究体系中微粒间的相互作用,测得溶液pH变化如图所示。实验现象中观察到:实验a中不产生白色沉淀;实验b、c、d中均产生白色沉淀。下列说法中不正确的是( )
A.实验a中溶液pH降低的原因是SO2与H2O反应生成H2SO3
B.实验a和c相比,实验c所表示的过程中O2是氧化SO2的主要微粒
C.与实验a、b、c相比,可知实验d所表示的过程中NO是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
4:下列转化必须加氧化剂才能实现的是( )
A: Fe2+ → FeCl3 B: H2O2→O2 C: Cr2O72-→ CrO42-
D: SiO2→Si E: CH3CH2OH→CH3CHO F:NO2→HNO3
AE
5:强氧化剂RO(OH)2+被Na2SO3还原到较低价,如果还原2.4×10-3molRO(OH)2+需要30ml0.2mol/L的Na2SO3溶液,那么R元素的最终化合价:
6:次磷酸H3PO2为一元中强酸,可将Ag+还原为银。
①:H3PO2的电离方程式:
②:NaH2PO2的是否为正盐?
③:利用H3PO2的化学镀银时,氧化剂与还原剂的量之比为4:1,则氧化产物为:
④: 在此反应中,2mol还原剂得到的电子数:
KMnO4 +HCl = MnCl2 + KCl+Cl2↑ + H2O
KMnO4+KNO2+H2SO4=MnSO4 + K2SO4 + KNO3 +H2O
7:配平下列氧化还原反应方程式
C + HNO3(浓)= NO2↑ + CO2↑ + H2O
H2O + KI+ O3 = O2 + I2 + KOH
NaIO3+NaHSO3 — NaHSO4+Na2SO4+H2O+I2
S+KNO3+C—K2S+CO2↑+N2↑
Fe3P+HNO3—Fe(NO3)3+NO↑+H3PO4+H2O
P4+CuSO4+H2O — Cu3P+H3PO4+H2SO4
2.下列制取CO2、通过CO2和NaAlO2溶液制取Al(OH)3、分离并
加热Al(OH)3制Al2O3的装置和原理能达到实验目的的是
A.制取CO2 B. 制取Al(OH)3 C. 分离Al(OH)3 D.制Al2O3
3.BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是
A.该过程的总反应:C6H6O+7O2催化剂光6CO2+3H2O
B.该过程中BMO表现较强氧化性
C.降解产物的分子中只含有极性共价键
D.①和②中被降解的苯酚的物质的量之比为3:1
B
D
已知铜能与浓硫酸反应,判断什么元素的化合价发生了变化?
实验:铜与浓硫酸的反应
所以我们重点分析浓硫酸中的硫元素。
已知硝酸能与许多金属反应,但一般不产生氢气,判断什么元素的化合价发生了变化?
所以我们重点分析硝酸中的氮元素。
3、怎么分析物质中的重点元素,即核心元素?
A:2KW+Z2=2KZ+W2 B:2KY+W2=2KW+Y2
C:2KX+Z2=2KZ+X2 D:2KZ+X2=2KX+Z2
8:四种单质的氧化能力 W2 〉Z2 〉X2〉Y2 ,则下列反应可以发生的是( )
BC
9:常温下,溶液中有如下反应:Ce4++Fe2+=Ce3++Fe3+
Sn2++2Fe3+=Sn4++2Fe2+。氧化剂,还原剂分别是?其强弱顺序?
10:已知Co2O3在酸性溶液中被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。则下列反应不可能发生的是( )
A:3Cl2+6Fel2=2FeCl3+4Fel3
A
B:Cl2+Fel2=FeCl2+l2
C:2l-+2Fe3+=2Fe2++l2
D:6HCl+Co2O3=2CoCl2+Cl2↑ +3H2O
铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)稀溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表:
加入溶液 ①适量铋酸钠溶液 ②过量的双氧水 ③适量KI淀粉溶液
实验现象 溶液呈紫红色 紫红色消失,产生气泡 溶液变成蓝色
NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3
B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2
D.KMnO4、NaBiO3、I2、H2O2
1:已知氧化性Fe3+ > Ag+ > Cu2+ > H+ > Zn2+,在含有Fe3+ 、Ag+、Cu2+、H+、Zn2+各0.01mol的混合溶液中,加入0.01mol铁粉,充分反应后,溶液中的离子的量各有多少?
3:分别用KMnO4,氯酸钾,过氧化氢制取同温同压下相同体积的氧气,三个反应转移的电子的量之比为:
4:下列物质在酸性条件下都能将KI氧化成I2,自身发生如下变化: H2O2→H2O , IO3-→I2, MnO4-→Mn2+, HNO2→NO。 如分别用等量的下列物质氧化足量的I-,得到I2最多的是( )
A:H2O2 B: IO3- C:MnO4- D:HNO2
B
5:火法炼铜,先焙烧黄铜矿:2CuFeS2+O2=Cu2S+2FeS+SO2下列说法正确的是( )
A.每生成1molSO2转移6mol电子
B.CuFeS2中被氧化和被还原的原子数之比为2:1
C.每生成1molCu2S有4molS被氧化
D.每转移1.2mol电子有0.2molS被氧化
8:自然界中有如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
下列说法正确的是( )
A.CuSO4是氧化剂,FeS2还原剂
B.产物中的SO42-有一部分是氧化产物
C.Cu2S既是氧化产物,又是还原产物
D.每转移10mol电子,就有5molFeS2发生反应
B
6:Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,NaClO被还原为NaCl,Na2Sx与NaClO的量之比为1:16,则x为?
7:有些工业废水中有剧毒的Cr2O72-,可以用绿矾除去,测得反应后的溶液中有Fe2+、H+、Cr3+、Fe3+,离子方程式?
9:FeCl3溶液与草酸反应得到澄清溶液,并产生一种能使石灰水变浑浊的气体,则离子反应为:
10:在碱性溶液中,Cl2与NaI反应,每molNaI完全反应转移6mol电子,其离子方程式为?
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2molFeSO4发生反应时,反应中共有8mol电子转移
B
12:劣质美白产品中有铅白,时间久了会变成黑色的PbS,除去黑斑的方法是选择合适的氧化剂将其氧化为难溶于水的PbSO4,可选的氧化剂有KMnO4,H2O2,哪种好?方程式?
13:FeCl3与KClO在强碱性条件下制得K2FeO4其离子方程式?
14:砒霜(As2O3)与金属锌,盐酸混合加热可生成AsH3气体,其离子方程式?AsH3气体在热的试管中分解成黑亮的砷镜。比较氧化性和还原性。
15: 2Cu(IO3)2+24KI+12H2SO4=2CuI+13I2+12K2SO4+12H2O
其中1 mol氧化剂在反应中得到的电子为( )
A.10 mol B.11 mol C.12mol D.13 mol
16:在100ml含等量HBr和H2SO3的溶液中通入0.01molCl2有一半的Br-被氧化成Br2(已知Br2能氧化H2SO3)则原溶液中HBr的量浓度为?
17:已知Cl2在高温时的KOH溶液中可发生两个氧化还原反应,反应完全后溶液中KClO和KClO3的量之比为4:1,则溶液中KCl和KClO的量之比为?
18:①O3+2KI+H2O═2KOH+I2+O2 ②SiO2+2C= Si+2CO↑ ③4HCl(浓)+MnO2=MnCl2+Cl2↑+2H2O.氧化剂与还原剂的量之比为1:2的是( )
A.仅有② B.仅有②④ C.①②③④ D.仅有②③④
19:PbO2可与浓盐酸反应生成黄绿色的气体Cl2
在强酸性环境下,双氧水与Ce3+反应的离子方程式:
1:将不溶的黄色固体NaBiO3加入MnSO4和硫酸的混合液中,微热,溶液显紫色,(Bi3+无色)配平方程式:
Ce3+ + H2O2 + H2O == Ce(OH)4 ↓ + ___
强化练习
3BrF3+5H2O = 9HF + Br2+HBrO3+O2↑若有
5molH2O发生氧化反应,则被还原的BrF3的量?
11P+15CuSO4+24H2O = 5 Cu3P+6H3PO4+15H2SO4,15molCuSO4可以氧化P的量为?
6mol
有一铁的氧化物样品,用5 mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标况下0.56L Cl2,使亚铁离子全部变成Fe3+,则该氧化物可能的化学式为
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
D
一定质量的镁铝合金与500mL1mol/L的硝酸完全反应生成2.24LNO(标况),再向反应后的溶液中加入2mol/L的NaOH溶液,金属元素恰好完全沉淀,则消耗的NaOH溶液体积为?
SO2+2Fe3++2H2O - SO42-+2Fe2++W;
Cr2O72-+aFe2++bH+ -Cr3++Fe3++H2O。下列判断正确的是
A.还原性Cr3+> Fe2+> SO2 B.氧化性Cr2O72-> SO2> Fe3+
C.两个反应中Fe2(SO4)3均作还原剂 D.Cr2O72-能将SO2氧化成SO42-
D
实验室将NaClO3和Na2SO3按物质的量之比为2:1倒入烧瓶中,同时滴入适量硫酸,并用水浴加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为?
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3==2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 如果产生28gN2,转移电子数为?
A、5:3 B、5:4 C、1:1 D、3:5
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物
B. O2F2既是氧化剂又是还原剂
C. 若生成4.48LHF,则转移0.8mol电子
D. 还原剂与氧化剂的物质的量之比为1:4
D
一定条件下,H2O2氧化H2S,H2O2与H2S的量比不同
产物不同,若H2O2与H2S的量比为4:1,则氧化产物是?
KClO3和浓盐酸加热,产生棕黄色气体ClO2,
2KClO3+4HCl=2KCl+2ClO2↑+Cl2↑+2H2O氧化剂与还原剂的量之比:产生标况下6.72L气体,转移电子数:当有0.2molHCl被氧化,转移电子数:当有0.2molHCl参与反应,转移电子数为:当有 1mol氧化剂被还原,则被氧化的还原剂为:转移电子数为:
P4和烧碱溶液加热反应,产生毒气体PH3、NaH2PO2、Na2HPO3,已知NaH2PO2与Na2HPO3的量之比为3:1,则其化学反应为:
一定条件下,PbO2与Cr3+反应产物是Pb2+和CrO3,则1molCr3+需要的PbO2量?
物质在反应中可体现氧化性、还原性、酸性、碱性等,下面方程式中画线的物质体现两种或以上性质的有:
①3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑+ 5H2O
②C + 2H2SO4 = CO2↑+ 2SO2↑+ 2H2O
③8NH3 + 3Cl2 = 6NH4Cl + N2
④2Na2O2 + 2H2O = 4NaOH + O2↑
A:①② B:①④ C:③④ D:全部
B
Cu2S 与一定浓度的硝酸反应,生成CuSO4、
Cu(NO3)2。NO和水,反应为?
Na2Sx在碱性溶液中可以被NaClO氧化为
Na2SO4,还原产物为NaCl,Na2Sx
与NaClO的量之比为1:16,x=
(1)Mn2++S2O82-+H2O—SO42-+MnO4-+□( )(2)Zn+H++NO3-—Zn2++NH4++□( )(3)H2O2+Cr2(SO4)3+□——K2SO4+K2CrO4+H2O(1)2、5、8、10、2、16H+(2)4、10、1、4、1、3H2O(3)3、1、10KOH、3、2、、8【配平练习】Fe2+ + ClO- + —
Fe(OH)3+ Fe3+ + Cl-
1
2
2
+2
+3
+1
-1
3
4
2
3
3
6
H2O
3
+3
3
①考虑电子得失守恒
③根据Fe元素守恒:
Fe2+所带正电荷为+4,Fe3+所带正电荷为+3,最小公倍数为12,故Fe2+的系数再乘以3,
Fe(OH)3的系数为2;
(O守恒),ClO- 的系数为3。
②考虑电荷守恒: ClO- 所带电荷与Cl- 所带电荷一致;
【例5】配平下列方程式
Pt + HNO3+ HCl —
H2PtCl6 + NO↑ +
H2O
8
0
+5
+4
+2
4
3
3
4
3
4
3
4
18
比较两边H、O原子个数不等,可见生成物中含有H、O元素,再比较反应物比生成物多8个O、16个H,故知生成物为H2O,水的系数为8。
【例4】配平下列方程式
3.H2S和O2的混合气体,通入FeCl2、CuCl2、FeCl3的混合溶液,转化关系如图所示。下列描述正确的是( C )
A.在图示转化关系中化合价不变的元素只有氢和氯
B.过程Ⅱ反应的离子方程式为Cu2++S2-=CuS↓
C.氧化性强弱的顺序为O2>Fe3+>S
D.转化过程中参加循环反应的离子只有Fe2+、Fe3+
|C|C_______________________氧 化 剂 与 还 原 剂C|C—C—ФC + O2 = CO2
0
0
+4
-2
H2 + CuO = H2O + Cu
氧化剂:得电子→化合价降低的物质。具有氧化性。
还原剂:失电子→化合价升高的物质。具有还原性。
得 氧
失 还
化合价升高,失电子,氧化反应
化合价降低, 得电子,还原反应
0
+2
0
+1
氧化剂
还原剂
化合价升高,失电子,氧化反应
化合价降低, 得电子,还原反应
氧化剂
还原剂
氧化产物
还原产物
氧化产物
还原产物
反 应 物
氧化剂
还原剂
被还原
还原反应
还原产物
被氧化
氧化反应
氧化产物
生 成 物
得电子
失电子
化合价降低
化合价升高
转移电子
表 现
氧化剂、还原剂、氧化产物、还原产物之间的关系
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
失电子、化合价升高、被氧化,发生氧化反应
得电子、化合价降低、被还原,发生还原反应
4FeS2 + 11O2 =2Fe2O3 + 8SO2
2HNO3+3BaSO3=H2O + 2NO↑ + 3BaSO4
+5
+2
+4
+6
化合价降低, 得电子,还原反应
化合价升高,失电子,氧化反应
氧化剂
还原剂
还原产物
氧化产物
+2
-1
+3
+4
0
—2
-2
化合价降低, 得电子,还原反应
化合价升高,失电子,氧化反应
氧化剂
还原剂
还原产物
还原产物
氧化产物
氧化产物
A.2Na + 2H2O = 2NaOH + H2↑
B.2Na2O2 + 2H2O = O2↑ + 4NaOH
C.H2O + C == H2 + CO
D.SO3 + H2O = H2SO4
E.2H2O == 2H2↑+ O2↑
F.2F2 + 2H2O == 4HF + O2↑
AC
BD
E
F
电解
水只作氧化剂的是( )
水既不作氧化剂又不作还原剂的是( )
水只作为还原剂的是 ( )
水既作氧化剂又作还原剂的是 ( )
+2
+4
+3
0
化合价升高,失 e—,氧化反应
化合价降低,得 e—,还原反应
6
6
步骤:
1:标变价
2:画线桥
3:标电子得失数
a:箭头方向指向生成物
b:线桥的两端连接同一种元素
c:线桥两端指元素符号的正中间
a:电子得失数相等
转移电子数=
化合价改变的绝对值×化合价改变的原子数
(1)用双线桥法表示氧化还原反应中电子的转移
3CO+Fe2O3=3CO2+2Fe
H2+CuO === H2O+Cu
△
2KClO3 === 2KCl + 3O2 ↑
△
注意:A、箭头由失电子元素指向得电子元素 。
B、只须标明电子转移总数。不写“得” “ 失”。
(2)“单线桥”法
2e—
12e—
Fe的化合价
+3
+5
+2
+1
0
-1
Fe3+
只氧化性
只有还原性
Fe2+
兼有氧化性和还原性
Fee
S的化合价
+6
+5
+4
0
0
-2
只有氧化性
兼有氧化性和还原性
只有还原性
兼有氧化性和还原性
兼有氧化性和还原性
S2—
S2— 、HS— 、H2S
S
SO2 、HSO3— 、SO32—
SO3 、 H2SO4
O的化合价
0
+5
-1
+1
-2
-1
Fe3+
只氧化性
只有还原性
Fe2+
兼有氧化性和还原性
Fee
O2 、 O3
H2O2、Na2O2
H2O
专题1:常见的氧化剂、还原剂
氧化剂:得电子→化合价降低的物质。
还原剂:失电子→化合价升高的物质。
得 氧
失 还
元素的化合价可以继续降低,则具有氧化性。
元素的化合价可以继续升高,则具有还原性。
思考:
1物质中所含元素的化合价可以降低,该物质就一定适合做常见的氧化剂吗?
2物质中所含元素的化合价可以升高,该物质就一定适合做常见的还原剂吗?
因为NaCl中的阴、阳离子是稳定的价态,不容易变价,所以NaCl不适合做常见的氧化剂或还原剂。
常见元素的相对稳定的价态,不容易变价,通常就不适合从该元素入手分析此物质的性质:
K 、 Ca 、 Na 、 Mg 、 Al 、O 、 F、Cl 、 、
+1 —1
不一定
+1 +2 +1 +2 +3 —2 —1 —1
1)活泼的非金属单质:O3 、 O2 、 Cl2 、 Br2 、 I2
2)高价的氧化物:CuO 、 Fe2O3
3)高价的含氧酸及盐: KMnO4 、K2Cr2O7 、
浓H2SO4 、 HNO3 、
4)某些阳离子:Fe3+ 、 H+
常见强氧化剂:
O2 、 Cl2 、ClO— 、Br2、MnO4— 、Cr2O72— 、
H2O2 、Na2O2 、HNO3 、浓H2SO4 、Fe3+
专题1:常见的氧化剂: 具有氧化性,易得电子,高价态物质。
(1)活泼的金属单质:K、 Na 、 Mg 、 Al、Zn 、 Fe 、、
(2)某些非金属单质:H2 、 C 、、、、、
(3)变价元素的低价态物质:CO 、 Cu+ 、、、、
(4)某些阴离子: I— 、 S2— 、、、、、
常见强还原剂:
H2S 、S2— 、HS— 、 SO2、SO32— 、HSO3— 、I— 、Fe2+
思考:
强氧化剂与强还原剂混合,是否一定反应呢?
专题1:常见的还原剂: 具有还原性,失电子,低价态物质
思考:Na2SO3、Na2S2O3、FeSO4、H2O2、KI、FeCl3、KMnO4,从化合价角度分析,这些物质可能有哪些性质?它们之间反应吗?如何验证?
设计如下实验方案:
①:取适量酸性高锰酸钾溶液于试管中,滴加双氧水溶液。
②:取适量酸性碘化钾溶液于试管中,滴加双氧水溶液。
③:取适酸性高锰酸钾溶液于试管中,滴加硫酸亚铁溶液。
④:取适量酸性高锰酸钾溶液于试管中,滴加碘化钾溶液。
⑤:取适量酸性高锰酸钾溶液于试管中,滴加亚硫酸钠溶液。
⑥:取FeCl3溶液于试管中,滴加碘化钾溶液。
⑦:取适量硫代硫酸钠溶液于试管中,滴加稀硫酸溶液。
②:H2O2 + I—+ H+ = H2O + I2
⑥:I— + Fe3+ = I2 + Fe2+
①:H2O2 + MnO4— + H+ = O2 ↑ + Mn2+ + H2O
⑤:SO32— +MnO4—+ H+ = SO42— + Mn2+ + H2O
③:MnO4—+ Fe2+ + H+ = Mn2+ + Fe3+ + H2O
④:I— +MnO4—+ H+ = I2 + Mn2+ + H2O
⑦:H2SO4 + Na2S2O3 = Na2SO4 + S ↓+ SO2↑+ H2O
小结:氧化还原反应方程式的配平
1: 判断主要的反应物和生成物
2: 得失电子守恒
3: 电荷守恒
依 据
步骤:
①确定氧化剂、还原产物;还原剂、氧化产物的化合价
②用观察法找出元素化合价的变化值
③用得失电子数相等的原则确定化学计量数
④检查是否符合3个守恒
4: 质量守恒
物质的化学式
各元素的化合价
核心元素的化合价
预测氧化性/还原性
方法总结:研究分析未知物质性质的一般程序
实验验证
①Cu2(OH)2CO3与酸能否反应?
特性
SiO2+H2O = H2SiO3
≠
两种思路
②NaHSO3与烧碱、盐酸、硝酸能否反应?产物是?
氧化性越强:得电子越容易
还原性越强:失电子越容易
得电子的是氧化剂
失电子的是还原剂
得 氧
失 还
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
阳离子的氧化性逐渐增强,得电子能力增强
单质的还原性逐渐减弱,失电子能力减弱
氧化性、还原性的强弱只取决于得到或失去电子的难易,
与得失电子的多少没有直接关系。
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+ Pt Au
专题2:氧化性、还原性的强弱比较及规律、应用
氧化剂的氧化性强于氧化产物的氧化性
还原剂的还原性强于还原产物的还原性
② Mg+ H2SO4 = MgSO4 + H2↑
③ 2Al+ 3H2SO4 =Al2(SO4)3+3H2↑
④ Cu+ H2SO4 (稀) =
①Fe+CuSO4 =FeSO4 +Cu
规律1:
强 的 在 前
弱 的 在 后
还原性:Fe>Cu;氧化性:Cu2+>Fe2+
还原性:Mg>H2;氧化性:H+ > Mg2+
还原性:Mg>Al>Cu;
速 率:② > ③ > ④
规律2:
越强越容易
越弱越困难
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
失电子、化合价升高、被氧化,发生氧化反应
得电子、化合价降低、被还原,发生还原反应
专题2:氧化性、还原性的强弱比较及规律、应用
Fe的化合价
+3
+5
+2
+1
0
-1
Fe3+
只氧化性
只有还原性
Fe2+
兼有氧化性和还原性
Fee
S2-、HS-、H2S
S
SO2 、HSO3-、SO32-
SO3 、 H2SO4
氯元素的化合价
+7
+5
+3
+1
0
-1
只有氧化性
兼有氧化性和还原性
只有还原性
兼有氧化性和还原性
兼有氧化性和还原性
兼有氧化性和还原性
特
例
氧化性:HClO> HClO2 > HClO3 > HClO4
判断氧化性强弱: Fe3+与Fe2+;
KMnO4与MnO2
还原性强弱:S2— 、S 与 SO2
专题2:根据元素化合价高低来判断氧化性强弱
氧化性: Fe3+>Fe2+
KMnO4>MnO2 ;
还原性: S2— >S > SO2
S的化合价
+6
+5
+4
0
0
-2
只有氧化性
兼有氧化性和还原性
只有还原性
兼有氧化性和还原性
兼有氧化性和还原性
S2—
规律3:通常
化合价越高,氧化性越强
化合价越低,还原性越强
MnO2+4HCl (浓) = MnCl2+Cl2↑ + 2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
3Fe+2O2 = Fe3O4
Fe + S = FeS
2Fe+3Cl2 = 2FeCl3
点燃
点燃
氧化性强弱顺序的是?
Cl2 > O2> S
专题2:根据与同一种物质反应的情况判断氧化性强弱
同是将浓盐酸氧化为Cl2,MnO2必须在加热条件下才能进行,
而KMnO4在常温下即可进行,说明氧化能力KMnO4>MnO2 >Cl2
氧化性: MnO2 > Cl2
氧化性: KMnO4 > Cl2
思考:①同时将 铁片、铜片、金片放在室外,生锈的先后顺序是?
②如果圆底烧瓶中同时有: MnO2 和 KMnO4 ,哪个优先与盐酸反应?
规律4:
强 的 优 先
弱 的 靠 后
(1)物质的浓度越高,氧化性或还原性越强。
(2)酸性越强,氧化性越强;碱性越强,还原性越强。
浓HNO3的氧化性强于稀HNO3;
H2SO4(浓) > H2SO4(稀)
KMnO4氧化性:酸性 > 中性 > 碱性
专题2:外界条件对某些物质氧化性或还原性强弱的影响
专题2:氧化性、还原性的强弱规律总结
规律1:
强 的 在 前
弱 的 在 后
规律3:
越强越容易
越弱越困难
规律2:
强 的 优 先
弱 的 靠 后
规律4:通常
化合价越高,氧化性越强
化合价越低,还原性越强
思考:浓硫酸与二氧化硫/硫化氢反应吗?
☆ 稀硝酸溶液滴入Na2SO3溶液中
☆ Br2水滴入FeSO4溶液中
☆ 酸性双氧水溶液和FeSO4溶液混合
1.判断下列反应能否发生?若能,则写出离子方程式,并比较氧化性强弱。
☆ 3SO32-+ 2NO3-+ 2H+ = 3SO42- + 2NO↑ + H2O
☆ 2Fe2+ + Br2 = 2Fe3+ + 2Br-
☆ H2O2 + 2Fe2++ 2H+ = 2Fe3+ + 2H2O
氧化性:HNO3 > H2SO4 ; Br2 > Fe3+ ; H2O2 > Fe3+
氧化性: MnO4- > MnO2 > Cl2 > Br2 > Fe3+ > I2
思考:①在无色溶液中加入稀盐酸酸化的Ba(NO3)2溶液得到白色沉淀。能否说明原溶液存在SO42-?②能否用稀硝酸酸化?
2.根据下列三个方程式:
I2+SO2+2H2O = H2SO4+2HI; 2FeCl2+Cl2 = 2FeCl3;
2FeCl3+2HI = 2FeCl2+2HCl+I2有关物质的还原性强弱顺序是
A I— > Fe2+ > Cl— > SO2 B Cl— > Fe2+ > SO2 > I—
C Fe2+ > I— > SO2 D SO2 > I— > Fe2+ > Cl—
D
3. 已知I—、Fe2+、和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为: H2O2 < Fe2+ < I— < SO2。下列反应不能发生的是( )
A. 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42— + 4H+
B. H2O2 + H2SO4 = SO2 + O2 + 2H2O
C. I2 + SO2 + 2H2O = H2SO4 + 2HI
D. 2Fe3+ + 2I— = 2Fe2+ + I2
B
4.已知:Cu+2FeCl3 = CuCl2+2FeCl2,在FeCl3和CuCl2混合液中加铁粉。
①:如固体有剩余,则溶液中肯定没有的离子: Fe3+
肯定有的离子:Fe2+ 、Cl— 。可能有的离子:Cu2+
②:若固体全部为铜,则溶液中肯定没有的离子: Fe3+
肯定有的离子:Fe2+ 、Cl— 。 可能有的离子:Cu2+
③:若固体为混合物,则溶液中肯定没有离子: Cu2+、Fe3+
肯定有的离子:Fe2+ 、Cl—
④:若固体没有剩余,肯定有的离子:Cl—、Fe2+、Cu2+
可能有的离子:Fe3+
7.下列各组离子可以大量共存的是( )
A:遇石蕊变红的透明溶液 H+、 Fe2+、 MnO4-、 SO42-
B:遇石蕊变蓝的溶液中 OH-、 Ba2+、 Fe3+、 HSO3-
C:可以使酚酞不变色的溶液 H+、 Fe2+、NO3- 、Cl-
D:可以使酚酞变红的溶液 ClO-、S2-、Na+、 SO42-
E:Fe2+、 Cl-、 NO3-、 Fe3+、 SO42-
F:Fe3+、 I-、 H2O2、 H+、 Cl-、 K+
G:遇石蕊变红的溶液中, OH-、 Ba2+、 ClO-、 HCO3-
E
8.下列各组离子因氧化还原反应而不能共存的是( )
A:遇石蕊变红的透明溶液 Fe2+、 NO3-、 K+
B:OH-、K+ 、Ba2+、 SO42-
C: H+、 Ag+、NO3- 、Cl-
D: Cu2+、Br-、Na+、 OH-
5.已知:2FeCl3+2Kl = 2FeCl2+2KCl+l2 、
2FeCl2+Cl2 = 2FeCl3
2KMnO4 +16HCl=2MnCl2 + 2KCl+5Cl2↑+8 H2O 。若某溶液中有Fe2+和I—,要除去I—而不影响Fe2+和Cl—,可以选择的试剂是( ) A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
6. Li2NH是一种储氢材料其原理:Li2NH + H2 = LiNH2 + LiH
下列说法正确的是( )
A.Li2NH中N的化合价为—1
B.H2既是氧化剂,又是还原剂
C.每消耗2molH2 ,转移4NA个电子
D.此法储氢与钢瓶储氢原理相同
B
1:G、Q、X、Y、Z均为氯的含氧化合物,他们有如下转化关系:G→Q+NaCl, Q+H2O→X+H2, Y+NaOH→G+Q+H2O, Z+NaOH→X+Q+H2O
则G、Q、X、Y、Z中氯元素的化合价由高到低顺序:
2:已知:3Cu+2NO3— +xH+ =3Cu2+ +2R+yH2O
①参加反应的Cu与消耗的硝酸的数量之比为:
氧化剂与还原剂的数量之比:
③当1.5molCu被氧化时,转移的电子的量为:
此时被还原的硝酸的量为:
1.5mol
4mol
1mol
3mol
3mol
3:汽车安全气囊中的反应:10NaN3+2KNO3 =16N2↑+5Na2O+K2O 若氧化产物比还原产物多1.75mol,下列判断正确的是( )
A.转移电子数为1.25NA B.有0.25mol KNO3被氧化
C.产生氮气44.80L D.被氧化的氮原子的量为1.25mol
15a mol
10a mol
10a mol
10a mol
a mol
2a mol
15a - a = 1.75
a = 0.125
还原剂
氧化剂
A
歧
化
反
应
NO2 + H2O = NO + HNO3
NO2 + NaOH = NaNO3 + NaNO2 + H2O
H2SO4 + Cu2O = CuSO4 + Cu + H2O
S + KOH = K2S + K2SO3 + H2O
I2 + NaOH = NaIO3 + NaI + H2O
Cl2 + NaOH = NaCIO + NaCI + H2O
H2O2 = O2↑ + H2O
H2SO4 + Na2S2O3 = Na2SO4 + S ↓+ SO2↑ + H2O
归
中
反
应
Fe + Fe2(SO4)3 = FeSO4
H2S + SO2 = H2O + S↓
H2SO4 + H2S = SO2 + S↓ + H2O
C + CO2 = CO
KClO3 + HCl = KCl+ Cl2↑+ H2O
NH3 + NO2 = N2 + H2O
NH4H + H2O = H2↑ + NH3 H2O
N2H4 + N2O4 = N2↑ + H2O
FeS2 + O2 = SO2 + Fe2O3
Cu2S + O2 = Cu + SO2
H2S + O2F2 = O2↑ + HF+ SF6
P +CuSO4+H2O =Cu3P+ H3PO4 + H2SO4
As2S3 + HNO3 + = H3AsO4 + H2SO4 + NO
将1.1mol I2加入烧碱溶液中,得到NaI,NaIO,NaIO3,且后两产物的量之比为2:3
NaClO + Ag +H2O = AgCI + NaOH + O2
整体分析法的运用
Fe3P+ HNO3——Fe(NO3)3+ NO+ H3PO4+ H2O
ClO2 + CN— =Cl— + N2+CO2
ne―
谢
谢
观
看
n e―
ne―
时间就是金钱
效率就是生命
CH3-(CH2)n- -SO3Na
(2017·全国卷Ⅲ,27题节选)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质:
步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3 — Na2CrO4+Fe2O3+CO2+NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为____________。
[强化1] (1)(天津卷,9题节选)酸性条件下,MnO(OH)2将I-氧化为I2:
MnO(OH)2+I-+H+―→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学 计量数依次为__________________。
(2)(安徽卷,27题节选)请配平下列反应的化学方程式:
1, 2, 4, 1, 1, 3
1NaBO2+2SiO2+4Na+2H2=1NaBH4+2Na2SiO3。
(浙江卷,27题节选)完成以下氧化还原反应的离子方程式:
( )MnO4—+( )C2O42-+______===( )Mn2++( )CO2↑+________
通电
当Na2S2O3与足量稀硫酸反应时,溶液变浑浊,且有刺激性气体产生,则氧化产物与还原产物的物质的量之比为____________。
(5)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为____________(填化学式)。
(6)联氨(N2H4,常温下是液体)是航天飞船常用的高能燃料,联氨可以用尿素[CO(NH2)2]为原料制取,方法是在KMnO4催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、NaOH溶液反应生成联氨、Na2CO3、另一种钠盐和水,写出该反应的化学方程式:
MnO2+MnS+2H2SO4===2MnSO4+S+2H2O
7.(2020·广东湛江调研)将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中进行四组实验,探究体系中微粒间的相互作用,测得溶液pH变化如图所示。实验现象中观察到:实验a中不产生白色沉淀;实验b、c、d中均产生白色沉淀。下列说法中不正确的是( )
A.实验a中溶液pH降低的原因是SO2与H2O反应生成H2SO3
B.实验a和c相比,实验c所表示的过程中O2是氧化SO2的主要微粒
C.与实验a、b、c相比,可知实验d所表示的过程中NO是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
4:下列转化必须加氧化剂才能实现的是( )
A: Fe2+ → FeCl3 B: H2O2→O2 C: Cr2O72-→ CrO42-
D: SiO2→Si E: CH3CH2OH→CH3CHO F:NO2→HNO3
AE
5:强氧化剂RO(OH)2+被Na2SO3还原到较低价,如果还原2.4×10-3molRO(OH)2+需要30ml0.2mol/L的Na2SO3溶液,那么R元素的最终化合价:
6:次磷酸H3PO2为一元中强酸,可将Ag+还原为银。
①:H3PO2的电离方程式:
②:NaH2PO2的是否为正盐?
③:利用H3PO2的化学镀银时,氧化剂与还原剂的量之比为4:1,则氧化产物为:
④: 在此反应中,2mol还原剂得到的电子数:
KMnO4 +HCl = MnCl2 + KCl+Cl2↑ + H2O
KMnO4+KNO2+H2SO4=MnSO4 + K2SO4 + KNO3 +H2O
7:配平下列氧化还原反应方程式
C + HNO3(浓)= NO2↑ + CO2↑ + H2O
H2O + KI+ O3 = O2 + I2 + KOH
NaIO3+NaHSO3 — NaHSO4+Na2SO4+H2O+I2
S+KNO3+C—K2S+CO2↑+N2↑
Fe3P+HNO3—Fe(NO3)3+NO↑+H3PO4+H2O
P4+CuSO4+H2O — Cu3P+H3PO4+H2SO4
2.下列制取CO2、通过CO2和NaAlO2溶液制取Al(OH)3、分离并
加热Al(OH)3制Al2O3的装置和原理能达到实验目的的是
A.制取CO2 B. 制取Al(OH)3 C. 分离Al(OH)3 D.制Al2O3
3.BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是
A.该过程的总反应:C6H6O+7O2催化剂光6CO2+3H2O
B.该过程中BMO表现较强氧化性
C.降解产物的分子中只含有极性共价键
D.①和②中被降解的苯酚的物质的量之比为3:1
B
D
已知铜能与浓硫酸反应,判断什么元素的化合价发生了变化?
实验:铜与浓硫酸的反应
所以我们重点分析浓硫酸中的硫元素。
已知硝酸能与许多金属反应,但一般不产生氢气,判断什么元素的化合价发生了变化?
所以我们重点分析硝酸中的氮元素。
3、怎么分析物质中的重点元素,即核心元素?
A:2KW+Z2=2KZ+W2 B:2KY+W2=2KW+Y2
C:2KX+Z2=2KZ+X2 D:2KZ+X2=2KX+Z2
8:四种单质的氧化能力 W2 〉Z2 〉X2〉Y2 ,则下列反应可以发生的是( )
BC
9:常温下,溶液中有如下反应:Ce4++Fe2+=Ce3++Fe3+
Sn2++2Fe3+=Sn4++2Fe2+。氧化剂,还原剂分别是?其强弱顺序?
10:已知Co2O3在酸性溶液中被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。则下列反应不可能发生的是( )
A:3Cl2+6Fel2=2FeCl3+4Fel3
A
B:Cl2+Fel2=FeCl2+l2
C:2l-+2Fe3+=2Fe2++l2
D:6HCl+Co2O3=2CoCl2+Cl2↑ +3H2O
铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)稀溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表:
加入溶液 ①适量铋酸钠溶液 ②过量的双氧水 ③适量KI淀粉溶液
实验现象 溶液呈紫红色 紫红色消失,产生气泡 溶液变成蓝色
NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3
B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2
D.KMnO4、NaBiO3、I2、H2O2
1:已知氧化性Fe3+ > Ag+ > Cu2+ > H+ > Zn2+,在含有Fe3+ 、Ag+、Cu2+、H+、Zn2+各0.01mol的混合溶液中,加入0.01mol铁粉,充分反应后,溶液中的离子的量各有多少?
3:分别用KMnO4,氯酸钾,过氧化氢制取同温同压下相同体积的氧气,三个反应转移的电子的量之比为:
4:下列物质在酸性条件下都能将KI氧化成I2,自身发生如下变化: H2O2→H2O , IO3-→I2, MnO4-→Mn2+, HNO2→NO。 如分别用等量的下列物质氧化足量的I-,得到I2最多的是( )
A:H2O2 B: IO3- C:MnO4- D:HNO2
B
5:火法炼铜,先焙烧黄铜矿:2CuFeS2+O2=Cu2S+2FeS+SO2下列说法正确的是( )
A.每生成1molSO2转移6mol电子
B.CuFeS2中被氧化和被还原的原子数之比为2:1
C.每生成1molCu2S有4molS被氧化
D.每转移1.2mol电子有0.2molS被氧化
8:自然界中有如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4
下列说法正确的是( )
A.CuSO4是氧化剂,FeS2还原剂
B.产物中的SO42-有一部分是氧化产物
C.Cu2S既是氧化产物,又是还原产物
D.每转移10mol电子,就有5molFeS2发生反应
B
6:Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,NaClO被还原为NaCl,Na2Sx与NaClO的量之比为1:16,则x为?
7:有些工业废水中有剧毒的Cr2O72-,可以用绿矾除去,测得反应后的溶液中有Fe2+、H+、Cr3+、Fe3+,离子方程式?
9:FeCl3溶液与草酸反应得到澄清溶液,并产生一种能使石灰水变浑浊的气体,则离子反应为:
10:在碱性溶液中,Cl2与NaI反应,每molNaI完全反应转移6mol电子,其离子方程式为?
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2molFeSO4发生反应时,反应中共有8mol电子转移
B
12:劣质美白产品中有铅白,时间久了会变成黑色的PbS,除去黑斑的方法是选择合适的氧化剂将其氧化为难溶于水的PbSO4,可选的氧化剂有KMnO4,H2O2,哪种好?方程式?
13:FeCl3与KClO在强碱性条件下制得K2FeO4其离子方程式?
14:砒霜(As2O3)与金属锌,盐酸混合加热可生成AsH3气体,其离子方程式?AsH3气体在热的试管中分解成黑亮的砷镜。比较氧化性和还原性。
15: 2Cu(IO3)2+24KI+12H2SO4=2CuI+13I2+12K2SO4+12H2O
其中1 mol氧化剂在反应中得到的电子为( )
A.10 mol B.11 mol C.12mol D.13 mol
16:在100ml含等量HBr和H2SO3的溶液中通入0.01molCl2有一半的Br-被氧化成Br2(已知Br2能氧化H2SO3)则原溶液中HBr的量浓度为?
17:已知Cl2在高温时的KOH溶液中可发生两个氧化还原反应,反应完全后溶液中KClO和KClO3的量之比为4:1,则溶液中KCl和KClO的量之比为?
18:①O3+2KI+H2O═2KOH+I2+O2 ②SiO2+2C= Si+2CO↑ ③4HCl(浓)+MnO2=MnCl2+Cl2↑+2H2O.氧化剂与还原剂的量之比为1:2的是( )
A.仅有② B.仅有②④ C.①②③④ D.仅有②③④
19:PbO2可与浓盐酸反应生成黄绿色的气体Cl2
在强酸性环境下,双氧水与Ce3+反应的离子方程式:
1:将不溶的黄色固体NaBiO3加入MnSO4和硫酸的混合液中,微热,溶液显紫色,(Bi3+无色)配平方程式:
Ce3+ + H2O2 + H2O == Ce(OH)4 ↓ + ___
强化练习
3BrF3+5H2O = 9HF + Br2+HBrO3+O2↑若有
5molH2O发生氧化反应,则被还原的BrF3的量?
11P+15CuSO4+24H2O = 5 Cu3P+6H3PO4+15H2SO4,15molCuSO4可以氧化P的量为?
6mol
有一铁的氧化物样品,用5 mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标况下0.56L Cl2,使亚铁离子全部变成Fe3+,则该氧化物可能的化学式为
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
D
一定质量的镁铝合金与500mL1mol/L的硝酸完全反应生成2.24LNO(标况),再向反应后的溶液中加入2mol/L的NaOH溶液,金属元素恰好完全沉淀,则消耗的NaOH溶液体积为?
SO2+2Fe3++2H2O - SO42-+2Fe2++W;
Cr2O72-+aFe2++bH+ -Cr3++Fe3++H2O。下列判断正确的是
A.还原性Cr3+> Fe2+> SO2 B.氧化性Cr2O72-> SO2> Fe3+
C.两个反应中Fe2(SO4)3均作还原剂 D.Cr2O72-能将SO2氧化成SO42-
D
实验室将NaClO3和Na2SO3按物质的量之比为2:1倒入烧瓶中,同时滴入适量硫酸,并用水浴加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为?
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3==2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 如果产生28gN2,转移电子数为?
A、5:3 B、5:4 C、1:1 D、3:5
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物
B. O2F2既是氧化剂又是还原剂
C. 若生成4.48LHF,则转移0.8mol电子
D. 还原剂与氧化剂的物质的量之比为1:4
D
一定条件下,H2O2氧化H2S,H2O2与H2S的量比不同
产物不同,若H2O2与H2S的量比为4:1,则氧化产物是?
KClO3和浓盐酸加热,产生棕黄色气体ClO2,
2KClO3+4HCl=2KCl+2ClO2↑+Cl2↑+2H2O氧化剂与还原剂的量之比:产生标况下6.72L气体,转移电子数:当有0.2molHCl被氧化,转移电子数:当有0.2molHCl参与反应,转移电子数为:当有 1mol氧化剂被还原,则被氧化的还原剂为:转移电子数为:
P4和烧碱溶液加热反应,产生毒气体PH3、NaH2PO2、Na2HPO3,已知NaH2PO2与Na2HPO3的量之比为3:1,则其化学反应为:
一定条件下,PbO2与Cr3+反应产物是Pb2+和CrO3,则1molCr3+需要的PbO2量?
物质在反应中可体现氧化性、还原性、酸性、碱性等,下面方程式中画线的物质体现两种或以上性质的有:
①3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑+ 5H2O
②C + 2H2SO4 = CO2↑+ 2SO2↑+ 2H2O
③8NH3 + 3Cl2 = 6NH4Cl + N2
④2Na2O2 + 2H2O = 4NaOH + O2↑
A:①② B:①④ C:③④ D:全部
B
Cu2S 与一定浓度的硝酸反应,生成CuSO4、
Cu(NO3)2。NO和水,反应为?
Na2Sx在碱性溶液中可以被NaClO氧化为
Na2SO4,还原产物为NaCl,Na2Sx
与NaClO的量之比为1:16,x=
(1)Mn2++S2O82-+H2O—SO42-+MnO4-+□( )(2)Zn+H++NO3-—Zn2++NH4++□( )(3)H2O2+Cr2(SO4)3+□——K2SO4+K2CrO4+H2O(1)2、5、8、10、2、16H+(2)4、10、1、4、1、3H2O(3)3、1、10KOH、3、2、、8【配平练习】Fe2+ + ClO- + —
Fe(OH)3+ Fe3+ + Cl-
1
2
2
+2
+3
+1
-1
3
4
2
3
3
6
H2O
3
+3
3
①考虑电子得失守恒
③根据Fe元素守恒:
Fe2+所带正电荷为+4,Fe3+所带正电荷为+3,最小公倍数为12,故Fe2+的系数再乘以3,
Fe(OH)3的系数为2;
(O守恒),ClO- 的系数为3。
②考虑电荷守恒: ClO- 所带电荷与Cl- 所带电荷一致;
【例5】配平下列方程式
Pt + HNO3+ HCl —
H2PtCl6 + NO↑ +
H2O
8
0
+5
+4
+2
4
3
3
4
3
4
3
4
18
比较两边H、O原子个数不等,可见生成物中含有H、O元素,再比较反应物比生成物多8个O、16个H,故知生成物为H2O,水的系数为8。
【例4】配平下列方程式
3.H2S和O2的混合气体,通入FeCl2、CuCl2、FeCl3的混合溶液,转化关系如图所示。下列描述正确的是( C )
A.在图示转化关系中化合价不变的元素只有氢和氯
B.过程Ⅱ反应的离子方程式为Cu2++S2-=CuS↓
C.氧化性强弱的顺序为O2>Fe3+>S
D.转化过程中参加循环反应的离子只有Fe2+、Fe3+
