安徽省合肥市重点中学2023-2024学年高一上学期期末考试化学试卷(含解析)
文档属性
| 名称 | 安徽省合肥市重点中学2023-2024学年高一上学期期末考试化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 576.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-31 15:44:25 | ||
图片预览




文档简介
合肥市重点中学2023-2024学年度度第一学期高一年级期末考试
化 学
考生注意:
1.答题前,考生务必在答题卡上将自己的学校、姓名、班级、准考证号用0.5毫米黑色签字笔填写清楚,考生考试条码由监考老师粘贴在答题卡上的“条码粘贴处”。
2.选择题使用2B铅笔填涂在答题卡上对应题目标号的位置上,如需改动,用橡皮擦擦干净后再填涂其它答案;非选择题用0.5毫米黑色签字笔在答题卡的对应区域内作答,超出答题区域答题的答案无效;在草稿纸上、试卷上答题无效。
3.本试卷满分100分,考试时长75分钟,考试结束后由监考老师将答题卡收回。
4. 可能用到的相对原子质量为H 1 C 12 O 16 Na 23 P 31 S 32 Cl 35.5 Cu 64 Ba 137
一、单选题:本题共14小题,每题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 下列有关物质的性质与用途具有对应关系的是
A.镁可以和反应,可用于制造信号弹和焰火
B.纳米能与酸反应,可用作铁磁性材料
C.石墨的熔点很高,可用作干电池电极材料
D.无水呈蓝色,吸水后为粉红色[],可用于制造变色硅胶(干燥剂)
2.下列说法正确的是
A.氯化氢是由氢离子和氯离子构成的,常温下能够导电
B.白磷分子为正四面体结构,分子相当稳定,不容易发生反应
C.金刚石与石墨结构、性质不同,互为同位素
D.玻尔对轨道模型做出了具大贡献
3. 如图为元素周期表中短周期元素的一部分,下列说法中正确的是
A.不可能出现金属元素
B.气态氢化物的热稳定性:
C.六种元素中,③的最高价氧化物对应的水化物的酸性一定最强
D.六种元素,相互结合形成的二元化合物一定都是共价化合物
4. 1912年E.Beckmann冰点降低法获得了黄色的正交α 型硫元素的一种同素异形体S8分子。1891年,M.R.Engel首次制得了一种菱形的ε 硫,后来证明含有S6分子。下列说法不正确的是
A.S6和S8分子分别与铜粉反应,所得产物均为Cu2S
B.推测Na2S8既含离子键又含共价键
C.S8分子转化为S6分子,属于物理变化
D.一定条件下等质量的S6和S8分子分别与足量的铁粉反应,消耗铁粉的物质的量相同
5. 设为阿伏加德罗常数的值。下列说法错误的是
A.的硫酸溶液中,含氢离子数为
B.在标准状况下,分子中含氢原子数目为
C.分子中含极性键数目一定是
D.在反应中,每生成,转移的电子数为
6. “祝融号”火星车发回的遥测信号显示,火星的气体及岩石中富含原子序数依次递增的四种短周期主族元素X、Y、Z、W,它们分属长两个周期,且只含一种金属元素,X、W同主族,四种元素的原子最外层电子数之和为16,Y元素是地壳中含量最多的元素。下列判断错误的是
A.一定条件下Z可以与XY2发生反应
B.简单氢化物沸点:XC.原子半径:Z>W>Y>X
D.Y与Z形成的化合物中可能含有非极性键
7. 实验室需要稀硫酸,用浓硫酸进行配制.下列说法错误的是
A.用量筒量取浓硫酸的体积为
B.将冷却后的溶液沿玻璃棒注入容量瓶
C.转移溶液时有液体溅出,应重新配制
D.定容时俯视刻度线,会使所配溶液物质的量浓度偏大
8. 用聚合物包覆Mg微球可制得镁基微马达(如图)。在盐酸中,微马达包覆层开口处反应排出气体使其定向运动。在该微马达中能替代Mg的金属是
A.Zn
B.Cu
C.Ag
D.Au
9. 甲、丙、丁、戊的焰色试验均为黄色,甲是一种淡黄色固体,常温下乙为一种常见液体,X是一种常见的有刺激性气味的单质气体。(部分生成物已略去)下列相关叙述错误的是
A.反应①的离子方程式为
B.反应②为工业制漂白粉的原理
C.X溶于乙中形成的溶液为淡黄绿色
D.甲、乙反应,每有甲完全反应时转移电子
10.以不同类别物质间的转化为线索,认识钠及其化合物。下列分析不正确的是
A.CO2和氢氧化钠反应产物与氢氧化钠的用量有关
B.反应⑥中2molNa2O2与二氧化碳完全反应,转移电子数为4NA
C.反应⑤、⑥可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应
11.常温下,下列离子组在指定溶液中能大量共存的是
A.过氧化氢溶液中:
B.的溶液中:
C.的溶液中:
D.酸性的溶液中:
12.设为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,中电子的数目为
B.浓盐酸与足量的反应,转移电子的数目为
C.在空气中燃烧生成和,转移电子个数为
D.和混合气体中含有的质子数为
13.下列解释事实的方程式不正确的是
A.硫酸铁溶液中加入双氧水:
B.84消毒液与洁厕灵混用产生有毒气体:
C.将碳酸氢钙溶液与过量的澄清石灰水混合:
D.用硫化钠除去废水中的铜离子:
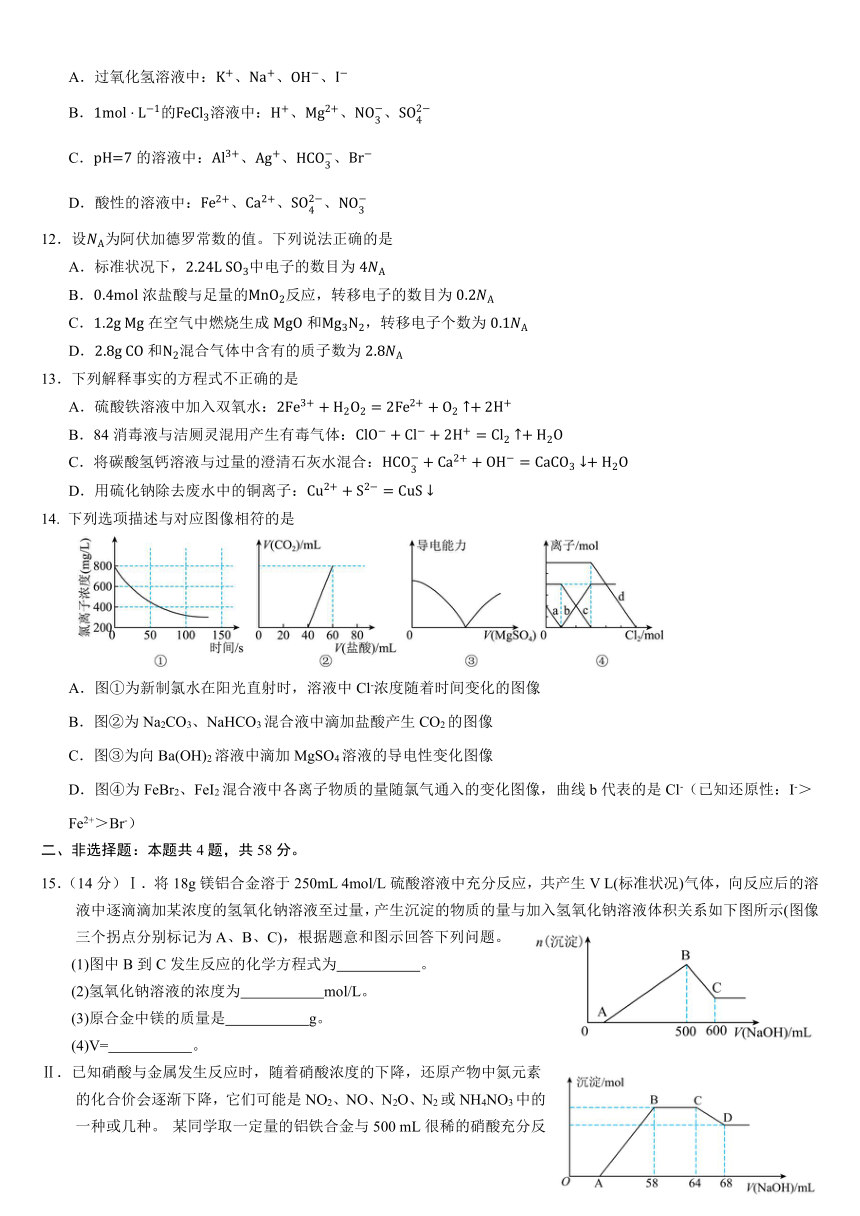
14. 下列选项描述与对应图像相符的是
A.图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像
B.图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像
C.图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像
D.图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-(已知还原性:I->Fe2+>Br-)
二、非选择题:本题共4题,共58分。
15.(14分)Ⅰ.将18g镁铝合金溶于250mL 4mol/L硫酸溶液中充分反应,共产生V L(标准状况)气体,向反应后的溶液中逐滴滴加某浓度的氢氧化钠溶液至过量,产生沉淀的物质的量与加入氢氧化钠溶液体积关系如下图所示(图像三个拐点分别标记为A、B、C),根据题意和图示回答下列问题。
(1)图中B到C发生反应的化学方程式为 。
(2)氢氧化钠溶液的浓度为 mol/L。
(3)原合金中镁的质量是 g。
(4)V= 。
Ⅱ.已知硝酸与金属发生反应时,随着硝酸浓度的下降,还原产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH4NO3中的一种或几种。 某同学取一定量的铝铁合金与500 mL很稀的硝酸充分反应,反应过程中无气体放出。向反应结束后的溶液中逐滴加入l mo/L NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
(5)写出合金中铝与该稀硝酸反应的离子方程式 。
(6)合金中铝和铁的物质的量比为 。
(7)A点对应的氢氧化钠溶液的体积为 mL。
(8)上述很稀的硝酸的浓度为 mo1/L。
16.(14分)17.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
(1)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是 、 ;如果是多种成分,可能是 、 。
(2)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用 。将C长期露置于空气中,最后将变成物质D,D的化学式为 。现有D和的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为 。
17.(16分)A、B、C、D为短周期元素,原子序数依次增大。A的最外层电子数是次外层电子数的3倍;A、C在同一主族;A、B可组成化合物和;B、D可组成离子化合物BD。
(1)写出各元素的元素符号:A ,B ,C ,D 。
(2)元素D在周期表中的位置: ;的电子式: 。
(3)写出D单质与B的最高价氧化物对应水化物反应的离子方程式: 。
(4)元素D可用来制作漂白粉,写出制作漂白粉的化学方程式: 。
18.(14分)化学让生活更美好,各类水处理剂能让水质得到提升达到饮用水的标准。生活中较常见的水处理剂有:氯气、次氯酸钠、漂白粉、二氧化氯、明矾、硫酸铁、高铁酸钠等等。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式: 。
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成。请写出在加热时,当与反应生成的时,与反应的化学方程式: 。
(3)近年来有科学家提出,氯气消毒时,会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂,如二氧化氯、臭氧等。被世界卫生组织列为A级高效、安全灭菌消毒剂,将逐渐取代成为自来水的消毒剂。
①是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:。该反应中氧化剂是 ,请用双线桥标明电子转移的方向和数目 。
②气体具有强氧化性,其还原产物的转化率与关系如图所示。对污水中等也有明显的去除效果,请写出时,与反应的离子方程式: 。某工厂污水中含,现用将氧化,生成了两种无毒无害的气体,处理这种污水,至少需要 。
(4)高铁酸钠在水中既能消毒杀菌,其产物胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,则(时)、三种消毒杀菌剂的消毒效率由大到小的顺序是 。
参考答案及解析
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 D C B C A A D B B D B C A C
1.D
【解析】A.镁在空气中燃烧发出耀眼的白光,可用于制造信号弹和焰火,与镁能和二氧化碳反应没有关系,A错误;B.纳米可用作铁磁性材料是因为其有磁性,与四氧化三铁能与酸反应没有关系,B错误;C.石墨可用作干电池电极材料是因其可以导电且常温下性质不活泼,与熔点很高无关,C错误;D.无水呈蓝色,吸水后为粉红色,因此可用于制造变色硅胶(干燥剂),D正确;故答案选D。
2.D
【解析】A.氯化氢是分子化合物,不是由氢离子和氯离子构成,常温下不导电,A错误;B.白磷分子为正四面体结构,但是白磷分子并不稳定,容易发生反应,B错误;C.金刚石与石墨都是碳的单质,属于同素异形体不是同位素,C错误;D.玻尔提出电子在一定轨道上运动的原子结构模型,对轨道模型做出了巨大贡献,D正确;故答案选D。
3.D
【解析】④可能是,A错误;同周期元素从左到右、同主族元素从下到上非金属性逐渐增强,气态氢化物的热稳定性也逐渐增强,因此气态氢化物的热稳定性:,B错误;③有可能是氧或氟元素,没有最高价氧化物对应的水化物,C错误。故答案选D。
4.C
【解析】A.硫单质具有弱氧化性,则S6和S8分子分别与铜反应,所得产物相同为Cu2S,A项正确;B.Na2S8由钠离子和构成,其中既含离子键又含非极性共价键,B项正确;C.硫单质之间的转化属于化学变化,C项错误;D.等质量的S6和S8分子中含有的硫原子物质的量相同,与足量铁粉反应的产物都是FeS,因此消耗铁粉的物质的量相同,D项正确;故答案选C。
5.B
【解析】A.1LpH=2的硫酸溶液中,含氢离子数为0.01mol/L×1L×NA=0.01NA,A正确;B.在标准状况下,HF为液体,不能用气体摩尔体积计算其物质的量,B错误;C.15gC2H6分子的物质的量为0.5mol,每个C2H6分子中含有6个极性键,则0.5molC2H6分子中含极性键数目一定是3NA,C正确;D.在反应中,KClO3中Cl的化合价降低了5价,转移了5个电子,故每生成,转移的电子数为,D正确; 故答案选B。
6.C
【解析】由Y元素是地球地壳中含量最高的元素,可知Y为O;X、Y、Z、W原子序数递增的四种短周期主族元素,X、W同主族,设X的最外层电子数为m,Z的最外层电子数为n,则与X同主族的W的最外层电子数也为m,根据四种元素的原子最外层电子数之和为16可得2m+n+6=16,可得2m+n=10,若m=1,则n=8(Z的最外层电子数为8,不符合短周期主族元素要求,舍弃);若m=2,则n=6(X、W分别为Be、Mg,不符合只含一种金属元素的要求,舍弃);若m=3,=4(W、Z分别为Al和Si,不符合原子序数递增的规律,舍弃);若m=4,n=2,则X是C元素,W是Si元素,Z是Mg元素,符合题意。综上分析可知,X、Y、Z、W分别为C、O、Mg、Si。
【解析】A.Mg可以在CO2中燃烧置换出C,故A正确;B.X、Y的简单氢化物分别是CH4、H2O,H2O能形成分子间氢键,CH4则没有,故沸点:CH4Si>C>O,故C错误;D.Y与Z形成的MgO2中可能含有O-O非极性键,故D正确;故答案选C。
7.A
【解析】A.需要稀硫酸,需要用容量瓶配制溶液,用量筒量取浓硫酸的体积为,A错误;B.需要用容量瓶,将冷却后的溶液沿玻璃棒注入容量瓶,B正确;C.转移溶液时有液体溅出,配制失败,应重新配制,C正确;D.定容时俯视刻度线,溶液体积偏小,会使所配溶液物质的量浓度偏大,D正确;故答案选A。
8.A
【解析】根据题意可知微马达中的物质可以和盐酸反应生成氢气,则选项中只有锌可以和盐酸反应;故答案选A。
9.B
【解析】A.反应①为过氧化钠与水反应,离子方程式为A正确;B.工业制漂白粉是将通入冷的石灰乳中,B错误;C.溶于水形成氯水,因含有,则溶液颜色为淡黄绿色,C正确;D.因为在反应是过氧化钠的过氧根离子里面,一个是得电子的与水结合生成氢氧根离子,另一个氧原子是失电子的,生成氧气,所以的过氧化钠与水完全反应时转移电子,D正确。故答案选B。
10.B
【解析】A.CO2和过量氢氧化钠反应生成碳酸钠,与少量氢氧化钠反应生成碳酸氢钠,产物与氢氧化钠的用量有关,故A正确;B.Na2O2与二氧化碳完全反应,方程式为2 Na2O2+2CO2=2Na2CO3+O2,为歧化反应,1mol Na2O2转移1mol电子,2molNa2O2完全反应转移电子数为2NA,故B错误;C.过氧化钠与水、二氧化碳反应都生成氧气,可用于潜水艇中氧气的供给,故C正确;D.碳酸氢钠分解属于分解反应,钠和氧气属于化合反应,钠和水属于置换反应,故D正确。故答案选B。
11.B
【解析】A.过氧化氢具有氧化性,可以氧化I-,故A错误;B.的溶液中:可以大量共存,故B正确;C.、都不能大量共存,故C错误;D.即酸性溶液中,不能大量共存,故D错误;故答案选B。
12.C
【解析】A.标准状况下SO3是固体,的物质的量不是0.1mol,故A错误;B.稀盐酸和二氧化锰不反应,浓盐酸与足量的反应,参加反应的HCl小于0.4mol,转移电子的数目小于,故B错误;
C.在空气中燃烧生成和,镁元素化合价由0升高为+2,转移电子个数,故C正确;D.CO和N2的摩尔质量都是28g/mol,每个分子中都含14个质子,和混合气体中含有的质子数为,故D错误;故答案选C。
13.A
【解析】A.硫酸铁溶液中加入双氧水,Fe3+催化分解双氧水,,故A错误;B.84消毒液与洁厕灵混用产生有毒气体,反应的离子方程式为,故B正确;C.将碳酸氢钙溶液与过量的澄清石灰水混合,生成碳酸钙沉淀和水,反应的离子方程式为,故C正确;D.用硫化钠除去废水中的铜离子,反应的离子方程式为,故D正确;故答案选A。
14.C
【解析】A.新制氯水中存在可逆反应Cl2+H2O HCl+HClO,阳光直射新制氯水时,发生反应2HClO2HCl+O2↑,随着时间的变化,溶液中c(Cl-)逐渐增大,图象不符合,A错误;B.Na2CO3、NaHCO3混合液中滴加盐酸,先发生反应Na2CO3+HCl=NaHCO3+NaCl,然后发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,前半段反应40mL盐酸,则在后半段反应中前阶段产生的碳酸氢钠就要消耗40mL盐酸,则后段消耗盐酸总体积要大于40mL,即盐酸总体积要在80mL以后才不产生二氧化碳气体,B错误;C.向Ba(OH)2溶液中滴加MgSO4溶液发生反应生成硫酸钡和氢氧化镁,离子浓度减小导电性减弱,完全反应时导电性接近于0,MgSO4溶液过量后导电能力增强,图象符合,C正确;D.根据还原性强弱为:I->Fe2+>Br->Cl-规律可知,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,则反应一旦开始Cl-浓度就逐步增大,图象不符合,D错误;故答案选C。
15.(1)Al(OH)3+NaOH=NaAlO2+2H2O(1分)
(2)4
(3)7.2
(4)20.16
(5)(1分)
(6)1∶3
(7)10
(8)0.14
(除标注外每空2分)
【解析】(1)由分析可知,图中B到C发生反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O;
(2)根据B点的溶液进行计算,B点的溶液中只有一种溶质Na2SO4,根据物料守恒,n(NaOH)=2n(H2SO4),则0.5L×c(NaOH)=2×0.25L×4mol·L-1,求得c(NaOH)=4mol·L-1;
(3)BC段Al(OH)3溶解,消耗了100mLNaOH溶液,即0.1L×4mol·L-1=0.4molNaOH,根据方程式可知Al(OH)3的物质的量为0.4mol,则合金中含有0.4molAl,其质量为0.4mol×27g·mol-1=10.8g,则Mg的质量为18g-10.8g=7.2g;Mg的物质的量为0.3mol;
(4)Al的物质的量为0.4mol,Mg的物质的量为0.3mol,根据化学方程式则生成n(H2)=1.5n(Al)+n(Mg)=1.5×0.4mol+0.3mol=0.9mol;则在标况下,V(H2)=22.4L·mol-1×0.9mol=20.16L;
(5)由上述分析可知,金属铁和稀硝酸反应生成硝酸铁、硝酸铵和水,反应的离子方程式为:;
(6)由上述分析计算可知:;,则其比值为1∶3;
(7)由上述分析计算可知:A点对应的氢氧化钠溶液的体积为10mL;
(8)由分析可知,金属总物质的量为0.016mol,则合金溶解后硝酸根的物质的量为0.016mol×3=0.048mol,硝酸铵的物质的量为0.006mol,剩余硝酸的物质的量为:10mL×10-3L/mL×lmo/L=0.01mol,则根据N元素守恒可知,原硝酸中含有硝酸的物质的量为0.048mol+0.006mol+0.006mol+0.01mol =0.07mol,硝酸的浓度为。
16.(1) NaOH、 、
(2) 或 83.2%
(每空两分)
【解析】(1)若A是一种黑色单质固体则A为C单质,则C物质为CO2,缓慢通入NaOH溶液的过程中发生的反应先后有:;
所以所得溶液显碱性,溶质如果是单一成分,可能是、;如果是多种成分,可能是、或、。
(2)若A是一种活泼金属,C是淡黄色固体,可知物质C为,用化学方程式表示该物质C的一个重要应用比如供氧剂:或。长期露置于空气中会与水、CO2相互作用,最后将变成物质。将和的固体混合物加热发生反应解得m=1.68g,则的质量分数为。
17.(1) O S
(2) 第三周期VIIA族
(3)
(4)
(每空两分)
【解析】本题考查元素周期表、元素周期律、元素的推导、电子式的书写、离子方程式和化学方程式的书写。A最外层电子数是次外层电子数3倍,A是O元素,短周期元素中S和O同主族,C是S元素,氧可形成氧化物和过氧化物,所以A、B组成的化合物中B显价,可知B是,由B和D形成的化合物的化学式可推知D显价,所以D是。
(2)是带有原子团的离子化合物。
(3)的最高价氧化物对应的水化物为,所以发生的是和的反应。
(4)制作漂白粉的原理为和氢氧化钙反应生成和。
18.(1)
(2)
(3) NaClO2
(4)ClO2> Cl2> Na2FeO4
(每空两分)
【解析】(1)软锰矿主要成分是二氧化锰,浓盐酸和二氧化锰混合加热生成氯气的化学方程式为
(2)当时,设生成5molNaClO,则反应中失电子总数为5mol×1+1mol×5=10mol,根据电子守恒,同时生成NaCl的物质的量为10mol,根据原子守恒,则反应中消耗NaOH和Cl2的物质的量之比为,则发生反应的化学方程式为;
(3)①,反应中Cl元素化合价发生变化,根据氧化还原反应规律,化合价只靠近不交叉(或就近原则),4NaClO2→4C1O2,+3价的氯元素化合价升高到+4价,失去4e-电子,1NaClO2→1NaCl,+3价的氯元素化合价降低到-1价,得到4e-,在氧化还原反应中,所含元素化合价降低的反应物为氧化剂,故NaClO2为氧化剂;
用双线桥表示该反应中电子转移的方向和数目为:
②根据图像可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是: ;
ClO2将CN-氧化生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为,50dm3废水中CN-质量,CN-的物质的量为,至少需要ClO2的物质的量;
(4)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2(pH≤2时)、Na2FeO4、Cl2三种消毒杀菌剂消毒效率分别为;;,所以由大到小的顺序为ClO2> Cl2> Na2FeO4。
化 学
考生注意:
1.答题前,考生务必在答题卡上将自己的学校、姓名、班级、准考证号用0.5毫米黑色签字笔填写清楚,考生考试条码由监考老师粘贴在答题卡上的“条码粘贴处”。
2.选择题使用2B铅笔填涂在答题卡上对应题目标号的位置上,如需改动,用橡皮擦擦干净后再填涂其它答案;非选择题用0.5毫米黑色签字笔在答题卡的对应区域内作答,超出答题区域答题的答案无效;在草稿纸上、试卷上答题无效。
3.本试卷满分100分,考试时长75分钟,考试结束后由监考老师将答题卡收回。
4. 可能用到的相对原子质量为H 1 C 12 O 16 Na 23 P 31 S 32 Cl 35.5 Cu 64 Ba 137
一、单选题:本题共14小题,每题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 下列有关物质的性质与用途具有对应关系的是
A.镁可以和反应,可用于制造信号弹和焰火
B.纳米能与酸反应,可用作铁磁性材料
C.石墨的熔点很高,可用作干电池电极材料
D.无水呈蓝色,吸水后为粉红色[],可用于制造变色硅胶(干燥剂)
2.下列说法正确的是
A.氯化氢是由氢离子和氯离子构成的,常温下能够导电
B.白磷分子为正四面体结构,分子相当稳定,不容易发生反应
C.金刚石与石墨结构、性质不同,互为同位素
D.玻尔对轨道模型做出了具大贡献
3. 如图为元素周期表中短周期元素的一部分,下列说法中正确的是
A.不可能出现金属元素
B.气态氢化物的热稳定性:
C.六种元素中,③的最高价氧化物对应的水化物的酸性一定最强
D.六种元素,相互结合形成的二元化合物一定都是共价化合物
4. 1912年E.Beckmann冰点降低法获得了黄色的正交α 型硫元素的一种同素异形体S8分子。1891年,M.R.Engel首次制得了一种菱形的ε 硫,后来证明含有S6分子。下列说法不正确的是
A.S6和S8分子分别与铜粉反应,所得产物均为Cu2S
B.推测Na2S8既含离子键又含共价键
C.S8分子转化为S6分子,属于物理变化
D.一定条件下等质量的S6和S8分子分别与足量的铁粉反应,消耗铁粉的物质的量相同
5. 设为阿伏加德罗常数的值。下列说法错误的是
A.的硫酸溶液中,含氢离子数为
B.在标准状况下,分子中含氢原子数目为
C.分子中含极性键数目一定是
D.在反应中,每生成,转移的电子数为
6. “祝融号”火星车发回的遥测信号显示,火星的气体及岩石中富含原子序数依次递增的四种短周期主族元素X、Y、Z、W,它们分属长两个周期,且只含一种金属元素,X、W同主族,四种元素的原子最外层电子数之和为16,Y元素是地壳中含量最多的元素。下列判断错误的是
A.一定条件下Z可以与XY2发生反应
B.简单氢化物沸点:X
D.Y与Z形成的化合物中可能含有非极性键
7. 实验室需要稀硫酸,用浓硫酸进行配制.下列说法错误的是
A.用量筒量取浓硫酸的体积为
B.将冷却后的溶液沿玻璃棒注入容量瓶
C.转移溶液时有液体溅出,应重新配制
D.定容时俯视刻度线,会使所配溶液物质的量浓度偏大
8. 用聚合物包覆Mg微球可制得镁基微马达(如图)。在盐酸中,微马达包覆层开口处反应排出气体使其定向运动。在该微马达中能替代Mg的金属是
A.Zn
B.Cu
C.Ag
D.Au
9. 甲、丙、丁、戊的焰色试验均为黄色,甲是一种淡黄色固体,常温下乙为一种常见液体,X是一种常见的有刺激性气味的单质气体。(部分生成物已略去)下列相关叙述错误的是
A.反应①的离子方程式为
B.反应②为工业制漂白粉的原理
C.X溶于乙中形成的溶液为淡黄绿色
D.甲、乙反应,每有甲完全反应时转移电子
10.以不同类别物质间的转化为线索,认识钠及其化合物。下列分析不正确的是
A.CO2和氢氧化钠反应产物与氢氧化钠的用量有关
B.反应⑥中2molNa2O2与二氧化碳完全反应,转移电子数为4NA
C.反应⑤、⑥可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应
11.常温下,下列离子组在指定溶液中能大量共存的是
A.过氧化氢溶液中:
B.的溶液中:
C.的溶液中:
D.酸性的溶液中:
12.设为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,中电子的数目为
B.浓盐酸与足量的反应,转移电子的数目为
C.在空气中燃烧生成和,转移电子个数为
D.和混合气体中含有的质子数为
13.下列解释事实的方程式不正确的是
A.硫酸铁溶液中加入双氧水:
B.84消毒液与洁厕灵混用产生有毒气体:
C.将碳酸氢钙溶液与过量的澄清石灰水混合:
D.用硫化钠除去废水中的铜离子:
14. 下列选项描述与对应图像相符的是
A.图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像
B.图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像
C.图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像
D.图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-(已知还原性:I->Fe2+>Br-)
二、非选择题:本题共4题,共58分。
15.(14分)Ⅰ.将18g镁铝合金溶于250mL 4mol/L硫酸溶液中充分反应,共产生V L(标准状况)气体,向反应后的溶液中逐滴滴加某浓度的氢氧化钠溶液至过量,产生沉淀的物质的量与加入氢氧化钠溶液体积关系如下图所示(图像三个拐点分别标记为A、B、C),根据题意和图示回答下列问题。
(1)图中B到C发生反应的化学方程式为 。
(2)氢氧化钠溶液的浓度为 mol/L。
(3)原合金中镁的质量是 g。
(4)V= 。
Ⅱ.已知硝酸与金属发生反应时,随着硝酸浓度的下降,还原产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH4NO3中的一种或几种。 某同学取一定量的铝铁合金与500 mL很稀的硝酸充分反应,反应过程中无气体放出。向反应结束后的溶液中逐滴加入l mo/L NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
(5)写出合金中铝与该稀硝酸反应的离子方程式 。
(6)合金中铝和铁的物质的量比为 。
(7)A点对应的氢氧化钠溶液的体积为 mL。
(8)上述很稀的硝酸的浓度为 mo1/L。
16.(14分)17.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
(1)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是 、 ;如果是多种成分,可能是 、 。
(2)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用 。将C长期露置于空气中,最后将变成物质D,D的化学式为 。现有D和的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为 。
17.(16分)A、B、C、D为短周期元素,原子序数依次增大。A的最外层电子数是次外层电子数的3倍;A、C在同一主族;A、B可组成化合物和;B、D可组成离子化合物BD。
(1)写出各元素的元素符号:A ,B ,C ,D 。
(2)元素D在周期表中的位置: ;的电子式: 。
(3)写出D单质与B的最高价氧化物对应水化物反应的离子方程式: 。
(4)元素D可用来制作漂白粉,写出制作漂白粉的化学方程式: 。
18.(14分)化学让生活更美好,各类水处理剂能让水质得到提升达到饮用水的标准。生活中较常见的水处理剂有:氯气、次氯酸钠、漂白粉、二氧化氯、明矾、硫酸铁、高铁酸钠等等。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式: 。
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成。请写出在加热时,当与反应生成的时,与反应的化学方程式: 。
(3)近年来有科学家提出,氯气消毒时,会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂,如二氧化氯、臭氧等。被世界卫生组织列为A级高效、安全灭菌消毒剂,将逐渐取代成为自来水的消毒剂。
①是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:。该反应中氧化剂是 ,请用双线桥标明电子转移的方向和数目 。
②气体具有强氧化性,其还原产物的转化率与关系如图所示。对污水中等也有明显的去除效果,请写出时,与反应的离子方程式: 。某工厂污水中含,现用将氧化,生成了两种无毒无害的气体,处理这种污水,至少需要 。
(4)高铁酸钠在水中既能消毒杀菌,其产物胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,则(时)、三种消毒杀菌剂的消毒效率由大到小的顺序是 。
参考答案及解析
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 D C B C A A D B B D B C A C
1.D
【解析】A.镁在空气中燃烧发出耀眼的白光,可用于制造信号弹和焰火,与镁能和二氧化碳反应没有关系,A错误;B.纳米可用作铁磁性材料是因为其有磁性,与四氧化三铁能与酸反应没有关系,B错误;C.石墨可用作干电池电极材料是因其可以导电且常温下性质不活泼,与熔点很高无关,C错误;D.无水呈蓝色,吸水后为粉红色,因此可用于制造变色硅胶(干燥剂),D正确;故答案选D。
2.D
【解析】A.氯化氢是分子化合物,不是由氢离子和氯离子构成,常温下不导电,A错误;B.白磷分子为正四面体结构,但是白磷分子并不稳定,容易发生反应,B错误;C.金刚石与石墨都是碳的单质,属于同素异形体不是同位素,C错误;D.玻尔提出电子在一定轨道上运动的原子结构模型,对轨道模型做出了巨大贡献,D正确;故答案选D。
3.D
【解析】④可能是,A错误;同周期元素从左到右、同主族元素从下到上非金属性逐渐增强,气态氢化物的热稳定性也逐渐增强,因此气态氢化物的热稳定性:,B错误;③有可能是氧或氟元素,没有最高价氧化物对应的水化物,C错误。故答案选D。
4.C
【解析】A.硫单质具有弱氧化性,则S6和S8分子分别与铜反应,所得产物相同为Cu2S,A项正确;B.Na2S8由钠离子和构成,其中既含离子键又含非极性共价键,B项正确;C.硫单质之间的转化属于化学变化,C项错误;D.等质量的S6和S8分子中含有的硫原子物质的量相同,与足量铁粉反应的产物都是FeS,因此消耗铁粉的物质的量相同,D项正确;故答案选C。
5.B
【解析】A.1LpH=2的硫酸溶液中,含氢离子数为0.01mol/L×1L×NA=0.01NA,A正确;B.在标准状况下,HF为液体,不能用气体摩尔体积计算其物质的量,B错误;C.15gC2H6分子的物质的量为0.5mol,每个C2H6分子中含有6个极性键,则0.5molC2H6分子中含极性键数目一定是3NA,C正确;D.在反应中,KClO3中Cl的化合价降低了5价,转移了5个电子,故每生成,转移的电子数为,D正确; 故答案选B。
6.C
【解析】由Y元素是地球地壳中含量最高的元素,可知Y为O;X、Y、Z、W原子序数递增的四种短周期主族元素,X、W同主族,设X的最外层电子数为m,Z的最外层电子数为n,则与X同主族的W的最外层电子数也为m,根据四种元素的原子最外层电子数之和为16可得2m+n+6=16,可得2m+n=10,若m=1,则n=8(Z的最外层电子数为8,不符合短周期主族元素要求,舍弃);若m=2,则n=6(X、W分别为Be、Mg,不符合只含一种金属元素的要求,舍弃);若m=3,=4(W、Z分别为Al和Si,不符合原子序数递增的规律,舍弃);若m=4,n=2,则X是C元素,W是Si元素,Z是Mg元素,符合题意。综上分析可知,X、Y、Z、W分别为C、O、Mg、Si。
【解析】A.Mg可以在CO2中燃烧置换出C,故A正确;B.X、Y的简单氢化物分别是CH4、H2O,H2O能形成分子间氢键,CH4则没有,故沸点:CH4
7.A
【解析】A.需要稀硫酸,需要用容量瓶配制溶液,用量筒量取浓硫酸的体积为,A错误;B.需要用容量瓶,将冷却后的溶液沿玻璃棒注入容量瓶,B正确;C.转移溶液时有液体溅出,配制失败,应重新配制,C正确;D.定容时俯视刻度线,溶液体积偏小,会使所配溶液物质的量浓度偏大,D正确;故答案选A。
8.A
【解析】根据题意可知微马达中的物质可以和盐酸反应生成氢气,则选项中只有锌可以和盐酸反应;故答案选A。
9.B
【解析】A.反应①为过氧化钠与水反应,离子方程式为A正确;B.工业制漂白粉是将通入冷的石灰乳中,B错误;C.溶于水形成氯水,因含有,则溶液颜色为淡黄绿色,C正确;D.因为在反应是过氧化钠的过氧根离子里面,一个是得电子的与水结合生成氢氧根离子,另一个氧原子是失电子的,生成氧气,所以的过氧化钠与水完全反应时转移电子,D正确。故答案选B。
10.B
【解析】A.CO2和过量氢氧化钠反应生成碳酸钠,与少量氢氧化钠反应生成碳酸氢钠,产物与氢氧化钠的用量有关,故A正确;B.Na2O2与二氧化碳完全反应,方程式为2 Na2O2+2CO2=2Na2CO3+O2,为歧化反应,1mol Na2O2转移1mol电子,2molNa2O2完全反应转移电子数为2NA,故B错误;C.过氧化钠与水、二氧化碳反应都生成氧气,可用于潜水艇中氧气的供给,故C正确;D.碳酸氢钠分解属于分解反应,钠和氧气属于化合反应,钠和水属于置换反应,故D正确。故答案选B。
11.B
【解析】A.过氧化氢具有氧化性,可以氧化I-,故A错误;B.的溶液中:可以大量共存,故B正确;C.、都不能大量共存,故C错误;D.即酸性溶液中,不能大量共存,故D错误;故答案选B。
12.C
【解析】A.标准状况下SO3是固体,的物质的量不是0.1mol,故A错误;B.稀盐酸和二氧化锰不反应,浓盐酸与足量的反应,参加反应的HCl小于0.4mol,转移电子的数目小于,故B错误;
C.在空气中燃烧生成和,镁元素化合价由0升高为+2,转移电子个数,故C正确;D.CO和N2的摩尔质量都是28g/mol,每个分子中都含14个质子,和混合气体中含有的质子数为,故D错误;故答案选C。
13.A
【解析】A.硫酸铁溶液中加入双氧水,Fe3+催化分解双氧水,,故A错误;B.84消毒液与洁厕灵混用产生有毒气体,反应的离子方程式为,故B正确;C.将碳酸氢钙溶液与过量的澄清石灰水混合,生成碳酸钙沉淀和水,反应的离子方程式为,故C正确;D.用硫化钠除去废水中的铜离子,反应的离子方程式为,故D正确;故答案选A。
14.C
【解析】A.新制氯水中存在可逆反应Cl2+H2O HCl+HClO,阳光直射新制氯水时,发生反应2HClO2HCl+O2↑,随着时间的变化,溶液中c(Cl-)逐渐增大,图象不符合,A错误;B.Na2CO3、NaHCO3混合液中滴加盐酸,先发生反应Na2CO3+HCl=NaHCO3+NaCl,然后发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,前半段反应40mL盐酸,则在后半段反应中前阶段产生的碳酸氢钠就要消耗40mL盐酸,则后段消耗盐酸总体积要大于40mL,即盐酸总体积要在80mL以后才不产生二氧化碳气体,B错误;C.向Ba(OH)2溶液中滴加MgSO4溶液发生反应生成硫酸钡和氢氧化镁,离子浓度减小导电性减弱,完全反应时导电性接近于0,MgSO4溶液过量后导电能力增强,图象符合,C正确;D.根据还原性强弱为:I->Fe2+>Br->Cl-规律可知,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,则反应一旦开始Cl-浓度就逐步增大,图象不符合,D错误;故答案选C。
15.(1)Al(OH)3+NaOH=NaAlO2+2H2O(1分)
(2)4
(3)7.2
(4)20.16
(5)(1分)
(6)1∶3
(7)10
(8)0.14
(除标注外每空2分)
【解析】(1)由分析可知,图中B到C发生反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O;
(2)根据B点的溶液进行计算,B点的溶液中只有一种溶质Na2SO4,根据物料守恒,n(NaOH)=2n(H2SO4),则0.5L×c(NaOH)=2×0.25L×4mol·L-1,求得c(NaOH)=4mol·L-1;
(3)BC段Al(OH)3溶解,消耗了100mLNaOH溶液,即0.1L×4mol·L-1=0.4molNaOH,根据方程式可知Al(OH)3的物质的量为0.4mol,则合金中含有0.4molAl,其质量为0.4mol×27g·mol-1=10.8g,则Mg的质量为18g-10.8g=7.2g;Mg的物质的量为0.3mol;
(4)Al的物质的量为0.4mol,Mg的物质的量为0.3mol,根据化学方程式则生成n(H2)=1.5n(Al)+n(Mg)=1.5×0.4mol+0.3mol=0.9mol;则在标况下,V(H2)=22.4L·mol-1×0.9mol=20.16L;
(5)由上述分析可知,金属铁和稀硝酸反应生成硝酸铁、硝酸铵和水,反应的离子方程式为:;
(6)由上述分析计算可知:;,则其比值为1∶3;
(7)由上述分析计算可知:A点对应的氢氧化钠溶液的体积为10mL;
(8)由分析可知,金属总物质的量为0.016mol,则合金溶解后硝酸根的物质的量为0.016mol×3=0.048mol,硝酸铵的物质的量为0.006mol,剩余硝酸的物质的量为:10mL×10-3L/mL×lmo/L=0.01mol,则根据N元素守恒可知,原硝酸中含有硝酸的物质的量为0.048mol+0.006mol+0.006mol+0.01mol =0.07mol,硝酸的浓度为。
16.(1) NaOH、 、
(2) 或 83.2%
(每空两分)
【解析】(1)若A是一种黑色单质固体则A为C单质,则C物质为CO2,缓慢通入NaOH溶液的过程中发生的反应先后有:;
所以所得溶液显碱性,溶质如果是单一成分,可能是、;如果是多种成分,可能是、或、。
(2)若A是一种活泼金属,C是淡黄色固体,可知物质C为,用化学方程式表示该物质C的一个重要应用比如供氧剂:或。长期露置于空气中会与水、CO2相互作用,最后将变成物质。将和的固体混合物加热发生反应解得m=1.68g,则的质量分数为。
17.(1) O S
(2) 第三周期VIIA族
(3)
(4)
(每空两分)
【解析】本题考查元素周期表、元素周期律、元素的推导、电子式的书写、离子方程式和化学方程式的书写。A最外层电子数是次外层电子数3倍,A是O元素,短周期元素中S和O同主族,C是S元素,氧可形成氧化物和过氧化物,所以A、B组成的化合物中B显价,可知B是,由B和D形成的化合物的化学式可推知D显价,所以D是。
(2)是带有原子团的离子化合物。
(3)的最高价氧化物对应的水化物为,所以发生的是和的反应。
(4)制作漂白粉的原理为和氢氧化钙反应生成和。
18.(1)
(2)
(3) NaClO2
(4)ClO2> Cl2> Na2FeO4
(每空两分)
【解析】(1)软锰矿主要成分是二氧化锰,浓盐酸和二氧化锰混合加热生成氯气的化学方程式为
(2)当时,设生成5molNaClO,则反应中失电子总数为5mol×1+1mol×5=10mol,根据电子守恒,同时生成NaCl的物质的量为10mol,根据原子守恒,则反应中消耗NaOH和Cl2的物质的量之比为,则发生反应的化学方程式为;
(3)①,反应中Cl元素化合价发生变化,根据氧化还原反应规律,化合价只靠近不交叉(或就近原则),4NaClO2→4C1O2,+3价的氯元素化合价升高到+4价,失去4e-电子,1NaClO2→1NaCl,+3价的氯元素化合价降低到-1价,得到4e-,在氧化还原反应中,所含元素化合价降低的反应物为氧化剂,故NaClO2为氧化剂;
用双线桥表示该反应中电子转移的方向和数目为:
②根据图像可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是: ;
ClO2将CN-氧化生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为,50dm3废水中CN-质量,CN-的物质的量为,至少需要ClO2的物质的量;
(4)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2(pH≤2时)、Na2FeO4、Cl2三种消毒杀菌剂消毒效率分别为;;,所以由大到小的顺序为ClO2> Cl2> Na2FeO4。
同课章节目录
