安徽省部分学校2023-2024学年高一上学期期末质量检测化学试题(无答案)
文档属性
| 名称 | 安徽省部分学校2023-2024学年高一上学期期末质量检测化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 506.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-31 17:01:49 | ||
图片预览

文档简介
2023-2024学年安徽高一(上)期末质量检测
化学
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Fe 56 Zn 65
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.绿色甲醇是2023年杭州亚运会主火炬燃料.已知甲醇易溶于水且不电离,下列关于甲醇的说法正确的是( )
A.甲醇是一种碱 B.液态甲醇可以导电
C.燃烧时被氧化 D.甲醇因含有氧元素,故可用作燃料
2.关于碳、氮、硫、氯的氧化物,下列性质与用途正确且具有因果关系的是( )
A.干冰属于酸性氧化物,可在舞台上制造“云雾”
B.NO具有还原性,能作为“信使分子”传递神经信息
C.无毒无味,可用作食品添加剂
D.具有强氧化性,可用作自来水杀菌消毒剂
3.一种新型合成氨的方法如图所示.下列说法错误的是( )
A.过程①与工业合成氨反应均属于“氮的固定”
B.的水溶液能导电,属于电解质
C.该过程的总反应为
D.过程②和③均属于非氧化还原反应
4.下列说法正确的是( )
A.冷的浓硫酸可用铁质或铝质容器储存,说明铝、铁不与浓硫酸反应
B.和氯水均有漂白性,二者的漂白原理相同
C.铁在空气中点燃剧烈反应,火星四射
D.、均为碱性氧化物,均难溶于水
5.在给定条件下,下列选项所示的物质间转化能实现的是( )
A. B.溶液
C.溶液 D.
6.设代表阿伏加德罗常数的值.下列说法正确的是( )
A.常温常压下,中含有的电子数为
B.溶液中含有的数为
C.与足量铁在加热条件下完全反应时转移的电子数为
D.标准状况下,和的混合气体中含有的原子数为
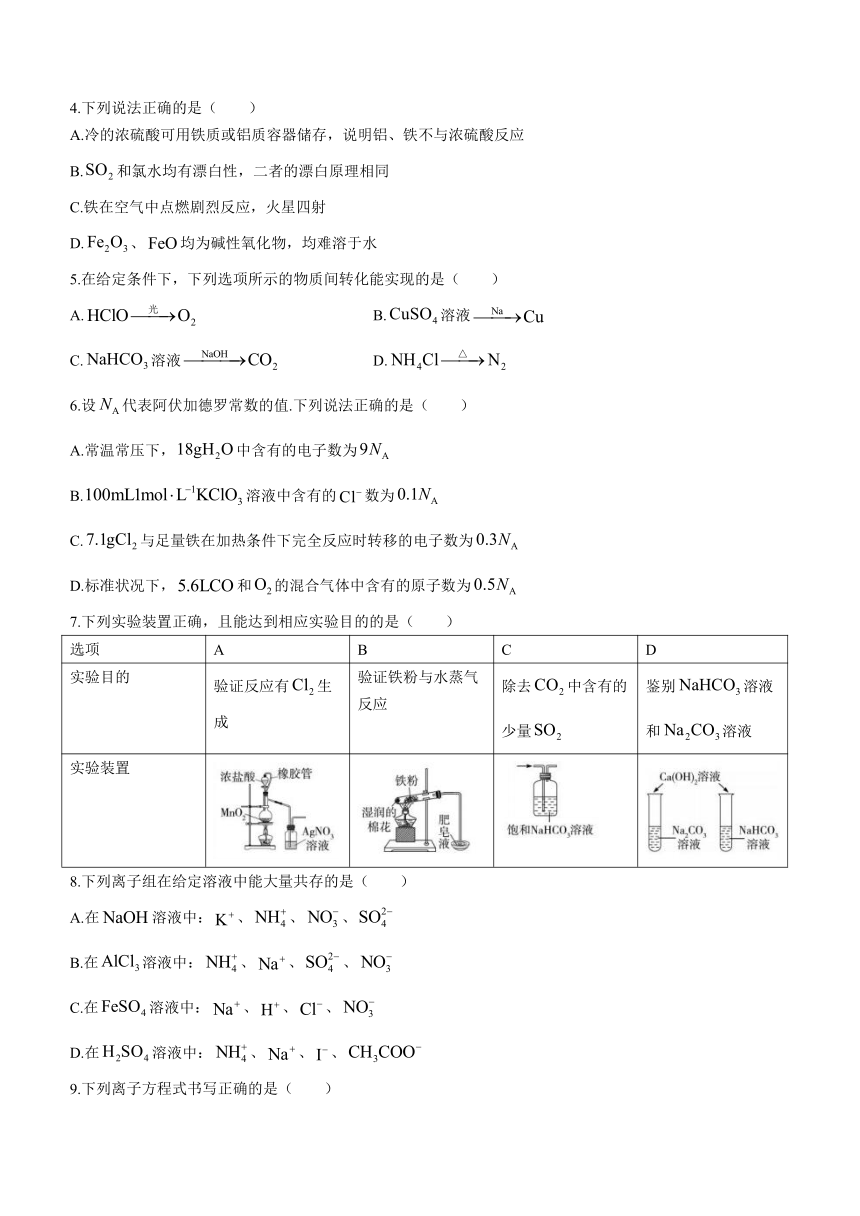
7.下列实验装置正确,且能达到相应实验目的的是( )
选项 A B C D
实验目的 验证反应有生成 验证铁粉与水蒸气反应 除去中含有的少量 鉴别溶液和溶液
实验装置
8.下列离子组在给定溶液中能大量共存的是( )
A.在溶液中:、、、
B.在溶液中:、、、
C.在溶液中:、、、
D.在溶液中:、、、
9.下列离子方程式书写正确的是( )
A.溶液与溶液反应:
B.足量通入氨水中:
C.溶于稀盐酸:
D.溶液与少量硫酸混合:
10.我国古代四大发明之一黑火药的爆炸反应为(未配平).下列说法错误的是( )
A.上述反应中涉及两种电解质 B.固体中含有离子
C.上述反应生成时,转移电子 D.上述反应配平后的化学计量数为3
11.依据下列实验方案设计和现象所得结论正确的是( )
选项 方案设计 现象 结论
A 用红色激光笔照射某液体 有一条光亮的“通路” 该液体一定是胶体
B 向盛有和的试管中分别滴加浓盐酸 盛有的试管中产生黄绿色气体 氧化性:
C 向某溶液中滴加几滴稀溶液,用湿润的红色石蕊试纸靠近试管口 红色石蕊试纸 无明显现象 该溶液中一定无
D 将氯气通入紫色石蕊试液中 紫色石蕊试液 先变红后褪色 氯气既有酸性又有漂白性
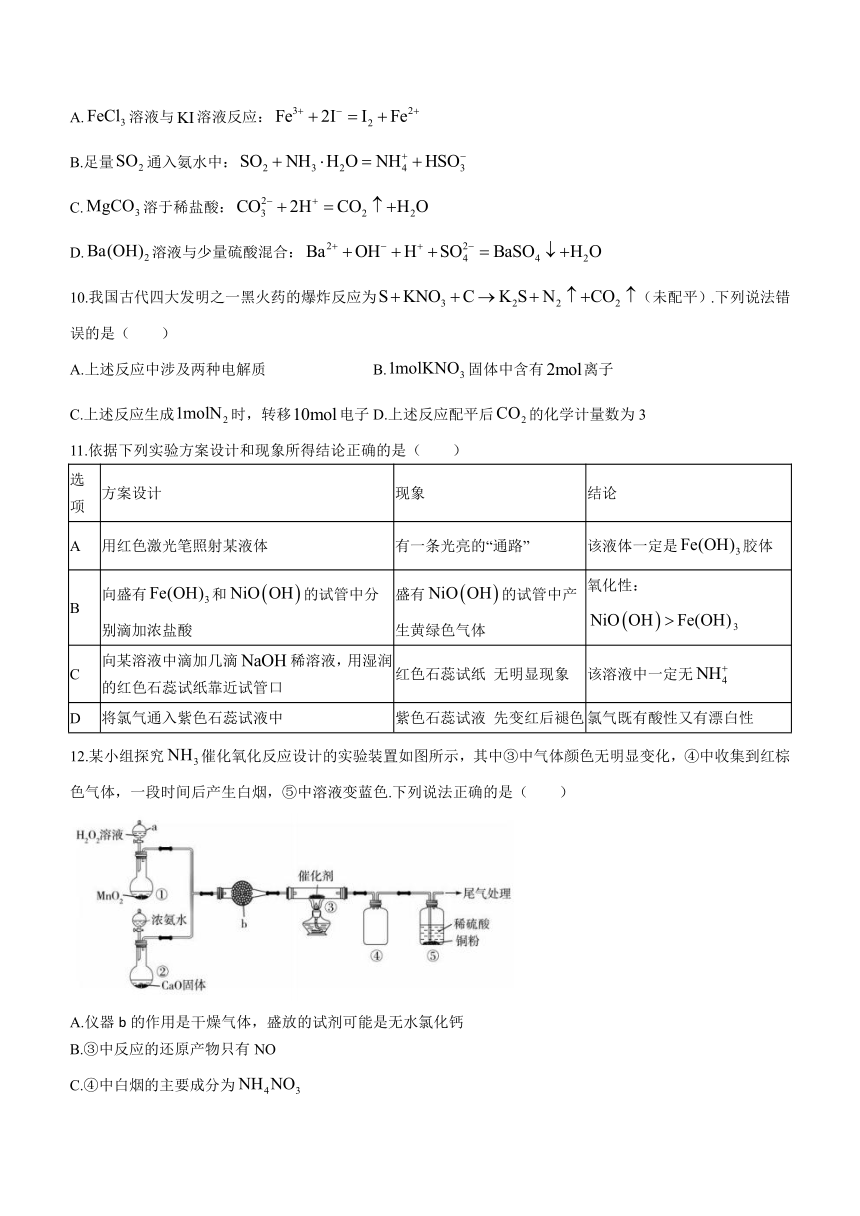
12.某小组探究催化氧化反应设计的实验装置如图所示,其中③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后产生白烟,⑤中溶液变蓝色.下列说法正确的是( )
A.仪器b的作用是干燥气体,盛放的试剂可能是无水氯化钙
B.③中反应的还原产物只有NO
C.④中白烟的主要成分为
D.⑤中溶液变蓝的原因可能是催化了铜粉与稀硫酸的反应
13.以不同类别物质间的转化为线索,构建铁及其化合物的转化关系如图所示:
下列叙述正确的有( )
①铁粉与水蒸气在高温下反应可实现的转化
②可利用铜粉除去溶液中的杂质
③可利用新制氯水和溶液检验是否被完全氧化为
④向盛放在试管中的溶液中直接滴加溶液能制备并收集
A.1个 B.2个 C.3个 D.4个
14.已知某溶液(该溶液称为)中仅含有两种溶质和,且物质的量浓度依次为和,向该溶液中投入铁粉恰好完全反应,释放出的气体体积为.下列叙述正确的是( )
A.中的物质的量为
B.
C.反应后所得溶液中氧化产物与还原产物的物质的量之比为
D.
二、非选择题:本题共4小题,共58分.
15.(15分)、、、、等钠盐在生产生活中具有重要应用.
(1)可用作食用面碱,是因为溶液显____________性.
(2)广泛用于烘焙糕点的膨松剂,是因为____________________________________(用化学方程式表示).
(3)大苏打具有较强的还原性,常用于防毒面具中吸收氯气.在溶液中,若完全反应失去电子,则反应后溶液中的含硫微粒为____________(用离子符号表示).
(4)高铁酸盐(如)被科学家们公认为绿色消毒剂,制备原理之一为(未配平).
①能用于消毒与其具有____________有关(填“氧化性”或“还原性”).
②配平上述反应后可得____________
③高铁酸钠也可用于净水,其原理为,生成的胶体能凝聚水中的悬浮物.若有参加反应,则生成的胶粒数目____________(填“大于”“小于”或“等于”,设表示阿伏加德罗常数的值).
(5)“84”消毒液是一种以为主的消毒剂,广泛应用于医院、食品加工等场所的环境消毒.取适量“84”消毒液于试管中,滴入几滴紫色石蕊试液,溶液变蓝,再滴入浓盐酸,蓝色迅速褪去,过一会儿有刺激性气味的黄绿色气体生成.
①工业制备“84”消毒液的化学方程式为________________________________________________.
②产生黄绿色气体的离子方程式为____________________________________________________________.
16.(14分)合理应用和处理含硫、氮的化合物,在生产生活以及科学研究中有重要意义.
(1)硫铁矿(含)是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
①反应Ⅰ的化学方程式可表示为,其中的系数为___________________.
②在工业生产中,与足量的反应,得到的物质的量________(填序号).
a.小于 b.等于 c.大于
③“”与“”是形成酸雨的两种常见途径,请写出的化学方程式:________________________________________________________________________.
(2)能形成酸雨,写出溶于水转化为的化学方程式:________________________________________________;工厂中常采用溶液吸收、的混合气体,并通入足量的空气,使其转化为化工产品________________(填“”或“”).
(3)为探究的还原性,设计如图所示的装置,将通入和的混合溶液中,观察到有白色沉淀生成.
①甲同学认为具有氧化性,将氧化为,与反应生成白色沉淀.
与反应的离子方程式为_______________________________.
②乙同学认为甲同学的分析有失偏颇,其理由是_____________________________________________.
17.(15分)物质的量在实验与科研中应用广泛.请回答下列问题:
(1)实验室欲用的浓硫酸配制的稀硫酸.
①下列操作正确的是_____________(填序号).
操作
选项 a b c d
②用量筒量取浓硫酸的体积为______________
③配制溶液的过程中,其他操作都正确,下列不当操作对所配溶液浓度的影响:
a.用量筒量取浓硫酸时俯视读数:______________(填“偏大”“偏小”或“无影响”,下同).
b.稀释浓硫酸时,未冷却到室温即转移到容量瓶中:_______________.
c.将量取浓硫酸后的量筒进行洗涤,并将洗涤液转移到容量瓶中:______________.
(2)室温下测得的密度为,则室温下的气体摩尔体积为______________(用含的代数式表示).
(3)为测定溶液的浓度,某同学设计了如下实验方案.
实验原理:、.
实验步骤:
ⅰ.按图安装装置(夹持仪器略去),并检查装置气密性;
ⅱ.在各仪器中加入图示试剂;
iii.调整D、E中两液面使其相平,使D中液面保持在0或略低于0刻度位置,读数并记录;
iv.将溶液全部滴入A中并搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生;
v.待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录、处理数据.
①步骤ⅲ需“调整D、E中两液面使其相平”的原因是____________________________________.
②将实验过程中测得的数据转化为的质量时,其质量为,则为_________(列出计算式).
③有同学认为用同样的装置和方法不能测定溶液的浓度,其原因为____________________________________________________________________________________.
18.(14分)常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水.实验室以含锌废液(主要成分为,含少量的、)为原料制备的实验流程如图所示:
请回答下列问题:
(1)已知中存在一个过氧键,则过二硫酸钠中元素的化合价为;“除锰”阶段被氧化的元素有_________(填元素名称).
(2)加入能“除铁”的原因:消耗使溶液调整至左右时,能使溶液中的完全转化为沉淀,则该阶段发生总反应的离子方程式为_________
(3)“沉锌”过程中通常加入.
①在水溶液中的电离方程式为___________________________
②向饱和食盐水中加入与等物质的量的固体时发生反应的化学方程式为__________________
(4)________________(填“属于”或“不属于”)盐,其与醋酸反应生成的离子方程式为____________________________________
化学
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Fe 56 Zn 65
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.绿色甲醇是2023年杭州亚运会主火炬燃料.已知甲醇易溶于水且不电离,下列关于甲醇的说法正确的是( )
A.甲醇是一种碱 B.液态甲醇可以导电
C.燃烧时被氧化 D.甲醇因含有氧元素,故可用作燃料
2.关于碳、氮、硫、氯的氧化物,下列性质与用途正确且具有因果关系的是( )
A.干冰属于酸性氧化物,可在舞台上制造“云雾”
B.NO具有还原性,能作为“信使分子”传递神经信息
C.无毒无味,可用作食品添加剂
D.具有强氧化性,可用作自来水杀菌消毒剂
3.一种新型合成氨的方法如图所示.下列说法错误的是( )
A.过程①与工业合成氨反应均属于“氮的固定”
B.的水溶液能导电,属于电解质
C.该过程的总反应为
D.过程②和③均属于非氧化还原反应
4.下列说法正确的是( )
A.冷的浓硫酸可用铁质或铝质容器储存,说明铝、铁不与浓硫酸反应
B.和氯水均有漂白性,二者的漂白原理相同
C.铁在空气中点燃剧烈反应,火星四射
D.、均为碱性氧化物,均难溶于水
5.在给定条件下,下列选项所示的物质间转化能实现的是( )
A. B.溶液
C.溶液 D.
6.设代表阿伏加德罗常数的值.下列说法正确的是( )
A.常温常压下,中含有的电子数为
B.溶液中含有的数为
C.与足量铁在加热条件下完全反应时转移的电子数为
D.标准状况下,和的混合气体中含有的原子数为
7.下列实验装置正确,且能达到相应实验目的的是( )
选项 A B C D
实验目的 验证反应有生成 验证铁粉与水蒸气反应 除去中含有的少量 鉴别溶液和溶液
实验装置
8.下列离子组在给定溶液中能大量共存的是( )
A.在溶液中:、、、
B.在溶液中:、、、
C.在溶液中:、、、
D.在溶液中:、、、
9.下列离子方程式书写正确的是( )
A.溶液与溶液反应:
B.足量通入氨水中:
C.溶于稀盐酸:
D.溶液与少量硫酸混合:
10.我国古代四大发明之一黑火药的爆炸反应为(未配平).下列说法错误的是( )
A.上述反应中涉及两种电解质 B.固体中含有离子
C.上述反应生成时,转移电子 D.上述反应配平后的化学计量数为3
11.依据下列实验方案设计和现象所得结论正确的是( )
选项 方案设计 现象 结论
A 用红色激光笔照射某液体 有一条光亮的“通路” 该液体一定是胶体
B 向盛有和的试管中分别滴加浓盐酸 盛有的试管中产生黄绿色气体 氧化性:
C 向某溶液中滴加几滴稀溶液,用湿润的红色石蕊试纸靠近试管口 红色石蕊试纸 无明显现象 该溶液中一定无
D 将氯气通入紫色石蕊试液中 紫色石蕊试液 先变红后褪色 氯气既有酸性又有漂白性
12.某小组探究催化氧化反应设计的实验装置如图所示,其中③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后产生白烟,⑤中溶液变蓝色.下列说法正确的是( )
A.仪器b的作用是干燥气体,盛放的试剂可能是无水氯化钙
B.③中反应的还原产物只有NO
C.④中白烟的主要成分为
D.⑤中溶液变蓝的原因可能是催化了铜粉与稀硫酸的反应
13.以不同类别物质间的转化为线索,构建铁及其化合物的转化关系如图所示:
下列叙述正确的有( )
①铁粉与水蒸气在高温下反应可实现的转化
②可利用铜粉除去溶液中的杂质
③可利用新制氯水和溶液检验是否被完全氧化为
④向盛放在试管中的溶液中直接滴加溶液能制备并收集
A.1个 B.2个 C.3个 D.4个
14.已知某溶液(该溶液称为)中仅含有两种溶质和,且物质的量浓度依次为和,向该溶液中投入铁粉恰好完全反应,释放出的气体体积为.下列叙述正确的是( )
A.中的物质的量为
B.
C.反应后所得溶液中氧化产物与还原产物的物质的量之比为
D.
二、非选择题:本题共4小题,共58分.
15.(15分)、、、、等钠盐在生产生活中具有重要应用.
(1)可用作食用面碱,是因为溶液显____________性.
(2)广泛用于烘焙糕点的膨松剂,是因为____________________________________(用化学方程式表示).
(3)大苏打具有较强的还原性,常用于防毒面具中吸收氯气.在溶液中,若完全反应失去电子,则反应后溶液中的含硫微粒为____________(用离子符号表示).
(4)高铁酸盐(如)被科学家们公认为绿色消毒剂,制备原理之一为(未配平).
①能用于消毒与其具有____________有关(填“氧化性”或“还原性”).
②配平上述反应后可得____________
③高铁酸钠也可用于净水,其原理为,生成的胶体能凝聚水中的悬浮物.若有参加反应,则生成的胶粒数目____________(填“大于”“小于”或“等于”,设表示阿伏加德罗常数的值).
(5)“84”消毒液是一种以为主的消毒剂,广泛应用于医院、食品加工等场所的环境消毒.取适量“84”消毒液于试管中,滴入几滴紫色石蕊试液,溶液变蓝,再滴入浓盐酸,蓝色迅速褪去,过一会儿有刺激性气味的黄绿色气体生成.
①工业制备“84”消毒液的化学方程式为________________________________________________.
②产生黄绿色气体的离子方程式为____________________________________________________________.
16.(14分)合理应用和处理含硫、氮的化合物,在生产生活以及科学研究中有重要意义.
(1)硫铁矿(含)是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
①反应Ⅰ的化学方程式可表示为,其中的系数为___________________.
②在工业生产中,与足量的反应,得到的物质的量________(填序号).
a.小于 b.等于 c.大于
③“”与“”是形成酸雨的两种常见途径,请写出的化学方程式:________________________________________________________________________.
(2)能形成酸雨,写出溶于水转化为的化学方程式:________________________________________________;工厂中常采用溶液吸收、的混合气体,并通入足量的空气,使其转化为化工产品________________(填“”或“”).
(3)为探究的还原性,设计如图所示的装置,将通入和的混合溶液中,观察到有白色沉淀生成.
①甲同学认为具有氧化性,将氧化为,与反应生成白色沉淀.
与反应的离子方程式为_______________________________.
②乙同学认为甲同学的分析有失偏颇,其理由是_____________________________________________.
17.(15分)物质的量在实验与科研中应用广泛.请回答下列问题:
(1)实验室欲用的浓硫酸配制的稀硫酸.
①下列操作正确的是_____________(填序号).
操作
选项 a b c d
②用量筒量取浓硫酸的体积为______________
③配制溶液的过程中,其他操作都正确,下列不当操作对所配溶液浓度的影响:
a.用量筒量取浓硫酸时俯视读数:______________(填“偏大”“偏小”或“无影响”,下同).
b.稀释浓硫酸时,未冷却到室温即转移到容量瓶中:_______________.
c.将量取浓硫酸后的量筒进行洗涤,并将洗涤液转移到容量瓶中:______________.
(2)室温下测得的密度为,则室温下的气体摩尔体积为______________(用含的代数式表示).
(3)为测定溶液的浓度,某同学设计了如下实验方案.
实验原理:、.
实验步骤:
ⅰ.按图安装装置(夹持仪器略去),并检查装置气密性;
ⅱ.在各仪器中加入图示试剂;
iii.调整D、E中两液面使其相平,使D中液面保持在0或略低于0刻度位置,读数并记录;
iv.将溶液全部滴入A中并搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生;
v.待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录、处理数据.
①步骤ⅲ需“调整D、E中两液面使其相平”的原因是____________________________________.
②将实验过程中测得的数据转化为的质量时,其质量为,则为_________(列出计算式).
③有同学认为用同样的装置和方法不能测定溶液的浓度,其原因为____________________________________________________________________________________.
18.(14分)常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水.实验室以含锌废液(主要成分为,含少量的、)为原料制备的实验流程如图所示:
请回答下列问题:
(1)已知中存在一个过氧键,则过二硫酸钠中元素的化合价为;“除锰”阶段被氧化的元素有_________(填元素名称).
(2)加入能“除铁”的原因:消耗使溶液调整至左右时,能使溶液中的完全转化为沉淀,则该阶段发生总反应的离子方程式为_________
(3)“沉锌”过程中通常加入.
①在水溶液中的电离方程式为___________________________
②向饱和食盐水中加入与等物质的量的固体时发生反应的化学方程式为__________________
(4)________________(填“属于”或“不属于”)盐,其与醋酸反应生成的离子方程式为____________________________________
同课章节目录
