化学人教版(2019)必修第一册2.3.3物质的量浓度课件(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.3物质的量浓度课件(共17张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-31 22:25:10 | ||
图片预览




文档简介
(共17张PPT)
第二章 海水中的重要元素——钠和氯
第三节 物质的量
第3课时 物质的量浓度
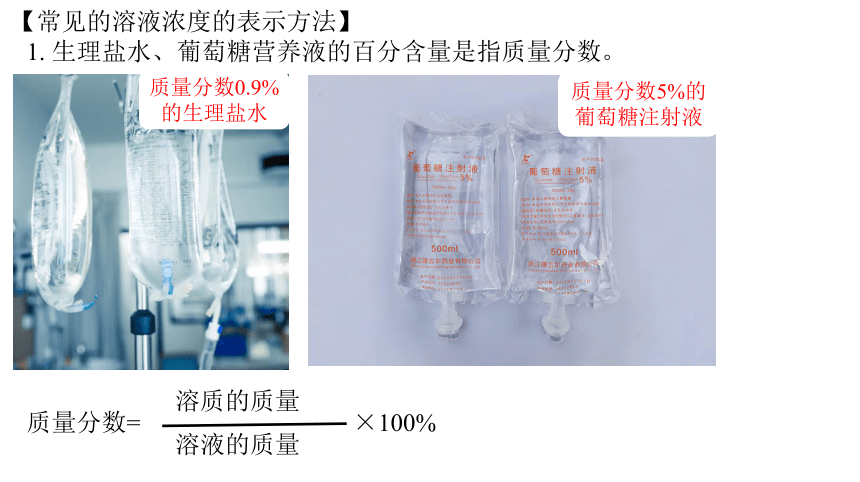
质量分数0.9%的生理盐水
1. 生理盐水、葡萄糖营养液的百分含量是指质量分数。
【常见的溶液浓度的表示方法】
质量分数5%的葡萄糖注射液
质量分数=
溶液的质量
溶质的质量
×100%
体积分数=
溶液的体积
溶质的体积
×100%
体积分数为75%的医用酒精
关于酒的小常识:
通常是以20℃时每100mL酒中乙醇的体积比表示的。
53度:100mL酒中含有53mL乙醇。
一般啤酒酒精度约为:3.5%(v/v)
2. 酒精的百分含量是指体积分数。
质量—体积浓度=
溶液的体积
溶质的质量
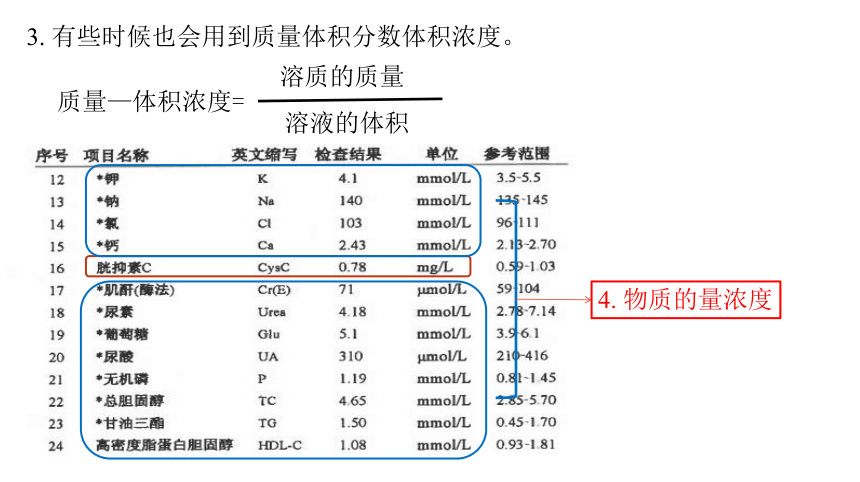
3. 有些时候也会用到质量体积分数体积浓度。
4. 物质的量浓度
【学习任务一】物质的量浓度
3、表达式:
mol/L或mol L-1
4、单位:
2、符号:cB
1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
【新概念】
cB
=
nB
V
注意:不要和气体摩尔体积的单位弄混了,意义是不同的!!!
【注意事项】
(1)体积V指的是?
(2)在一定物质的量浓度溶液中取出任意体积的溶液,取出后溶液的物质的量浓度有变化么?其所含溶质的物质的量有变化么?
溶液的体积,而不是溶剂的体积
不变,但其所含溶质的物质的量或质量会因体积的不同而改变。
【探究】根据所学知识,思考下列问题,判断正误,并说明原因。
1、将1mol NaCl溶于1L水中配成溶液,其物质的量浓度是1mol/L。
错,体积指的是溶液的体积,而不是溶剂的体积。
2、从100mL2mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度为1mol/L。
错,在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变。
正确:将1mol NaCl溶于水配制成1L的溶液,其物质的量浓度是1mol/L。
正确:取出的溶液中溶质的物质的量浓度为2mol/L
3、将22.4L的NH3溶于水配制成1L的溶液,所得溶液中溶质的物质的量浓度为1mol/L。
错,没有指明气体的温度和压强,无法计算NH3的物质的量。
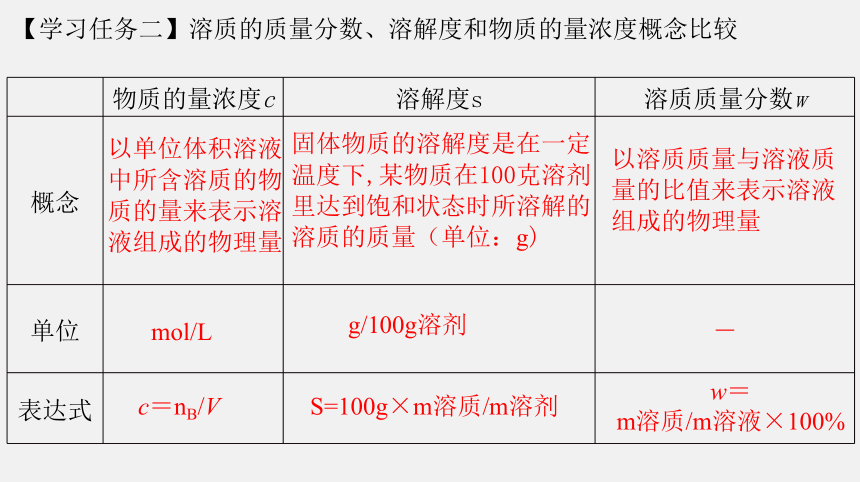
物质的量浓度c 溶解度s 溶质质量分数w
概念
单位 -
表达式
以单位体积溶液中所含溶质的物质的量来表示溶液组成的物理量
固体物质的溶解度是在一定温度下,某物质在100克溶剂里达到饱和状态时所溶解的溶质的质量(单位:g)
以溶质质量与溶液质量的比值来表示溶液组成的物理量
mol/L
g/100g溶剂
c=nB/V
w=
m溶质/m溶液×100%
S=100g×m溶质/m溶剂
【学习任务二】溶质的质量分数、溶解度和物质的量浓度概念比较
【学习任务三】有关物质的量浓度的计算
cB
=
nB
V
变式
V=
nB
cB
nB=cB V
【练习】体会物质的量浓度的计算需要经过过那些关键步骤。
1. 53.0g的Na2CO3配置成500mL溶液,所配制溶液浓度是多少?
n(Na2CO3)
=
m(Na2CO3)
M(Na2CO3)
解:
=
53g
106g/mol
=0.5mol
答:所配制溶液浓度为1mol/L。
1、根据物质的量求算
C(Na2CO3)
=
n(Na2CO3)
V[Na2CO3(aq)]
=
0.5mol
0.5L
=1mol/L
2. 从100mL的浓度为0.5mol/L的NaOH溶液中取出20mL,则取出来的溶液中含溶质物质的量是多少?
n(NaOH)=c(NaOH) V[NaOH(aq)]
解:在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变,c(NaOH)=0.5mol/L。
答:取出来的溶液中含溶质物质的量0.01mol。
= 0.5mol/L×0.02L
= 0.01mol
【思考】将一份溶液分成多份,有哪些物理量不变,有哪些物理量会变?
物质的量浓度不变,物质的量会随体积改变而改变。
3. 将配制500mL0.1mol/LNaOH溶液,需要NaOH的质量是多少
m(NaOH)=n(NaOH)· M(NaOH)=0.05mol× 40g/mol=2g
【分析】可以先通过物质的量浓度的定义,根据 nB=cB V,求得NaOH的物质的量。然后通过质量与物质的量的关系,根据m=n M,求得NaOH的质量。
课本p58
【解 】500 mL0.1mol/LNaOH溶液中NaOH的物质的量为:
n(NaOH)=c(NaOH)· V[NaOH(aq)] =0.1mol/L× 0.5L=0.05mol
0.05 mol NaOH的质量为 :
答:需要NaOH的质量是2g。
物质的量
粒子数(N)
n=N/NA
n=N/NA
质量(m)
气体体积
n=
V
Vm
【构建模型】以物质的量(n)为中心构建物质质量(m)、气体体积(V)、
粒子数(N)、物质的量浓度(C)之间的认知模型:
我们已经学习了多个公式,尝试用物质的量将他们联系起来。
物质的量浓度
nB=cB V
【思考与讨论】如果将5mL的浓硫酸稀释为20mL的稀硫酸,得到的稀硫酸与
原浓硫酸中所含H2SO4的物质的量相等吗?说明你的理由。
相等。稀释过程中,溶剂的量会减少,而溶质的物质的量没有增减。
2、有关溶液稀释的计算
(1)物质的量守恒:
n(溶质)= V(浓)×c(浓)= V(稀)×c(稀)
(2)溶质质量守恒:
m(溶质)= m(浓)×ω(浓)= m(稀)×ω(稀)
【小结】
稀释过程中存在溶质物质的量和质量守恒,浓溶液中溶质物质的量和质量等于稀溶液中溶质物质的量和质量。
3、根据质量分数求算
V(aq)
mB
MB
=
m(溶液)×ω(B)
MB×V(aq)
1000ρV(aq)×ω(B)
MB×V(aq)
=
=
结论:c=1000ρ ω/M (直接使用)
1000ρ×ω(B)
MB
=
ρ
(注意:密度(ρ )的单位为g/mL)
推导过程
c=1000ρ ω/M
【练习】1. 现有质量分数为98%、密度为1.84g/mL的硫酸溶液,求此溶液中硫酸的物质的量浓度
解:c(H2SO4)=1000ρ ω(H2SO4)/M(H2SO4)
1000mL/L×1.84g/mL×98%
=
98g/mol
=18.4mol/L
答:此溶液中硫酸的物质的量浓度18.4g/mol。
2. 若需配制250mL2.0mol/LH2SO4溶液,需要上述溶液的体积是多少
250mL×2.0mol/L=18.4mol/L×V(H2SO4)
解:根据 V(浓)×c(浓)= V(稀)×c(稀)可得:
V(H2SO4)≈27.2mL
7、(教材P57 4.)阅读并分析体检报告,可以初步判断体检者的身体状况。
(1)在图2-23所示的体检报告中,表示葡萄糖指标的物理量是______(填字母 )。
a.质量分数 b.溶解度 c.摩尔质量 d.物质的量浓度
(2)查看自己或家人的体检报告,哪些项目的指标是用物质的量浓度表示的
d
(3)检测人的血液中葡萄糖 (简称血糖 ,葡萄糖的相对分子质量为180)的含量 ,参考指标常以两种计量单位表示,即 “mmol/L” 和 “mg/dL”(1L=10dL)。 以 “mmol/L” 表示时,人的血糖正常值为3.9~6.1mmol/L。 如果以 “mg/dL”表示 ,血糖正常值范围是多少 若某人的血糖检测结果为92 mg/dL,他 (她 )的血糖正常吗
正常,3.9~6.1mmol/L 单位换算后对应70.2mg/dL~109.8mg/dL
设血液体积为VL,由题意可知:血糖最小值为3.9mmol/L;最大值为6.1mmol/L。此外,1L=10dL,1nmol=1×10-3mol 。
如果以 “mg/dL”表示 ,血糖正常值范围是70.2mg/dL~109.8mg/L;92 mg/dL为正常值。
n(血糖)=3.9mmol/L×V=3.9Vmmol=3.9V×10-3mol
m(血糖)=n M=3.9V×10-3mol×180g/mol=0.702Vg
0.702Vg÷V=0.702g/L
血糖最小值:70.2mg/dL;
同理解得血糖最大值为:109.8mg/L。
=702mg/L=70.2mg/dL
总结:
2、物质的量浓度的有关计算
(定义、单位、表达式)
(3)与质量分数的相互换算
(1)与物质的量、质量、粒子数、气体体积之间的换算关系
(2)有关溶液稀释的计算
1、物质的量浓度的概念
n(溶质)= V(浓)×c(浓)= V(稀)×c(稀)
c=1000ρ ω/M
第二章 海水中的重要元素——钠和氯
第三节 物质的量
第3课时 物质的量浓度
质量分数0.9%的生理盐水
1. 生理盐水、葡萄糖营养液的百分含量是指质量分数。
【常见的溶液浓度的表示方法】
质量分数5%的葡萄糖注射液
质量分数=
溶液的质量
溶质的质量
×100%
体积分数=
溶液的体积
溶质的体积
×100%
体积分数为75%的医用酒精
关于酒的小常识:
通常是以20℃时每100mL酒中乙醇的体积比表示的。
53度:100mL酒中含有53mL乙醇。
一般啤酒酒精度约为:3.5%(v/v)
2. 酒精的百分含量是指体积分数。
质量—体积浓度=
溶液的体积
溶质的质量
3. 有些时候也会用到质量体积分数体积浓度。
4. 物质的量浓度
【学习任务一】物质的量浓度
3、表达式:
mol/L或mol L-1
4、单位:
2、符号:cB
1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
【新概念】
cB
=
nB
V
注意:不要和气体摩尔体积的单位弄混了,意义是不同的!!!
【注意事项】
(1)体积V指的是?
(2)在一定物质的量浓度溶液中取出任意体积的溶液,取出后溶液的物质的量浓度有变化么?其所含溶质的物质的量有变化么?
溶液的体积,而不是溶剂的体积
不变,但其所含溶质的物质的量或质量会因体积的不同而改变。
【探究】根据所学知识,思考下列问题,判断正误,并说明原因。
1、将1mol NaCl溶于1L水中配成溶液,其物质的量浓度是1mol/L。
错,体积指的是溶液的体积,而不是溶剂的体积。
2、从100mL2mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度为1mol/L。
错,在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变。
正确:将1mol NaCl溶于水配制成1L的溶液,其物质的量浓度是1mol/L。
正确:取出的溶液中溶质的物质的量浓度为2mol/L
3、将22.4L的NH3溶于水配制成1L的溶液,所得溶液中溶质的物质的量浓度为1mol/L。
错,没有指明气体的温度和压强,无法计算NH3的物质的量。
物质的量浓度c 溶解度s 溶质质量分数w
概念
单位 -
表达式
以单位体积溶液中所含溶质的物质的量来表示溶液组成的物理量
固体物质的溶解度是在一定温度下,某物质在100克溶剂里达到饱和状态时所溶解的溶质的质量(单位:g)
以溶质质量与溶液质量的比值来表示溶液组成的物理量
mol/L
g/100g溶剂
c=nB/V
w=
m溶质/m溶液×100%
S=100g×m溶质/m溶剂
【学习任务二】溶质的质量分数、溶解度和物质的量浓度概念比较
【学习任务三】有关物质的量浓度的计算
cB
=
nB
V
变式
V=
nB
cB
nB=cB V
【练习】体会物质的量浓度的计算需要经过过那些关键步骤。
1. 53.0g的Na2CO3配置成500mL溶液,所配制溶液浓度是多少?
n(Na2CO3)
=
m(Na2CO3)
M(Na2CO3)
解:
=
53g
106g/mol
=0.5mol
答:所配制溶液浓度为1mol/L。
1、根据物质的量求算
C(Na2CO3)
=
n(Na2CO3)
V[Na2CO3(aq)]
=
0.5mol
0.5L
=1mol/L
2. 从100mL的浓度为0.5mol/L的NaOH溶液中取出20mL,则取出来的溶液中含溶质物质的量是多少?
n(NaOH)=c(NaOH) V[NaOH(aq)]
解:在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变,c(NaOH)=0.5mol/L。
答:取出来的溶液中含溶质物质的量0.01mol。
= 0.5mol/L×0.02L
= 0.01mol
【思考】将一份溶液分成多份,有哪些物理量不变,有哪些物理量会变?
物质的量浓度不变,物质的量会随体积改变而改变。
3. 将配制500mL0.1mol/LNaOH溶液,需要NaOH的质量是多少
m(NaOH)=n(NaOH)· M(NaOH)=0.05mol× 40g/mol=2g
【分析】可以先通过物质的量浓度的定义,根据 nB=cB V,求得NaOH的物质的量。然后通过质量与物质的量的关系,根据m=n M,求得NaOH的质量。
课本p58
【解 】500 mL0.1mol/LNaOH溶液中NaOH的物质的量为:
n(NaOH)=c(NaOH)· V[NaOH(aq)] =0.1mol/L× 0.5L=0.05mol
0.05 mol NaOH的质量为 :
答:需要NaOH的质量是2g。
物质的量
粒子数(N)
n=N/NA
n=N/NA
质量(m)
气体体积
n=
V
Vm
【构建模型】以物质的量(n)为中心构建物质质量(m)、气体体积(V)、
粒子数(N)、物质的量浓度(C)之间的认知模型:
我们已经学习了多个公式,尝试用物质的量将他们联系起来。
物质的量浓度
nB=cB V
【思考与讨论】如果将5mL的浓硫酸稀释为20mL的稀硫酸,得到的稀硫酸与
原浓硫酸中所含H2SO4的物质的量相等吗?说明你的理由。
相等。稀释过程中,溶剂的量会减少,而溶质的物质的量没有增减。
2、有关溶液稀释的计算
(1)物质的量守恒:
n(溶质)= V(浓)×c(浓)= V(稀)×c(稀)
(2)溶质质量守恒:
m(溶质)= m(浓)×ω(浓)= m(稀)×ω(稀)
【小结】
稀释过程中存在溶质物质的量和质量守恒,浓溶液中溶质物质的量和质量等于稀溶液中溶质物质的量和质量。
3、根据质量分数求算
V(aq)
mB
MB
=
m(溶液)×ω(B)
MB×V(aq)
1000ρV(aq)×ω(B)
MB×V(aq)
=
=
结论:c=1000ρ ω/M (直接使用)
1000ρ×ω(B)
MB
=
ρ
(注意:密度(ρ )的单位为g/mL)
推导过程
c=1000ρ ω/M
【练习】1. 现有质量分数为98%、密度为1.84g/mL的硫酸溶液,求此溶液中硫酸的物质的量浓度
解:c(H2SO4)=1000ρ ω(H2SO4)/M(H2SO4)
1000mL/L×1.84g/mL×98%
=
98g/mol
=18.4mol/L
答:此溶液中硫酸的物质的量浓度18.4g/mol。
2. 若需配制250mL2.0mol/LH2SO4溶液,需要上述溶液的体积是多少
250mL×2.0mol/L=18.4mol/L×V(H2SO4)
解:根据 V(浓)×c(浓)= V(稀)×c(稀)可得:
V(H2SO4)≈27.2mL
7、(教材P57 4.)阅读并分析体检报告,可以初步判断体检者的身体状况。
(1)在图2-23所示的体检报告中,表示葡萄糖指标的物理量是______(填字母 )。
a.质量分数 b.溶解度 c.摩尔质量 d.物质的量浓度
(2)查看自己或家人的体检报告,哪些项目的指标是用物质的量浓度表示的
d
(3)检测人的血液中葡萄糖 (简称血糖 ,葡萄糖的相对分子质量为180)的含量 ,参考指标常以两种计量单位表示,即 “mmol/L” 和 “mg/dL”(1L=10dL)。 以 “mmol/L” 表示时,人的血糖正常值为3.9~6.1mmol/L。 如果以 “mg/dL”表示 ,血糖正常值范围是多少 若某人的血糖检测结果为92 mg/dL,他 (她 )的血糖正常吗
正常,3.9~6.1mmol/L 单位换算后对应70.2mg/dL~109.8mg/dL
设血液体积为VL,由题意可知:血糖最小值为3.9mmol/L;最大值为6.1mmol/L。此外,1L=10dL,1nmol=1×10-3mol 。
如果以 “mg/dL”表示 ,血糖正常值范围是70.2mg/dL~109.8mg/L;92 mg/dL为正常值。
n(血糖)=3.9mmol/L×V=3.9Vmmol=3.9V×10-3mol
m(血糖)=n M=3.9V×10-3mol×180g/mol=0.702Vg
0.702Vg÷V=0.702g/L
血糖最小值:70.2mg/dL;
同理解得血糖最大值为:109.8mg/L。
=702mg/L=70.2mg/dL
总结:
2、物质的量浓度的有关计算
(定义、单位、表达式)
(3)与质量分数的相互换算
(1)与物质的量、质量、粒子数、气体体积之间的换算关系
(2)有关溶液稀释的计算
1、物质的量浓度的概念
n(溶质)= V(浓)×c(浓)= V(稀)×c(稀)
c=1000ρ ω/M
