2024鲁教版化学必修第二册练习题--分层作业4 元素周期律(含解析)
文档属性
| 名称 | 2024鲁教版化学必修第二册练习题--分层作业4 元素周期律(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 343.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 11:15:07 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024鲁教版化学必修第二册练习题
第1章分层作业4 元素周期律
A级 必备知识基础练
1.某元素R的最高正化合价与最低负化合价的绝对值之差为2,其气态氢化物中含氢的质量分数为8.8%,试推断该元素是( )
A.N B.P
C.S D.O
2.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期序数与族序数相同;d与a同族。下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d的族序数最小
3.下列微粒半径大小的比较中,正确的是( )
A.Na+B.S2->Cl->Na+>Al3+
C.NaD.Cs4.某元素最高价氧化物对应水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A.HX
B.H2X
C.XH3
D.XH4
5.下列关于物质性质的比较,正确的是( )
A.酸性:HClO4B.碱性:NaOHC.氧化性:Cl2>Br2>I2
D.金属性:Li>Na>K
6.下列粒子半径之比大于1的是( )
A.
B.
C.
D.
7.下列有关原子序数的说法不正确的是( )
A.原子序数=原子核内的质子数=原子核外的电子数
B.简单阳离子对应的原子序数=阳离子核外电子数+电荷数
C.简单阴离子对应的原子序数=阴离子核外电子数-电荷数
D.原子序数=相对原子质量-中子数
8.(2023福建南平高一校考阶段练习)元素性质呈现周期性变化规律的根本原因是( )
A.核电荷数依次增大
B.元素的相对原子质量逐渐增大
C.元素化合价呈周期性变化
D.元素原子核外电子排布呈现周期性变化
9.已知X、Y为原子序数在1~18之间的两种元素,原子序数X>Y,且X、Y的最高化合价与其最低化合价绝对值相等,填写下列空白(用元素符号或化学式填空):
(1)X是 ,Y是 ,原子半径X (填“>”或“<”)Y。
(2)X、Y的简单氢化物的化学式分别为 ;最高价氧化物的化学式分别为 。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
10.元素X的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。X元素可能为( )
A.Al B.P
C.Ar D.K
11.X、Y、Z均为短周期主族元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子的最外层电子数:X>Y>Z
B.阴离子还原性:X2-C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
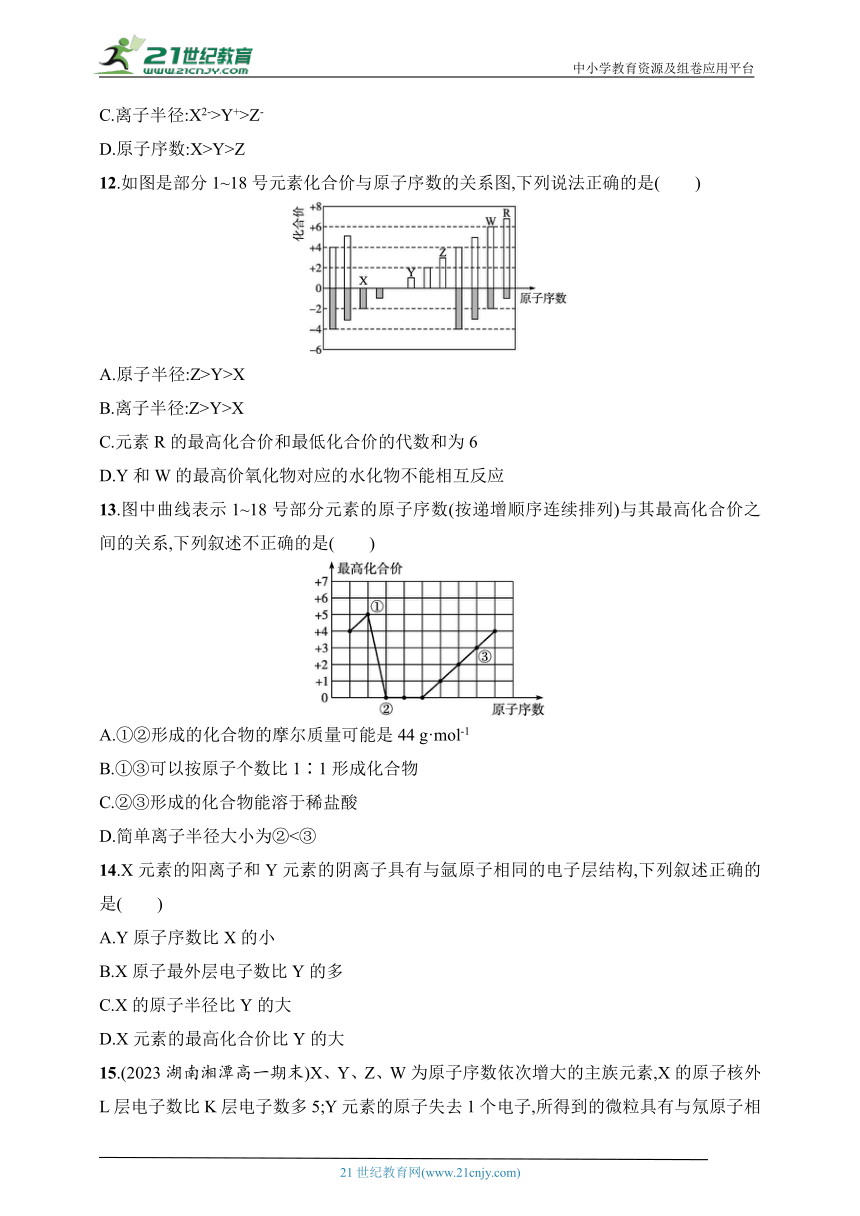
12.如图是部分1~18号元素化合价与原子序数的关系图,下列说法正确的是( )
A.原子半径:Z>Y>X
B.离子半径:Z>Y>X
C.元素R的最高化合价和最低化合价的代数和为6
D.Y和W的最高价氧化物对应的水化物不能相互反应
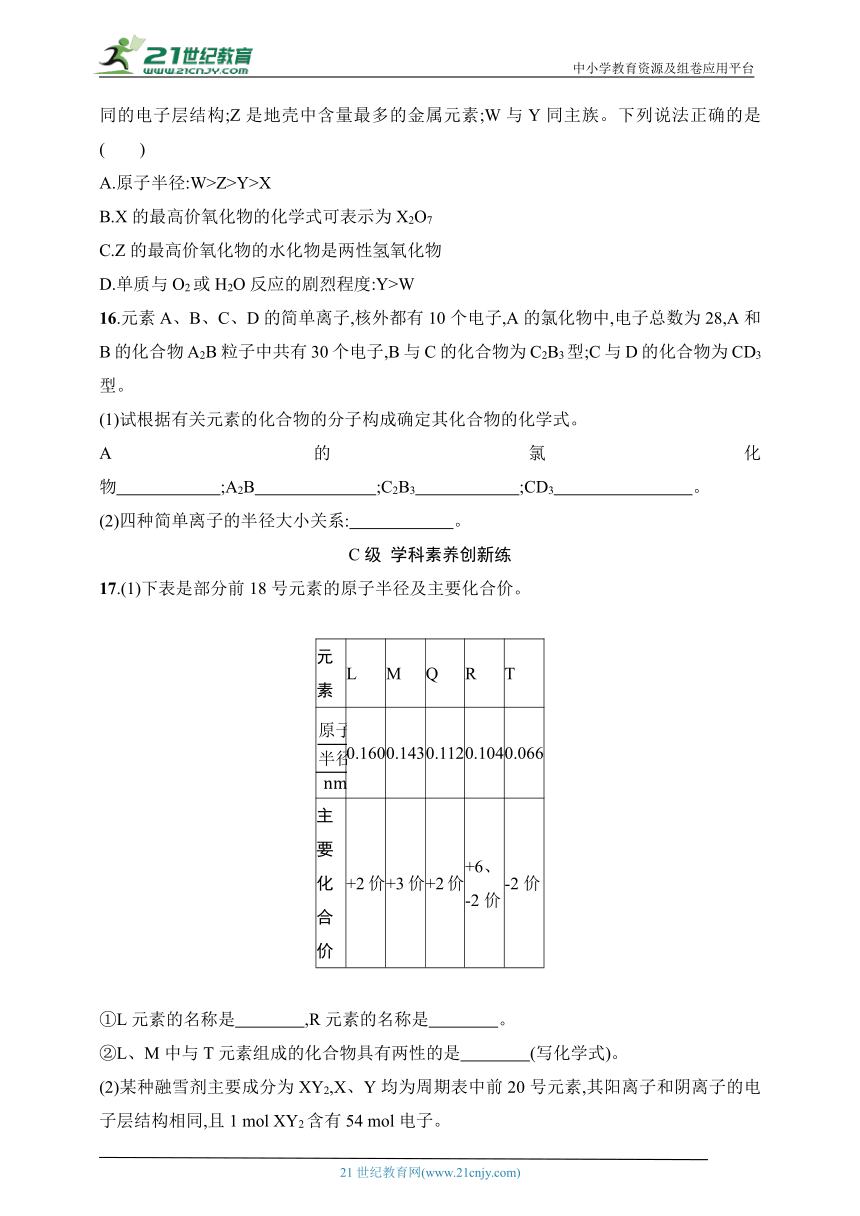
13.图中曲线表示1~18号部分元素的原子序数(按递增顺序连续排列)与其最高化合价之间的关系,下列叙述不正确的是( )
A.①②形成的化合物的摩尔质量可能是44 g·mol-1
B.①③可以按原子个数比1∶1形成化合物
C.②③形成的化合物能溶于稀盐酸
D.简单离子半径大小为②<③
14.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
A.Y原子序数比X的小
B.X原子最外层电子数比Y的多
C.X的原子半径比Y的大
D.X元素的最高化合价比Y的大
15.(2023湖南湘潭高一期末)X、Y、Z、W为原子序数依次增大的主族元素,X的原子核外L层电子数比K层电子数多5;Y元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构;Z是地壳中含量最多的金属元素;W与Y同主族。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.X的最高价氧化物的化学式可表示为X2O7
C.Z的最高价氧化物的水化物是两性氢氧化物
D.单质与O2或H2O反应的剧烈程度:Y>W
16.元素A、B、C、D的简单离子,核外都有10个电子,A的氯化物中,电子总数为28,A和B的化合物A2B粒子中共有30个电子,B与C的化合物为C2B3型;C与D的化合物为CD3型。
(1)试根据有关元素的化合物的分子构成确定其化合物的化学式。
A的氯化物 ;A2B ;C2B3 ;CD3 。
(2)四种简单离子的半径大小关系: 。
C级 学科素养创新练
17.(1)下表是部分前18号元素的原子半径及主要化合价。
元素 L M Q R T
0.160 0.143 0.112 0.104 0.066
主要化合价 +2价 +3价 +2价 +6、 -2价 -2价
①L元素的名称是 ,R元素的名称是 。
②L、M中与T元素组成的化合物具有两性的是 (写化学式)。
(2)某种融雪剂主要成分为XY2,X、Y均为周期表中前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
①该融雪剂主要成分的化学式为 。
②元素D、E原子的最外层电子数是相应原子电子层数的2倍,D与Y相邻,D元素是 ,E元素是 。
分层作业4 元素周期律
1.B 2.B 3.B 4.B
5.C 解析 非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,A错误;金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,B错误;非金属性:Cl>Br>I,则单质的氧化性:Cl2>Br2>I2,C正确;同主族元素自上而下,金属性逐渐增强,则金属性:Li6.C 解析 Al、Na电子层数相同,核电荷数前者大,则r(Al)1,C项正确;同种元素的阳离子半径小于原子半径,则<1,D项错误。
7.D 解析 根据原子序数的定义可知,A正确;原子失去电子形成阳离子,故简单阳离子对应的原子序数=阳离子核外电子数+电荷数,B正确;原子得到电子形成阴离子,故简单阴离子对应的原子序数=阴离子核外电子数-电荷数,C正确;原子序数=质子数=质量数-中子数,D错误。
8.D 解析 元素性质呈现周期性变化规律的根本原因是元素原子核外电子排布呈现周期性变化,故选D。
9.答案 (1)Si C > (2)SiH4、CH4 SiO2、CO2
解析 X、Y的最高化合价等于其最低化合价的绝对值,且原子序数在1~18之间,根据最高化合价+|最低化合价|=8可知X、Y的最高化合价为+4价,即二者原子最外层电子数均为4,则为C、Si;由原子序数X>Y可知,X为Si,Y为C。
10.D 解析 由X形成的离子与Ca2+核外电子排布相同,可排除Al、Ar;由X的离子半径小于S2-的半径可知,X元素可能为钾。
11.D 解析 X、Y、Z分别为S元素、Na元素、F元素,原子最外层电子数分别为6、1、7,即原子最外层电子数:Z>X>Y,故A错误;单质的非金属性越强,氧化性越强,其离子的还原性越弱,氧化性:F2>S,则还原性:S2->F-,故B错误;Na+、F-具有相同的核外电子排布,离子的核电荷数越大,半径越小,则F->Na+,S2-电子层最多,离子半径最大,故离子半径:S2->F->Na+,故C错误;X、Y、Z的原子序数分别为16、11、9,则原子序数:X>Y>Z,故D正确。
12.C
13.D 解析 ①的最高化合价为+5价,②的最高化合价为0价,③的最高化合价为+3价,结合原子序数可知,①为氮元素,②为氧元素,③为铝元素。①②形成的化合物N2O的摩尔质量是44 g·mol-1,A正确;①③可以形成化合物AlN,原子个数比为1∶1,B正确;②③形成的化合物Al2O3能与稀盐酸反应,C正确;核外电子排布相同的离子,原子序数越大,离子半径越小,则简单离子半径:O2->Al3+,D错误。
14.AC 解析 Xn+、Ym-与Ar具有相同的电子层结构,其原子序数:X>Ar>Y,A项正确;X原子最外层电子数比Y的少,B项错误;X的原子半径比Y的大,C项正确;X元素的最高化合价比Y的小,D项错误。
15.C 解析 X的原子核外L层电子数比K层电子数多5,故X为F;Y元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构,则Y为Na;Z是地壳中含量最多的金属元素,则Z为Al;W与Y同主族,则W为K。一般电子层数相同,核电荷数越多半径越小,故Na>Al,A错误;F无正化合价,不存在氧化物,B错误;氢氧化铝是两性氢氧化物,C正确;K的金属性强于Na,故与O2或H2O反应更剧烈,D错误。
16.答案 (1)NaCl Na2O Al2O3 AlF3
(2)O2->F->Na+>Al3+
解析 由元素A、B、C、D的离子核外都有10个电子可知,A、B、C、D是C、N、O、F、Na、Mg、Al中的四种元素。设A的氯化物分子式为AClx,因其电子总数为28,只有x=1时合理,可确定A为钠元素。A与B元素形成的化合物为Na2B,该粒子的电子总数为30,可得B元素原子有8个电子,B是氧元素。B与C两种元素形成的化合物为C2O3,可知C为铝元素。C与D两种元素形成的化合物为AlD3,可得D为氟元素。四种离子核外电子排布相同,核电荷数越大,离子半径越小,故r(O2-)>r(F-)>r(Na+)>r(Al3+)。
17.答案 (1)①镁 硫 ②Al2O3 (2)①CaCl2 ②S C或He
解析 (1)根据主要化合价可知,L、Q最外层有2个电子,根据原子半径特点,Q是Be,L是Mg,M是Al;T只有-2价,则T是O,R是S。Al与O形成的Al2O3具有两性。
(2)XY2中1 mol离子含有电子54 mol×=18 mol,又结合X、Y均为周期表中前20号元素,则X是Ca,Y是Cl,XY2是CaCl2。对于D、E元素来说,如果有1个电子层,最外层有2个电子,则是He;若有2个电子层,最外层有4个电子,则是C;如果有3个电子层,最外层有6个电子,则是S;据题意,D与Cl相邻,则D是S,E是C或He。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版化学必修第二册练习题
第1章分层作业4 元素周期律
A级 必备知识基础练
1.某元素R的最高正化合价与最低负化合价的绝对值之差为2,其气态氢化物中含氢的质量分数为8.8%,试推断该元素是( )
A.N B.P
C.S D.O
2.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期序数与族序数相同;d与a同族。下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d的族序数最小
3.下列微粒半径大小的比较中,正确的是( )
A.Na+
C.Na
A.HX
B.H2X
C.XH3
D.XH4
5.下列关于物质性质的比较,正确的是( )
A.酸性:HClO4
D.金属性:Li>Na>K
6.下列粒子半径之比大于1的是( )
A.
B.
C.
D.
7.下列有关原子序数的说法不正确的是( )
A.原子序数=原子核内的质子数=原子核外的电子数
B.简单阳离子对应的原子序数=阳离子核外电子数+电荷数
C.简单阴离子对应的原子序数=阴离子核外电子数-电荷数
D.原子序数=相对原子质量-中子数
8.(2023福建南平高一校考阶段练习)元素性质呈现周期性变化规律的根本原因是( )
A.核电荷数依次增大
B.元素的相对原子质量逐渐增大
C.元素化合价呈周期性变化
D.元素原子核外电子排布呈现周期性变化
9.已知X、Y为原子序数在1~18之间的两种元素,原子序数X>Y,且X、Y的最高化合价与其最低化合价绝对值相等,填写下列空白(用元素符号或化学式填空):
(1)X是 ,Y是 ,原子半径X (填“>”或“<”)Y。
(2)X、Y的简单氢化物的化学式分别为 ;最高价氧化物的化学式分别为 。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
10.元素X的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。X元素可能为( )
A.Al B.P
C.Ar D.K
11.X、Y、Z均为短周期主族元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子的最外层电子数:X>Y>Z
B.阴离子还原性:X2-
D.原子序数:X>Y>Z
12.如图是部分1~18号元素化合价与原子序数的关系图,下列说法正确的是( )
A.原子半径:Z>Y>X
B.离子半径:Z>Y>X
C.元素R的最高化合价和最低化合价的代数和为6
D.Y和W的最高价氧化物对应的水化物不能相互反应
13.图中曲线表示1~18号部分元素的原子序数(按递增顺序连续排列)与其最高化合价之间的关系,下列叙述不正确的是( )
A.①②形成的化合物的摩尔质量可能是44 g·mol-1
B.①③可以按原子个数比1∶1形成化合物
C.②③形成的化合物能溶于稀盐酸
D.简单离子半径大小为②<③
14.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
A.Y原子序数比X的小
B.X原子最外层电子数比Y的多
C.X的原子半径比Y的大
D.X元素的最高化合价比Y的大
15.(2023湖南湘潭高一期末)X、Y、Z、W为原子序数依次增大的主族元素,X的原子核外L层电子数比K层电子数多5;Y元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构;Z是地壳中含量最多的金属元素;W与Y同主族。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.X的最高价氧化物的化学式可表示为X2O7
C.Z的最高价氧化物的水化物是两性氢氧化物
D.单质与O2或H2O反应的剧烈程度:Y>W
16.元素A、B、C、D的简单离子,核外都有10个电子,A的氯化物中,电子总数为28,A和B的化合物A2B粒子中共有30个电子,B与C的化合物为C2B3型;C与D的化合物为CD3型。
(1)试根据有关元素的化合物的分子构成确定其化合物的化学式。
A的氯化物 ;A2B ;C2B3 ;CD3 。
(2)四种简单离子的半径大小关系: 。
C级 学科素养创新练
17.(1)下表是部分前18号元素的原子半径及主要化合价。
元素 L M Q R T
0.160 0.143 0.112 0.104 0.066
主要化合价 +2价 +3价 +2价 +6、 -2价 -2价
①L元素的名称是 ,R元素的名称是 。
②L、M中与T元素组成的化合物具有两性的是 (写化学式)。
(2)某种融雪剂主要成分为XY2,X、Y均为周期表中前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
①该融雪剂主要成分的化学式为 。
②元素D、E原子的最外层电子数是相应原子电子层数的2倍,D与Y相邻,D元素是 ,E元素是 。
分层作业4 元素周期律
1.B 2.B 3.B 4.B
5.C 解析 非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,A错误;金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,B错误;非金属性:Cl>Br>I,则单质的氧化性:Cl2>Br2>I2,C正确;同主族元素自上而下,金属性逐渐增强,则金属性:Li
7.D 解析 根据原子序数的定义可知,A正确;原子失去电子形成阳离子,故简单阳离子对应的原子序数=阳离子核外电子数+电荷数,B正确;原子得到电子形成阴离子,故简单阴离子对应的原子序数=阴离子核外电子数-电荷数,C正确;原子序数=质子数=质量数-中子数,D错误。
8.D 解析 元素性质呈现周期性变化规律的根本原因是元素原子核外电子排布呈现周期性变化,故选D。
9.答案 (1)Si C > (2)SiH4、CH4 SiO2、CO2
解析 X、Y的最高化合价等于其最低化合价的绝对值,且原子序数在1~18之间,根据最高化合价+|最低化合价|=8可知X、Y的最高化合价为+4价,即二者原子最外层电子数均为4,则为C、Si;由原子序数X>Y可知,X为Si,Y为C。
10.D 解析 由X形成的离子与Ca2+核外电子排布相同,可排除Al、Ar;由X的离子半径小于S2-的半径可知,X元素可能为钾。
11.D 解析 X、Y、Z分别为S元素、Na元素、F元素,原子最外层电子数分别为6、1、7,即原子最外层电子数:Z>X>Y,故A错误;单质的非金属性越强,氧化性越强,其离子的还原性越弱,氧化性:F2>S,则还原性:S2->F-,故B错误;Na+、F-具有相同的核外电子排布,离子的核电荷数越大,半径越小,则F->Na+,S2-电子层最多,离子半径最大,故离子半径:S2->F->Na+,故C错误;X、Y、Z的原子序数分别为16、11、9,则原子序数:X>Y>Z,故D正确。
12.C
13.D 解析 ①的最高化合价为+5价,②的最高化合价为0价,③的最高化合价为+3价,结合原子序数可知,①为氮元素,②为氧元素,③为铝元素。①②形成的化合物N2O的摩尔质量是44 g·mol-1,A正确;①③可以形成化合物AlN,原子个数比为1∶1,B正确;②③形成的化合物Al2O3能与稀盐酸反应,C正确;核外电子排布相同的离子,原子序数越大,离子半径越小,则简单离子半径:O2->Al3+,D错误。
14.AC 解析 Xn+、Ym-与Ar具有相同的电子层结构,其原子序数:X>Ar>Y,A项正确;X原子最外层电子数比Y的少,B项错误;X的原子半径比Y的大,C项正确;X元素的最高化合价比Y的小,D项错误。
15.C 解析 X的原子核外L层电子数比K层电子数多5,故X为F;Y元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构,则Y为Na;Z是地壳中含量最多的金属元素,则Z为Al;W与Y同主族,则W为K。一般电子层数相同,核电荷数越多半径越小,故Na>Al,A错误;F无正化合价,不存在氧化物,B错误;氢氧化铝是两性氢氧化物,C正确;K的金属性强于Na,故与O2或H2O反应更剧烈,D错误。
16.答案 (1)NaCl Na2O Al2O3 AlF3
(2)O2->F->Na+>Al3+
解析 由元素A、B、C、D的离子核外都有10个电子可知,A、B、C、D是C、N、O、F、Na、Mg、Al中的四种元素。设A的氯化物分子式为AClx,因其电子总数为28,只有x=1时合理,可确定A为钠元素。A与B元素形成的化合物为Na2B,该粒子的电子总数为30,可得B元素原子有8个电子,B是氧元素。B与C两种元素形成的化合物为C2O3,可知C为铝元素。C与D两种元素形成的化合物为AlD3,可得D为氟元素。四种离子核外电子排布相同,核电荷数越大,离子半径越小,故r(O2-)>r(F-)>r(Na+)>r(Al3+)。
17.答案 (1)①镁 硫 ②Al2O3 (2)①CaCl2 ②S C或He
解析 (1)根据主要化合价可知,L、Q最外层有2个电子,根据原子半径特点,Q是Be,L是Mg,M是Al;T只有-2价,则T是O,R是S。Al与O形成的Al2O3具有两性。
(2)XY2中1 mol离子含有电子54 mol×=18 mol,又结合X、Y均为周期表中前20号元素,则X是Ca,Y是Cl,XY2是CaCl2。对于D、E元素来说,如果有1个电子层,最外层有2个电子,则是He;若有2个电子层,最外层有4个电子,则是C;如果有3个电子层,最外层有6个电子,则是S;据题意,D与Cl相邻,则D是S,E是C或He。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
