2024鲁教版化学必修第二册练习题--分层作业10 化学反应能量转化的重要应用——化学电池(含解析)
文档属性
| 名称 | 2024鲁教版化学必修第二册练习题--分层作业10 化学反应能量转化的重要应用——化学电池(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 654.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 11:21:07 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024鲁教版化学必修第二册练习题
第2章分层作业10 化学反应能量转化的重要应用——化学电池
A级 必备知识基础练
1.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是( )
2.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述不正确的是( )
A.碱性锌锰干电池比普通锌锰干电池的能量高
B.锌锰干电池工作一段时间后碳棒质量不变
C.燃料电池可连续不断地将热能直接转变为电能
D.原电池是利用氧化还原反应将化学能直接转化为电能的装置
3.某普通锌锰干电池的结构如图所示。下列说法正确的是( )
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨沿电解质溶液流向锌筒
4.某原电池总反应的离子方程式是Zn+Cu2+Zn2++Cu,则该反应的原电池组成正确的是( )
选项 A B C D
正极 Zn Cu Ag Cu
负极 Cu Zn Cu Fe
电解质溶液 CuCl2 溶液 CuSO4 溶液 H2SO4 溶液 ZnCl2 溶液
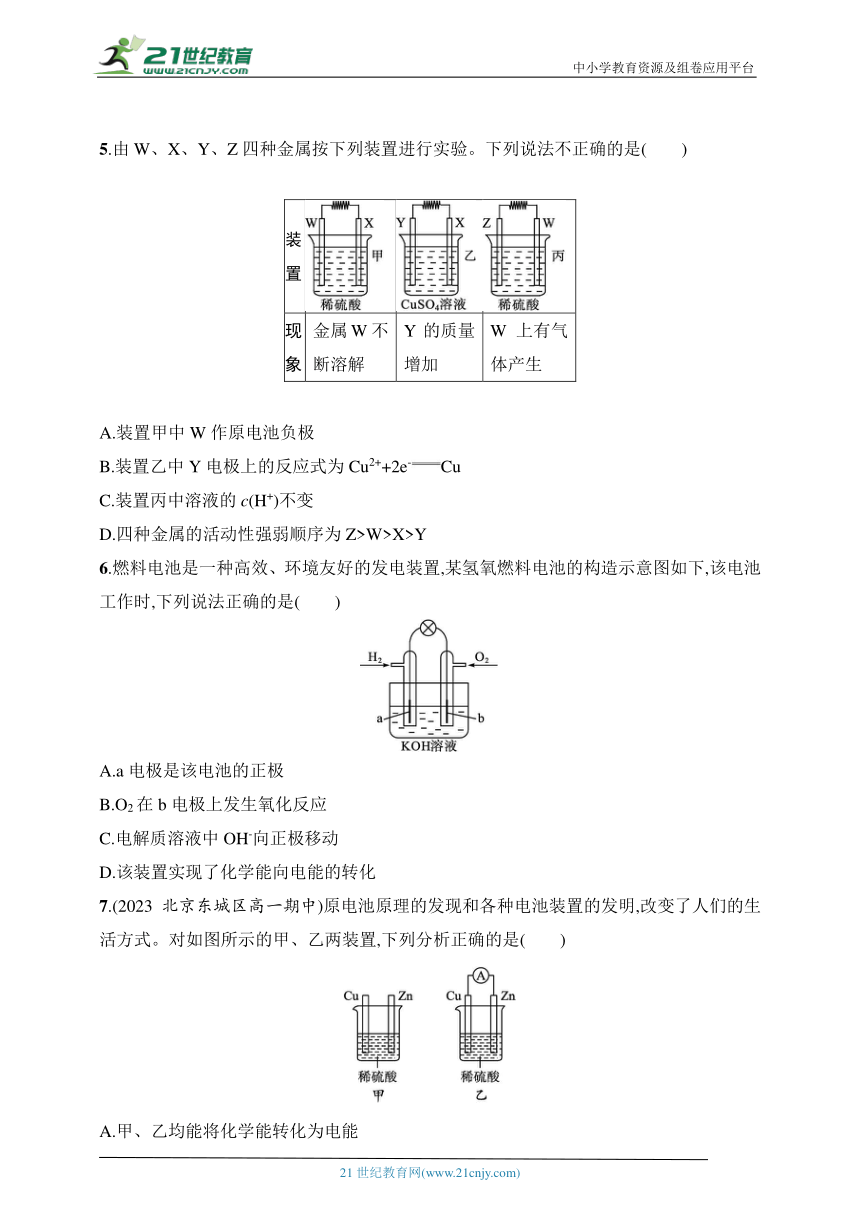
5.由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是( )
装置
现象 金属W不断溶解 Y的质量增加 W上有气体产生
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e-Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
6.燃料电池是一种高效、环境友好的发电装置,某氢氧燃料电池的构造示意图如下,该电池工作时,下列说法正确的是( )
A.a电极是该电池的正极
B.O2在b电极上发生氧化反应
C.电解质溶液中OH-向正极移动
D.该装置实现了化学能向电能的转化
7.(2023北京东城区高一期中)原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。对如图所示的甲、乙两装置,下列分析正确的是( )
A.甲、乙均能将化学能转化为电能
B.甲、乙中铜片上均有气泡产生
C.甲、乙中铜片上均发生氧化反应
D.甲、乙中均能发生的反应是Zn+2H+Zn2++H2↑
8.(2022湖南卷)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( )
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
9.现有如下两个反应:
①KOH+HNO3KNO3+H2O
②H2SO4+ZnZnSO4+H2↑
(1)根据两反应的本质判断能否设计成原电池:
① ,② 。
(2)如果不能,说明其原因: 。
(3)如果可以,则写出作原电池正极材料的名称: ,电极反应:负极 ;正极 。
(4)在铜锌原电池中,以稀硫酸为电解质溶液,若工作一段时间后,锌片的质量减少了32.5 g,则铜片表面析出了氢气 (标准状况下),导线中通过 mol电子。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
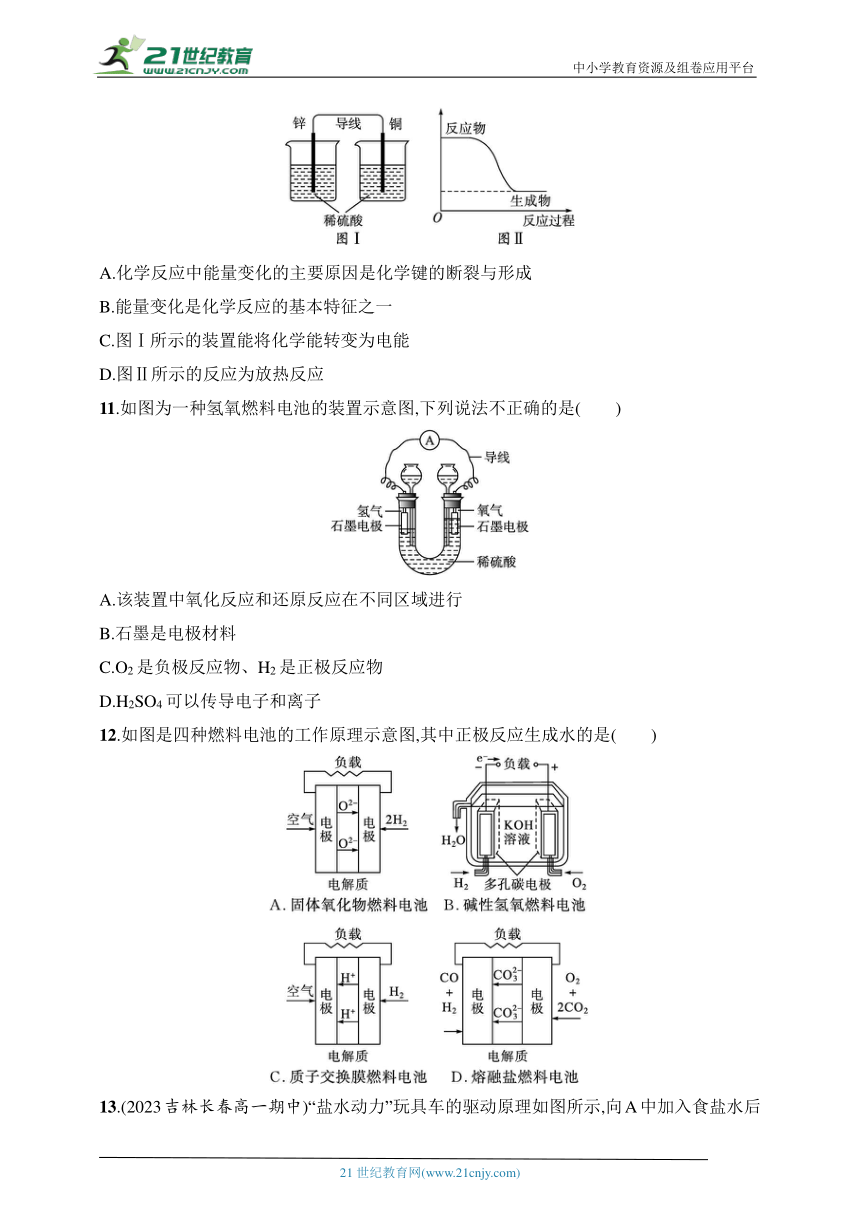
10.化学能可与热能、电能等相互转化。下列表述不正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.能量变化是化学反应的基本特征之一
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为放热反应
11.如图为一种氢氧燃料电池的装置示意图,下列说法不正确的是( )
A.该装置中氧化反应和还原反应在不同区域进行
B.石墨是电极材料
C.O2是负极反应物、H2是正极反应物
D.H2SO4可以传导电子和离子
12.如图是四种燃料电池的工作原理示意图,其中正极反应生成水的是( )
13.(2023吉林长春高一期中)“盐水动力”玩具车的驱动原理如图所示,向A中加入食盐水后便可驱动玩具车行驶。加入食盐水后,下列有关叙述不正确的是( )
A.实现了化学能向电能的转化
B.Mg作正极,不断地被消耗
C.活性炭作正极,Na+向活性炭电极移动
D.该玩具车的驱动能源运用了原电池原理
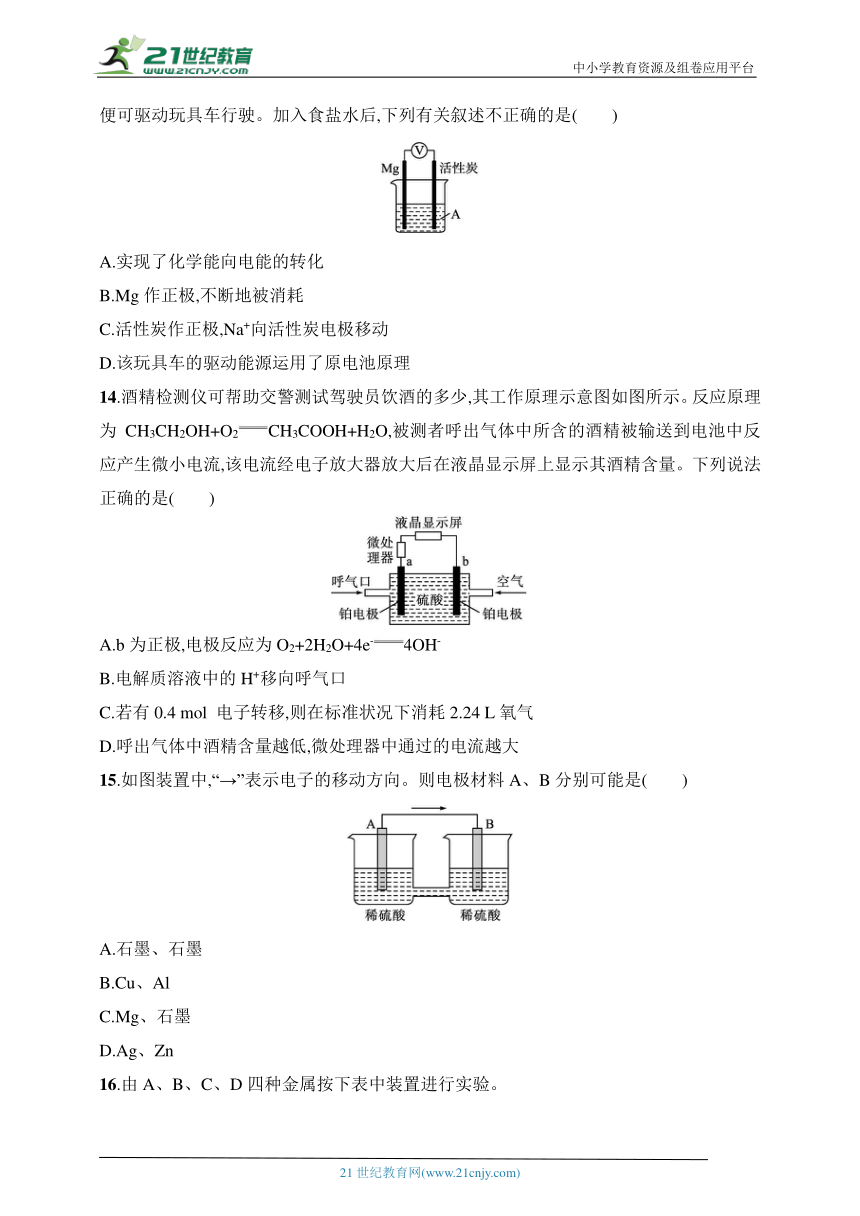
14.酒精检测仪可帮助交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为CH3CH2OH+O2CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
A.b为正极,电极反应为O2+2H2O+4e-4OH-
B.电解质溶液中的H+移向呼气口
C.若有0.4 mol 电子转移,则在标准状况下消耗2.24 L氧气
D.呼出气体中酒精含量越低,微处理器中通过的电流越大
15.如图装置中,“→”表示电子的移动方向。则电极材料A、B分别可能是( )
A.石墨、石墨
B.Cu、Al
C.Mg、石墨
D.Ag、Zn
16.由A、B、C、D四种金属按下表中装置进行实验。
装置
现象 金属A 不断溶解 C的质量 增加 A上有 气体产生
根据实验现象回答下列问题:
(1)装置甲中作为正极的是 (填“A”或“B”)。
(2)装置乙中C电极的反应为 ;装置乙中反应一段时间后,测得C电极的质量增加12.8 g,则该电池反应转移电子的物质的量为 mol。
(3)装置丙中金属A上电极反应属于 (填“氧化反应”或“还原反应”)。
(4)四种金属活动性由强到弱的顺序是 。
C级 学科素养创新练
17.(1)为了验证Fe2+与Cu2+氧化性的强弱,下列装置能达到实验目的的是 ,能达到目的的装置中正极的电极反应为 。若开始时原电池中两个电极的质量相等,当导线中通过0.05 mol 电子时,两个电极的质量差为 。
(2)将CH4与O2的反应设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
①实验测得OH-向B电极移动,则 (填“A”或“B”)处电极入口通甲烷。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为 。
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应为 ;放电时每转移3 mol电子,有 mol K2FeO4被还原,正极附近溶液的碱性 (填“增强”“不变”或“减弱”)。
分层作业10 化学反应能量转化的重要应用——化学电池
1.C 2.C 3.C 4.B
5.C 解析 装置甲中W不断溶解,说明W作原电池负极,金属的活动性W>X,A项正确;装置乙中Y电极为正极,其电极反应式为Cu2++2e-Cu,金属的活动性X>Y,B项正确;装置丙中溶液中有氢气产生,故c(H+)减小,金属的活动性Z>W,C项错误;四种金属的活动性强弱顺序为Z>W>X>Y,D项正确。
6.D
7.D 解析 装置甲中Cu、Zn未通过导线连接(或接触),不能形成闭合回路,不能实现化学能转化为电能,A错误;甲中Cu是不活泼金属,与稀硫酸不反应,铜片表面不产生气泡,B、C错误;甲中Zn与稀硫酸反应生成ZnSO4和H2,乙中形成原电池,Zn作负极,电池总反应为Zn+2H+Zn2++H2↑,D正确。
8.B 解析 海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,A正确。锂-海水电池的总反应为4Li+2H2O+O24LiOH,M极上Li失去电子发生氧化反应,则M电极为负极,电极反应为Li-e-Li+,N极为正极,电极反应为O2+2H2O+4e-4OH-,B错误。Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,C正确。该电池以海水为电解质溶液,海水源源不断,不需要另加电解质溶液,该电池不可充电,属于一次电池,D正确。
9.答案 (1)不能 能 (2)①反应是非氧化还原反应,没有电子转移 (3)石墨或铜片(合理即可) Zn-2e-Zn2+ 2H++2e-H2↑ (4)11.2 L 1
解析 (1)①反应中各元素化合价不变,不属于氧化还原反应,属于复分解反应,所以不能设计成原电池;②反应中锌元素化合价由0价变为+2价,氢元素化合价由+1价变为0价,且该反应是放热反应,能自发进行,所以能设计成原电池。
(2)①反应是非氧化还原反应,没有电子转移,所以不能设计成原电池。
(3)由反应②可知,Zn作负极,不如锌活泼的金属或能导电的非金属作正极,如碳棒或铜片,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电极反应分别为:负极:Zn-2e-Zn2+,正极:2H++2e-H2↑。
(4)锌失电子的物质的量=×2=1 mol,根据电子守恒可得标准状况下生成氢气的体积=×22.4 L·mol-1=11.2 L;根据Zn-2e-Zn2+得转移电子的物质的量=×2=1 mol。
10.C 解析 化学反应中能量变化的主要原因是化学键的断裂与形成,因为断裂旧键要吸收能量,形成新键要放出能量,A项正确;能量变化是化学反应的基本特征之一,B项正确;题图Ⅰ所示的装置没有构成闭合回路,不是原电池,不能将化学能转变为电能,C项错误;题图Ⅱ所示的反应中,反应物的总能量高于生成物的总能量,故其为放热反应,D项正确。
11.CD
12.C 解析 固体氧化物燃料电池中正极通入空气,负极通入氢气,正极的电极反应为O2+4e-2,正极没有水生成,故A不符合题意;碱性氢氧燃料电池中正极通入氧气,负极通入氢气,正极的电极反应为O2+2H2O+4e-4OH-,正极没有水生成,故B不符合题意;质子交换膜燃料电池中正极通入空气,负极通入氢气,正极的电极反应为O2+4H++4e-2H2O,正极生成了水,故C符合题意;熔融盐燃料电池中正极通入氧气和二氧化碳,负极通入一氧化碳和氢气,正极的电极反应为O2+2CO2+4e-2C,正极没有水生成,故D不符合题意。
13.B 解析 镁与活性炭相连插入食盐水中形成原电池,将化学能转化为电能,可为玩具车提供电能,运用了原电池原理,A、D正确;Mg作负极,加食盐水后,Mg发生氧化反应生成Mg2+,不断被消耗,B错误;原电池中阳离子移向正极,活性炭电极是正极,故Na+向活性炭电极移动,C正确。
14.C 解析 b电极上氧气得电子发生还原反应,b为正极,电解质溶液为硫酸,则正极反应为O2+4H++4e-2H2O,A错误;在原电池中,阳离子移向正极,即电解质溶液中的H+移向b极,B错误;1 mol O2参与反应得到4 mol 电子,则有0.4 mol 电子转移时消耗0.1 mol 氧气,标准状况下体积为2.24 L ,C正确;单位时间内呼出的气体中酒精越多,转移的电子也越多,电流越大,D错误。
15.C 解析 石墨与稀硫酸不反应,不能形成原电池,故A项错误;Al比Cu活泼,所以Al作负极,电子的移动方向与题意不符,故B项错误;Mg能与稀硫酸发生反应,镁作负极,失去的电子沿导线流向石墨,故C项正确;Zn比Ag活泼,Zn作负极,电子的移动方向与题意不符,故D项错误。
16.答案 (1)B (2)Cu2++2e-Cu 0.4 (3)还原反应 (4)D>A>B>C
解析 (1)甲装置中,金属A不断溶解,说明A是负极,B是正极。
(2)乙装置中,C的质量不断增加,说明C电极是正极,溶液中的铜离子放电生成铜,电极反应是Cu2++2e-Cu,反应一段时间后,测得C电极的质量增加12.8 g,即生成铜的物质的量为12.8 g÷64 g·mol-1=0.2 mol,则转移电子的物质的量为0.2 mol×2=0.4 mol。
(3)丙装置中A电极上有气体生成,所以A电极是正极,溶液中的氢离子得电子发生还原反应生成氢气。
(4)甲中A是负极,B是正极;乙中C是正极,B是负极;丙中A是正极,D是负极,所以四种金属活动性由强到弱的顺序是D>A>B>C。
17.答案 (1)③ Cu2++2e-Cu 3.0 g (2)①B
②9.6 mol (3)Zn-2e-+2OH-Zn(OH)2 1 增强
解析 (1)①中铜是负极,碳是正极,铁离子在正极放电生成亚铁离子,不能比较Fe2+与Cu2+的氧化性强弱;②中在常温下铁遇浓硝酸发生钝化,铁是正极,铜是负极,不能比较Fe2+与Cu2+的氧化性强弱;③中铁是负极,碳是正极,铜离子在正极得到电子生成铜,能比较Fe2+与Cu2+的氧化性强弱,正极的电极反应为Cu2++2e-Cu。当导线中通过0.05 mol电子时,消耗铁0.025 mol×56 g·mol-1=1.4 g,析出铜是0.025 mol×64 g·mol-1=1.6 g,则两个电极的质量差为1.4 g+1.6 g=3.0 g。
(2)①实验测得OH-向B电极移动,则B电极是负极,因此B处通入的是甲烷。②甲烷的体积为33.6 L(标准状况下),其物质的量是1.5 mol,假设电池的能量转化率为80%,则导线中转移电子的物质的量为1.5 mol×80%×8=9.6 mol。
(3)反应中锌失去电子,则原电池负极的电极反应为Zn-2e-+2OH-Zn(OH)2;铁元素化合价从+6价降低到+3价,因此放电时每转移3 mol电子,有1 mol K2FeO4被还原。正极附近溶液的碱性增强。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版化学必修第二册练习题
第2章分层作业10 化学反应能量转化的重要应用——化学电池
A级 必备知识基础练
1.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是( )
2.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述不正确的是( )
A.碱性锌锰干电池比普通锌锰干电池的能量高
B.锌锰干电池工作一段时间后碳棒质量不变
C.燃料电池可连续不断地将热能直接转变为电能
D.原电池是利用氧化还原反应将化学能直接转化为电能的装置
3.某普通锌锰干电池的结构如图所示。下列说法正确的是( )
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨沿电解质溶液流向锌筒
4.某原电池总反应的离子方程式是Zn+Cu2+Zn2++Cu,则该反应的原电池组成正确的是( )
选项 A B C D
正极 Zn Cu Ag Cu
负极 Cu Zn Cu Fe
电解质溶液 CuCl2 溶液 CuSO4 溶液 H2SO4 溶液 ZnCl2 溶液
5.由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是( )
装置
现象 金属W不断溶解 Y的质量增加 W上有气体产生
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e-Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
6.燃料电池是一种高效、环境友好的发电装置,某氢氧燃料电池的构造示意图如下,该电池工作时,下列说法正确的是( )
A.a电极是该电池的正极
B.O2在b电极上发生氧化反应
C.电解质溶液中OH-向正极移动
D.该装置实现了化学能向电能的转化
7.(2023北京东城区高一期中)原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。对如图所示的甲、乙两装置,下列分析正确的是( )
A.甲、乙均能将化学能转化为电能
B.甲、乙中铜片上均有气泡产生
C.甲、乙中铜片上均发生氧化反应
D.甲、乙中均能发生的反应是Zn+2H+Zn2++H2↑
8.(2022湖南卷)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( )
A.海水起电解质溶液作用
B.N极仅发生的电极反应:2H2O+2e-2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂-海水电池属于一次电池
9.现有如下两个反应:
①KOH+HNO3KNO3+H2O
②H2SO4+ZnZnSO4+H2↑
(1)根据两反应的本质判断能否设计成原电池:
① ,② 。
(2)如果不能,说明其原因: 。
(3)如果可以,则写出作原电池正极材料的名称: ,电极反应:负极 ;正极 。
(4)在铜锌原电池中,以稀硫酸为电解质溶液,若工作一段时间后,锌片的质量减少了32.5 g,则铜片表面析出了氢气 (标准状况下),导线中通过 mol电子。
B级 关键能力提升练
以下选择题有1~2个选项符合题意。
10.化学能可与热能、电能等相互转化。下列表述不正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.能量变化是化学反应的基本特征之一
C.图Ⅰ所示的装置能将化学能转变为电能
D.图Ⅱ所示的反应为放热反应
11.如图为一种氢氧燃料电池的装置示意图,下列说法不正确的是( )
A.该装置中氧化反应和还原反应在不同区域进行
B.石墨是电极材料
C.O2是负极反应物、H2是正极反应物
D.H2SO4可以传导电子和离子
12.如图是四种燃料电池的工作原理示意图,其中正极反应生成水的是( )
13.(2023吉林长春高一期中)“盐水动力”玩具车的驱动原理如图所示,向A中加入食盐水后便可驱动玩具车行驶。加入食盐水后,下列有关叙述不正确的是( )
A.实现了化学能向电能的转化
B.Mg作正极,不断地被消耗
C.活性炭作正极,Na+向活性炭电极移动
D.该玩具车的驱动能源运用了原电池原理
14.酒精检测仪可帮助交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为CH3CH2OH+O2CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
A.b为正极,电极反应为O2+2H2O+4e-4OH-
B.电解质溶液中的H+移向呼气口
C.若有0.4 mol 电子转移,则在标准状况下消耗2.24 L氧气
D.呼出气体中酒精含量越低,微处理器中通过的电流越大
15.如图装置中,“→”表示电子的移动方向。则电极材料A、B分别可能是( )
A.石墨、石墨
B.Cu、Al
C.Mg、石墨
D.Ag、Zn
16.由A、B、C、D四种金属按下表中装置进行实验。
装置
现象 金属A 不断溶解 C的质量 增加 A上有 气体产生
根据实验现象回答下列问题:
(1)装置甲中作为正极的是 (填“A”或“B”)。
(2)装置乙中C电极的反应为 ;装置乙中反应一段时间后,测得C电极的质量增加12.8 g,则该电池反应转移电子的物质的量为 mol。
(3)装置丙中金属A上电极反应属于 (填“氧化反应”或“还原反应”)。
(4)四种金属活动性由强到弱的顺序是 。
C级 学科素养创新练
17.(1)为了验证Fe2+与Cu2+氧化性的强弱,下列装置能达到实验目的的是 ,能达到目的的装置中正极的电极反应为 。若开始时原电池中两个电极的质量相等,当导线中通过0.05 mol 电子时,两个电极的质量差为 。
(2)将CH4与O2的反应设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
①实验测得OH-向B电极移动,则 (填“A”或“B”)处电极入口通甲烷。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为 。
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应为 ;放电时每转移3 mol电子,有 mol K2FeO4被还原,正极附近溶液的碱性 (填“增强”“不变”或“减弱”)。
分层作业10 化学反应能量转化的重要应用——化学电池
1.C 2.C 3.C 4.B
5.C 解析 装置甲中W不断溶解,说明W作原电池负极,金属的活动性W>X,A项正确;装置乙中Y电极为正极,其电极反应式为Cu2++2e-Cu,金属的活动性X>Y,B项正确;装置丙中溶液中有氢气产生,故c(H+)减小,金属的活动性Z>W,C项错误;四种金属的活动性强弱顺序为Z>W>X>Y,D项正确。
6.D
7.D 解析 装置甲中Cu、Zn未通过导线连接(或接触),不能形成闭合回路,不能实现化学能转化为电能,A错误;甲中Cu是不活泼金属,与稀硫酸不反应,铜片表面不产生气泡,B、C错误;甲中Zn与稀硫酸反应生成ZnSO4和H2,乙中形成原电池,Zn作负极,电池总反应为Zn+2H+Zn2++H2↑,D正确。
8.B 解析 海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,A正确。锂-海水电池的总反应为4Li+2H2O+O24LiOH,M极上Li失去电子发生氧化反应,则M电极为负极,电极反应为Li-e-Li+,N极为正极,电极反应为O2+2H2O+4e-4OH-,B错误。Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,C正确。该电池以海水为电解质溶液,海水源源不断,不需要另加电解质溶液,该电池不可充电,属于一次电池,D正确。
9.答案 (1)不能 能 (2)①反应是非氧化还原反应,没有电子转移 (3)石墨或铜片(合理即可) Zn-2e-Zn2+ 2H++2e-H2↑ (4)11.2 L 1
解析 (1)①反应中各元素化合价不变,不属于氧化还原反应,属于复分解反应,所以不能设计成原电池;②反应中锌元素化合价由0价变为+2价,氢元素化合价由+1价变为0价,且该反应是放热反应,能自发进行,所以能设计成原电池。
(2)①反应是非氧化还原反应,没有电子转移,所以不能设计成原电池。
(3)由反应②可知,Zn作负极,不如锌活泼的金属或能导电的非金属作正极,如碳棒或铜片,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电极反应分别为:负极:Zn-2e-Zn2+,正极:2H++2e-H2↑。
(4)锌失电子的物质的量=×2=1 mol,根据电子守恒可得标准状况下生成氢气的体积=×22.4 L·mol-1=11.2 L;根据Zn-2e-Zn2+得转移电子的物质的量=×2=1 mol。
10.C 解析 化学反应中能量变化的主要原因是化学键的断裂与形成,因为断裂旧键要吸收能量,形成新键要放出能量,A项正确;能量变化是化学反应的基本特征之一,B项正确;题图Ⅰ所示的装置没有构成闭合回路,不是原电池,不能将化学能转变为电能,C项错误;题图Ⅱ所示的反应中,反应物的总能量高于生成物的总能量,故其为放热反应,D项正确。
11.CD
12.C 解析 固体氧化物燃料电池中正极通入空气,负极通入氢气,正极的电极反应为O2+4e-2,正极没有水生成,故A不符合题意;碱性氢氧燃料电池中正极通入氧气,负极通入氢气,正极的电极反应为O2+2H2O+4e-4OH-,正极没有水生成,故B不符合题意;质子交换膜燃料电池中正极通入空气,负极通入氢气,正极的电极反应为O2+4H++4e-2H2O,正极生成了水,故C符合题意;熔融盐燃料电池中正极通入氧气和二氧化碳,负极通入一氧化碳和氢气,正极的电极反应为O2+2CO2+4e-2C,正极没有水生成,故D不符合题意。
13.B 解析 镁与活性炭相连插入食盐水中形成原电池,将化学能转化为电能,可为玩具车提供电能,运用了原电池原理,A、D正确;Mg作负极,加食盐水后,Mg发生氧化反应生成Mg2+,不断被消耗,B错误;原电池中阳离子移向正极,活性炭电极是正极,故Na+向活性炭电极移动,C正确。
14.C 解析 b电极上氧气得电子发生还原反应,b为正极,电解质溶液为硫酸,则正极反应为O2+4H++4e-2H2O,A错误;在原电池中,阳离子移向正极,即电解质溶液中的H+移向b极,B错误;1 mol O2参与反应得到4 mol 电子,则有0.4 mol 电子转移时消耗0.1 mol 氧气,标准状况下体积为2.24 L ,C正确;单位时间内呼出的气体中酒精越多,转移的电子也越多,电流越大,D错误。
15.C 解析 石墨与稀硫酸不反应,不能形成原电池,故A项错误;Al比Cu活泼,所以Al作负极,电子的移动方向与题意不符,故B项错误;Mg能与稀硫酸发生反应,镁作负极,失去的电子沿导线流向石墨,故C项正确;Zn比Ag活泼,Zn作负极,电子的移动方向与题意不符,故D项错误。
16.答案 (1)B (2)Cu2++2e-Cu 0.4 (3)还原反应 (4)D>A>B>C
解析 (1)甲装置中,金属A不断溶解,说明A是负极,B是正极。
(2)乙装置中,C的质量不断增加,说明C电极是正极,溶液中的铜离子放电生成铜,电极反应是Cu2++2e-Cu,反应一段时间后,测得C电极的质量增加12.8 g,即生成铜的物质的量为12.8 g÷64 g·mol-1=0.2 mol,则转移电子的物质的量为0.2 mol×2=0.4 mol。
(3)丙装置中A电极上有气体生成,所以A电极是正极,溶液中的氢离子得电子发生还原反应生成氢气。
(4)甲中A是负极,B是正极;乙中C是正极,B是负极;丙中A是正极,D是负极,所以四种金属活动性由强到弱的顺序是D>A>B>C。
17.答案 (1)③ Cu2++2e-Cu 3.0 g (2)①B
②9.6 mol (3)Zn-2e-+2OH-Zn(OH)2 1 增强
解析 (1)①中铜是负极,碳是正极,铁离子在正极放电生成亚铁离子,不能比较Fe2+与Cu2+的氧化性强弱;②中在常温下铁遇浓硝酸发生钝化,铁是正极,铜是负极,不能比较Fe2+与Cu2+的氧化性强弱;③中铁是负极,碳是正极,铜离子在正极得到电子生成铜,能比较Fe2+与Cu2+的氧化性强弱,正极的电极反应为Cu2++2e-Cu。当导线中通过0.05 mol电子时,消耗铁0.025 mol×56 g·mol-1=1.4 g,析出铜是0.025 mol×64 g·mol-1=1.6 g,则两个电极的质量差为1.4 g+1.6 g=3.0 g。
(2)①实验测得OH-向B电极移动,则B电极是负极,因此B处通入的是甲烷。②甲烷的体积为33.6 L(标准状况下),其物质的量是1.5 mol,假设电池的能量转化率为80%,则导线中转移电子的物质的量为1.5 mol×80%×8=9.6 mol。
(3)反应中锌失去电子,则原电池负极的电极反应为Zn-2e-+2OH-Zn(OH)2;铁元素化合价从+6价降低到+3价,因此放电时每转移3 mol电子,有1 mol K2FeO4被还原。正极附近溶液的碱性增强。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
