化学人教版(2019)选择性必修1 3.4.2沉淀溶解平衡的应用(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.4.2沉淀溶解平衡的应用(共20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 39.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-31 22:30:42 | ||
图片预览








文档简介
(共20张PPT)
沉淀溶解平衡的应用
练习
已知25 ℃时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(1)25 ℃时,氯化银的饱和溶液中,c(Cl-)= ,向其中加入NaCl固体,溶解平衡 ,溶度积常数 。
练习
已知25 ℃时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(2)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为 ,由此可得出 更难溶。
练习
已知25 ℃时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(3)25 ℃时,取一定量含有I-、Cl-的溶液,向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中= 。
练习
已知25 ℃时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(4)将等体积的4×10-3 mol·L-1的AgNO3溶液和4×10-3 mol·L-1的K2CrO4溶液混合 (填“有”或“没有”)Ag2CrO4沉淀产生。
总结:
(1)Ksp只与难溶电解质的性质、温度有关,而与沉淀的量和溶液中离子浓度无关。
(2)①Ksp反映了难溶电解质在水中的溶解能力。在相同温度时,对于同类型物质,Ksp数值越大,难溶电解质在水中的溶解能力越强。如由Ksp数值可知,溶解能力:AgCl>AgBr>AgI,Cu(OH)2②不同类型的物质,Ksp差距不大时不能直接作为比较依据。如(25 ℃):
但是Ag2CrO4更易溶。
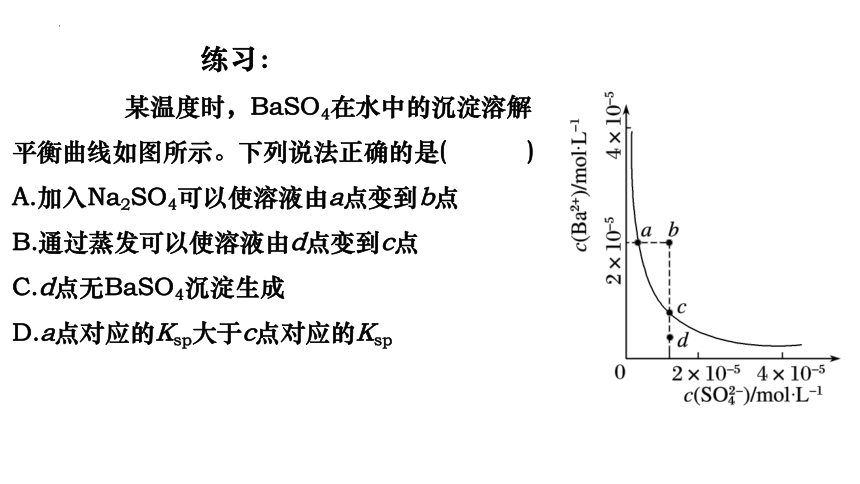
练习:
某温度时,BaSO4在水中的沉淀溶解
平衡曲线如图所示。下列说法正确的是( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
二、沉淀溶解平衡的应用
1、沉淀的生成
对AaBb aAb++bBa-来说,
1)Qc=ca(Ab+)cb(Ba-)<Ksp,溶液未饱和,还可溶解;
2)Qc=ca(Ab+)cb(Ba-)=Ksp, 恰好饱和,达到平衡;
3)Qc=ca(Ab+)cb(Ba-)>Ksp, 过饱和,有沉淀析出。
例题:在1000mL0.001mol/LNaCl溶液中滴入1滴(约0.04mL)
0.001mol/L AgNO3溶液,试判断有无AgCl生成。
(已知:Ksp(AgCl)=1.8×10-10)
(1)应用:除杂或提纯物质
(2)原则:生成沉淀的反应能发生,且进行得越完全越好。
(3)方法
①加沉淀剂:如沉淀Cu2+、Hg2+等,
以Na2S、H2S做沉淀剂
Cu2++S2-=CuS↓ Hg2++S2-=HgS↓
二、沉淀溶解平衡的应用
1、沉淀的生成
例:将4×10-3mol·L-1的AgNO3溶液与4×10-3mol·L-1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10
二、沉淀溶解平衡的应用
1、沉淀的生成
(3)方法
①加沉淀剂:
二、沉淀溶解平衡的应用
1、沉淀的生成
(3)方法
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值(<10-5 mol/L)
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
②通过调节pH
例:根据上表的数据,CuCl2中混有少量Fe3+如何除去?
③氧化还原法
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值(<10-5 mol/L)
Fe(OH)2 6.34 8.34
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
要求:不引入杂质
二、沉淀溶解平衡的应用
1、沉淀的生成
(3)方法
例:根据上表的数据,CuCl2中混有少量Fe2+如何除去?
分步沉淀: 溶液中含有几种离子,加入某沉淀剂均可生成沉淀,沉淀有先后顺序,叫作分步沉淀。离子浓度相等时,溶度积小的先沉淀。
例:已知AgI的Ksp=8.5×10-17,AgCl的Ksp=1.8×10-10.在含有
0.01mol/LNaI和0.01mol/LNaCl的溶液中,逐滴加入AgNO3溶液,先析出什么沉淀?
二、沉淀溶解平衡的应用
1、沉淀的生成
练习:如果溶液中Fe3+和Cu2+的浓度均为0.010 mol/L, 使Fe3+完全沉淀而使Cu2+不沉淀的pH条件是什么?
已知:Ksp(Fe(OH)3)=4.0×10-39, Ksp(Cu(OH)2)=5.6×10-20
二、沉淀溶解平衡的应用
1、沉淀的生成
(1)实质:平衡向沉淀溶解的方向移动
例:CaCO3易溶于HCl
①酸(碱)溶解法
例:Al(OH)3既溶于HCl,又溶于NaOH
②难溶于水的电解质溶于某些盐溶液
例:Mg(OH)2溶于NH4Cl溶液
(2)方法
二、沉淀溶解平衡的应用
2、沉淀的溶解
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
(1)加入盐酸时,
(2)加入NH4Cl时,
a、NH4+直接结合OH-,使c(OH-)减小,平衡右移;
b、NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移;
H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解;
二、沉淀溶解平衡的应用
2、沉淀的溶解
二、沉淀溶解平衡的应用
过量
0.1 mol/L
NaCl溶液
预期生成
白色沉淀
几滴
0.1 mol/L
KI溶液
预期白色沉淀转化为黄色沉淀
预期黄色沉淀转化为黑色沉淀
Ag2S沉淀
Ksp = 6.3×10-50
AgCl沉淀
Ksp = 1.8×10-10
AgI沉淀
Ksp = 8.5×10-17
几滴0.1 mol/L
AgNO3溶液
几滴
0.1 mol/L
Na2S溶液
保证Ag+不过量
若Ag+过量,与I-、S2-反应直接生成沉淀,无法证明平衡移动。
二、沉淀溶解平衡的应用
反应向正反应方向进行完全,即AgCl可转化为AgI沉淀。
AgCl(s) Ag+(aq) + Cl-(aq)
白色
黄色
Ksp = 1.8×10-10
Ksp=8.5×10-17
当向AgCl沉淀中滴加KI溶液时,溶液中Ag+与I-的离子积—
Q(AgI)>Ksp(AgI),因此,Ag+与I-结合生成AgI沉淀,导致AgCl的沉淀溶解平衡向溶解的方向移动,直至建立新沉淀溶解平衡。
AgI(s)
+
I-(aq)
如果加入足量的KI溶液,上述过程会继续进行,直到绝大部分AgCl沉淀转化为AgI沉淀。
AgCl(s) + I-(aq) AgI(s) + Cl-(aq)
K= ;
二、沉淀溶解平衡的应用
当向AgI沉淀中滴加Na2S溶液时,溶液中Ag+与S2-的离子积——
Q(Ag2S)>Ksp(Ag2S),因此 Ag+与S2-结合生成Ag2S沉淀,导致AgI的沉淀溶解平衡向溶解的方向移动,直至建立新沉淀溶解平衡。
+
S2-(aq)
Ag2S(s)
AgI(s) Ag+(aq) + I-(aq)
黄色
黑色
Ksp = 6.3×10-50
Ksp = 8.5×10-17
如果加入足量的Na2S溶液,上述过程会继续进行,直到绝大部分AgI沉淀转化为Ag2S沉淀。
2AgI(s) + S2-(aq) Ag2S(s) + 2I-(aq)
课后作业:一周一练课时2
沉淀溶解平衡的应用
练习
已知25 ℃时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(1)25 ℃时,氯化银的饱和溶液中,c(Cl-)= ,向其中加入NaCl固体,溶解平衡 ,溶度积常数 。
练习
已知25 ℃时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(2)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为 ,由此可得出 更难溶。
练习
已知25 ℃时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(3)25 ℃时,取一定量含有I-、Cl-的溶液,向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中= 。
练习
已知25 ℃时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(4)将等体积的4×10-3 mol·L-1的AgNO3溶液和4×10-3 mol·L-1的K2CrO4溶液混合 (填“有”或“没有”)Ag2CrO4沉淀产生。
总结:
(1)Ksp只与难溶电解质的性质、温度有关,而与沉淀的量和溶液中离子浓度无关。
(2)①Ksp反映了难溶电解质在水中的溶解能力。在相同温度时,对于同类型物质,Ksp数值越大,难溶电解质在水中的溶解能力越强。如由Ksp数值可知,溶解能力:AgCl>AgBr>AgI,Cu(OH)2
但是Ag2CrO4更易溶。
练习:
某温度时,BaSO4在水中的沉淀溶解
平衡曲线如图所示。下列说法正确的是( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
二、沉淀溶解平衡的应用
1、沉淀的生成
对AaBb aAb++bBa-来说,
1)Qc=ca(Ab+)cb(Ba-)<Ksp,溶液未饱和,还可溶解;
2)Qc=ca(Ab+)cb(Ba-)=Ksp, 恰好饱和,达到平衡;
3)Qc=ca(Ab+)cb(Ba-)>Ksp, 过饱和,有沉淀析出。
例题:在1000mL0.001mol/LNaCl溶液中滴入1滴(约0.04mL)
0.001mol/L AgNO3溶液,试判断有无AgCl生成。
(已知:Ksp(AgCl)=1.8×10-10)
(1)应用:除杂或提纯物质
(2)原则:生成沉淀的反应能发生,且进行得越完全越好。
(3)方法
①加沉淀剂:如沉淀Cu2+、Hg2+等,
以Na2S、H2S做沉淀剂
Cu2++S2-=CuS↓ Hg2++S2-=HgS↓
二、沉淀溶解平衡的应用
1、沉淀的生成
例:将4×10-3mol·L-1的AgNO3溶液与4×10-3mol·L-1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10
二、沉淀溶解平衡的应用
1、沉淀的生成
(3)方法
①加沉淀剂:
二、沉淀溶解平衡的应用
1、沉淀的生成
(3)方法
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值(<10-5 mol/L)
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
②通过调节pH
例:根据上表的数据,CuCl2中混有少量Fe3+如何除去?
③氧化还原法
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值(<10-5 mol/L)
Fe(OH)2 6.34 8.34
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
要求:不引入杂质
二、沉淀溶解平衡的应用
1、沉淀的生成
(3)方法
例:根据上表的数据,CuCl2中混有少量Fe2+如何除去?
分步沉淀: 溶液中含有几种离子,加入某沉淀剂均可生成沉淀,沉淀有先后顺序,叫作分步沉淀。离子浓度相等时,溶度积小的先沉淀。
例:已知AgI的Ksp=8.5×10-17,AgCl的Ksp=1.8×10-10.在含有
0.01mol/LNaI和0.01mol/LNaCl的溶液中,逐滴加入AgNO3溶液,先析出什么沉淀?
二、沉淀溶解平衡的应用
1、沉淀的生成
练习:如果溶液中Fe3+和Cu2+的浓度均为0.010 mol/L, 使Fe3+完全沉淀而使Cu2+不沉淀的pH条件是什么?
已知:Ksp(Fe(OH)3)=4.0×10-39, Ksp(Cu(OH)2)=5.6×10-20
二、沉淀溶解平衡的应用
1、沉淀的生成
(1)实质:平衡向沉淀溶解的方向移动
例:CaCO3易溶于HCl
①酸(碱)溶解法
例:Al(OH)3既溶于HCl,又溶于NaOH
②难溶于水的电解质溶于某些盐溶液
例:Mg(OH)2溶于NH4Cl溶液
(2)方法
二、沉淀溶解平衡的应用
2、沉淀的溶解
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
(1)加入盐酸时,
(2)加入NH4Cl时,
a、NH4+直接结合OH-,使c(OH-)减小,平衡右移;
b、NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移;
H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解;
二、沉淀溶解平衡的应用
2、沉淀的溶解
二、沉淀溶解平衡的应用
过量
0.1 mol/L
NaCl溶液
预期生成
白色沉淀
几滴
0.1 mol/L
KI溶液
预期白色沉淀转化为黄色沉淀
预期黄色沉淀转化为黑色沉淀
Ag2S沉淀
Ksp = 6.3×10-50
AgCl沉淀
Ksp = 1.8×10-10
AgI沉淀
Ksp = 8.5×10-17
几滴0.1 mol/L
AgNO3溶液
几滴
0.1 mol/L
Na2S溶液
保证Ag+不过量
若Ag+过量,与I-、S2-反应直接生成沉淀,无法证明平衡移动。
二、沉淀溶解平衡的应用
反应向正反应方向进行完全,即AgCl可转化为AgI沉淀。
AgCl(s) Ag+(aq) + Cl-(aq)
白色
黄色
Ksp = 1.8×10-10
Ksp=8.5×10-17
当向AgCl沉淀中滴加KI溶液时,溶液中Ag+与I-的离子积—
Q(AgI)>Ksp(AgI),因此,Ag+与I-结合生成AgI沉淀,导致AgCl的沉淀溶解平衡向溶解的方向移动,直至建立新沉淀溶解平衡。
AgI(s)
+
I-(aq)
如果加入足量的KI溶液,上述过程会继续进行,直到绝大部分AgCl沉淀转化为AgI沉淀。
AgCl(s) + I-(aq) AgI(s) + Cl-(aq)
K= ;
二、沉淀溶解平衡的应用
当向AgI沉淀中滴加Na2S溶液时,溶液中Ag+与S2-的离子积——
Q(Ag2S)>Ksp(Ag2S),因此 Ag+与S2-结合生成Ag2S沉淀,导致AgI的沉淀溶解平衡向溶解的方向移动,直至建立新沉淀溶解平衡。
+
S2-(aq)
Ag2S(s)
AgI(s) Ag+(aq) + I-(aq)
黄色
黑色
Ksp = 6.3×10-50
Ksp = 8.5×10-17
如果加入足量的Na2S溶液,上述过程会继续进行,直到绝大部分AgI沉淀转化为Ag2S沉淀。
2AgI(s) + S2-(aq) Ag2S(s) + 2I-(aq)
课后作业:一周一练课时2
