2024鲁教版化学选择性必修2练习题--第3章测评(含解析)
文档属性
| 名称 | 2024鲁教版化学选择性必修2练习题--第3章测评(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 427.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 11:24:57 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024鲁教版化学选择性必修2练习题
第3章测评
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H8
B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5
D.CCl4、Na2S、H2O2
2.下列关于物质特殊聚集状态结构的叙述中,错误的是( )
A.超分子是由两个或多个分子相互“组合”在一起形成具有特定结构和功能的聚集体,能表现出不同于单个分子的性质
B.非晶体基本构成微粒的排列是长程无序和短程有序的
C.液晶内部分子沿分子短轴方向有序排列,使液晶具有各向异性
D.纳米材料具有既不同于微观粒子又不同于宏观物体的独特性质
3.下列说法正确的是( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔、沸点低,常温下均呈液态或气态
D.共价晶体中的各相邻原子以共价键相结合
4.下列叙述正确的是( )
A.干冰升华时碳氧键发生断裂
B.CaO和SiO2晶体中都不存在单个分子
C.Na2O与Na2O2所含的化学键类型完全相同
D.Br2蒸气被活性炭吸附时共价键被破坏
5.下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键 ②在晶体中只要有阳离子就一定有阴离子 ③金刚石、晶体硅、NaF、NaCl、H2O、H2S晶体的熔点依次降低 ④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 ⑤晶格能由大到小的顺序:NaF>NaCl>NaBr>NaI ⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合 ⑦分子晶体中分子间作用力越大,分子越稳定
A.只有①②③⑥
B.只有①②④
C.只有③⑤⑥⑦
D.只有③⑤
6.下列各组物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
7.已知NaH的晶胞如图,晶胞边长为a。下列说法错误的是( )
NaH晶胞
A.钠离子的配位数是6
B.该结构单元中氢离子数目为4
C.氢离子之间的最短距离为a
D.基态钠离子的电子排布式为1s22s22p6
8.MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是( )
A.MgO>Rb2O>BaO>CaO
B.MgO>CaO>BaO>Rb2O
C.CaO>BaO>MgO>Rb2O
D.CaO>BaO>Rb2O>MgO
9.为了确定SbCl3、SbCl5是否为离子晶体,以下分析正确的是( )
A.常温下,SbCl3、SbCl5均为液体,说明SbCl3和SbCl5都是离子晶体
B.SbCl3、SbCl5的熔点依次为73.5 ℃、2.8 ℃,说明SbCl3、SbCl5都不是离子晶体
C.SbCl3、SbCl5溶液中,滴入酸化的AgNO3溶液,产生白色沉淀,说明SbCl3、SbCl5都是离子晶体
D.SbCl3、SbCl5的水溶液都可以导电,说明SbCl3、SbCl5都是离子晶体
10.下列物质所属晶体类型分类正确的是( )
选项 A B C D
共价晶体 石墨 生石灰 碳化硅 金刚石
分子晶体 冰 固态氨 氯化铯 干冰
离子晶体 氮化铝 食盐 明矾 芒硝
金属晶体 铜 汞 铝 铁
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分)
11.下列有关晶体结构或性质的描述不正确的是( )
A.冰中存在非极性键、分子间作用力和氢键
B.因金属性K>Na,故金属钾的熔点高于金属钠
C.各1 mol的金刚石与石墨晶体中所含的C—C键的数目不相同
D.氧化钙的晶格能大于氯化钾,故其熔点高于氯化钾
12.碱金属卤化物是典型的离子晶体,它们的晶格能与成正比(d0是晶体中最邻近的导电性离子的核间距)。下面说法错误的是( )
晶格能/(kJ·mol-1) 离子半径/pm
LiF LiCl LiBr LiI Li+ Na+ K+
1 031 845 807 752 60 95 133
NaF NaCl NaBr NaI F- Cl- Br- I-
915 787 736 686
KF KCl KBr KI 136 181 195 216
812 708 676 641
A.晶格能的大小与离子半径成正比
B.阳离子相同、阴离子不同的离子晶体,阴离子半径越大,晶格能越小
C.阳离子不同、阴离子相同的离子晶体,阳离子半径越小,晶格能越大
D.碱金属卤化物中,晶格能越小,氧化性越强
13.Co3+的八面体配合物CoClm·nNH3的结构如图所示,其中数字处的小圆圈表示NH3分子或Cl-,Co3+位于八面体的中心。若1 mol该配合物与AgNO3作用生成2 mol AgCl沉淀,则n的值是( )
A.2 B.3
C.4 D.5
14.冠醚能与阳离子,尤其是与碱金属离子作用,并且随环的大小不同而与不同的金属离子作用。12-冠-4与锂离子作用而不与钠离子、钾离子作用;18-冠-6与钾离子作用(如图),还可与重氮盐作用,但不与锂离子或钠离子作用。下列说法错误的是( )
A.18-冠-6中C和O的杂化轨道类型相同
B.18-冠-6与钾离子作用,不与锂离子或钠离子作用,这反映了超分子的“分子识别”的特征
C.18-冠-6与钾离子作用反映了超分子的自组装的特征
D.冠醚与碱金属离子作用的原理与其可作相转移催化剂的原理有关
15.下列说法正确的是( )
①干冰是CO2分子通过氢键和分子间作用力有规则排列成的分子晶体 ②正四面体结构的分子,键角都是109°28',其晶体类型可能是共价晶体或分子晶体 ③分子晶体中都含有化学键 ④含4.8 g碳原子的金刚石晶体中的共价键的物质的量为0.8 mol
A.①②③ B.只有④
C.②④ D.③④
三、非选择题(本题共5小题,共60分)
16.(13分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y原子有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期且第一电离能比Z的小,R与Y同一主族,Q原子的最外层只有一个电子,其他电子层均处于饱和状态。请回答下列问题:
(1)Q+的核外电子排布式为 。
(2)化合物X2W2中W的杂化方式为 ,Z的空间结构是 。
(3)Y、R的最高价氧化物的沸点较高的是 (填化学式),原因是 。
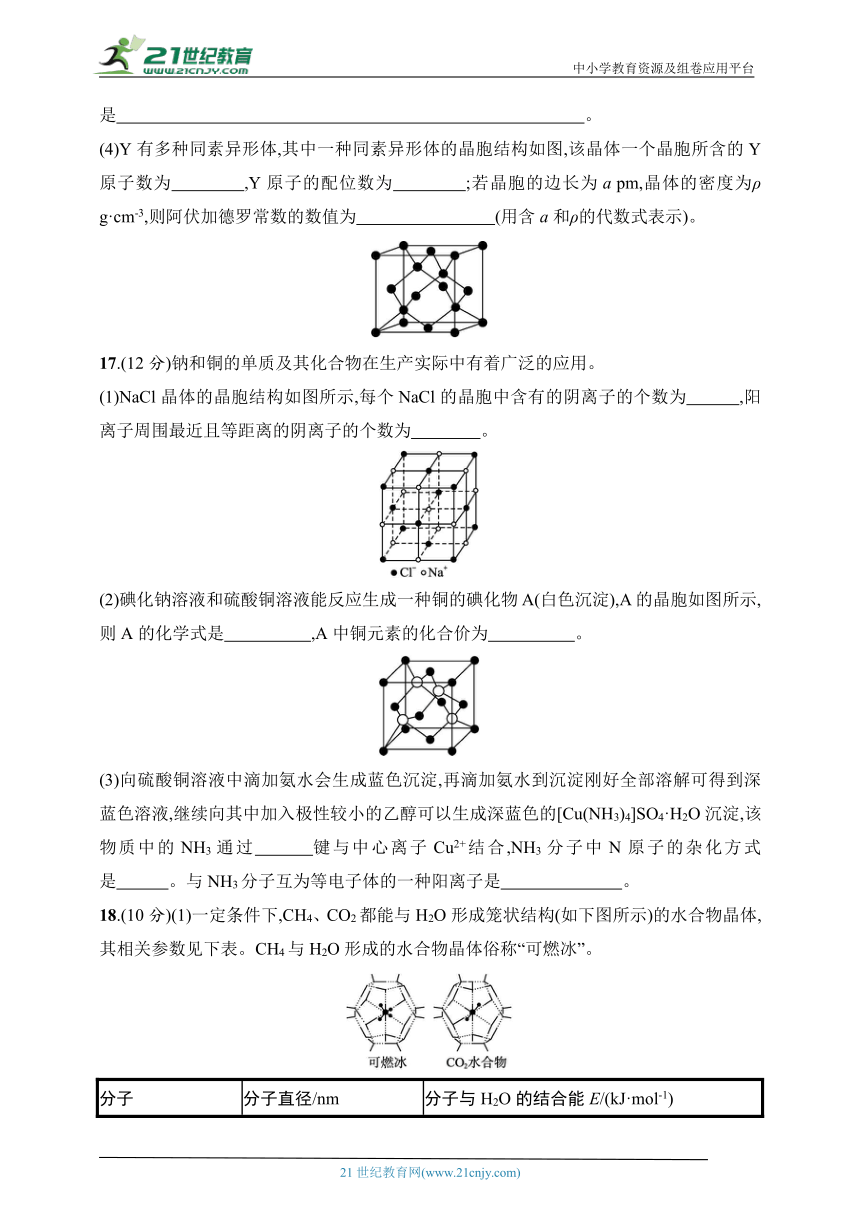
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞所含的Y原子数为 ,Y原子的配位数为 ;若晶胞的边长为a pm,晶体的密度为ρ g·cm-3,则阿伏加德罗常数的数值为 (用含a和ρ的代数式表示)。
17.(12分)钠和铜的单质及其化合物在生产实际中有着广泛的应用。
(1)NaCl晶体的晶胞结构如图所示,每个NaCl的晶胞中含有的阴离子的个数为 ,阳离子周围最近且等距离的阴离子的个数为 。
(2)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图所示,则A的化学式是 ,A中铜元素的化合价为 。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过 键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是 。与NH3分子互为等电子体的一种阳离子是 。
18.(10分)(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
分子 分子直径/nm 分子与H2O的结合能E/(kJ·mol-1)
CH4 0.436 16.40
CO2 0.512 29.91
①“可燃冰”中分子间存在的两种作用力是 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是 。
(2)H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为 。
19.(15分)铜元素及其化合物在生产实际中有许多重要用途。磷化铜(Cu3P2)常用于制造磷青铜(含少量锡、磷的铜合金)。请回答下列有关问题:
(1)现代化学中,常利用 上的特征谱线来鉴定元素。
(2)基态磷原子中,电子占据的最高电子层符号为 ;该电子层中具有的能量最高的电子所在能级有 个伸展方向。
(3)磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间结构为 ;P、S的第一电离能(I1)的大小为I1(P) (填“>”“<”或“=”)I1(S);PH3的沸点 (填“高于”或“低于”)NH3的沸点,原因是 。
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的 的空隙中。若晶体密度为a g·cm-3,则P与最近的Cu原子的核间距为 nm(用含NA的代数式表示,设NA为阿伏加德罗常数的值;已知Sn的相对原子质量为119)。
20.(10分)金属及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
(1)铜在元素周期表中的位置是 ,基态镍原子的核外电子排布式为 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。CO2在高温高压下所形成晶体的晶胞如下图所示。则该晶体的类型属于 。
(3)铜晶体中铜原子的堆积方式如下图所示。其中铜原子的配位数为 。
答案:
1.B 解析 A中HD为单质,不是化合物,C中SiO2晶体为共价晶体,D中Na2S晶体为离子晶体。
2.C 解析 超分子能表现出不同于单个分子的性质,其原因是两个或多个分子相互“组合”在一起,形成具有特定结构和功能的聚集体,A正确;构成非晶体的微粒,在非晶体中的排列,遵循长程无序和短程有序的规则,B正确;液晶具有各向异性,其原因是液晶内部分子沿分子长轴方向进行有序排列,C错误;纳米颗粒内部具有晶状结构,但界面处则为无序结构,所以具有既不同于微观粒子又不同于宏观物体的独特性质,D正确。
3.D 解析 选项A,离子晶体中每个离子周围吸引带相反电荷的离子数目与离子半径有关,如一个Cs+可同时吸引8个Cl-;选项B,金属内部的自由电子不是在外加电场的作用下产生的;选项C,分子晶体在常温下也有呈固态的,如I2。
4.B 解析 A、D项所述变化属于物理变化,化学键均未被破坏;C项,Na2O只含离子键,Na2O2既含有离子键又含有非极性共价键。
5.D 解析 ①分子晶体中不一定都存在共价键,如稀有气体分子是单原子分子,在分子内不存在共价键,故错误。②在晶体中有阳离子不一定有阴离子,如金属晶体中存在的微粒是金属阳离子和自由电子,故错误。③不同类型晶体熔点的高低顺序一般是共价晶体>离子晶体>分子晶体;在共价晶体中,原子半径越大,熔点越低;在离子晶体中,离子半径越大,熔点越低,离子所带电荷越多,熔点越高;在分子晶体中,组成和结构相似的物质的熔点与相对分子质量成正比(含有氢键的物质除外),所以这几种物质的熔点由高到低的顺序是金刚石、晶体硅、NaF、NaCl、H2O、H2S,故正确。④离子晶体中一定含有离子键,可能含有共价键,分子晶体中肯定没有离子键,故错误。⑤F-、Cl-、Br-、I-的离子半径逐渐增大,所以晶格能由大到小的顺序:NaF>NaCl>NaBr>NaI,故正确。⑥硅原子的最外层电子数为4,1个硅原子可与4个氧原子形成4个硅氧键,故错误。⑦分子稳定性与分子内共价键的强弱有关,与分子间作用力无关,故错误。
6.C 解析 ①SiO2是共价晶体,SO3是分子晶体,故①错误;②HCl是分子晶体,晶体硼是共价晶体,二者都只含共价键,故②错误;③CO2和SO2都是分子晶体,二者都只含共价键,故③正确;④晶体硅和金刚石都是共价晶体,二者都只含共价键,故④正确;⑤晶体氖和晶体氮都是分子晶体,晶体氖中不含共价键,晶体氮中含有共价键,故⑤错误;⑥硫黄和碘都是分子晶体,二者都只含共价键,故⑥正确。
7.C 解析 从晶胞中可以看出,钠离子周围有6个氢离子,其配位数为6,故A正确;该结构单元中,氢离子的个数为4,故B正确;从题图中可以看出,氢离子之间距离最短的为每相邻两条棱中点的距离,因为边长为a,所以可根据勾股定理求出其距离为a,故C错误;基态钠离子有10个电子,其电子排布式为1s22s22p6,故D正确。
8.B 解析 四种离子晶体所含阴离子相同,所含阳离子不同。Mg2+、Rb+、Ca2+、Ba2+中,Rb+所带电荷数最少且半径最大,与O2-形成的离子键最弱,Rb2O的熔点最低。Mg2+、Ca2+、Ba2+所带正电荷数一样多,半径:Mg2+Ca2+>Ba2+,相应离子晶体的熔点由高到低的顺序是MgO>CaO>BaO。综上所述,四种离子晶体熔点的高低顺序是MgO>CaO>BaO>Rb2O。
9.B 解析 离子晶体常温下呈固态,熔、沸点较高,故A错误;SbCl3、SbCl5的熔点较低,不是离子晶体,故B正确;如果SbCl3、SbCl5是分子晶体,它们在水溶液中水的作用下也会电离出氯离子和金属离子,滴入酸化的AgNO3溶液,产生白色沉淀,且可以导电,故C、D两项错误。
10.D 解析 A选项中石墨为混合型晶体,氮化铝为共价晶体,B选项中生石灰为离子晶体,C选项中氯化铯为离子晶体。
11.AB 解析 冰中存在极性键、分子间作用力和氢键,A错误;因原子半径K>Na,故金属钾的熔点低于金属钠,B错误;金刚石中每个碳原子与周围碳原子形成4个C—C键,石墨中每个碳原子与周围碳原子形成3个C—C键,因此各1 mol的金刚石与石墨晶体中所含的C—C键的数目不相同,C正确;氧化钙的晶格能大于氯化钾,故其熔点高于氯化钾,D正确。
12.AD 解析 由表中数据可知,晶格能的大小与离子半径成反比,A项错误;由NaF、NaCl、NaBr、NaI晶格能的大小即可确定B项正确;由LiF、NaF、KF晶格能的大小即可确定C项正确;晶格能:LiI>NaI>KI,阳离子的氧化性:Li+>Na+>K+,可知D项错误。
13.D 解析 由1 mol该配合物生成2 mol AgCl可知1 mol该配合物电离出2 mol Cl-,即配离子显+2价,外界有2个Cl-。因为Co显+3价,所以[CoClm-2·nNH3]2+中有1个Cl-,又因为该配合物的空间结构是八面体,所以n=6-1=5。
14.C 解析 18-冠-6中C和O都是sp3杂化,A项正确;18-冠-6与钾离子作用,不与锂离子或钠离子作用,反映了超分子的“分子识别”的特征,B项正确,C项错误;由于冠醚是皇冠状分子,可有不同大小的空穴适配不同大小的碱金属离子,把无机物带入有机化合物中,故可以作为有机相和无机相转移的催化剂,D项正确。
15.B 解析 CO2分子间不能形成氢键,①不正确;正四面体结构的分子,若为AB4型,键角都是109°28',若为A4型,键角为60°,②不正确;稀有气体形成的分子晶体中不含有化学键,③不正确;4.8 g碳原子的物质的量为0.4 mol,金刚石晶体中平均每个碳原子形成2个共价键,所以共价键的物质的量为0.4 mol×2=0.8 mol,④正确。
16.答案 (1)1s22s22p63s23p63d10(或[Ar]3d10)
(2)sp3 角形
(3)SiO2 SiO2为共价晶体,CO2为分子晶体
(4)8 4
解析 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,则X为H元素;Y原子有三个能级,且每个能级上的电子数相等,其核外电子排布式为1s22s22p2,故Y为C元素;R与Y同一主族,结合原子序数可知,R为Si元素;而Z原子未成对电子数在同周期元素中最多,则价电子排布式为ns2np3,原子序数小于Si,故Z为N元素;W与Z同周期且第一电离能比Z的小,则W为O元素;Q原子的最外层只有一个电子,其他电子层均处于饱和状态,不可能为短周期元素,且原子序数小于30,故核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,则Q为Cu元素。
(1)Cu+核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10。
(2)化合物H2O2的结构式为H—O—O—H,O原子价电子对数为4,故O原子采取sp3杂化;N中N原子的孤电子对数为=1,价电子对数为2+1=3,故其空间结构是角形。
(3)Y、R的最高价氧化物分别为二氧化碳、二氧化硅,SiO2为共价晶体,CO2为分子晶体,故沸点较高的是SiO2。
(4)碳有多种同素异形体,其中一种同素异形体的晶胞结构如题图,该晶体一个晶胞所含的Y原子数为4+8×+6×=8;每个Y原子与周围的4个Y原子相邻,故Y原子的配位数为4;若晶胞的边长为a pm,则晶胞体积为(a×10-10)3 cm3,晶体的密度为ρ g·cm-3,则晶胞质量为(a×10-10)3 cm3×ρ g·cm-3=ρa3×10-30g,则8×=ρa3×10-30 g,故NA=。
17.答案 (1)4 6 (2)CuI +1价 (3)配位 sp3 H3O+
解析 (1)黑色球表示氯离子,白色球表示钠离子,该晶胞中钠离子数目=1+12×=4,氯离子数目=×8+×6=4,所以每个NaCl晶胞中含有的Na+和Cl-的数目均是4,一个钠离子周围最近且等距离的氯离子有6个。
(2)根据A的晶胞结构可知,黑球的个数是×8+×6=4,白球的个数为4,所以A的化学式是CuI,A中铜元素显+1价。
(3)NH3中N原子提供孤电子对,Cu2+提供空轨道,二者形成配位键,NH3分子中,N原子的孤电子对数为1,成键电子对数为3,则N原子的杂化方式为sp3;与NH3分子互为等电子体的阳离子具有相同的价电子数8和原子数4,可以是H3O+等。
18.答案 (1)①氢键、范德华力 ②CO2的分子直径小于笼状空腔直径,且与H2O的结合能大于CH4与H2O之间的结合能
(2)H2O与CH3CH2OH之间可以形成氢键
解析 (1)②根据题给数据可知,笼状结构的空腔直径是0.586 nm,而CO2分子的直径是0.512 nm,笼状空腔直径大于CO2分子的直径,而且CO2与H2O之间的结合能大于CH4与H2O之间的结合能,因此可以实现用CO2置换CH4的设想。
(2)水可以与乙醇互溶,除因为它们都是极性分子外,还因为H2O与CH3CH2OH之间可以形成分子间氢键。
19.答案 (1)原子光谱
(2)M 3
(3)三角锥形 > 低于 NH3分子间能形成氢键,而PH3不能
(4)正八面体 ×107
解析 (2)基态磷原子中,电子占据的最高电子层符号为M,能量最高的电子在3p能级,在空间有3个伸展方向。(3)N、P为同主族元素,PH3和NH3的空间结构相同,NH3为三角锥形,则PH3为三角锥形;同周期元素的第一电离能随原子序数的递增,有增大的趋势,但核外电子排布满足全充满或半充满状态时,第一电离能大于其后面的元素的第一电离能,故I1(P)>I1(S);氢键对物质的熔、沸点影响较大,氨气分子间存在氢键,磷化氢中无氢键,则磷化氢的沸点低于氨气。(4)观察磷青铜晶体的晶胞结构,Cu原子位于正方体的六个面的中心位置,形成正八面体的结构;P原子与最近的Cu原子之间的距离为棱长的,Sn原子个数为8×=1,Cu原子个数为6×=3,P原子个数为1,化学式为SnCu3P,摩尔质量为342 g·mol-1,1 mol SnCu3P的体积为,晶胞的体积为 cm3,棱长= cm,P与最近的Cu原子的核间距为×107 nm。
20.答案 (1)第4周期ⅠB族 [Ar]3d84s2(或1s22s22p63s23p63d84s2)
(2)分子晶体 共价晶体
(3)12
解析 (1)铜元素位于第4周期ⅠB族;Ni为28号元素,基态镍原子的核外电子排布式为[Ar]3d84s2或1s22s22p63s23p63d84s2。
(2)Fe(CO)x晶体熔、沸点较低,易溶于非极性溶剂,所以属于分子晶体;由CO2在高温高压下所形成的晶体的晶胞图可知,在晶胞中原子之间通过共价键结合形成空间网状结构,故属于共价晶体。
(3)金属铜中原子采用面心立方最密堆积,铜原子配位数为12。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版化学选择性必修2练习题
第3章测评
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H8
B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5
D.CCl4、Na2S、H2O2
2.下列关于物质特殊聚集状态结构的叙述中,错误的是( )
A.超分子是由两个或多个分子相互“组合”在一起形成具有特定结构和功能的聚集体,能表现出不同于单个分子的性质
B.非晶体基本构成微粒的排列是长程无序和短程有序的
C.液晶内部分子沿分子短轴方向有序排列,使液晶具有各向异性
D.纳米材料具有既不同于微观粒子又不同于宏观物体的独特性质
3.下列说法正确的是( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔、沸点低,常温下均呈液态或气态
D.共价晶体中的各相邻原子以共价键相结合
4.下列叙述正确的是( )
A.干冰升华时碳氧键发生断裂
B.CaO和SiO2晶体中都不存在单个分子
C.Na2O与Na2O2所含的化学键类型完全相同
D.Br2蒸气被活性炭吸附时共价键被破坏
5.下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键 ②在晶体中只要有阳离子就一定有阴离子 ③金刚石、晶体硅、NaF、NaCl、H2O、H2S晶体的熔点依次降低 ④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 ⑤晶格能由大到小的顺序:NaF>NaCl>NaBr>NaI ⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合 ⑦分子晶体中分子间作用力越大,分子越稳定
A.只有①②③⑥
B.只有①②④
C.只有③⑤⑥⑦
D.只有③⑤
6.下列各组物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
7.已知NaH的晶胞如图,晶胞边长为a。下列说法错误的是( )
NaH晶胞
A.钠离子的配位数是6
B.该结构单元中氢离子数目为4
C.氢离子之间的最短距离为a
D.基态钠离子的电子排布式为1s22s22p6
8.MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是( )
A.MgO>Rb2O>BaO>CaO
B.MgO>CaO>BaO>Rb2O
C.CaO>BaO>MgO>Rb2O
D.CaO>BaO>Rb2O>MgO
9.为了确定SbCl3、SbCl5是否为离子晶体,以下分析正确的是( )
A.常温下,SbCl3、SbCl5均为液体,说明SbCl3和SbCl5都是离子晶体
B.SbCl3、SbCl5的熔点依次为73.5 ℃、2.8 ℃,说明SbCl3、SbCl5都不是离子晶体
C.SbCl3、SbCl5溶液中,滴入酸化的AgNO3溶液,产生白色沉淀,说明SbCl3、SbCl5都是离子晶体
D.SbCl3、SbCl5的水溶液都可以导电,说明SbCl3、SbCl5都是离子晶体
10.下列物质所属晶体类型分类正确的是( )
选项 A B C D
共价晶体 石墨 生石灰 碳化硅 金刚石
分子晶体 冰 固态氨 氯化铯 干冰
离子晶体 氮化铝 食盐 明矾 芒硝
金属晶体 铜 汞 铝 铁
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分)
11.下列有关晶体结构或性质的描述不正确的是( )
A.冰中存在非极性键、分子间作用力和氢键
B.因金属性K>Na,故金属钾的熔点高于金属钠
C.各1 mol的金刚石与石墨晶体中所含的C—C键的数目不相同
D.氧化钙的晶格能大于氯化钾,故其熔点高于氯化钾
12.碱金属卤化物是典型的离子晶体,它们的晶格能与成正比(d0是晶体中最邻近的导电性离子的核间距)。下面说法错误的是( )
晶格能/(kJ·mol-1) 离子半径/pm
LiF LiCl LiBr LiI Li+ Na+ K+
1 031 845 807 752 60 95 133
NaF NaCl NaBr NaI F- Cl- Br- I-
915 787 736 686
KF KCl KBr KI 136 181 195 216
812 708 676 641
A.晶格能的大小与离子半径成正比
B.阳离子相同、阴离子不同的离子晶体,阴离子半径越大,晶格能越小
C.阳离子不同、阴离子相同的离子晶体,阳离子半径越小,晶格能越大
D.碱金属卤化物中,晶格能越小,氧化性越强
13.Co3+的八面体配合物CoClm·nNH3的结构如图所示,其中数字处的小圆圈表示NH3分子或Cl-,Co3+位于八面体的中心。若1 mol该配合物与AgNO3作用生成2 mol AgCl沉淀,则n的值是( )
A.2 B.3
C.4 D.5
14.冠醚能与阳离子,尤其是与碱金属离子作用,并且随环的大小不同而与不同的金属离子作用。12-冠-4与锂离子作用而不与钠离子、钾离子作用;18-冠-6与钾离子作用(如图),还可与重氮盐作用,但不与锂离子或钠离子作用。下列说法错误的是( )
A.18-冠-6中C和O的杂化轨道类型相同
B.18-冠-6与钾离子作用,不与锂离子或钠离子作用,这反映了超分子的“分子识别”的特征
C.18-冠-6与钾离子作用反映了超分子的自组装的特征
D.冠醚与碱金属离子作用的原理与其可作相转移催化剂的原理有关
15.下列说法正确的是( )
①干冰是CO2分子通过氢键和分子间作用力有规则排列成的分子晶体 ②正四面体结构的分子,键角都是109°28',其晶体类型可能是共价晶体或分子晶体 ③分子晶体中都含有化学键 ④含4.8 g碳原子的金刚石晶体中的共价键的物质的量为0.8 mol
A.①②③ B.只有④
C.②④ D.③④
三、非选择题(本题共5小题,共60分)
16.(13分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y原子有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期且第一电离能比Z的小,R与Y同一主族,Q原子的最外层只有一个电子,其他电子层均处于饱和状态。请回答下列问题:
(1)Q+的核外电子排布式为 。
(2)化合物X2W2中W的杂化方式为 ,Z的空间结构是 。
(3)Y、R的最高价氧化物的沸点较高的是 (填化学式),原因是 。
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞所含的Y原子数为 ,Y原子的配位数为 ;若晶胞的边长为a pm,晶体的密度为ρ g·cm-3,则阿伏加德罗常数的数值为 (用含a和ρ的代数式表示)。
17.(12分)钠和铜的单质及其化合物在生产实际中有着广泛的应用。
(1)NaCl晶体的晶胞结构如图所示,每个NaCl的晶胞中含有的阴离子的个数为 ,阳离子周围最近且等距离的阴离子的个数为 。
(2)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图所示,则A的化学式是 ,A中铜元素的化合价为 。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过 键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是 。与NH3分子互为等电子体的一种阳离子是 。
18.(10分)(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
分子 分子直径/nm 分子与H2O的结合能E/(kJ·mol-1)
CH4 0.436 16.40
CO2 0.512 29.91
①“可燃冰”中分子间存在的两种作用力是 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是 。
(2)H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为 。
19.(15分)铜元素及其化合物在生产实际中有许多重要用途。磷化铜(Cu3P2)常用于制造磷青铜(含少量锡、磷的铜合金)。请回答下列有关问题:
(1)现代化学中,常利用 上的特征谱线来鉴定元素。
(2)基态磷原子中,电子占据的最高电子层符号为 ;该电子层中具有的能量最高的电子所在能级有 个伸展方向。
(3)磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间结构为 ;P、S的第一电离能(I1)的大小为I1(P) (填“>”“<”或“=”)I1(S);PH3的沸点 (填“高于”或“低于”)NH3的沸点,原因是 。
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的 的空隙中。若晶体密度为a g·cm-3,则P与最近的Cu原子的核间距为 nm(用含NA的代数式表示,设NA为阿伏加德罗常数的值;已知Sn的相对原子质量为119)。
20.(10分)金属及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
(1)铜在元素周期表中的位置是 ,基态镍原子的核外电子排布式为 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。CO2在高温高压下所形成晶体的晶胞如下图所示。则该晶体的类型属于 。
(3)铜晶体中铜原子的堆积方式如下图所示。其中铜原子的配位数为 。
答案:
1.B 解析 A中HD为单质,不是化合物,C中SiO2晶体为共价晶体,D中Na2S晶体为离子晶体。
2.C 解析 超分子能表现出不同于单个分子的性质,其原因是两个或多个分子相互“组合”在一起,形成具有特定结构和功能的聚集体,A正确;构成非晶体的微粒,在非晶体中的排列,遵循长程无序和短程有序的规则,B正确;液晶具有各向异性,其原因是液晶内部分子沿分子长轴方向进行有序排列,C错误;纳米颗粒内部具有晶状结构,但界面处则为无序结构,所以具有既不同于微观粒子又不同于宏观物体的独特性质,D正确。
3.D 解析 选项A,离子晶体中每个离子周围吸引带相反电荷的离子数目与离子半径有关,如一个Cs+可同时吸引8个Cl-;选项B,金属内部的自由电子不是在外加电场的作用下产生的;选项C,分子晶体在常温下也有呈固态的,如I2。
4.B 解析 A、D项所述变化属于物理变化,化学键均未被破坏;C项,Na2O只含离子键,Na2O2既含有离子键又含有非极性共价键。
5.D 解析 ①分子晶体中不一定都存在共价键,如稀有气体分子是单原子分子,在分子内不存在共价键,故错误。②在晶体中有阳离子不一定有阴离子,如金属晶体中存在的微粒是金属阳离子和自由电子,故错误。③不同类型晶体熔点的高低顺序一般是共价晶体>离子晶体>分子晶体;在共价晶体中,原子半径越大,熔点越低;在离子晶体中,离子半径越大,熔点越低,离子所带电荷越多,熔点越高;在分子晶体中,组成和结构相似的物质的熔点与相对分子质量成正比(含有氢键的物质除外),所以这几种物质的熔点由高到低的顺序是金刚石、晶体硅、NaF、NaCl、H2O、H2S,故正确。④离子晶体中一定含有离子键,可能含有共价键,分子晶体中肯定没有离子键,故错误。⑤F-、Cl-、Br-、I-的离子半径逐渐增大,所以晶格能由大到小的顺序:NaF>NaCl>NaBr>NaI,故正确。⑥硅原子的最外层电子数为4,1个硅原子可与4个氧原子形成4个硅氧键,故错误。⑦分子稳定性与分子内共价键的强弱有关,与分子间作用力无关,故错误。
6.C 解析 ①SiO2是共价晶体,SO3是分子晶体,故①错误;②HCl是分子晶体,晶体硼是共价晶体,二者都只含共价键,故②错误;③CO2和SO2都是分子晶体,二者都只含共价键,故③正确;④晶体硅和金刚石都是共价晶体,二者都只含共价键,故④正确;⑤晶体氖和晶体氮都是分子晶体,晶体氖中不含共价键,晶体氮中含有共价键,故⑤错误;⑥硫黄和碘都是分子晶体,二者都只含共价键,故⑥正确。
7.C 解析 从晶胞中可以看出,钠离子周围有6个氢离子,其配位数为6,故A正确;该结构单元中,氢离子的个数为4,故B正确;从题图中可以看出,氢离子之间距离最短的为每相邻两条棱中点的距离,因为边长为a,所以可根据勾股定理求出其距离为a,故C错误;基态钠离子有10个电子,其电子排布式为1s22s22p6,故D正确。
8.B 解析 四种离子晶体所含阴离子相同,所含阳离子不同。Mg2+、Rb+、Ca2+、Ba2+中,Rb+所带电荷数最少且半径最大,与O2-形成的离子键最弱,Rb2O的熔点最低。Mg2+、Ca2+、Ba2+所带正电荷数一样多,半径:Mg2+
9.B 解析 离子晶体常温下呈固态,熔、沸点较高,故A错误;SbCl3、SbCl5的熔点较低,不是离子晶体,故B正确;如果SbCl3、SbCl5是分子晶体,它们在水溶液中水的作用下也会电离出氯离子和金属离子,滴入酸化的AgNO3溶液,产生白色沉淀,且可以导电,故C、D两项错误。
10.D 解析 A选项中石墨为混合型晶体,氮化铝为共价晶体,B选项中生石灰为离子晶体,C选项中氯化铯为离子晶体。
11.AB 解析 冰中存在极性键、分子间作用力和氢键,A错误;因原子半径K>Na,故金属钾的熔点低于金属钠,B错误;金刚石中每个碳原子与周围碳原子形成4个C—C键,石墨中每个碳原子与周围碳原子形成3个C—C键,因此各1 mol的金刚石与石墨晶体中所含的C—C键的数目不相同,C正确;氧化钙的晶格能大于氯化钾,故其熔点高于氯化钾,D正确。
12.AD 解析 由表中数据可知,晶格能的大小与离子半径成反比,A项错误;由NaF、NaCl、NaBr、NaI晶格能的大小即可确定B项正确;由LiF、NaF、KF晶格能的大小即可确定C项正确;晶格能:LiI>NaI>KI,阳离子的氧化性:Li+>Na+>K+,可知D项错误。
13.D 解析 由1 mol该配合物生成2 mol AgCl可知1 mol该配合物电离出2 mol Cl-,即配离子显+2价,外界有2个Cl-。因为Co显+3价,所以[CoClm-2·nNH3]2+中有1个Cl-,又因为该配合物的空间结构是八面体,所以n=6-1=5。
14.C 解析 18-冠-6中C和O都是sp3杂化,A项正确;18-冠-6与钾离子作用,不与锂离子或钠离子作用,反映了超分子的“分子识别”的特征,B项正确,C项错误;由于冠醚是皇冠状分子,可有不同大小的空穴适配不同大小的碱金属离子,把无机物带入有机化合物中,故可以作为有机相和无机相转移的催化剂,D项正确。
15.B 解析 CO2分子间不能形成氢键,①不正确;正四面体结构的分子,若为AB4型,键角都是109°28',若为A4型,键角为60°,②不正确;稀有气体形成的分子晶体中不含有化学键,③不正确;4.8 g碳原子的物质的量为0.4 mol,金刚石晶体中平均每个碳原子形成2个共价键,所以共价键的物质的量为0.4 mol×2=0.8 mol,④正确。
16.答案 (1)1s22s22p63s23p63d10(或[Ar]3d10)
(2)sp3 角形
(3)SiO2 SiO2为共价晶体,CO2为分子晶体
(4)8 4
解析 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,则X为H元素;Y原子有三个能级,且每个能级上的电子数相等,其核外电子排布式为1s22s22p2,故Y为C元素;R与Y同一主族,结合原子序数可知,R为Si元素;而Z原子未成对电子数在同周期元素中最多,则价电子排布式为ns2np3,原子序数小于Si,故Z为N元素;W与Z同周期且第一电离能比Z的小,则W为O元素;Q原子的最外层只有一个电子,其他电子层均处于饱和状态,不可能为短周期元素,且原子序数小于30,故核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,则Q为Cu元素。
(1)Cu+核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10。
(2)化合物H2O2的结构式为H—O—O—H,O原子价电子对数为4,故O原子采取sp3杂化;N中N原子的孤电子对数为=1,价电子对数为2+1=3,故其空间结构是角形。
(3)Y、R的最高价氧化物分别为二氧化碳、二氧化硅,SiO2为共价晶体,CO2为分子晶体,故沸点较高的是SiO2。
(4)碳有多种同素异形体,其中一种同素异形体的晶胞结构如题图,该晶体一个晶胞所含的Y原子数为4+8×+6×=8;每个Y原子与周围的4个Y原子相邻,故Y原子的配位数为4;若晶胞的边长为a pm,则晶胞体积为(a×10-10)3 cm3,晶体的密度为ρ g·cm-3,则晶胞质量为(a×10-10)3 cm3×ρ g·cm-3=ρa3×10-30g,则8×=ρa3×10-30 g,故NA=。
17.答案 (1)4 6 (2)CuI +1价 (3)配位 sp3 H3O+
解析 (1)黑色球表示氯离子,白色球表示钠离子,该晶胞中钠离子数目=1+12×=4,氯离子数目=×8+×6=4,所以每个NaCl晶胞中含有的Na+和Cl-的数目均是4,一个钠离子周围最近且等距离的氯离子有6个。
(2)根据A的晶胞结构可知,黑球的个数是×8+×6=4,白球的个数为4,所以A的化学式是CuI,A中铜元素显+1价。
(3)NH3中N原子提供孤电子对,Cu2+提供空轨道,二者形成配位键,NH3分子中,N原子的孤电子对数为1,成键电子对数为3,则N原子的杂化方式为sp3;与NH3分子互为等电子体的阳离子具有相同的价电子数8和原子数4,可以是H3O+等。
18.答案 (1)①氢键、范德华力 ②CO2的分子直径小于笼状空腔直径,且与H2O的结合能大于CH4与H2O之间的结合能
(2)H2O与CH3CH2OH之间可以形成氢键
解析 (1)②根据题给数据可知,笼状结构的空腔直径是0.586 nm,而CO2分子的直径是0.512 nm,笼状空腔直径大于CO2分子的直径,而且CO2与H2O之间的结合能大于CH4与H2O之间的结合能,因此可以实现用CO2置换CH4的设想。
(2)水可以与乙醇互溶,除因为它们都是极性分子外,还因为H2O与CH3CH2OH之间可以形成分子间氢键。
19.答案 (1)原子光谱
(2)M 3
(3)三角锥形 > 低于 NH3分子间能形成氢键,而PH3不能
(4)正八面体 ×107
解析 (2)基态磷原子中,电子占据的最高电子层符号为M,能量最高的电子在3p能级,在空间有3个伸展方向。(3)N、P为同主族元素,PH3和NH3的空间结构相同,NH3为三角锥形,则PH3为三角锥形;同周期元素的第一电离能随原子序数的递增,有增大的趋势,但核外电子排布满足全充满或半充满状态时,第一电离能大于其后面的元素的第一电离能,故I1(P)>I1(S);氢键对物质的熔、沸点影响较大,氨气分子间存在氢键,磷化氢中无氢键,则磷化氢的沸点低于氨气。(4)观察磷青铜晶体的晶胞结构,Cu原子位于正方体的六个面的中心位置,形成正八面体的结构;P原子与最近的Cu原子之间的距离为棱长的,Sn原子个数为8×=1,Cu原子个数为6×=3,P原子个数为1,化学式为SnCu3P,摩尔质量为342 g·mol-1,1 mol SnCu3P的体积为,晶胞的体积为 cm3,棱长= cm,P与最近的Cu原子的核间距为×107 nm。
20.答案 (1)第4周期ⅠB族 [Ar]3d84s2(或1s22s22p63s23p63d84s2)
(2)分子晶体 共价晶体
(3)12
解析 (1)铜元素位于第4周期ⅠB族;Ni为28号元素,基态镍原子的核外电子排布式为[Ar]3d84s2或1s22s22p63s23p63d84s2。
(2)Fe(CO)x晶体熔、沸点较低,易溶于非极性溶剂,所以属于分子晶体;由CO2在高温高压下所形成的晶体的晶胞图可知,在晶胞中原子之间通过共价键结合形成空间网状结构,故属于共价晶体。
(3)金属铜中原子采用面心立方最密堆积,铜原子配位数为12。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
