2024鲁科版化学必修第一册练习题--分层作业10 离子反应(含解析)
文档属性
| 名称 | 2024鲁科版化学必修第一册练习题--分层作业10 离子反应(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 488.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 11:57:26 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024鲁科版化学必修第一册练习题
第2章 分层作业10 离子反应
A级 必备知识基础练
1.下列各组溶液中的两个反应,可用同一离子方程式表示的是( )
A.BaCO3和HCl、BaCO3和H2SO4
B.BaCl2和H2SO4、Ba(OH)2和H2SO4
C.HNO3和K2CO3、HCl和NaHCO3
D.KOH和H2SO4、Ba(OH)2和HNO3
2.下列反应的离子方程式书写正确的是( )
A.CH3COOH和CaCO3反应:2CH3COOH+C══2CH3COO-+CO2↑+H2O
B.钠与水反应:Na+2H2O══Na++2OH-+H2↑
C.铜片插入硝酸银溶液:Ag++Cu══Ag+Cu2+
D.用小苏打治疗胃酸过多:HC+H+══CO2↑+H2O
3.在酸性溶液中能大量共存而且为无色透明溶液的是( )
A.N、Al3+、S、N
B.K+、Na+、N、C
C.K+、Mn、N、N
D.Na+、K+、HC、N
4.下列离子方程式中正确的是( )
A.澄清石灰水与稀盐酸反应Ca(OH)2+2H+══Ca2++2H2O
B.氢氧化钡与硫酸反应OH-+H+══H2O
C.Fe片插入硝酸银溶液中Fe+Ag+══Fe2++Ag
D.氯化镁溶液与氢氧化钠溶液反应Mg2++2OH-══Mg(OH)2↓
5.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1NaOH溶液:Na+、K+、C、S
B.0.1 mol·L-1MgCl2溶液:K+、Ba2+、S、N
C.0.1 mol·L-1K2CO3溶液:Na+、Ba2+、Cl-、OH-
D.0.1 mol·L-1H2SO4溶液:K+、N、N、CH3COO-
6.下列离子方程式书写正确的是( )
A.碳酸钠与足量盐酸反应:C+2H+══CO2↑+H2O
B.铁粉与稀硫酸反应:2Fe+6H+══2Fe3++3H2↑
C.向盐酸中滴入氢氧化钠溶液:HCl+OH-══H2O+Cl-
D.稀硝酸滴在石灰石上:C+2H+══CO2↑+H2O
7.下列各组离子在给定条件下能大量共存的是( )
A.滴加无色酚酞溶液呈红色的溶液中:Na+、K+、S、C
B.无色透明的溶液中:Cu2+、K+、S、N
C.滴加紫色石蕊溶液呈红色的溶液中:Na+、K+、C、N
D.强碱性溶液:Na+、Mg2+、S、Cl-
8.粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④过滤;
⑤滴入稀盐酸至无气泡产生。
正确的操作顺序是( )
A.①③②④⑤ B.③②①④⑤
C.②③①⑤④ D.③④②①⑤
9.现有下列几种物质:①铝;②蔗糖;③CO2;④H2SO4;⑤Ba(OH)2;⑥红褐色的氢氧化铁胶体;⑦HCl;⑧冰水混合物;⑨碳酸钙;⑩CuSO4·5H2O。按要求填写下列空白。
(1)上述物质中属于电解质的有 (填序号)。
(2)向⑥中逐渐滴加⑦的溶液,看到的现象是 。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为H++OH-══H2O,则该反应的化学方程式为 。
(4)书写下列反应的离子方程式。
①将NH4Cl溶液和NaOH溶液混合: 。
②醋酸溶液和NaHCO3溶液混合: 。
B级 关键能力提升练
10.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.所含溶质为NaHSO4的溶液:加入K+、C、N、Na+
B.滴加酚酞溶液变红的溶液:加入S、Cu2+、K+、Cl-
C.含有大量S的溶液:加入K+、Cu2+、Cl-、N
D.常温下,加入铁粉能生成H2的溶液:Na+、Ca2+、Cl-、C
11.关于粗盐提纯的下列说法正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.将制得的食盐晶体转移到新制过滤器中用大量水进行洗涤
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.为除去粗盐中的Ca2+、Mg2+、S,可依次向溶液中加入足量的碳酸钠溶液、氢氧化钠溶液、氯化钡溶液、稀盐酸
12.下列离子方程式书写正确的是( )
A.向碳酸氢钠溶液中加入盐酸:HC+H+══CO2↑+H2O
B.向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
C.氢氧化铜与稀硫酸反应:H++OH-══H2O
D.澄清石灰水与碳酸钠溶液反应:C+Ca(OH)2══CaCO3↓+2OH-
13.离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HC的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
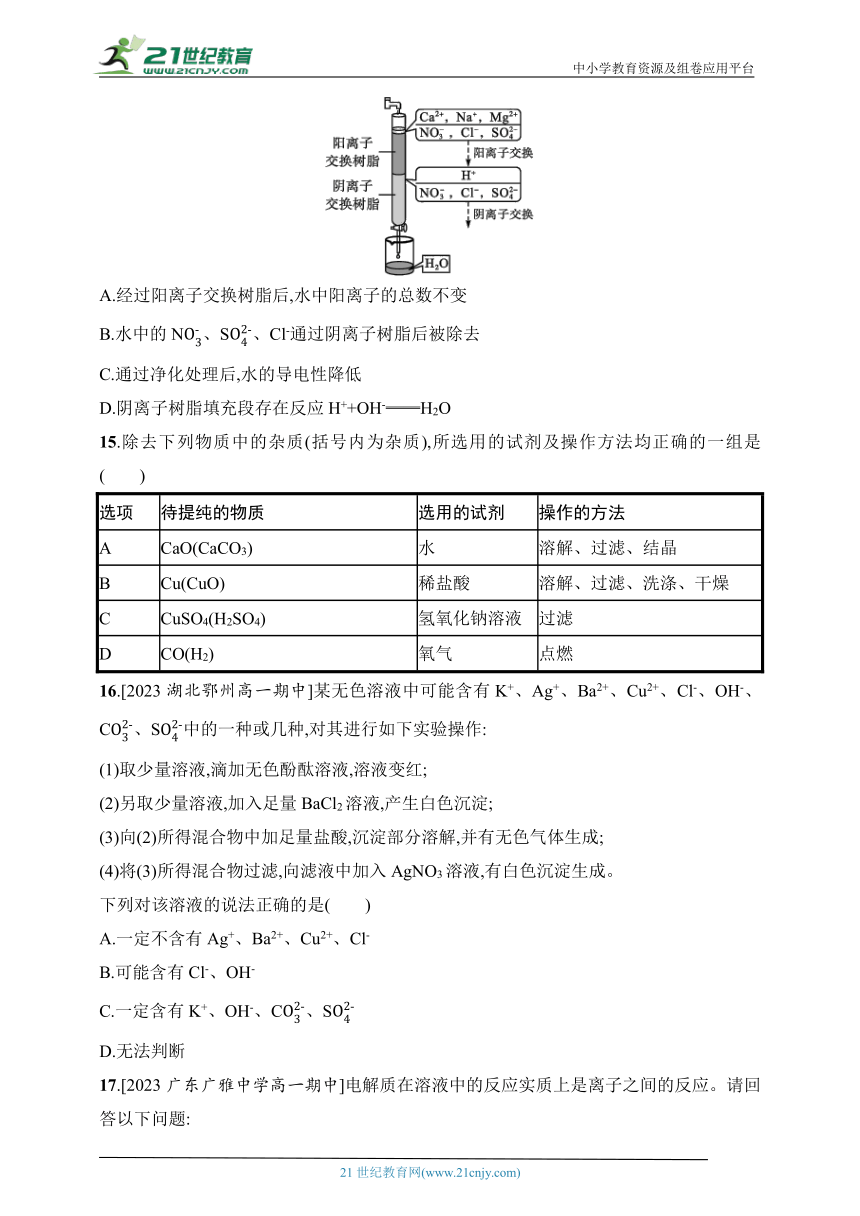
14.离子交换法净化水过程如图所示。下列说法中错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的N、S、Cl-通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH-══H2O
15.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是( )
选项 待提纯的物质 选用的试剂 操作的方法
A CaO(CaCO3) 水 溶解、过滤、结晶
B Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥
C CuSO4(H2SO4) 氢氧化钠溶液 过滤
D CO(H2) 氧气 点燃
16.[2023湖北鄂州高一期中]某无色溶液中可能含有K+、Ag+、Ba2+、Cu2+、Cl-、OH-、C、S中的一种或几种,对其进行如下实验操作:
(1)取少量溶液,滴加无色酚酞溶液,溶液变红;
(2)另取少量溶液,加入足量BaCl2溶液,产生白色沉淀;
(3)向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;
(4)将(3)所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成。
下列对该溶液的说法正确的是( )
A.一定不含有Ag+、Ba2+、Cu2+、Cl-
B.可能含有Cl-、OH-
C.一定含有K+、OH-、C、S
D.无法判断
17.[2023广东广雅中学高一期中]电解质在溶液中的反应实质上是离子之间的反应。请回答以下问题:
(1)有四种物质:a.氧化铁;b.盐酸;c.碳酸氢钠;d.氢氧化钠。
①写出其中盐的电离方程式: 。
②上述物质中有一种与其他三种物质均能反应,此物质是 (填字母)。
③写出c和d两种溶液反应的离子方程式: 。
(2)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程图如右(已知溶液2为无色溶液):
①分离得到沉淀1和溶液1的实验中,使用到的玻璃仪器有 。
②沉淀3的化学式: 。
③“溶液1+B”生成沉淀2的离子方程式为 。
18.有一瓶溶液只含Cl-、C、S、Na+、Mg2+、Cu2+六种离子中的某几种。进行下列实验:
①原溶液白色沉淀。
②原溶液中加BaCl2溶液不产生沉淀。
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
回答下列问题:
(1)试分析原溶液中一定含有的离子是 ,一定不含有的离子是 ,可能含有的离子是 。
(2)有的同学认为实验③可以省略,你认为是否正确 (填“是”或“否”),理由是 。
19.某同学用某种粗盐进行提纯实验,步骤见下图。
请回答下列问题:
(1)步骤①和②的操作名称是 。
(2)步骤③判断加入盐酸“适量”的方法是 ;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了 ,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 验证的方法 现象 结论
猜想Ⅰ:固体A中可能含CaCO3、MgCO3 取少量固体A置于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 猜想Ⅰ成立
猜想Ⅱ:固体A中含BaCO3 取少量固体A置于试管中,先滴入 ,再滴入Na2SO4溶液 有气泡放出,无白色沉淀
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 取少量NaCl晶体溶于试管中的蒸馏水中, 猜想Ⅲ成立
C级 学科情境创新练
20.电解质溶于水时会发生电离而产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20 mL 0.01 mol·L-1Ba(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2 mol·L-1H2SO4溶液,获得电导率随时间变化的曲线图。
(1)0~80 s在烧杯中观察到的实验现象是 。
(2)写出该实验中涉及反应的离子方程式: 。
(3)截至b点,加入0.2 mol·L-1H2SO4溶液的体积为 mL,解释b点的电导率不等于零和bc段电导率又增大的原因: 。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是 。
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
答案:
1.D 解析 BaCO3+2H+══Ba2++CO2↑+H2O,BaCO3+2H++S══BaSO4↓+CO2↑+H2O, A错误;Ba2++S══BaSO4↓,Ba2++2OH-+2H++S══BaSO4↓+2H2O,B错误; C+2H+══CO2↑+H2O,HC+H+══CO2↑+H2O,C错误;D项中两个反应的离子方程式均为OH-+H+══H2O,D正确。
2.D 解析 CH3COOH和CaCO3反应的离子方程式为2CH3COOH+CaCO3══2CH3COO-+Ca2++CO2↑+H2O,A错误;钠与水反应的离子方程式为2Na+2H2O══2Na++2OH-+H2↑,B错误;铜与硝酸银溶液反应的离子方程式为2Ag++Cu══2Ag+Cu2+,C错误;小苏打的成分是碳酸氢钠,胃酸的主要成分为HCl,用小苏打治疗胃酸过多时发生反应的离子方程式为HC+H+══CO2↑+H2O,D正确。
3.A 解析 B项,2H++C══CO2↑+H2O,不能大量共存;C项,Mn为红色,不符合题意;D项,HC+H+══CO2↑+H2O,不能大量共存。
4.D 解析 澄清石灰水中的Ca(OH)2在离子方程式中应该拆成离子,离子方程式为OH-+H+══H2O,A项错误;Ba2+和S结合可生成BaSO4沉淀,Ba(OH)2和H2SO4反应的离子方程式为Ba2++2OH-+S+2H+══BaSO4↓+2H2O,B项错误;Fe片插入硝酸银溶液中,铁会置换出银,离子方程式为Fe+2Ag+══Fe2++2Ag,C项错误;氯化镁溶液与氢氧化钠溶液反应会生成氢氧化镁沉淀,D项正确。
5.A 解析 Na+、K+、C、S能大量共存,且与NaOH溶液不反应,A项符合题意;Ba2+与S反应生成BaSO4沉淀,Ba2+与S不能大量共存,B项不符合题意;Ba2+与C反应生成BaCO3沉淀,0.1 mol·L-1K2CO3溶液中Ba2+不能大量存在,C项不符合题意;醋酸是弱酸,0.1 mol·L-1 H2SO4溶液中不能大量存在CH3COO-,D项不符合题意。
6.A 解析 铁粉与稀硫酸反应生成FeSO4和H2,反应的离子方程式为Fe+2H+══Fe2++H2↑,B错误;HCl是强酸,要拆分成离子形式,HCl与NaOH反应的离子方程式为H++OH-══H2O,C错误;石灰石的主要成分是CaCO3,难溶于水,要用化学式表示,反应的离子方程式为CaCO3+2H+══Ca2++CO2↑+H2O,D错误。
7.A 解析 滴加无色酚酞溶液呈红色的溶液显碱性,A项中四种离子相互之间不反应,也不与OH-反应,可以大量共存,A正确;无色透明的溶液中,Cu2+不能大量存在,B错误;滴加紫色石蕊溶液呈红色的溶液显酸性,C与H+反应生成CO2和H2O,不能大量存在,C错误;强碱性溶液中含大量OH-,Mg2+与OH-生成Mg(OH)2沉淀而不能大量共存,D错误。
8.B 解析 粗盐的提纯过程中,用碳酸钠溶液除去钙离子,用氢氧化钠溶液除去镁离子,用氯化钡溶液除去硫酸根离子,为保证杂质离子除尽,所加试剂要过量,过量的离子也要除去,故碳酸钠溶液的作用为除去钙离子和过量的钡离子,故①应在③之后,然后过滤,向滤液中滴加盐酸至无气泡产生,可除去过量的氢氧化钠和碳酸钠。
9.答案 (1)④⑤⑦⑧⑨⑩
(2)开始产生红褐色沉淀,后来沉淀溶解消失
(3)Ba(OH)2+2HCl══BaCl2+2H2O
(4)①N+OH-══NH3·H2O ②CH3COOH+HC══CH3COO-+H2O+CO2↑
解析 (1)①铝为金属单质,既不是电解质也不是非电解质;②蔗糖在熔融状态和水溶液中都不能导电,是非电解质;③CO2自身不能电离,是非电解质;④H2SO4是酸,在水溶液中能电离出离子,是电解质;⑤Ba(OH)2是碱,在水溶液和熔融状态下能电离出离子,是电解质;⑥红褐色的氢氧化铁胶体是混合物,既不是电解质也不是非电解质;⑦HCl在水溶液中能电离产生自由移动的离子,可以导电,是电解质;⑧冰水混合物的成分是水,属于化合物,水为电解质;⑨碳酸钙在熔融状态下导电,属于电解质;⑩CuSO4·5H2O是盐的结晶水合物,在水溶液中能够电离产生自由移动的离子,可以导电,属于电解质。根据上述分析可知:属于电解质的是④⑤⑦⑧⑨⑩。
(2)盐酸是电解质HCl的水溶液,氢氧化铁胶体遇到盐酸时,胶体粒子首先发生聚沉,生成红褐色氢氧化铁沉淀;再滴加盐酸,氢氧化铁沉淀与盐酸发生酸碱中和反应生成可溶性氯化铁和水,因此看到的实验现象是先有红褐色沉淀产生,后沉淀逐渐溶解。
(3)离子方程式H++OH-══H2O代表强酸和强碱反应生成可溶性的盐和水的反应,符合条件的反应为Ba(OH)2+2HCl══BaCl2+2H2O。
(4)①将NH4Cl溶液和NaOH溶液混合,发生反应的离子方程式为N+OH-══NH3·H2O;②由于酸性CH3COOH>H2CO3,所以根据复分解反应的规律,将醋酸溶液和NaHCO3溶液混合发生反应的离子方程式为CH3COOH+HC══CH3COO-+H2O+CO2↑。
10.C 解析 NaHSO4溶液中含大量H+,C与H+反应生成CO2和H2O而不能大量共存,A错误;滴加酚酞溶液变红的溶液呈碱性,含大量OH-,Cu2+与OH-结合生成Cu(OH)2沉淀而不能大量共存,B错误;加入铁粉生成H2的溶液呈强酸性,含大量H+,C与H+、Ca2+均发生反应而不能大量共存,D错误。
11.C 解析 溶解时不是越稀越好,如果溶液太稀,蒸发时就要消耗很长时间才能蒸干,A错误;晶体应该用少量水洗涤,否则制得的晶体会有很多溶于水,B错误;蒸发时,当有大量晶体析出时应停止加热,利用余热蒸干,以免晶体受热后飞溅出来,不仅造成损失,而且可能因此发生意外事故,C正确;由于过量的钡离子需要碳酸钠除去,则为除去粗盐中的Ca2+、Mg2+、S,可依次向溶液中加入足量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液,然后过滤,再向滤液中加入稀盐酸,D错误。
12.A 解析 向碳酸氢钠溶液中加入盐酸,反应的离子方程式为HC+H+══CO2↑+H2O,故A正确;向沸水中滴加饱和的FeCl3溶液制得Fe(OH)3胶体,不是Fe(OH)3沉淀,该反应的离子方程式为Fe3++3H2OFe(OH)3(胶体)+3H+,故B错误;氢氧化铜与稀硫酸反应,离子方程式为2H++Cu(OH)2══2H2O+Cu2+,故C错误;澄清石灰水与碳酸钠溶液反应的离子方程式为C+Ca2+══CaCO3↓,故D错误。
13.D 解析 向澄清石灰水中通入CO2,当CO2适量时发生反应Ca(OH)2+CO2══CaCO3↓+H2O,该反应的离子方程式为Ca2++2OH-+CO2══CaCO3↓+H2O,当CO2过量时发生反应CaCO3+CO2+H2O══Ca(HCO3)2,该反应的离子方程式为CaCO3+CO2+H2O══Ca2++2HC。所以向澄清石灰水中通入过量的CO2,先生成碳酸钙沉淀,钙离子、氢氧根离子浓度减小,溶液导电能力减弱,后沉淀溶解生成碳酸氢钙溶液,钙离子、碳酸氢根离子的浓度增大,最终钙离子的浓度与原来几乎相等,碳酸氢根离子的浓度与原来氢氧根离子浓度几乎相等,但OH-的摩尔电导率大于HC的摩尔电导率,所以最后溶液的导电性小于原来的导电性,最后CaCO3全部溶解后,溶液中离子的浓度不再发生变化,即导电能力趋于稳定。
14.A 解析 本题考查了离子交换法净化水的过程分析。根据图示可以看出,通过阳离子交换树脂后,原有的Ca2+、Na+、Mg2+被换为了H+,根据电荷守恒可知,阳离子数目增多,A项错误;通过阴离子交换树脂后,阴离子N、Cl-、S被OH-交换,B项正确;在阴离子交换树脂上同时发生反应:H++OH-══H2O,D项正确;由于多数阴、阳离子被除去,变为较为纯净的水,故水的导电性减弱,C项正确。
15.B 解析 在混合物中加水后,氧化钙会与水反应生成氢氧化钙,而碳酸钙不会与水反应,过滤、结晶后得不到CaO,故A项错误;在混合物中加入稀盐酸,氧化铜会与稀盐酸反应而溶解,铜不会与稀盐酸反应,过滤后再进行洗涤、干燥即可得到铜,故B项正确;混合物中加入氢氧化钠溶液,氢氧化钠既会与硫酸反应,也会与硫酸铜反应,杂质除去了,主要物质也除去了,故C项错误;一氧化碳和氢气都可以在氧气中燃烧,故D项错误。
16.C 解析 该溶液无色则一定没有Cu2+;(1)取少量溶液,滴加无色酚酞溶液,溶液变红,说明溶液显碱性,一定有OH-,则一定没有Ag+;(2)另取少量溶液,加入足量BaCl2溶液,产生白色沉淀,该白色沉淀可能是BaCO3或BaSO4或BaCO3和BaSO4;(3)向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成,说明该沉淀是BaCO3和BaSO4的混合物,则说明溶液中一定存在C和S,则原溶液一定没有Ba2+;(4)将(3)所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成,因(2)步加入了BaCl2,此步得到的白色沉淀AgCl无法证明Cl-的来源。综上所述,溶液中一定存在阴离子OH-、C、S,Cl-不能确定,阳离子Ag+、Ba2+、Cu2+一定没有,根据电中性原则,溶液中一定有K+,故选C。
17.答案 (1)①NaHCO3══Na++HC ②b ③HC+OH-══H2O+C
(2)①烧杯、漏斗和玻璃棒 ②BaSO4 ③Cu2++2OH-══Cu(OH)2↓
解析 (1)①四种物质分别是氧化物、酸、盐和碱。碳酸氢钠的电离方程式为NaHCO3══Na++HC。②氧化铁是碱性氧化物可溶于盐酸生成氯化铁,碳酸氢钠可与盐酸反应生成二氧化碳气体,氢氧化钠可与盐酸发生中和反应生成盐和水。
(2)①用过滤的方法可分离得到沉淀1和溶液1,使用到的玻璃仪器有烧杯、漏斗和玻璃棒;②用NaOH溶液、盐酸和Na2SO4溶液将Ba2+、Cu2+、Ag+三种离子逐一沉淀分离,因盐酸引入Cl-所引发的沉淀只有AgCl而放第一步,故试剂A是盐酸,沉淀1是AgCl。溶液2为无色溶液,故试剂B是氢氧化钠,沉淀2是氢氧化铜。试剂C是硫酸钠,沉淀3为硫酸钡,其化学式为BaSO4。
18.答案 (1)Mg2+、Cl- C、S、Cu2+ Na+
(2)是 溶液呈电中性,必须同时含有阴、阳离子
解析 (1)实验①说明原溶液中肯定存在Mg2+,肯定不存在Cu2+和C;实验②说明原溶液中一定不存在C和S;实验③表明原溶液中一定存在Cl-。综上所述,原溶液中一定含有Mg2+、Cl-,一定不含有S、C及Cu2+,可能含有Na+。
(2)该同学的想法正确,因为任何溶液均呈现电中性,而溶液呈电中性则必须同时含有阴、阳离子。
19.答案 (1)过滤
(2)滴加盐酸至无气泡产生为止 防止溶液飞溅
(3)有气泡放出,澄清石灰水变浑浊 稀盐酸(或稀硝酸) 猜想Ⅱ不成立 滴入BaCl2溶液和稀盐酸 有白色沉淀且不溶于稀盐酸
解析 将粗盐溶于水,然后采用过滤的方法除去难溶性泥沙,得到滤液1,向滤液1中加入过量碳酸钠溶液,搅拌,然后过滤除去难溶性固体A,得到滤液2,向滤液2中加入适量稀盐酸,过量碳酸钠与稀盐酸反应得到氯化钠,将氯化钠溶液蒸发得到氯化钠晶体。
(1)步骤①和②都是将不溶于液体的固体和液体分离,操作方法都是过滤。
(2)盐酸与过量的碳酸钠反应生成氯化钠、水和二氧化碳,滴加盐酸至无气泡产生为止,说明刚好与碳酸钠反应完;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热造成液滴飞溅;当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想Ⅰ:碳酸盐能和稀盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以可以用澄清石灰水检验二氧化碳,如果有气泡放出且澄清石灰水变浑浊,则说明猜想Ⅰ成立;猜想Ⅱ:碳酸根离子可以用稀盐酸或稀硝酸检验,所以滴加的试剂是稀盐酸或稀硝酸,钡离子可以用可溶性的硫酸盐检验,如果有气泡冒出说明含有碳酸根离子,如果不产生白色沉淀说明不含钡离子,则猜想Ⅱ不成立;猜想Ⅲ:要检验硫酸根离子,将固体溶于水,滴入BaCl2溶液和稀盐酸,观察到有白色沉淀且不溶于稀盐酸,则猜想Ⅲ成立。
20.答案 (1)产生白色沉淀,溶液红色褪去
(2)2H++S+Ba2++2OH-══BaSO4↓+2H2O
(3)1 b点:BaSO4在水中溶解度很小,溶液中S和Ba2+浓度很小但不等于零,溶液中有自由移动的离子,电导率不等于零。bc段:b点溶液中的Ba(OH)2被反应完,溶液中自由移动的离子浓度达到最小值,随着H2SO4溶液的不断滴加,溶液中H+和S浓度又增大,自由移动离子浓度变大,则bc段电导率增大
(4)ABCE
解析 (1)0~80 s,Ba(OH)2是强电解质,开始滴定时溶液中离子浓度较大,溶液的电导率大,随反应的进行,溶液中钡离子生成硫酸钡沉淀,氢氧根离子变成水,恰好完全反应时,溶液中主要是水和极少量溶解的硫酸钡。观察到的实验现象是产生白色沉淀,溶液红色褪去,电导率减小。
(2)该实验中硫酸与氢氧化钡反应生成硫酸钡沉淀和水,该反应的离子方程式为2H++S+Ba2++2OH-══BaSO4↓+2H2O。
(3)截至b点,加入0.2 mol·L-1H2SO4溶液的体积为V=20×10-3 L×0.01 mol·L-1÷0.2 mol·L-1=0.001 L=1 mL;b点:BaSO4在水中溶解度很小,溶液中S和Ba2+浓度很小但不等于零,溶液中有自由移动的离子,电导率不等于零。bc段:b点溶液中的Ba(OH)2被反应完,溶液中自由移动的离子浓度达到最小值,随着H2SO4溶液的不断滴加,溶液中H+和S浓度变大,自由移动离子浓度变大,bc段电导率增大。
(4)溶液中Ba2+与S反应生成硫酸钡沉淀,OH-与H+结合生成水,曲线①中a点溶液的导电能力接近0,则①代表滴加H2SO4溶液的变化曲线,故A正确;②是NaHSO4溶液与氢氧化钡反应,b点时,氢氧化钡与硫酸氢钠以物质的量之比1∶1反应生成硫酸钡、水和NaOH,溶液中有NaOH,溶液中大量存在的离子是Na+、OH-,故B正确;a、d两点均将氢氧化钡全部反应,a点硫酸与氢氧化钡恰好反应生成硫酸钡和水,d点硫酸氢钠与氢氧化钡恰好反应生成硫酸钡、硫酸钠和水,a和d对应的溶液均显中性,故C正确;c点,两溶液中导电能力相同,曲线①体系中硫酸过量,溶液呈酸性,曲线②体系中OH-未被完全中和,溶液呈碱性,OH-含量不相同,故D错误;根据曲线①和②导电能力的变化幅度分析,H+导电能力比Na+强,故E正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁科版化学必修第一册练习题
第2章 分层作业10 离子反应
A级 必备知识基础练
1.下列各组溶液中的两个反应,可用同一离子方程式表示的是( )
A.BaCO3和HCl、BaCO3和H2SO4
B.BaCl2和H2SO4、Ba(OH)2和H2SO4
C.HNO3和K2CO3、HCl和NaHCO3
D.KOH和H2SO4、Ba(OH)2和HNO3
2.下列反应的离子方程式书写正确的是( )
A.CH3COOH和CaCO3反应:2CH3COOH+C══2CH3COO-+CO2↑+H2O
B.钠与水反应:Na+2H2O══Na++2OH-+H2↑
C.铜片插入硝酸银溶液:Ag++Cu══Ag+Cu2+
D.用小苏打治疗胃酸过多:HC+H+══CO2↑+H2O
3.在酸性溶液中能大量共存而且为无色透明溶液的是( )
A.N、Al3+、S、N
B.K+、Na+、N、C
C.K+、Mn、N、N
D.Na+、K+、HC、N
4.下列离子方程式中正确的是( )
A.澄清石灰水与稀盐酸反应Ca(OH)2+2H+══Ca2++2H2O
B.氢氧化钡与硫酸反应OH-+H+══H2O
C.Fe片插入硝酸银溶液中Fe+Ag+══Fe2++Ag
D.氯化镁溶液与氢氧化钠溶液反应Mg2++2OH-══Mg(OH)2↓
5.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1NaOH溶液:Na+、K+、C、S
B.0.1 mol·L-1MgCl2溶液:K+、Ba2+、S、N
C.0.1 mol·L-1K2CO3溶液:Na+、Ba2+、Cl-、OH-
D.0.1 mol·L-1H2SO4溶液:K+、N、N、CH3COO-
6.下列离子方程式书写正确的是( )
A.碳酸钠与足量盐酸反应:C+2H+══CO2↑+H2O
B.铁粉与稀硫酸反应:2Fe+6H+══2Fe3++3H2↑
C.向盐酸中滴入氢氧化钠溶液:HCl+OH-══H2O+Cl-
D.稀硝酸滴在石灰石上:C+2H+══CO2↑+H2O
7.下列各组离子在给定条件下能大量共存的是( )
A.滴加无色酚酞溶液呈红色的溶液中:Na+、K+、S、C
B.无色透明的溶液中:Cu2+、K+、S、N
C.滴加紫色石蕊溶液呈红色的溶液中:Na+、K+、C、N
D.强碱性溶液:Na+、Mg2+、S、Cl-
8.粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④过滤;
⑤滴入稀盐酸至无气泡产生。
正确的操作顺序是( )
A.①③②④⑤ B.③②①④⑤
C.②③①⑤④ D.③④②①⑤
9.现有下列几种物质:①铝;②蔗糖;③CO2;④H2SO4;⑤Ba(OH)2;⑥红褐色的氢氧化铁胶体;⑦HCl;⑧冰水混合物;⑨碳酸钙;⑩CuSO4·5H2O。按要求填写下列空白。
(1)上述物质中属于电解质的有 (填序号)。
(2)向⑥中逐渐滴加⑦的溶液,看到的现象是 。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为H++OH-══H2O,则该反应的化学方程式为 。
(4)书写下列反应的离子方程式。
①将NH4Cl溶液和NaOH溶液混合: 。
②醋酸溶液和NaHCO3溶液混合: 。
B级 关键能力提升练
10.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.所含溶质为NaHSO4的溶液:加入K+、C、N、Na+
B.滴加酚酞溶液变红的溶液:加入S、Cu2+、K+、Cl-
C.含有大量S的溶液:加入K+、Cu2+、Cl-、N
D.常温下,加入铁粉能生成H2的溶液:Na+、Ca2+、Cl-、C
11.关于粗盐提纯的下列说法正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.将制得的食盐晶体转移到新制过滤器中用大量水进行洗涤
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.为除去粗盐中的Ca2+、Mg2+、S,可依次向溶液中加入足量的碳酸钠溶液、氢氧化钠溶液、氯化钡溶液、稀盐酸
12.下列离子方程式书写正确的是( )
A.向碳酸氢钠溶液中加入盐酸:HC+H+══CO2↑+H2O
B.向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
C.氢氧化铜与稀硫酸反应:H++OH-══H2O
D.澄清石灰水与碳酸钠溶液反应:C+Ca(OH)2══CaCO3↓+2OH-
13.离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HC的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
14.离子交换法净化水过程如图所示。下列说法中错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的N、S、Cl-通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH-══H2O
15.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是( )
选项 待提纯的物质 选用的试剂 操作的方法
A CaO(CaCO3) 水 溶解、过滤、结晶
B Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥
C CuSO4(H2SO4) 氢氧化钠溶液 过滤
D CO(H2) 氧气 点燃
16.[2023湖北鄂州高一期中]某无色溶液中可能含有K+、Ag+、Ba2+、Cu2+、Cl-、OH-、C、S中的一种或几种,对其进行如下实验操作:
(1)取少量溶液,滴加无色酚酞溶液,溶液变红;
(2)另取少量溶液,加入足量BaCl2溶液,产生白色沉淀;
(3)向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;
(4)将(3)所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成。
下列对该溶液的说法正确的是( )
A.一定不含有Ag+、Ba2+、Cu2+、Cl-
B.可能含有Cl-、OH-
C.一定含有K+、OH-、C、S
D.无法判断
17.[2023广东广雅中学高一期中]电解质在溶液中的反应实质上是离子之间的反应。请回答以下问题:
(1)有四种物质:a.氧化铁;b.盐酸;c.碳酸氢钠;d.氢氧化钠。
①写出其中盐的电离方程式: 。
②上述物质中有一种与其他三种物质均能反应,此物质是 (填字母)。
③写出c和d两种溶液反应的离子方程式: 。
(2)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程图如右(已知溶液2为无色溶液):
①分离得到沉淀1和溶液1的实验中,使用到的玻璃仪器有 。
②沉淀3的化学式: 。
③“溶液1+B”生成沉淀2的离子方程式为 。
18.有一瓶溶液只含Cl-、C、S、Na+、Mg2+、Cu2+六种离子中的某几种。进行下列实验:
①原溶液白色沉淀。
②原溶液中加BaCl2溶液不产生沉淀。
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
回答下列问题:
(1)试分析原溶液中一定含有的离子是 ,一定不含有的离子是 ,可能含有的离子是 。
(2)有的同学认为实验③可以省略,你认为是否正确 (填“是”或“否”),理由是 。
19.某同学用某种粗盐进行提纯实验,步骤见下图。
请回答下列问题:
(1)步骤①和②的操作名称是 。
(2)步骤③判断加入盐酸“适量”的方法是 ;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了 ,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 验证的方法 现象 结论
猜想Ⅰ:固体A中可能含CaCO3、MgCO3 取少量固体A置于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 猜想Ⅰ成立
猜想Ⅱ:固体A中含BaCO3 取少量固体A置于试管中,先滴入 ,再滴入Na2SO4溶液 有气泡放出,无白色沉淀
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 取少量NaCl晶体溶于试管中的蒸馏水中, 猜想Ⅲ成立
C级 学科情境创新练
20.电解质溶于水时会发生电离而产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20 mL 0.01 mol·L-1Ba(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2 mol·L-1H2SO4溶液,获得电导率随时间变化的曲线图。
(1)0~80 s在烧杯中观察到的实验现象是 。
(2)写出该实验中涉及反应的离子方程式: 。
(3)截至b点,加入0.2 mol·L-1H2SO4溶液的体积为 mL,解释b点的电导率不等于零和bc段电导率又增大的原因: 。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是 。
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
答案:
1.D 解析 BaCO3+2H+══Ba2++CO2↑+H2O,BaCO3+2H++S══BaSO4↓+CO2↑+H2O, A错误;Ba2++S══BaSO4↓,Ba2++2OH-+2H++S══BaSO4↓+2H2O,B错误; C+2H+══CO2↑+H2O,HC+H+══CO2↑+H2O,C错误;D项中两个反应的离子方程式均为OH-+H+══H2O,D正确。
2.D 解析 CH3COOH和CaCO3反应的离子方程式为2CH3COOH+CaCO3══2CH3COO-+Ca2++CO2↑+H2O,A错误;钠与水反应的离子方程式为2Na+2H2O══2Na++2OH-+H2↑,B错误;铜与硝酸银溶液反应的离子方程式为2Ag++Cu══2Ag+Cu2+,C错误;小苏打的成分是碳酸氢钠,胃酸的主要成分为HCl,用小苏打治疗胃酸过多时发生反应的离子方程式为HC+H+══CO2↑+H2O,D正确。
3.A 解析 B项,2H++C══CO2↑+H2O,不能大量共存;C项,Mn为红色,不符合题意;D项,HC+H+══CO2↑+H2O,不能大量共存。
4.D 解析 澄清石灰水中的Ca(OH)2在离子方程式中应该拆成离子,离子方程式为OH-+H+══H2O,A项错误;Ba2+和S结合可生成BaSO4沉淀,Ba(OH)2和H2SO4反应的离子方程式为Ba2++2OH-+S+2H+══BaSO4↓+2H2O,B项错误;Fe片插入硝酸银溶液中,铁会置换出银,离子方程式为Fe+2Ag+══Fe2++2Ag,C项错误;氯化镁溶液与氢氧化钠溶液反应会生成氢氧化镁沉淀,D项正确。
5.A 解析 Na+、K+、C、S能大量共存,且与NaOH溶液不反应,A项符合题意;Ba2+与S反应生成BaSO4沉淀,Ba2+与S不能大量共存,B项不符合题意;Ba2+与C反应生成BaCO3沉淀,0.1 mol·L-1K2CO3溶液中Ba2+不能大量存在,C项不符合题意;醋酸是弱酸,0.1 mol·L-1 H2SO4溶液中不能大量存在CH3COO-,D项不符合题意。
6.A 解析 铁粉与稀硫酸反应生成FeSO4和H2,反应的离子方程式为Fe+2H+══Fe2++H2↑,B错误;HCl是强酸,要拆分成离子形式,HCl与NaOH反应的离子方程式为H++OH-══H2O,C错误;石灰石的主要成分是CaCO3,难溶于水,要用化学式表示,反应的离子方程式为CaCO3+2H+══Ca2++CO2↑+H2O,D错误。
7.A 解析 滴加无色酚酞溶液呈红色的溶液显碱性,A项中四种离子相互之间不反应,也不与OH-反应,可以大量共存,A正确;无色透明的溶液中,Cu2+不能大量存在,B错误;滴加紫色石蕊溶液呈红色的溶液显酸性,C与H+反应生成CO2和H2O,不能大量存在,C错误;强碱性溶液中含大量OH-,Mg2+与OH-生成Mg(OH)2沉淀而不能大量共存,D错误。
8.B 解析 粗盐的提纯过程中,用碳酸钠溶液除去钙离子,用氢氧化钠溶液除去镁离子,用氯化钡溶液除去硫酸根离子,为保证杂质离子除尽,所加试剂要过量,过量的离子也要除去,故碳酸钠溶液的作用为除去钙离子和过量的钡离子,故①应在③之后,然后过滤,向滤液中滴加盐酸至无气泡产生,可除去过量的氢氧化钠和碳酸钠。
9.答案 (1)④⑤⑦⑧⑨⑩
(2)开始产生红褐色沉淀,后来沉淀溶解消失
(3)Ba(OH)2+2HCl══BaCl2+2H2O
(4)①N+OH-══NH3·H2O ②CH3COOH+HC══CH3COO-+H2O+CO2↑
解析 (1)①铝为金属单质,既不是电解质也不是非电解质;②蔗糖在熔融状态和水溶液中都不能导电,是非电解质;③CO2自身不能电离,是非电解质;④H2SO4是酸,在水溶液中能电离出离子,是电解质;⑤Ba(OH)2是碱,在水溶液和熔融状态下能电离出离子,是电解质;⑥红褐色的氢氧化铁胶体是混合物,既不是电解质也不是非电解质;⑦HCl在水溶液中能电离产生自由移动的离子,可以导电,是电解质;⑧冰水混合物的成分是水,属于化合物,水为电解质;⑨碳酸钙在熔融状态下导电,属于电解质;⑩CuSO4·5H2O是盐的结晶水合物,在水溶液中能够电离产生自由移动的离子,可以导电,属于电解质。根据上述分析可知:属于电解质的是④⑤⑦⑧⑨⑩。
(2)盐酸是电解质HCl的水溶液,氢氧化铁胶体遇到盐酸时,胶体粒子首先发生聚沉,生成红褐色氢氧化铁沉淀;再滴加盐酸,氢氧化铁沉淀与盐酸发生酸碱中和反应生成可溶性氯化铁和水,因此看到的实验现象是先有红褐色沉淀产生,后沉淀逐渐溶解。
(3)离子方程式H++OH-══H2O代表强酸和强碱反应生成可溶性的盐和水的反应,符合条件的反应为Ba(OH)2+2HCl══BaCl2+2H2O。
(4)①将NH4Cl溶液和NaOH溶液混合,发生反应的离子方程式为N+OH-══NH3·H2O;②由于酸性CH3COOH>H2CO3,所以根据复分解反应的规律,将醋酸溶液和NaHCO3溶液混合发生反应的离子方程式为CH3COOH+HC══CH3COO-+H2O+CO2↑。
10.C 解析 NaHSO4溶液中含大量H+,C与H+反应生成CO2和H2O而不能大量共存,A错误;滴加酚酞溶液变红的溶液呈碱性,含大量OH-,Cu2+与OH-结合生成Cu(OH)2沉淀而不能大量共存,B错误;加入铁粉生成H2的溶液呈强酸性,含大量H+,C与H+、Ca2+均发生反应而不能大量共存,D错误。
11.C 解析 溶解时不是越稀越好,如果溶液太稀,蒸发时就要消耗很长时间才能蒸干,A错误;晶体应该用少量水洗涤,否则制得的晶体会有很多溶于水,B错误;蒸发时,当有大量晶体析出时应停止加热,利用余热蒸干,以免晶体受热后飞溅出来,不仅造成损失,而且可能因此发生意外事故,C正确;由于过量的钡离子需要碳酸钠除去,则为除去粗盐中的Ca2+、Mg2+、S,可依次向溶液中加入足量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液,然后过滤,再向滤液中加入稀盐酸,D错误。
12.A 解析 向碳酸氢钠溶液中加入盐酸,反应的离子方程式为HC+H+══CO2↑+H2O,故A正确;向沸水中滴加饱和的FeCl3溶液制得Fe(OH)3胶体,不是Fe(OH)3沉淀,该反应的离子方程式为Fe3++3H2OFe(OH)3(胶体)+3H+,故B错误;氢氧化铜与稀硫酸反应,离子方程式为2H++Cu(OH)2══2H2O+Cu2+,故C错误;澄清石灰水与碳酸钠溶液反应的离子方程式为C+Ca2+══CaCO3↓,故D错误。
13.D 解析 向澄清石灰水中通入CO2,当CO2适量时发生反应Ca(OH)2+CO2══CaCO3↓+H2O,该反应的离子方程式为Ca2++2OH-+CO2══CaCO3↓+H2O,当CO2过量时发生反应CaCO3+CO2+H2O══Ca(HCO3)2,该反应的离子方程式为CaCO3+CO2+H2O══Ca2++2HC。所以向澄清石灰水中通入过量的CO2,先生成碳酸钙沉淀,钙离子、氢氧根离子浓度减小,溶液导电能力减弱,后沉淀溶解生成碳酸氢钙溶液,钙离子、碳酸氢根离子的浓度增大,最终钙离子的浓度与原来几乎相等,碳酸氢根离子的浓度与原来氢氧根离子浓度几乎相等,但OH-的摩尔电导率大于HC的摩尔电导率,所以最后溶液的导电性小于原来的导电性,最后CaCO3全部溶解后,溶液中离子的浓度不再发生变化,即导电能力趋于稳定。
14.A 解析 本题考查了离子交换法净化水的过程分析。根据图示可以看出,通过阳离子交换树脂后,原有的Ca2+、Na+、Mg2+被换为了H+,根据电荷守恒可知,阳离子数目增多,A项错误;通过阴离子交换树脂后,阴离子N、Cl-、S被OH-交换,B项正确;在阴离子交换树脂上同时发生反应:H++OH-══H2O,D项正确;由于多数阴、阳离子被除去,变为较为纯净的水,故水的导电性减弱,C项正确。
15.B 解析 在混合物中加水后,氧化钙会与水反应生成氢氧化钙,而碳酸钙不会与水反应,过滤、结晶后得不到CaO,故A项错误;在混合物中加入稀盐酸,氧化铜会与稀盐酸反应而溶解,铜不会与稀盐酸反应,过滤后再进行洗涤、干燥即可得到铜,故B项正确;混合物中加入氢氧化钠溶液,氢氧化钠既会与硫酸反应,也会与硫酸铜反应,杂质除去了,主要物质也除去了,故C项错误;一氧化碳和氢气都可以在氧气中燃烧,故D项错误。
16.C 解析 该溶液无色则一定没有Cu2+;(1)取少量溶液,滴加无色酚酞溶液,溶液变红,说明溶液显碱性,一定有OH-,则一定没有Ag+;(2)另取少量溶液,加入足量BaCl2溶液,产生白色沉淀,该白色沉淀可能是BaCO3或BaSO4或BaCO3和BaSO4;(3)向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成,说明该沉淀是BaCO3和BaSO4的混合物,则说明溶液中一定存在C和S,则原溶液一定没有Ba2+;(4)将(3)所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成,因(2)步加入了BaCl2,此步得到的白色沉淀AgCl无法证明Cl-的来源。综上所述,溶液中一定存在阴离子OH-、C、S,Cl-不能确定,阳离子Ag+、Ba2+、Cu2+一定没有,根据电中性原则,溶液中一定有K+,故选C。
17.答案 (1)①NaHCO3══Na++HC ②b ③HC+OH-══H2O+C
(2)①烧杯、漏斗和玻璃棒 ②BaSO4 ③Cu2++2OH-══Cu(OH)2↓
解析 (1)①四种物质分别是氧化物、酸、盐和碱。碳酸氢钠的电离方程式为NaHCO3══Na++HC。②氧化铁是碱性氧化物可溶于盐酸生成氯化铁,碳酸氢钠可与盐酸反应生成二氧化碳气体,氢氧化钠可与盐酸发生中和反应生成盐和水。
(2)①用过滤的方法可分离得到沉淀1和溶液1,使用到的玻璃仪器有烧杯、漏斗和玻璃棒;②用NaOH溶液、盐酸和Na2SO4溶液将Ba2+、Cu2+、Ag+三种离子逐一沉淀分离,因盐酸引入Cl-所引发的沉淀只有AgCl而放第一步,故试剂A是盐酸,沉淀1是AgCl。溶液2为无色溶液,故试剂B是氢氧化钠,沉淀2是氢氧化铜。试剂C是硫酸钠,沉淀3为硫酸钡,其化学式为BaSO4。
18.答案 (1)Mg2+、Cl- C、S、Cu2+ Na+
(2)是 溶液呈电中性,必须同时含有阴、阳离子
解析 (1)实验①说明原溶液中肯定存在Mg2+,肯定不存在Cu2+和C;实验②说明原溶液中一定不存在C和S;实验③表明原溶液中一定存在Cl-。综上所述,原溶液中一定含有Mg2+、Cl-,一定不含有S、C及Cu2+,可能含有Na+。
(2)该同学的想法正确,因为任何溶液均呈现电中性,而溶液呈电中性则必须同时含有阴、阳离子。
19.答案 (1)过滤
(2)滴加盐酸至无气泡产生为止 防止溶液飞溅
(3)有气泡放出,澄清石灰水变浑浊 稀盐酸(或稀硝酸) 猜想Ⅱ不成立 滴入BaCl2溶液和稀盐酸 有白色沉淀且不溶于稀盐酸
解析 将粗盐溶于水,然后采用过滤的方法除去难溶性泥沙,得到滤液1,向滤液1中加入过量碳酸钠溶液,搅拌,然后过滤除去难溶性固体A,得到滤液2,向滤液2中加入适量稀盐酸,过量碳酸钠与稀盐酸反应得到氯化钠,将氯化钠溶液蒸发得到氯化钠晶体。
(1)步骤①和②都是将不溶于液体的固体和液体分离,操作方法都是过滤。
(2)盐酸与过量的碳酸钠反应生成氯化钠、水和二氧化碳,滴加盐酸至无气泡产生为止,说明刚好与碳酸钠反应完;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热造成液滴飞溅;当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想Ⅰ:碳酸盐能和稀盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以可以用澄清石灰水检验二氧化碳,如果有气泡放出且澄清石灰水变浑浊,则说明猜想Ⅰ成立;猜想Ⅱ:碳酸根离子可以用稀盐酸或稀硝酸检验,所以滴加的试剂是稀盐酸或稀硝酸,钡离子可以用可溶性的硫酸盐检验,如果有气泡冒出说明含有碳酸根离子,如果不产生白色沉淀说明不含钡离子,则猜想Ⅱ不成立;猜想Ⅲ:要检验硫酸根离子,将固体溶于水,滴入BaCl2溶液和稀盐酸,观察到有白色沉淀且不溶于稀盐酸,则猜想Ⅲ成立。
20.答案 (1)产生白色沉淀,溶液红色褪去
(2)2H++S+Ba2++2OH-══BaSO4↓+2H2O
(3)1 b点:BaSO4在水中溶解度很小,溶液中S和Ba2+浓度很小但不等于零,溶液中有自由移动的离子,电导率不等于零。bc段:b点溶液中的Ba(OH)2被反应完,溶液中自由移动的离子浓度达到最小值,随着H2SO4溶液的不断滴加,溶液中H+和S浓度又增大,自由移动离子浓度变大,则bc段电导率增大
(4)ABCE
解析 (1)0~80 s,Ba(OH)2是强电解质,开始滴定时溶液中离子浓度较大,溶液的电导率大,随反应的进行,溶液中钡离子生成硫酸钡沉淀,氢氧根离子变成水,恰好完全反应时,溶液中主要是水和极少量溶解的硫酸钡。观察到的实验现象是产生白色沉淀,溶液红色褪去,电导率减小。
(2)该实验中硫酸与氢氧化钡反应生成硫酸钡沉淀和水,该反应的离子方程式为2H++S+Ba2++2OH-══BaSO4↓+2H2O。
(3)截至b点,加入0.2 mol·L-1H2SO4溶液的体积为V=20×10-3 L×0.01 mol·L-1÷0.2 mol·L-1=0.001 L=1 mL;b点:BaSO4在水中溶解度很小,溶液中S和Ba2+浓度很小但不等于零,溶液中有自由移动的离子,电导率不等于零。bc段:b点溶液中的Ba(OH)2被反应完,溶液中自由移动的离子浓度达到最小值,随着H2SO4溶液的不断滴加,溶液中H+和S浓度变大,自由移动离子浓度变大,bc段电导率增大。
(4)溶液中Ba2+与S反应生成硫酸钡沉淀,OH-与H+结合生成水,曲线①中a点溶液的导电能力接近0,则①代表滴加H2SO4溶液的变化曲线,故A正确;②是NaHSO4溶液与氢氧化钡反应,b点时,氢氧化钡与硫酸氢钠以物质的量之比1∶1反应生成硫酸钡、水和NaOH,溶液中有NaOH,溶液中大量存在的离子是Na+、OH-,故B正确;a、d两点均将氢氧化钡全部反应,a点硫酸与氢氧化钡恰好反应生成硫酸钡和水,d点硫酸氢钠与氢氧化钡恰好反应生成硫酸钡、硫酸钠和水,a和d对应的溶液均显中性,故C正确;c点,两溶液中导电能力相同,曲线①体系中硫酸过量,溶液呈酸性,曲线②体系中OH-未被完全中和,溶液呈碱性,OH-含量不相同,故D错误;根据曲线①和②导电能力的变化幅度分析,H+导电能力比Na+强,故E正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
