2024鲁科版化学必修第一册练习题--分层作业19 自然界中的氮循环 氮气和氮的氧化物(含解析)
文档属性
| 名称 | 2024鲁科版化学必修第一册练习题--分层作业19 自然界中的氮循环 氮气和氮的氧化物(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 433.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 12:02:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024鲁科版化学必修第一册练习题
第3章 分层作业19 自然界中的氮循环 氮气和氮的氧化物
A级 必备知识基础练
1.下列关于N2性质的叙述错误的是( )
A.任何物质在氮气中都不能燃烧
B.氮气既具有氧化性,又具有还原性
C.将空气中的氮气转变成含氮化合物属于氮的固定
D.氮气与氧气在一定条件下反应生成一氧化氮
2.实验室收集NO、NO2两种气体,下列收集方法正确的是( )
A.均可用排水法
B.均可用向上排空气法
C.NO用向上排空气法,NO2用排水法
D.NO用排水法,NO2用向上排空气法
3.下列关于自然界中氮循环(如下图)的说法不正确的是( )
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参加了氮循环
4.四氧化二氮和肼常用作火箭发射的推进剂,发生反应N2O4+2N2H43N2+4H2O。下列关于该反应的说法错误的是( )
A.肼中N的化合价为-2价,表现还原性
B.N2O4为氧化剂,发生还原反应
C.每生成8.4 g N2转移0.8 mol电子
D.氧化产物与还原产物的质量之比为1∶2
5.对于NO2通入水中的反应,下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.NO2既是氧化剂又是还原剂
C.每当有1 mol NO2参加反应时,则转移2 mol电子
D.H2O是氧化剂,NO2是还原剂
6.将充满NO2和O2的量筒倒立于盛有水的水槽中,经过一段时间后,水上升到量筒容积的一半处停止,则剩余气体的成分是( )
A.NO2 B.NO
C.O2 D.NO或O2
7.某无色混合气体中可能含有Cl2、O2、SO2、NO、NO2中的一种或几种。现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色。下列对原混合气体成分的判断正确的是( )
A.肯定只有SO2
B.肯定没有Cl2、O2和NO2
C.可能有Cl2和O2
D.肯定只有NO
8.将盛有N2和NO2(无N2O4)混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N2和NO2的体积比是( )
A.3∶1 B.1∶3
C.1∶2 D.1∶1
9.Ⅰ.氮在自然界中的转化是一个复杂的过程,涉及地球上生物圈的方方面面。
(1)汽车尾气中的NO和NO2是大气污染物。
①写出NO造成酸雨的两个化学方程式: 、
。
②在汽车尾气排放管中安装一个催化转化器,可以将尾气中另一种有害气体(CO)跟NO反应转化为无毒气体,该反应的化学方程式为 。
(2)用化学方程式表达工业上以NH3为原料生产HNO3的第一步反应: 。
Ⅱ.(1)用少量氯气消毒的自来水养金鱼时,通常需要先将自来水晒一晒,其原因是 (用化学方程式表示)。
(2)小苏打通常用来治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,其原因是 (用离子方程式表示)。
B级 关键能力提升练
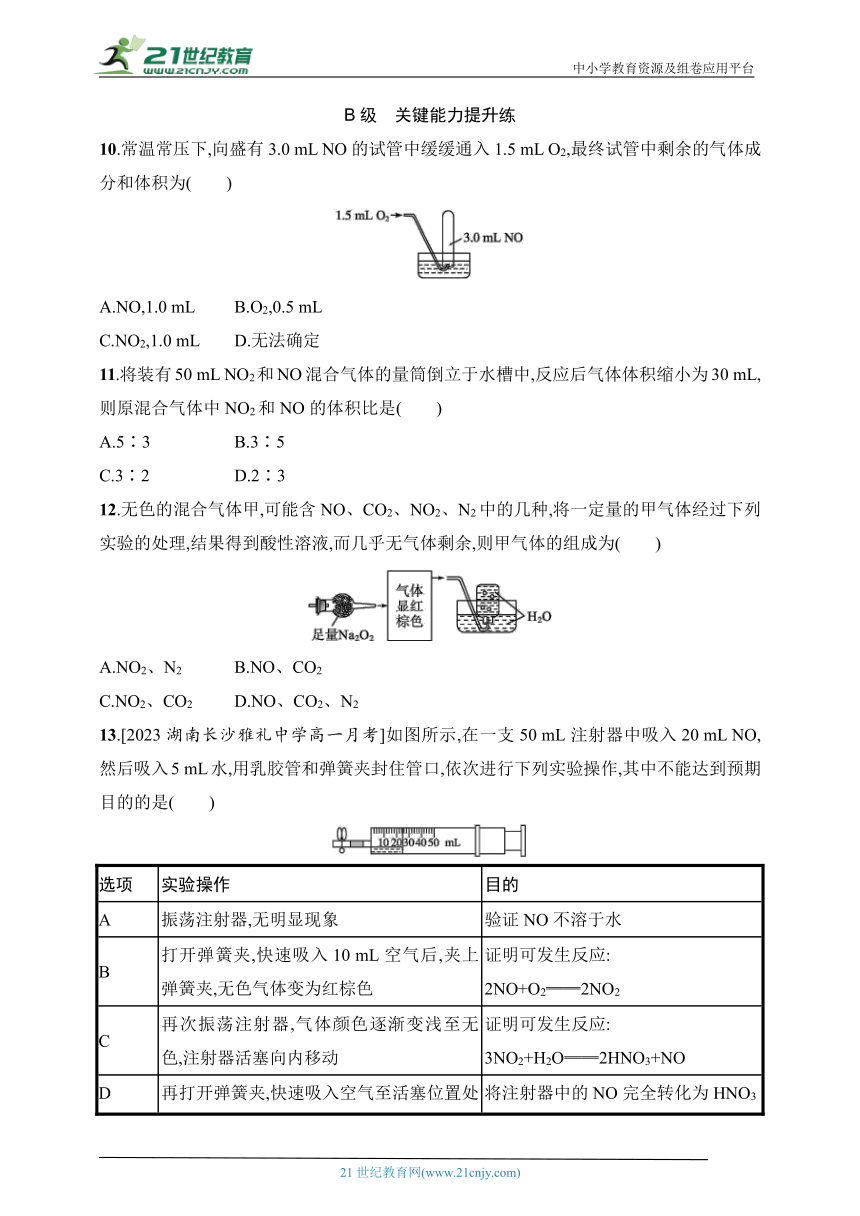
10.常温常压下,向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2,最终试管中剩余的气体成分和体积为( )
A.NO,1.0 mL B.O2,0.5 mL
C.NO2,1.0 mL D.无法确定
11.将装有50 mL NO2和NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30 mL,则原混合气体中NO2和NO的体积比是( )
A.5∶3 B.3∶5
C.3∶2 D.2∶3
12.无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过下列实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
A.NO2、N2 B.NO、CO2
C.NO2、CO2 D.NO、CO2、N2
13.[2023湖南长沙雅礼中学高一月考]如图所示,在一支50 mL注射器中吸入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,依次进行下列实验操作,其中不能达到预期目的的是( )
选项 实验操作 目的
A 振荡注射器,无明显现象 验证NO不溶于水
B 打开弹簧夹,快速吸入10 mL空气后,夹上弹簧夹,无色气体变为红棕色 证明可发生反应: 2NO+O2══2NO2
C 再次振荡注射器,气体颜色逐渐变浅至无色,注射器活塞向内移动 证明可发生反应: 3NO2+H2O══2HNO3+NO
D 再打开弹簧夹,快速吸入空气至活塞位置处于最大刻度处,夹上弹簧夹,充分振荡注射器后静置,直至无明显现象为止 将注射器中的NO完全转化为HNO3
14.已知HNO2在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是( )
pH范围 >7 <7
产物 N NO、N2O、N2中的一种
A.碱性条件下,NaNO2与NaClO反应的离子方程式为+ClO-══+Cl-
B.向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
C.向冷的NaNO2溶液中通入SO2会发生氧化还原反应
D.低温时不用其他试剂不能区分HNO2溶液与Na2CO3溶液
15.氮的氧化物(用NOx表示)是大气污染物,必须进行处理。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)在汽车尾气系统中安装催化转化器,可有效降低NOx的排放,当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO和CO反应生成N2和另一种无毒气体的化学方程式: 。
(3)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO5N2+6H2O,8NH3+6NO27N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是 。
(4)工业尾气中氮的氧化物常采用碱液吸收法处理,若NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是 。
C级 学科情境创新练
16.氮元素是地球上含量丰富的一种元素,氮单质及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)二氧化氮溶于水时与水反应生成硝酸和一氧化氮,请写出该反应的化学方程式:
。
(2)下列有关氮元素的说法正确的是 。
A.氮气因为其化学性质不活泼,可以做保护气,比如充填食品包装,充填电灯泡,保存贵重书画等
B.医学上常用液氮作冷冻剂,在冷冻麻醉条件下做手术,是利用氮气化学性质的不活泼性
C.氮、磷、钾是植物生长必需的营养元素
D.用NO2与水反应制取硝酸时,水做还原剂
(3)豆科植物种植时不需施加氮肥的原因是 。
(4)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气与二氧化氮在一定条件下反应的化学方程式: 。
答案:
1.A 解析 活泼金属镁等可以在N2中燃烧。
2.D 解析 NO2气体能与水反应产生硝酸和NO,不能用排水法收集;NO能与O2反应产生NO2,所以NO不能用排空气法收集,D项正确。
3.A 解析 合成氨反应中,氮元素的化合价降低被还原,A项错误;工业合成氨属于人工固氮,B项正确;硝酸盐转化为蛋白质经动物消化使蛋白质转化为氨气和铵盐,实现了含氮无机物和含氮有机物的相互转化,并且碳、氢、氧三种元素也参加了氮的循环,C项、D项正确。
4.D 解析 根据题给化学方程式分析。肼中N的化合价为-2价,反应后化合价升高,表现还原性,A项正确;N2O4中氮元素反应后化合价降低,N2O4是氧化剂,发生还原反应,B项正确;8.4 g N2的物质的量是0.3 mol,则每生成8.4 g N2时转移0.8 mol电子,C项正确;氧化产物与还原产物的物质的量之比是2∶1,质量之比也是2∶1,D项错误。
5.B 解析 根据可知,只有氮元素的化合价有升高和降低,所以NO2既是氧化剂又是还原剂;3 mol NO2参加反应,转移2 mol电子,故每当有1 mol NO2参加反应时,转移 mol电子。
6.C 解析 设量筒的容积为V L,剩余 L的气体可能是NO或O2。①若剩余气体为NO,根据反应3NO2+H2O══2HNO3+NO,则过量NO2为 L,不合题意。②若剩余气体为O2,则有 L NO2与O2的混合气体发生反应4NO2+O2+2H2O══4HNO3,符合题意。
7.B 解析 原混合气体为无色气体,故一定不含氯气和二氧化氮,也不同时存在氧气和一氧化氮,混合气体通过品红溶液后,品红溶液褪色,故原混合气体中一定含有二氧化硫;向剩余气体中通入空气,很快变为红棕色,所以原混合气体中一定含有一氧化氮,则一定不含氧气。结合以上分析可知,B正确。
8.B 解析 设原混合气体中含有x mol N2,y mol NO2,相同条件下气体的物质的量与体积成正比。
盛有N2和NO2的混合气体的试管倒立于水中发生3NO2+H2O══2HNO3+NO,则
3NO2+H2O══2HNO3+NO
3 1
y
则(x+)∶(x+y)=1∶2,
解得x∶y=1∶3。
9.答案 Ⅰ.(1)①2NO+O2══2NO2 3NO2+H2O══2HNO3+NO
②2NO+2CON2+2CO2
(2)4NH3+5O24NO+6H2O
Ⅱ.(1)2HClO2HCl+O2↑
(2)HC+H+══H2O+CO2↑
解析 Ⅰ.(1)①一氧化氮被氧气氧化生成二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮,反应的化学方程式为2NO+O2══2NO2,3NO2+H2O══2HNO3+NO;②在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体(CO)跟NO反应转化为无毒气体二氧化碳和氮气,反应的化学方程式为2NO+2CON2+2CO2。
(2)工业上以NH3为原料生产HNO3的第一步是氨气的催化氧化生成一氧化氮和水,该反应的化学方程式为4NH3+5O24NO+6H2O。
Ⅱ.(1)用少量氯气消毒的自来水中,发生了反应Cl2+H2O══HCl+HClO,其中次氯酸见光分解反应为2HClO2HCl+O2↑。
(2)小苏打通常用于治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,因为反应时生成的二氧化碳易造成胃穿孔,该过程发生的反应为HC+H+══CO2↑+H2O。
10.A 解析 NO和O2在水中发生反应4NO+3O2+2H2O══4HNO3,根据化学方程式可知,1.5 mL O2与NO反应时消耗2.0 mL NO,故NO有剩余,其体积为3.0 mL-2.0 mL=1.0 mL。
11.C 解析 运用差量法计算。
设混合气体中NO2的体积为x,
3NO2+H2O══2HNO3+NO ΔV
3 1 2
x 50 mL-30 mL=20 mL
,解得x=30 mL。
则原混合气体中NO为50 mL-30 mL=20 mL。
所以V(NO2)∶V(NO)=30 mL∶20 mL=3∶2。
12.B 解析 混合气体无色,气体中不含NO2,气体通过Na2O2后显红棕色,说明原混合气体中含有NO,且有与Na2O2反应生成O2的气体CO2,通入水中,溶液呈酸性,且几乎无气体剩余,说明原气体中不含N2。
13.D 解析 注射器中吸入20 mL NO和5 mL水,振荡注射器,无明显现象,能说明NO不溶于水且不与水发生反应,A不符合题意;打开弹簧夹,快速吸入10 mL空气后,夹上弹簧夹,无色气体变为红棕色,能证明发生反应:2NO+O2══2NO2,B不符合题意;再次振荡注射器,气体颜色逐渐变浅至无色,注射器活塞向内移动,气体压强减小,能说明NO2与H2O发生反应,C不符合题意;由反应4NO+3O2+2H2O══4HNO3可知,使20 mL NO完全转化为HNO3需要15 mL O2,打开弹簧夹,快速吸入空气至活塞位置处于最大刻度50 mL处,此时注射器中的O2(O2占空气的21%)不足以将NO完全转化为HNO3,故充分振荡注射器后静置直至无明显现象为止,NO不能完全转化为HNO3,D符合题意。
14.D 解析 由表中数据知,碱性条件下HNO2可被氧化为,ClO-有强氧化性,能将N氧化为N,同时ClO-被还原为Cl-,所以A项正确;酸性条件下,NaNO2有氧化性,而I-具有强还原性,能将I-氧化成I2,淀粉遇碘变蓝,所以B项正确;HNO2具有氧化性,SO2具有强还原性,因此亚硝酸能将SO2氧化成硫酸根离子,HNO2被还原为NO、N2O和N2中的一种,所以C项正确;由信息可知,HNO2在低温下较稳定,且亚硝酸的酸性强于醋酸,醋酸的酸性强于碳酸,即亚硝酸的酸性强于碳酸,亚硝酸和碳酸钠溶液采用互滴的方法进行区分,把碳酸钠溶液滴入亚硝酸溶液,立即产生气体,将亚硝酸溶液滴入碳酸钠溶液,过一段时间后才产生气体,所以D项错误。
15.答案 (1)3NO2+H2O══2HNO3+NO
(2)2NO+2CON2+2CO2
(3)1∶3
(4)NaNO2
解析 (1)NO2转化为HNO3的化学方程式为3NO2+H2O══2HNO3+NO。
(2)根据题目信息可知,NO被CO还原为N2,而CO被氧化成CO2,化学方程式为2NO+2CON2+2CO2。
(3)V(NO)+V(NO2)=3.0 L,V(NO)+V(NO2)=3.5 L,则V(NO)=0.75 L,V(NO2)=2.25 L,V(NO)∶V(NO2)=1∶3。
(4)NO中氮的化合价为+2价,NO2中氮的化合价为+4价,二者按物质的量之比1∶1混合时与NaOH反应生成盐中氮元素的化合价必然为+3价,即为NaNO2。
16.答案 (1)3NO2+H2O══2HNO3+NO
(2)AC
(3)豆科植物的根瘤菌能够把空气中的氮气转化为含氮化合物,供自身生长使用
(4)8NH3+6NO27N2+12H2O
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁科版化学必修第一册练习题
第3章 分层作业19 自然界中的氮循环 氮气和氮的氧化物
A级 必备知识基础练
1.下列关于N2性质的叙述错误的是( )
A.任何物质在氮气中都不能燃烧
B.氮气既具有氧化性,又具有还原性
C.将空气中的氮气转变成含氮化合物属于氮的固定
D.氮气与氧气在一定条件下反应生成一氧化氮
2.实验室收集NO、NO2两种气体,下列收集方法正确的是( )
A.均可用排水法
B.均可用向上排空气法
C.NO用向上排空气法,NO2用排水法
D.NO用排水法,NO2用向上排空气法
3.下列关于自然界中氮循环(如下图)的说法不正确的是( )
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参加了氮循环
4.四氧化二氮和肼常用作火箭发射的推进剂,发生反应N2O4+2N2H43N2+4H2O。下列关于该反应的说法错误的是( )
A.肼中N的化合价为-2价,表现还原性
B.N2O4为氧化剂,发生还原反应
C.每生成8.4 g N2转移0.8 mol电子
D.氧化产物与还原产物的质量之比为1∶2
5.对于NO2通入水中的反应,下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.NO2既是氧化剂又是还原剂
C.每当有1 mol NO2参加反应时,则转移2 mol电子
D.H2O是氧化剂,NO2是还原剂
6.将充满NO2和O2的量筒倒立于盛有水的水槽中,经过一段时间后,水上升到量筒容积的一半处停止,则剩余气体的成分是( )
A.NO2 B.NO
C.O2 D.NO或O2
7.某无色混合气体中可能含有Cl2、O2、SO2、NO、NO2中的一种或几种。现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色。下列对原混合气体成分的判断正确的是( )
A.肯定只有SO2
B.肯定没有Cl2、O2和NO2
C.可能有Cl2和O2
D.肯定只有NO
8.将盛有N2和NO2(无N2O4)混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N2和NO2的体积比是( )
A.3∶1 B.1∶3
C.1∶2 D.1∶1
9.Ⅰ.氮在自然界中的转化是一个复杂的过程,涉及地球上生物圈的方方面面。
(1)汽车尾气中的NO和NO2是大气污染物。
①写出NO造成酸雨的两个化学方程式: 、
。
②在汽车尾气排放管中安装一个催化转化器,可以将尾气中另一种有害气体(CO)跟NO反应转化为无毒气体,该反应的化学方程式为 。
(2)用化学方程式表达工业上以NH3为原料生产HNO3的第一步反应: 。
Ⅱ.(1)用少量氯气消毒的自来水养金鱼时,通常需要先将自来水晒一晒,其原因是 (用化学方程式表示)。
(2)小苏打通常用来治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,其原因是 (用离子方程式表示)。
B级 关键能力提升练
10.常温常压下,向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2,最终试管中剩余的气体成分和体积为( )
A.NO,1.0 mL B.O2,0.5 mL
C.NO2,1.0 mL D.无法确定
11.将装有50 mL NO2和NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30 mL,则原混合气体中NO2和NO的体积比是( )
A.5∶3 B.3∶5
C.3∶2 D.2∶3
12.无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过下列实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
A.NO2、N2 B.NO、CO2
C.NO2、CO2 D.NO、CO2、N2
13.[2023湖南长沙雅礼中学高一月考]如图所示,在一支50 mL注射器中吸入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,依次进行下列实验操作,其中不能达到预期目的的是( )
选项 实验操作 目的
A 振荡注射器,无明显现象 验证NO不溶于水
B 打开弹簧夹,快速吸入10 mL空气后,夹上弹簧夹,无色气体变为红棕色 证明可发生反应: 2NO+O2══2NO2
C 再次振荡注射器,气体颜色逐渐变浅至无色,注射器活塞向内移动 证明可发生反应: 3NO2+H2O══2HNO3+NO
D 再打开弹簧夹,快速吸入空气至活塞位置处于最大刻度处,夹上弹簧夹,充分振荡注射器后静置,直至无明显现象为止 将注射器中的NO完全转化为HNO3
14.已知HNO2在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是( )
pH范围 >7 <7
产物 N NO、N2O、N2中的一种
A.碱性条件下,NaNO2与NaClO反应的离子方程式为+ClO-══+Cl-
B.向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
C.向冷的NaNO2溶液中通入SO2会发生氧化还原反应
D.低温时不用其他试剂不能区分HNO2溶液与Na2CO3溶液
15.氮的氧化物(用NOx表示)是大气污染物,必须进行处理。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)在汽车尾气系统中安装催化转化器,可有效降低NOx的排放,当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO和CO反应生成N2和另一种无毒气体的化学方程式: 。
(3)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO5N2+6H2O,8NH3+6NO27N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是 。
(4)工业尾气中氮的氧化物常采用碱液吸收法处理,若NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是 。
C级 学科情境创新练
16.氮元素是地球上含量丰富的一种元素,氮单质及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)二氧化氮溶于水时与水反应生成硝酸和一氧化氮,请写出该反应的化学方程式:
。
(2)下列有关氮元素的说法正确的是 。
A.氮气因为其化学性质不活泼,可以做保护气,比如充填食品包装,充填电灯泡,保存贵重书画等
B.医学上常用液氮作冷冻剂,在冷冻麻醉条件下做手术,是利用氮气化学性质的不活泼性
C.氮、磷、钾是植物生长必需的营养元素
D.用NO2与水反应制取硝酸时,水做还原剂
(3)豆科植物种植时不需施加氮肥的原因是 。
(4)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气与二氧化氮在一定条件下反应的化学方程式: 。
答案:
1.A 解析 活泼金属镁等可以在N2中燃烧。
2.D 解析 NO2气体能与水反应产生硝酸和NO,不能用排水法收集;NO能与O2反应产生NO2,所以NO不能用排空气法收集,D项正确。
3.A 解析 合成氨反应中,氮元素的化合价降低被还原,A项错误;工业合成氨属于人工固氮,B项正确;硝酸盐转化为蛋白质经动物消化使蛋白质转化为氨气和铵盐,实现了含氮无机物和含氮有机物的相互转化,并且碳、氢、氧三种元素也参加了氮的循环,C项、D项正确。
4.D 解析 根据题给化学方程式分析。肼中N的化合价为-2价,反应后化合价升高,表现还原性,A项正确;N2O4中氮元素反应后化合价降低,N2O4是氧化剂,发生还原反应,B项正确;8.4 g N2的物质的量是0.3 mol,则每生成8.4 g N2时转移0.8 mol电子,C项正确;氧化产物与还原产物的物质的量之比是2∶1,质量之比也是2∶1,D项错误。
5.B 解析 根据可知,只有氮元素的化合价有升高和降低,所以NO2既是氧化剂又是还原剂;3 mol NO2参加反应,转移2 mol电子,故每当有1 mol NO2参加反应时,转移 mol电子。
6.C 解析 设量筒的容积为V L,剩余 L的气体可能是NO或O2。①若剩余气体为NO,根据反应3NO2+H2O══2HNO3+NO,则过量NO2为 L,不合题意。②若剩余气体为O2,则有 L NO2与O2的混合气体发生反应4NO2+O2+2H2O══4HNO3,符合题意。
7.B 解析 原混合气体为无色气体,故一定不含氯气和二氧化氮,也不同时存在氧气和一氧化氮,混合气体通过品红溶液后,品红溶液褪色,故原混合气体中一定含有二氧化硫;向剩余气体中通入空气,很快变为红棕色,所以原混合气体中一定含有一氧化氮,则一定不含氧气。结合以上分析可知,B正确。
8.B 解析 设原混合气体中含有x mol N2,y mol NO2,相同条件下气体的物质的量与体积成正比。
盛有N2和NO2的混合气体的试管倒立于水中发生3NO2+H2O══2HNO3+NO,则
3NO2+H2O══2HNO3+NO
3 1
y
则(x+)∶(x+y)=1∶2,
解得x∶y=1∶3。
9.答案 Ⅰ.(1)①2NO+O2══2NO2 3NO2+H2O══2HNO3+NO
②2NO+2CON2+2CO2
(2)4NH3+5O24NO+6H2O
Ⅱ.(1)2HClO2HCl+O2↑
(2)HC+H+══H2O+CO2↑
解析 Ⅰ.(1)①一氧化氮被氧气氧化生成二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮,反应的化学方程式为2NO+O2══2NO2,3NO2+H2O══2HNO3+NO;②在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体(CO)跟NO反应转化为无毒气体二氧化碳和氮气,反应的化学方程式为2NO+2CON2+2CO2。
(2)工业上以NH3为原料生产HNO3的第一步是氨气的催化氧化生成一氧化氮和水,该反应的化学方程式为4NH3+5O24NO+6H2O。
Ⅱ.(1)用少量氯气消毒的自来水中,发生了反应Cl2+H2O══HCl+HClO,其中次氯酸见光分解反应为2HClO2HCl+O2↑。
(2)小苏打通常用于治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,因为反应时生成的二氧化碳易造成胃穿孔,该过程发生的反应为HC+H+══CO2↑+H2O。
10.A 解析 NO和O2在水中发生反应4NO+3O2+2H2O══4HNO3,根据化学方程式可知,1.5 mL O2与NO反应时消耗2.0 mL NO,故NO有剩余,其体积为3.0 mL-2.0 mL=1.0 mL。
11.C 解析 运用差量法计算。
设混合气体中NO2的体积为x,
3NO2+H2O══2HNO3+NO ΔV
3 1 2
x 50 mL-30 mL=20 mL
,解得x=30 mL。
则原混合气体中NO为50 mL-30 mL=20 mL。
所以V(NO2)∶V(NO)=30 mL∶20 mL=3∶2。
12.B 解析 混合气体无色,气体中不含NO2,气体通过Na2O2后显红棕色,说明原混合气体中含有NO,且有与Na2O2反应生成O2的气体CO2,通入水中,溶液呈酸性,且几乎无气体剩余,说明原气体中不含N2。
13.D 解析 注射器中吸入20 mL NO和5 mL水,振荡注射器,无明显现象,能说明NO不溶于水且不与水发生反应,A不符合题意;打开弹簧夹,快速吸入10 mL空气后,夹上弹簧夹,无色气体变为红棕色,能证明发生反应:2NO+O2══2NO2,B不符合题意;再次振荡注射器,气体颜色逐渐变浅至无色,注射器活塞向内移动,气体压强减小,能说明NO2与H2O发生反应,C不符合题意;由反应4NO+3O2+2H2O══4HNO3可知,使20 mL NO完全转化为HNO3需要15 mL O2,打开弹簧夹,快速吸入空气至活塞位置处于最大刻度50 mL处,此时注射器中的O2(O2占空气的21%)不足以将NO完全转化为HNO3,故充分振荡注射器后静置直至无明显现象为止,NO不能完全转化为HNO3,D符合题意。
14.D 解析 由表中数据知,碱性条件下HNO2可被氧化为,ClO-有强氧化性,能将N氧化为N,同时ClO-被还原为Cl-,所以A项正确;酸性条件下,NaNO2有氧化性,而I-具有强还原性,能将I-氧化成I2,淀粉遇碘变蓝,所以B项正确;HNO2具有氧化性,SO2具有强还原性,因此亚硝酸能将SO2氧化成硫酸根离子,HNO2被还原为NO、N2O和N2中的一种,所以C项正确;由信息可知,HNO2在低温下较稳定,且亚硝酸的酸性强于醋酸,醋酸的酸性强于碳酸,即亚硝酸的酸性强于碳酸,亚硝酸和碳酸钠溶液采用互滴的方法进行区分,把碳酸钠溶液滴入亚硝酸溶液,立即产生气体,将亚硝酸溶液滴入碳酸钠溶液,过一段时间后才产生气体,所以D项错误。
15.答案 (1)3NO2+H2O══2HNO3+NO
(2)2NO+2CON2+2CO2
(3)1∶3
(4)NaNO2
解析 (1)NO2转化为HNO3的化学方程式为3NO2+H2O══2HNO3+NO。
(2)根据题目信息可知,NO被CO还原为N2,而CO被氧化成CO2,化学方程式为2NO+2CON2+2CO2。
(3)V(NO)+V(NO2)=3.0 L,V(NO)+V(NO2)=3.5 L,则V(NO)=0.75 L,V(NO2)=2.25 L,V(NO)∶V(NO2)=1∶3。
(4)NO中氮的化合价为+2价,NO2中氮的化合价为+4价,二者按物质的量之比1∶1混合时与NaOH反应生成盐中氮元素的化合价必然为+3价,即为NaNO2。
16.答案 (1)3NO2+H2O══2HNO3+NO
(2)AC
(3)豆科植物的根瘤菌能够把空气中的氮气转化为含氮化合物,供自身生长使用
(4)8NH3+6NO27N2+12H2O
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
