陕西省西安市2023-2024学年高二上学期期末教学质量监测化学试题(含答案)
文档属性
| 名称 | 陕西省西安市2023-2024学年高二上学期期末教学质量监测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 250.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 10:23:28 | ||
图片预览


文档简介
西安市2023-2024学年高二上学期期末教学质量监测
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名,考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号杂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1、选择性必修2第一章。
5.可能用到的相对原子质量:H1 C12 N14 O16 Ti48 Pb207
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产生活密切相关,下列说法正确的是
A.铁放置在潮湿的空气中主要发生化学腐蚀而生锈
B.铝热反应可用于焊接钢轨,该反应发生时,放出大量的热
C.氢气的燃烧过程中热能转化为化学能
D纳米级的锌粉能通过吸附作用除去水体中的Ag+,Cu2+等有害离子
2.常温下,下列离子在酸性条件下能大量存在的是
A. B. C. D.CH3COO-
3.甲醛(结构如图所示)的水溶液(又称福尔马林)具有杀菌、防腐性能,可用于消毒和制作生物标本。下列说法正确的是
A.基态碳原子中,电子占据的最高能层符号为P
B.基态碳原子中,1s、2s电子的能量逐渐升高
C.氧元素位于元素周期表第二周期第ⅣA族
D.基态氧原子中,1s、2s能级的轨道数依次增多
4.下列过程的热效应与其他三项不同的是
A.浓硫酸稀释 B.碳酸钠水解
C.水的电离 D.硝酸铵溶于水
5.下列物质在水中的电离方程式书写正确的是、
A.KOHK++OH- B.Al(OH)3=Al3++3OH-
C.MgCl2=Mg2++Cl2- D.NaHSO4=Na++H++
6.食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱(Na2CO3),和小苏打(Na2HCO3)。下列说法正确的是
A.离子半径:Na+>O2- B电负性:C>O
C.非金属性:C>O>H D.第一电离能:O>C>Na
7.对于反应M(g)+3N(g)=2P(g)+2Q(g),下列表示的反应速率最慢的是
A.v(N)=0.04mol/(L·s) B.v(M)=0.6 mol/(L·min)
C.v(P)=0.03 mol/(L·s) D.v(Q)=1.4 mol/(L·min)
8.工业废水中常含有一定量的易被人体吸收积累而导致病变。处理工业含铬废水的方法通常是将转化为Cr3+。可以利用工业废气中的SO2处理酸性含铬废水,发生的反应为(aq)+3SO2(g)+2H+(aq)2Cr3+(aq)+3(aq)+H2O(1),下列说法正确的是
已知:具有强氧化性。
A加入过量的氢硫酸,有利于反应正向进行
B加入过量的氢氧化钠溶液,有利于反应正向进行
C.含铬的酸性废水中存在的反应有+H2O2+2H+
D.加入足量的水,则正、逆反应速率均增大
9.某密闭容器中,发生反应COCl2(g)CO(g)+Cl2(g) △H>0。当该反应达到平衡时,保持温度和容积不变,向该容器中充入少量的稀有气体,下列图像正确的是
A. B. C. D.
10.蛋白质分子结构的一部分如图所示,下列说法正确的是
A.沸点:NH3C.核电荷数:C>N>O>H D.基态原子的未成对电子数:O>C>N
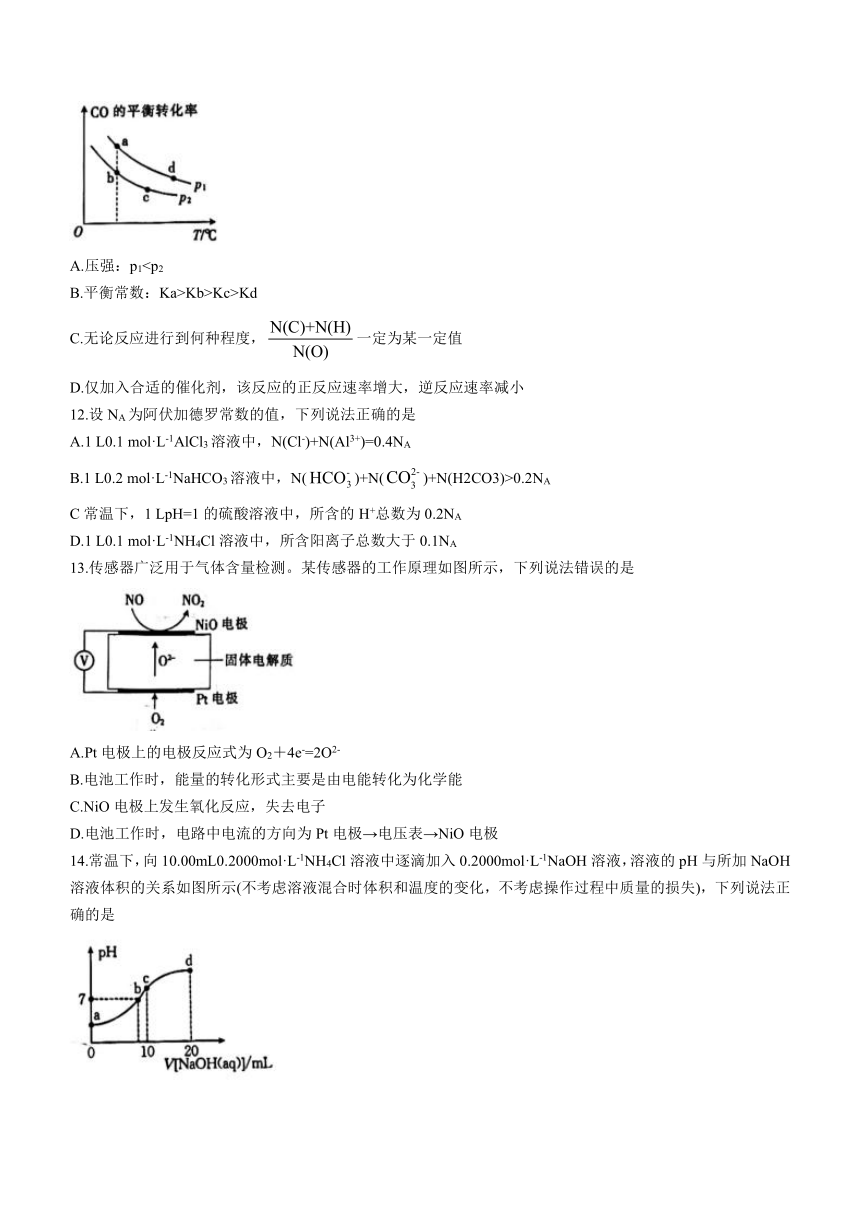
11.在某一恒容密闭容器中充入一定量的CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),其中CO的平衡转化率随温度(T)、压强(p)的变化如图所示,下列说法正确的是
A.压强:p1B.平衡常数:Ka>Kb>Kc>Kd
C.无论反应进行到何种程度,一定为某一定值
D.仅加入合适的催化剂,该反应的正反应速率增大,逆反应速率减小
12.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 L0.1 mol·L-1AlCl3溶液中,N(Cl-)+N(Al3+)=0.4NA
B.1 L0.2 mol·L-1NaHCO3溶液中,N()+N()+N(H2CO3)>0.2NA
C常温下,1 LpH=1的硫酸溶液中,所含的H+总数为0.2NA
D.1 L0.1 mol·L-1NH4Cl溶液中,所含阳离子总数大于0.1NA
13.传感器广泛用于气体含量检测。某传感器的工作原理如图所示,下列说法错误的是
A.Pt电极上的电极反应式为O2+4e-=2O2-
B.电池工作时,能量的转化形式主要是由电能转化为化学能
C.NiO电极上发生氧化反应,失去电子
D.电池工作时,电路中电流的方向为Pt电极→电压表→NiO电极
14.常温下,向10.00mL0.2000mol·L-1NH4Cl溶液中逐滴加入0.2000mol·L-1NaOH溶液,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑溶液混合时体积和温度的变化,不考虑操作过程中质量的损失),下列说法正确的是
A.a点溶液中,<1
B.b点溶液中,c(Na+)+c(Cl-)+c(NH3·H2O)=mol·L-1
C.c点溶液中,c(Na+)=2c()+2c(NH3·H2O)
D.d点溶液中,<15
二、非选择题:本题共4小题,共58分。
15.(14分)黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义,一种酸性条件下催化氧化黄铁矿的物质转化关系如图所示,回答下列问题:
(1)基态氮原子的价层电子排布式为____________。
(2)基态氧原子的核外电子有________种空间运动状态,其电子占据的最高能级的电子云轮廓图为____形。
(3)第一电离能;N________ (填“>”“<”或“=”)O。
(4)反应Ⅱ的离子方程式为____________________,Fe3+的半径比Fe2+________ (填“大”或“小”),Fe3+的稳定性比Fe2+更________(填“强”或“弱”)。
16.(15分)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+中,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准液滴定至Ti3+全部生成Ti4+。
(1)配制NH4Fe(SO4)2标准液的过程中,溶液转移时的操作如图所示。
①仪器a的名称为__________。
②图中错误的地方有______处,请指出其中一处:__________。
(2)滴定时:
①NH4Fe(SO4)2标准液应盛装在_______(填“酸”或“碱”)式滴定管中,理由为______________(用离子方程式表示,写一个即可)。
②滴定过程中,眼睛应注视____________。
③到达滴定终点时的现象为______________。
④若称取TiO2试样mg,消耗cmol·L-1 NH4Fe(SO4)2标准溶液VmL,则TiO2的质量分数为_______(用含m、c、V的代数式表示,不考虑操作过程中质量的损失)。
(3)下列实验误差分析错误的是____(填标号)。
A.滴定前滴定管内无气泡,终点读数时有气泡,所测定的结果偏小
B.刚看到指示剂局部的颜色有变化就停止滴定,所测定的结果偏大
C.读数时,滴定前俯视,滴定后仰视,所测定的结果偏小
D.未用标液溶液润洗滴定管,所测定的结果偏大
17.(14分)PbO主要用作颜料,冶金助熔剂、油漆催干剂,橡胶硫化促进剂、杀虫剂等。一种以方铅矿(含PbS及少量Fe2O3、MgO、SiO2等)为原料制备PbO的工艺流程如图:
回答下列问题:
(1)Pb的价电子轨道表示式为__________,Pb在元素周期表中属于______区元素。
(2)“酸浸氧化”过程中FeCl3与PbS发生反应生成[PbCl4]2-,反应的离子方程式为_____________。
(3)验证滤液1中存在Fe2+,可取样后滴加少量________(填化学式)溶液,观察到有蓝色沉淀析出。
(4)已知:Ksp(PbCO3)=7.4×10-14、Ksp(PbSO4)=1.6×10-8。要实现PbSO4将化明PbCO3,的最小值为___________(保留两位有效数字)。“洗涤”时,检验PbCO3固体是否洗涤干净的操作是________。
(5)已知焙烧PbCO3可制得铅的氧化物,为了研究其产物成分,取5.34gPbCO3进行焙烧,其热重曲线如图所示,请写出350℃时所得铅的氧化物的化学式:_________。
18.(15分)金属钛(Ti)在航空航天,医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
ⅰ.直接氯化法:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1>0 Kpl
ⅱ.碳氯化法:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2<0 Kp2
①反应2C(s)+O2(g)=2CO(g) △H3 Kp3,则△H3=______(用含△H1、△H2的代数式表示),Kp3=______(用含Kp1,Kp2的代数式表示),____(填“低温”“高温”或“任意温度”)有利于该反应自发进行。
②对于直接氯化法:仅增大压强,平衡_______(填“向左”“向右”或“不”)移动;仅升高温度,Cl2(g)平衡转化率_______(填“变大”“变小”或“不变”)。
(2)在压强为170kPa恒压作用下,将TiO2(s)、C(s)、Cl2(g)以物质的量之比为1:2.2:2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为______。
②反应C(s)+CO2(g)=2CO(g)的平衡常数Kp(T2℃)=______kPa(分压=物质的量分数×总压)。
(3)查阅资料可知:Kp2>Kp1,即碳氯化法的反应趋势远大于直接氯化法,其原因为___________。
西安市2023-2024学年高二上学期期末教学质量监测
化学参考答案
1.B 2.C 3.B 4.A 5.D 6.D 7.B 8.C 9.B 10.A 11.C 12.D 13.B 14.D
15.(1)2s22p3(2分)
(2)5(2分);哑铃(2分)
(3)>(2分)
(4)8H2O+14Fe3++FeS2=15Fe2++2+16H+(2分);小(2分);强(2分)
16.(1)100mL容量瓶(或容量瓶,1分)
②2(1分);玻璃棒应伸入刻度线以下(或容量瓶瓶塞应系在细颈瓶口,2分)
(2)①酸(1分);Fe3++3H2OFe(OH)3+3H+(或+H2ONH3·H2O+H+,2分)
②锥形瓶中溶液颜色的变化(2分)
③当滴入最后半滴标准液时,锥形瓶中溶液颜色变为红色,且30s内颜色不变(2分)
④(2分)
(3)BC(2分)
17.(1) (2分);p(2分)
(2)PbS+2Fe3++4Cl-=[PbCl4]2-+2Fe2++S(2分)
(3)K3[Fe(CN)6](2分)
(4)4.6×10-6(2分);取少许最后一次洗涤液于试管中,向其中加入盐酸酸化的BaCl2溶液(2分)
(5)Pb2O3(2分)
18.(1)①△H2-△H1;(2分);任意温度(2分)
②不(2分);变大(1分)
(2)①+1或-1(2分);②1740.8(2分)
(3)碳氯化法反应的气体分子数增加,△H<0,是熵增、放热过程,为自发过程,而直接氯化法的体系中气体分子数不变,且是吸热过程(或其他合理答案,2分)
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名,考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号杂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1、选择性必修2第一章。
5.可能用到的相对原子质量:H1 C12 N14 O16 Ti48 Pb207
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产生活密切相关,下列说法正确的是
A.铁放置在潮湿的空气中主要发生化学腐蚀而生锈
B.铝热反应可用于焊接钢轨,该反应发生时,放出大量的热
C.氢气的燃烧过程中热能转化为化学能
D纳米级的锌粉能通过吸附作用除去水体中的Ag+,Cu2+等有害离子
2.常温下,下列离子在酸性条件下能大量存在的是
A. B. C. D.CH3COO-
3.甲醛(结构如图所示)的水溶液(又称福尔马林)具有杀菌、防腐性能,可用于消毒和制作生物标本。下列说法正确的是
A.基态碳原子中,电子占据的最高能层符号为P
B.基态碳原子中,1s、2s电子的能量逐渐升高
C.氧元素位于元素周期表第二周期第ⅣA族
D.基态氧原子中,1s、2s能级的轨道数依次增多
4.下列过程的热效应与其他三项不同的是
A.浓硫酸稀释 B.碳酸钠水解
C.水的电离 D.硝酸铵溶于水
5.下列物质在水中的电离方程式书写正确的是、
A.KOHK++OH- B.Al(OH)3=Al3++3OH-
C.MgCl2=Mg2++Cl2- D.NaHSO4=Na++H++
6.食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱(Na2CO3),和小苏打(Na2HCO3)。下列说法正确的是
A.离子半径:Na+>O2- B电负性:C>O
C.非金属性:C>O>H D.第一电离能:O>C>Na
7.对于反应M(g)+3N(g)=2P(g)+2Q(g),下列表示的反应速率最慢的是
A.v(N)=0.04mol/(L·s) B.v(M)=0.6 mol/(L·min)
C.v(P)=0.03 mol/(L·s) D.v(Q)=1.4 mol/(L·min)
8.工业废水中常含有一定量的易被人体吸收积累而导致病变。处理工业含铬废水的方法通常是将转化为Cr3+。可以利用工业废气中的SO2处理酸性含铬废水,发生的反应为(aq)+3SO2(g)+2H+(aq)2Cr3+(aq)+3(aq)+H2O(1),下列说法正确的是
已知:具有强氧化性。
A加入过量的氢硫酸,有利于反应正向进行
B加入过量的氢氧化钠溶液,有利于反应正向进行
C.含铬的酸性废水中存在的反应有+H2O2+2H+
D.加入足量的水,则正、逆反应速率均增大
9.某密闭容器中,发生反应COCl2(g)CO(g)+Cl2(g) △H>0。当该反应达到平衡时,保持温度和容积不变,向该容器中充入少量的稀有气体,下列图像正确的是
A. B. C. D.
10.蛋白质分子结构的一部分如图所示,下列说法正确的是
A.沸点:NH3
11.在某一恒容密闭容器中充入一定量的CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),其中CO的平衡转化率随温度(T)、压强(p)的变化如图所示,下列说法正确的是
A.压强:p1
C.无论反应进行到何种程度,一定为某一定值
D.仅加入合适的催化剂,该反应的正反应速率增大,逆反应速率减小
12.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 L0.1 mol·L-1AlCl3溶液中,N(Cl-)+N(Al3+)=0.4NA
B.1 L0.2 mol·L-1NaHCO3溶液中,N()+N()+N(H2CO3)>0.2NA
C常温下,1 LpH=1的硫酸溶液中,所含的H+总数为0.2NA
D.1 L0.1 mol·L-1NH4Cl溶液中,所含阳离子总数大于0.1NA
13.传感器广泛用于气体含量检测。某传感器的工作原理如图所示,下列说法错误的是
A.Pt电极上的电极反应式为O2+4e-=2O2-
B.电池工作时,能量的转化形式主要是由电能转化为化学能
C.NiO电极上发生氧化反应,失去电子
D.电池工作时,电路中电流的方向为Pt电极→电压表→NiO电极
14.常温下,向10.00mL0.2000mol·L-1NH4Cl溶液中逐滴加入0.2000mol·L-1NaOH溶液,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑溶液混合时体积和温度的变化,不考虑操作过程中质量的损失),下列说法正确的是
A.a点溶液中,<1
B.b点溶液中,c(Na+)+c(Cl-)+c(NH3·H2O)=mol·L-1
C.c点溶液中,c(Na+)=2c()+2c(NH3·H2O)
D.d点溶液中,<15
二、非选择题:本题共4小题,共58分。
15.(14分)黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义,一种酸性条件下催化氧化黄铁矿的物质转化关系如图所示,回答下列问题:
(1)基态氮原子的价层电子排布式为____________。
(2)基态氧原子的核外电子有________种空间运动状态,其电子占据的最高能级的电子云轮廓图为____形。
(3)第一电离能;N________ (填“>”“<”或“=”)O。
(4)反应Ⅱ的离子方程式为____________________,Fe3+的半径比Fe2+________ (填“大”或“小”),Fe3+的稳定性比Fe2+更________(填“强”或“弱”)。
16.(15分)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+中,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准液滴定至Ti3+全部生成Ti4+。
(1)配制NH4Fe(SO4)2标准液的过程中,溶液转移时的操作如图所示。
①仪器a的名称为__________。
②图中错误的地方有______处,请指出其中一处:__________。
(2)滴定时:
①NH4Fe(SO4)2标准液应盛装在_______(填“酸”或“碱”)式滴定管中,理由为______________(用离子方程式表示,写一个即可)。
②滴定过程中,眼睛应注视____________。
③到达滴定终点时的现象为______________。
④若称取TiO2试样mg,消耗cmol·L-1 NH4Fe(SO4)2标准溶液VmL,则TiO2的质量分数为_______(用含m、c、V的代数式表示,不考虑操作过程中质量的损失)。
(3)下列实验误差分析错误的是____(填标号)。
A.滴定前滴定管内无气泡,终点读数时有气泡,所测定的结果偏小
B.刚看到指示剂局部的颜色有变化就停止滴定,所测定的结果偏大
C.读数时,滴定前俯视,滴定后仰视,所测定的结果偏小
D.未用标液溶液润洗滴定管,所测定的结果偏大
17.(14分)PbO主要用作颜料,冶金助熔剂、油漆催干剂,橡胶硫化促进剂、杀虫剂等。一种以方铅矿(含PbS及少量Fe2O3、MgO、SiO2等)为原料制备PbO的工艺流程如图:
回答下列问题:
(1)Pb的价电子轨道表示式为__________,Pb在元素周期表中属于______区元素。
(2)“酸浸氧化”过程中FeCl3与PbS发生反应生成[PbCl4]2-,反应的离子方程式为_____________。
(3)验证滤液1中存在Fe2+,可取样后滴加少量________(填化学式)溶液,观察到有蓝色沉淀析出。
(4)已知:Ksp(PbCO3)=7.4×10-14、Ksp(PbSO4)=1.6×10-8。要实现PbSO4将化明PbCO3,的最小值为___________(保留两位有效数字)。“洗涤”时,检验PbCO3固体是否洗涤干净的操作是________。
(5)已知焙烧PbCO3可制得铅的氧化物,为了研究其产物成分,取5.34gPbCO3进行焙烧,其热重曲线如图所示,请写出350℃时所得铅的氧化物的化学式:_________。
18.(15分)金属钛(Ti)在航空航天,医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
ⅰ.直接氯化法:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1>0 Kpl
ⅱ.碳氯化法:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2<0 Kp2
①反应2C(s)+O2(g)=2CO(g) △H3 Kp3,则△H3=______(用含△H1、△H2的代数式表示),Kp3=______(用含Kp1,Kp2的代数式表示),____(填“低温”“高温”或“任意温度”)有利于该反应自发进行。
②对于直接氯化法:仅增大压强,平衡_______(填“向左”“向右”或“不”)移动;仅升高温度,Cl2(g)平衡转化率_______(填“变大”“变小”或“不变”)。
(2)在压强为170kPa恒压作用下,将TiO2(s)、C(s)、Cl2(g)以物质的量之比为1:2.2:2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为______。
②反应C(s)+CO2(g)=2CO(g)的平衡常数Kp(T2℃)=______kPa(分压=物质的量分数×总压)。
(3)查阅资料可知:Kp2>Kp1,即碳氯化法的反应趋势远大于直接氯化法,其原因为___________。
西安市2023-2024学年高二上学期期末教学质量监测
化学参考答案
1.B 2.C 3.B 4.A 5.D 6.D 7.B 8.C 9.B 10.A 11.C 12.D 13.B 14.D
15.(1)2s22p3(2分)
(2)5(2分);哑铃(2分)
(3)>(2分)
(4)8H2O+14Fe3++FeS2=15Fe2++2+16H+(2分);小(2分);强(2分)
16.(1)100mL容量瓶(或容量瓶,1分)
②2(1分);玻璃棒应伸入刻度线以下(或容量瓶瓶塞应系在细颈瓶口,2分)
(2)①酸(1分);Fe3++3H2OFe(OH)3+3H+(或+H2ONH3·H2O+H+,2分)
②锥形瓶中溶液颜色的变化(2分)
③当滴入最后半滴标准液时,锥形瓶中溶液颜色变为红色,且30s内颜色不变(2分)
④(2分)
(3)BC(2分)
17.(1) (2分);p(2分)
(2)PbS+2Fe3++4Cl-=[PbCl4]2-+2Fe2++S(2分)
(3)K3[Fe(CN)6](2分)
(4)4.6×10-6(2分);取少许最后一次洗涤液于试管中,向其中加入盐酸酸化的BaCl2溶液(2分)
(5)Pb2O3(2分)
18.(1)①△H2-△H1;(2分);任意温度(2分)
②不(2分);变大(1分)
(2)①+1或-1(2分);②1740.8(2分)
(3)碳氯化法反应的气体分子数增加,△H<0,是熵增、放热过程,为自发过程,而直接氯化法的体系中气体分子数不变,且是吸热过程(或其他合理答案,2分)
同课章节目录
