山东省德州市2023-2024学年高一上学期期末统考化学试题(含答案)
文档属性
| 名称 | 山东省德州市2023-2024学年高一上学期期末统考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 829.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 17:20:49 | ||
图片预览


文档简介
德州市2023-2024学年高一上学期期末统考化学试题
2024.1
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分100分,考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子量:H1 C12 N14 O16 Na23 S32 Cl35.5 K39 Mn55 Fe56 Cu64 Ba137
第Ⅰ卷(选择题 共40分)
一、选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。下列说法不正确的是( )
A.自然固氮是将氮气转变为含氮化合物
B.可漂白纸浆,也可用于葡萄酒杀菌消毒
C.汽车尾气中的主要大气污染物为NO、和PM2.5
D.果汁中添加维生素C防变质,是利用维生素C的还原性
2.下列做法正确的是( )
A.用冷水储存金属钠 B.不能使用钢瓶盛放氯气
C.浓硝酸保存在无色玻璃瓶中 D.NaOH固体保存在广口塑料瓶中
3.下列生产过程中不涉及氧化还原的是( )
A.漂白粉制备 B.卤水点豆腐 C.高炉炼铁 D.铝热反应
4.下列鉴别或检验不能达到实验目的的是( )
A.用氧气鉴别CO、NO两种无色气体
B.用稀硫酸鉴别Fe、CuO、C三种黑色粉末
C.用溶液鉴别与
D.用硝酸酸化的溶液检验是否被氧化
5.下列有关说法正确的是( )
A.与均可通过化合反应得到
B.室温下,Fe与浓反应产生大量
C.蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生
D.饱和溶液与NaOH溶液反应制备氢氧化铁胶体
6.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.氨水溶液:、、、
B.盐酸溶液:、、、
C.溶液:、、、
D.溶液:、、、
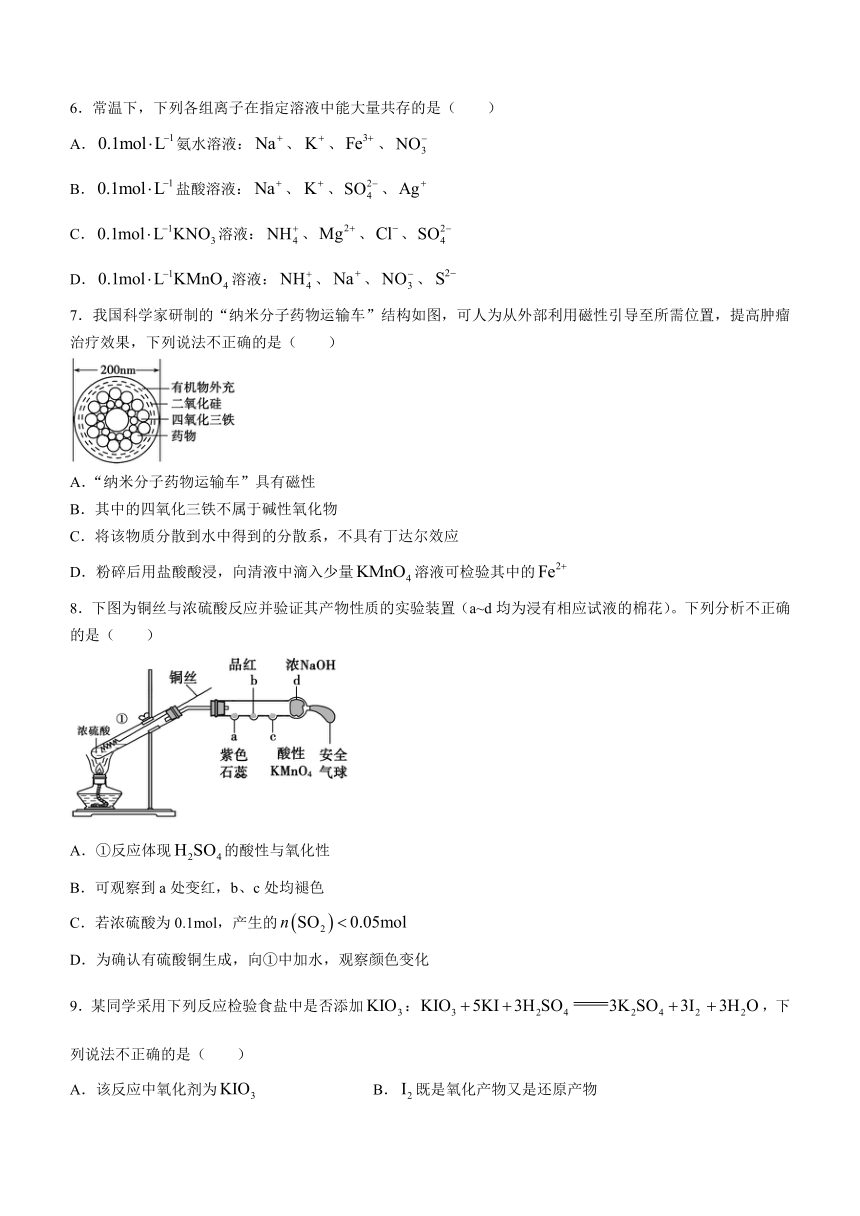
7.我国科学家研制的“纳米分子药物运输车”结构如图,可人为从外部利用磁性引导至所需位置,提高肿瘤治疗效果,下列说法不正确的是( )
A.“纳米分子药物运输车”具有磁性
B.其中的四氧化三铁不属于碱性氧化物
C.将该物质分散到水中得到的分散系,不具有丁达尔效应
D.粉碎后用盐酸酸浸,向清液中滴入少量溶液可检验其中的
8.下图为铜丝与浓硫酸反应并验证其产物性质的实验装置(a~d均为浸有相应试液的棉花)。下列分析不正确的是( )
A.①反应体现的酸性与氧化性
B.可观察到a处变红,b、c处均褪色
C.若浓硫酸为0.1mol,产生的
D.为确认有硫酸铜生成,向①中加水,观察颜色变化
9.某同学采用下列反应检验食盐中是否添加:,下列说法不正确的是( )
A.该反应中氧化剂为 B.既是氧化产物又是还原产物
C.生成时,转移2mol电子 D.氧化产物:还原产物=5:1
10.实验室制备固体并检验其纯度的实验流程如图所示。
下列说法正确的是( )
A.熔融钠在空气中的反应可在玻璃表面皿中进行
B.与水反应,是氧化剂,是还原剂
C.取样液加入酚酞,观察到样液先变红后褪色
D.取10.0g淡黄色样品进行反应,最后生成3.94g沉淀,则该样品纯度为21.2%
二、选择题:本题包括5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作 现象 结论
A 将少量铜粉加入稀硫酸中,无明显现象,再加入溶液 铜粉溶解 与铜粉反应
B 向某溶液中加入稀的NaOH溶液 湿润的红色石蕊试纸不变色 原溶液中不含有
C 将浓硫酸加入蔗糖中 形成多孔碳 浓硫酸具有氧化性和脱水性
D 向某溶液中加入稀硫酸,产生的气体通入澄清石灰水 石灰水变浑浊 原溶液中可能含有
12.纳米铁粉可用于处理含氧酸性废水中的,反应原理如图所示。下列说法不正确的是( )
A.上述反应中纳米铁粉和均体现还原性
B.若有56g纳米铁粉参与反应,至少可处理
C.在铁粉总量一定的条件下,处理的的量与通入的氧气量成正比
D.该历程说明氧化性
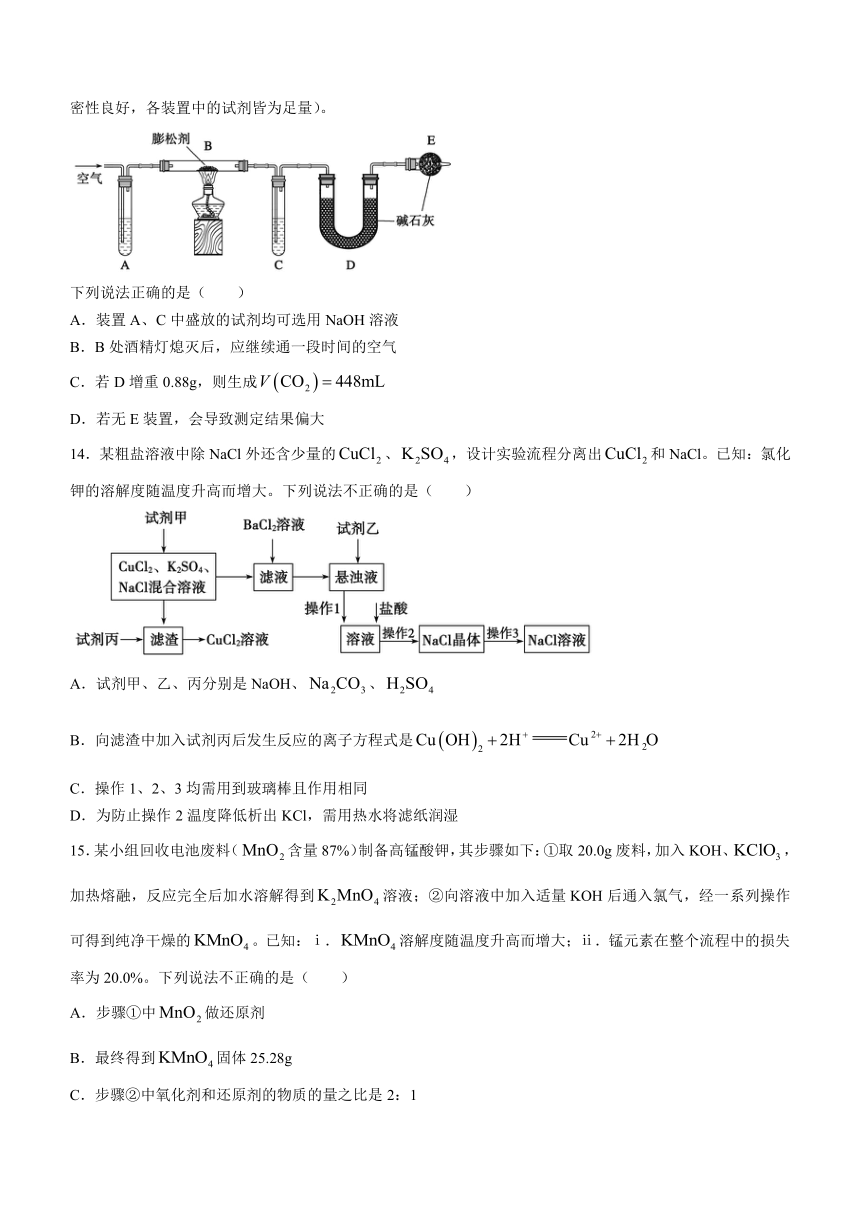
13.某兴趣小组为研究膨松剂(碳酸氢钠)受热分解放出气体的量,设计了以下实验。按如图所示连接装置(气密性良好,各装置中的试剂皆为足量)。
下列说法正确的是( )
A.装置A、C中盛放的试剂均可选用NaOH溶液
B.B处酒精灯熄灭后,应继续通一段时间的空气
C.若D增重0.88g,则生成
D.若无E装置,会导致测定结果偏大
14.某粗盐溶液中除NaCl外还含少量的、,设计实验流程分离出和NaCl。已知:氯化钾的溶解度随温度升高而增大。下列说法不正确的是( )
A.试剂甲、乙、丙分别是NaOH、、
B.向滤渣中加入试剂丙后发生反应的离子方程式是
C.操作1、2、3均需用到玻璃棒且作用相同
D.为防止操作2温度降低析出KCl,需用热水将滤纸润湿
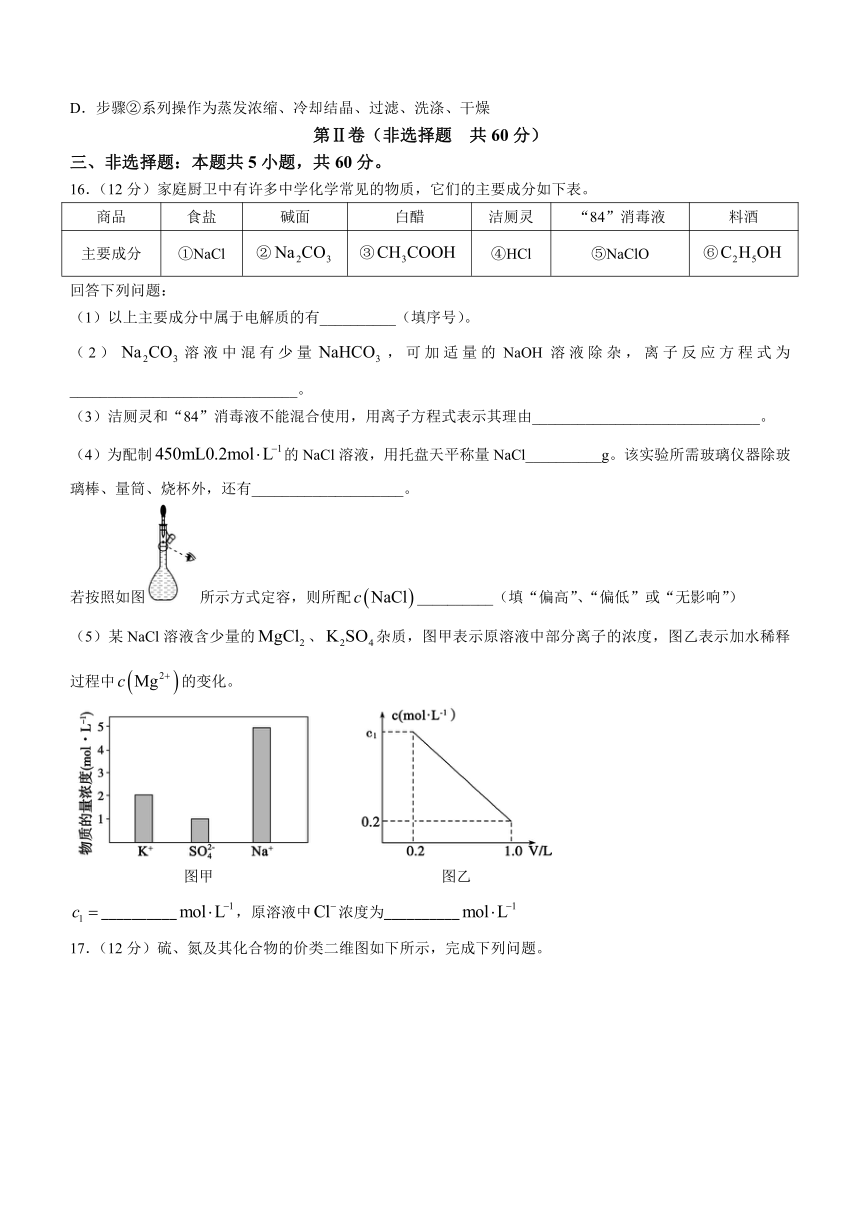
15.某小组回收电池废料(含量87%)制备高锰酸钾,其步骤如下:①取20.0g废料,加入KOH、,加热熔融,反应完全后加水溶解得到溶液;②向溶液中加入适量KOH后通入氯气,经一系列操作可得到纯净干燥的。已知:ⅰ.溶解度随温度升高而增大;ⅱ.锰元素在整个流程中的损失率为20.0%。下列说法不正确的是( )
A.步骤①中做还原剂
B.最终得到固体25.28g
C.步骤②中氧化剂和还原剂的物质的量之比是2:1
D.步骤②系列操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
第Ⅱ卷(非选择题 共60分)
三、非选择题:本题共5小题,共60分。
16.(12分)家庭厨卫中有许多中学化学常见的物质,它们的主要成分如下表。
商品 食盐 碱面 白醋 洁厕灵 “84”消毒液 料酒
主要成分 ①NaCl ② ③ ④HCl ⑤NaClO ⑥
回答下列问题:
(1)以上主要成分中属于电解质的有__________(填序号)。
(2)溶液中混有少量,可加适量的NaOH溶液除杂,离子反应方程式为______________________________。
(3)洁厕灵和“84”消毒液不能混合使用,用离子方程式表示其理由______________________________。
(4)为配制的NaCl溶液,用托盘天平称量NaCl__________g。该实验所需玻璃仪器除玻璃棒、量筒、烧杯外,还有____________________。
若按照如图所示方式定容,则所配__________(填“偏高”、“偏低”或“无影响”)
(5)某NaCl溶液含少量的、杂质,图甲表示原溶液中部分离子的浓度,图乙表示加水稀释过程中的变化。
图甲 图乙
__________,原溶液中浓度为__________
17.(12分)硫、氮及其化合物的价类二维图如下所示,完成下列问题。
已知:的沸点为44.8℃;的沸点为21℃。
(1)价类二维图中属于酸性氧化物的是__________(填化学式,下同),上图物质中不能用浓硫酸干燥的气体是__________。
(2)c的水溶液在空气中久置酸性增强,原因______________________________(用化学方程式表示)。
(3)25℃下,将c通入盛有溶液的试管中无明显现象,若再通入__________气体(从上图中选择,填化学式)可产生沉淀。
(4)取e和混合后的稀溶液100.00mL,加入足量铁粉充分反应,且反应后的溶液中只含有一种溶质,其浓度为(假设溶液体积不变),共收集到无色气体3.36L(标准状况),则混合液中e和的浓度比__________,产生氢气的体积(标准状况)__________L。
18.(12分)含铜电路板可以用进行刻蚀,对刻蚀后的液体(、和)进行处理以提取、胆矾,流程如图,回答下列问题。
(1)写出Cu与反应的离子方程式______________________________。证明完全被还原,所选试剂为:__________(填化学式)。
(2)过程②中选择的试剂为__________;过程③中加入铁粉的目的是______________________________。
(3)过程④发生反应的化学方程式为____________________,每消耗,转移电子数为__________。
(4)胆矾中结晶水含量测定:称量样品,经灼烧至胆矾全部变为白色,冷却,称量,重复上述操作,最终样品质量恒定为。从下列仪器中选出灼烧,冷却需使用的仪器,依次为____________________(填标号)。根据实验数据,胆矾分子中结晶水的个数为__________(写表达式)。
19.(12分)实验室模拟某工厂“氨氧化法”制备硝酸及工厂废气的处理过程,方法如下:
Ⅰ.硝酸制备
设计如下装置制备硝酸(夹持装置略),每个虚线框表示一个装置单元
回答下列问题:
(1)上述装置中错误的是____________________(填序号)
(2)装置②中发生的反应为______________________________。
(3)空气的作用为______________________________。
(4)要使制备硝酸的氮原子利用率为100%,制得,理论上需要通入空气的体积至少为__________L(标准状况下)(空气中氧气含量近似为20%)
Ⅱ.工厂废气处理
(5)制备一定量:下图是实验室制取氨气的装置和选用的试剂,其中错误的是____________________(填字母标号)。
(6)将制得的充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(两端用止水夹、夹好)。按下图所示装置进行实验。
打开,推动注射器活塞,使X中的气体缓慢通入Y管中,可观察到Y管中____________________,Y管中反应的化学方程式为______________________________。
20.(12分)次氯酸钠溶液和优氯净都是常用的杀菌消毒剂。可用NaClO与氰尿酸[]制备优氯净。
优氯净常温下为白色固体,难溶于冷水,实验装置如下图所示(加热与夹持装置略)
已知:①
②
(1)优氯净的摩尔质量为__________。
(2)用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是______________________________。
(3)A中软导管的作用为______________________________;A中反应的化学方程式为______________________________。
(4)装置C可选择__________(填“冰水浴”或“热水浴”)目的是______________________________。
(5)反应结束后,C中浊液经__________、洗涤、干燥得到粗产品。
(6)下列说法正确的是__________。
a.装置B的试剂为浓硫酸
b.当C上方出现黄绿色气体时,再滴入氰尿酸溶液
c.当C中加入2molNaOH时,可消耗0.5mol氰尿酸
d.D中试剂可为NaOH或
高一化学试题参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.C 2.D 3.B 4.D 5.A
6.C 7.D 8.D 9.C 10.C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.CD 12.C 13.BD 14.AC 15.C
三、非选择题:本题共5小题,共60分16,(12分,除标注外,每空2分)
(1)①②③④⑤(1分)
(2)(1分)
(3)
(4)5.9 胶头滴管、500mL容量瓶 偏低(1分)
(5)1(1分) 7
17.(12分,每空2分)
(1)、 、
(2)
(3)、、
(4)2:1 1.12L
18.(12分,除标注外,每空2分)
(1) KSCN(1分)
(2)盐酸(1分) 防止亚铁离子被氧化(1分)
(3) (1分)
(4)AC
19.(12分,除标注外,每空2分)
(1)①
(2)
(3)提供氧气,将氨气吹到②装置中反应,将产生的气体通入④中反应
(4)22.4L
(5)a(1分)
(6)红棕色褪去,内壁有小液滴(1分)
20.(12分,除标注外,每空2分)
(1)220g/mol
(2)NaClO溶液吸收空气中的后产生HClO,HClO见光分解
(3)平衡气压,使液体能够顺利滴下(1分)
(4)冰水浴(1分) 防止温度过高生成(1分)
(5)过滤(1分)
(6)bd
2024.1
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分100分,考试时间90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子量:H1 C12 N14 O16 Na23 S32 Cl35.5 K39 Mn55 Fe56 Cu64 Ba137
第Ⅰ卷(选择题 共40分)
一、选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。下列说法不正确的是( )
A.自然固氮是将氮气转变为含氮化合物
B.可漂白纸浆,也可用于葡萄酒杀菌消毒
C.汽车尾气中的主要大气污染物为NO、和PM2.5
D.果汁中添加维生素C防变质,是利用维生素C的还原性
2.下列做法正确的是( )
A.用冷水储存金属钠 B.不能使用钢瓶盛放氯气
C.浓硝酸保存在无色玻璃瓶中 D.NaOH固体保存在广口塑料瓶中
3.下列生产过程中不涉及氧化还原的是( )
A.漂白粉制备 B.卤水点豆腐 C.高炉炼铁 D.铝热反应
4.下列鉴别或检验不能达到实验目的的是( )
A.用氧气鉴别CO、NO两种无色气体
B.用稀硫酸鉴别Fe、CuO、C三种黑色粉末
C.用溶液鉴别与
D.用硝酸酸化的溶液检验是否被氧化
5.下列有关说法正确的是( )
A.与均可通过化合反应得到
B.室温下,Fe与浓反应产生大量
C.蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生
D.饱和溶液与NaOH溶液反应制备氢氧化铁胶体
6.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.氨水溶液:、、、
B.盐酸溶液:、、、
C.溶液:、、、
D.溶液:、、、
7.我国科学家研制的“纳米分子药物运输车”结构如图,可人为从外部利用磁性引导至所需位置,提高肿瘤治疗效果,下列说法不正确的是( )
A.“纳米分子药物运输车”具有磁性
B.其中的四氧化三铁不属于碱性氧化物
C.将该物质分散到水中得到的分散系,不具有丁达尔效应
D.粉碎后用盐酸酸浸,向清液中滴入少量溶液可检验其中的
8.下图为铜丝与浓硫酸反应并验证其产物性质的实验装置(a~d均为浸有相应试液的棉花)。下列分析不正确的是( )
A.①反应体现的酸性与氧化性
B.可观察到a处变红,b、c处均褪色
C.若浓硫酸为0.1mol,产生的
D.为确认有硫酸铜生成,向①中加水,观察颜色变化
9.某同学采用下列反应检验食盐中是否添加:,下列说法不正确的是( )
A.该反应中氧化剂为 B.既是氧化产物又是还原产物
C.生成时,转移2mol电子 D.氧化产物:还原产物=5:1
10.实验室制备固体并检验其纯度的实验流程如图所示。
下列说法正确的是( )
A.熔融钠在空气中的反应可在玻璃表面皿中进行
B.与水反应,是氧化剂,是还原剂
C.取样液加入酚酞,观察到样液先变红后褪色
D.取10.0g淡黄色样品进行反应,最后生成3.94g沉淀,则该样品纯度为21.2%
二、选择题:本题包括5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作 现象 结论
A 将少量铜粉加入稀硫酸中,无明显现象,再加入溶液 铜粉溶解 与铜粉反应
B 向某溶液中加入稀的NaOH溶液 湿润的红色石蕊试纸不变色 原溶液中不含有
C 将浓硫酸加入蔗糖中 形成多孔碳 浓硫酸具有氧化性和脱水性
D 向某溶液中加入稀硫酸,产生的气体通入澄清石灰水 石灰水变浑浊 原溶液中可能含有
12.纳米铁粉可用于处理含氧酸性废水中的,反应原理如图所示。下列说法不正确的是( )
A.上述反应中纳米铁粉和均体现还原性
B.若有56g纳米铁粉参与反应,至少可处理
C.在铁粉总量一定的条件下,处理的的量与通入的氧气量成正比
D.该历程说明氧化性
13.某兴趣小组为研究膨松剂(碳酸氢钠)受热分解放出气体的量,设计了以下实验。按如图所示连接装置(气密性良好,各装置中的试剂皆为足量)。
下列说法正确的是( )
A.装置A、C中盛放的试剂均可选用NaOH溶液
B.B处酒精灯熄灭后,应继续通一段时间的空气
C.若D增重0.88g,则生成
D.若无E装置,会导致测定结果偏大
14.某粗盐溶液中除NaCl外还含少量的、,设计实验流程分离出和NaCl。已知:氯化钾的溶解度随温度升高而增大。下列说法不正确的是( )
A.试剂甲、乙、丙分别是NaOH、、
B.向滤渣中加入试剂丙后发生反应的离子方程式是
C.操作1、2、3均需用到玻璃棒且作用相同
D.为防止操作2温度降低析出KCl,需用热水将滤纸润湿
15.某小组回收电池废料(含量87%)制备高锰酸钾,其步骤如下:①取20.0g废料,加入KOH、,加热熔融,反应完全后加水溶解得到溶液;②向溶液中加入适量KOH后通入氯气,经一系列操作可得到纯净干燥的。已知:ⅰ.溶解度随温度升高而增大;ⅱ.锰元素在整个流程中的损失率为20.0%。下列说法不正确的是( )
A.步骤①中做还原剂
B.最终得到固体25.28g
C.步骤②中氧化剂和还原剂的物质的量之比是2:1
D.步骤②系列操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
第Ⅱ卷(非选择题 共60分)
三、非选择题:本题共5小题,共60分。
16.(12分)家庭厨卫中有许多中学化学常见的物质,它们的主要成分如下表。
商品 食盐 碱面 白醋 洁厕灵 “84”消毒液 料酒
主要成分 ①NaCl ② ③ ④HCl ⑤NaClO ⑥
回答下列问题:
(1)以上主要成分中属于电解质的有__________(填序号)。
(2)溶液中混有少量,可加适量的NaOH溶液除杂,离子反应方程式为______________________________。
(3)洁厕灵和“84”消毒液不能混合使用,用离子方程式表示其理由______________________________。
(4)为配制的NaCl溶液,用托盘天平称量NaCl__________g。该实验所需玻璃仪器除玻璃棒、量筒、烧杯外,还有____________________。
若按照如图所示方式定容,则所配__________(填“偏高”、“偏低”或“无影响”)
(5)某NaCl溶液含少量的、杂质,图甲表示原溶液中部分离子的浓度,图乙表示加水稀释过程中的变化。
图甲 图乙
__________,原溶液中浓度为__________
17.(12分)硫、氮及其化合物的价类二维图如下所示,完成下列问题。
已知:的沸点为44.8℃;的沸点为21℃。
(1)价类二维图中属于酸性氧化物的是__________(填化学式,下同),上图物质中不能用浓硫酸干燥的气体是__________。
(2)c的水溶液在空气中久置酸性增强,原因______________________________(用化学方程式表示)。
(3)25℃下,将c通入盛有溶液的试管中无明显现象,若再通入__________气体(从上图中选择,填化学式)可产生沉淀。
(4)取e和混合后的稀溶液100.00mL,加入足量铁粉充分反应,且反应后的溶液中只含有一种溶质,其浓度为(假设溶液体积不变),共收集到无色气体3.36L(标准状况),则混合液中e和的浓度比__________,产生氢气的体积(标准状况)__________L。
18.(12分)含铜电路板可以用进行刻蚀,对刻蚀后的液体(、和)进行处理以提取、胆矾,流程如图,回答下列问题。
(1)写出Cu与反应的离子方程式______________________________。证明完全被还原,所选试剂为:__________(填化学式)。
(2)过程②中选择的试剂为__________;过程③中加入铁粉的目的是______________________________。
(3)过程④发生反应的化学方程式为____________________,每消耗,转移电子数为__________。
(4)胆矾中结晶水含量测定:称量样品,经灼烧至胆矾全部变为白色,冷却,称量,重复上述操作,最终样品质量恒定为。从下列仪器中选出灼烧,冷却需使用的仪器,依次为____________________(填标号)。根据实验数据,胆矾分子中结晶水的个数为__________(写表达式)。
19.(12分)实验室模拟某工厂“氨氧化法”制备硝酸及工厂废气的处理过程,方法如下:
Ⅰ.硝酸制备
设计如下装置制备硝酸(夹持装置略),每个虚线框表示一个装置单元
回答下列问题:
(1)上述装置中错误的是____________________(填序号)
(2)装置②中发生的反应为______________________________。
(3)空气的作用为______________________________。
(4)要使制备硝酸的氮原子利用率为100%,制得,理论上需要通入空气的体积至少为__________L(标准状况下)(空气中氧气含量近似为20%)
Ⅱ.工厂废气处理
(5)制备一定量:下图是实验室制取氨气的装置和选用的试剂,其中错误的是____________________(填字母标号)。
(6)将制得的充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(两端用止水夹、夹好)。按下图所示装置进行实验。
打开,推动注射器活塞,使X中的气体缓慢通入Y管中,可观察到Y管中____________________,Y管中反应的化学方程式为______________________________。
20.(12分)次氯酸钠溶液和优氯净都是常用的杀菌消毒剂。可用NaClO与氰尿酸[]制备优氯净。
优氯净常温下为白色固体,难溶于冷水,实验装置如下图所示(加热与夹持装置略)
已知:①
②
(1)优氯净的摩尔质量为__________。
(2)用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是______________________________。
(3)A中软导管的作用为______________________________;A中反应的化学方程式为______________________________。
(4)装置C可选择__________(填“冰水浴”或“热水浴”)目的是______________________________。
(5)反应结束后,C中浊液经__________、洗涤、干燥得到粗产品。
(6)下列说法正确的是__________。
a.装置B的试剂为浓硫酸
b.当C上方出现黄绿色气体时,再滴入氰尿酸溶液
c.当C中加入2molNaOH时,可消耗0.5mol氰尿酸
d.D中试剂可为NaOH或
高一化学试题参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.C 2.D 3.B 4.D 5.A
6.C 7.D 8.D 9.C 10.C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.CD 12.C 13.BD 14.AC 15.C
三、非选择题:本题共5小题,共60分16,(12分,除标注外,每空2分)
(1)①②③④⑤(1分)
(2)(1分)
(3)
(4)5.9 胶头滴管、500mL容量瓶 偏低(1分)
(5)1(1分) 7
17.(12分,每空2分)
(1)、 、
(2)
(3)、、
(4)2:1 1.12L
18.(12分,除标注外,每空2分)
(1) KSCN(1分)
(2)盐酸(1分) 防止亚铁离子被氧化(1分)
(3) (1分)
(4)AC
19.(12分,除标注外,每空2分)
(1)①
(2)
(3)提供氧气,将氨气吹到②装置中反应,将产生的气体通入④中反应
(4)22.4L
(5)a(1分)
(6)红棕色褪去,内壁有小液滴(1分)
20.(12分,除标注外,每空2分)
(1)220g/mol
(2)NaClO溶液吸收空气中的后产生HClO,HClO见光分解
(3)平衡气压,使液体能够顺利滴下(1分)
(4)冰水浴(1分) 防止温度过高生成(1分)
(5)过滤(1分)
(6)bd
同课章节目录
