化学人教版(2019)选择性必修2 2.1.1共价键(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.1.1共价键(共24张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 00:00:00 | ||
图片预览




文档简介
(共24张PPT)
第二章 分子结构与性质
第一节 共价键
第一课时
1. 认识共价键的本质,原子间通过原子轨道重叠形成共价键。
2. 知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
TARGETS
学 习 目 标
3. 知道共价键的特征——具有饱和性和方向性。
情境微课堂
诺贝尔物理学奖得主理查德·费曼曾说过,假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,“万物皆由原子构成”。
知 识 回 顾
化学键:相邻原子之间强烈的相互作用
化学键
共价键
离子键
极性共价键
非极性共价键
本质?
原子之间通过共用电子对(或原子轨道重叠)形成共价键
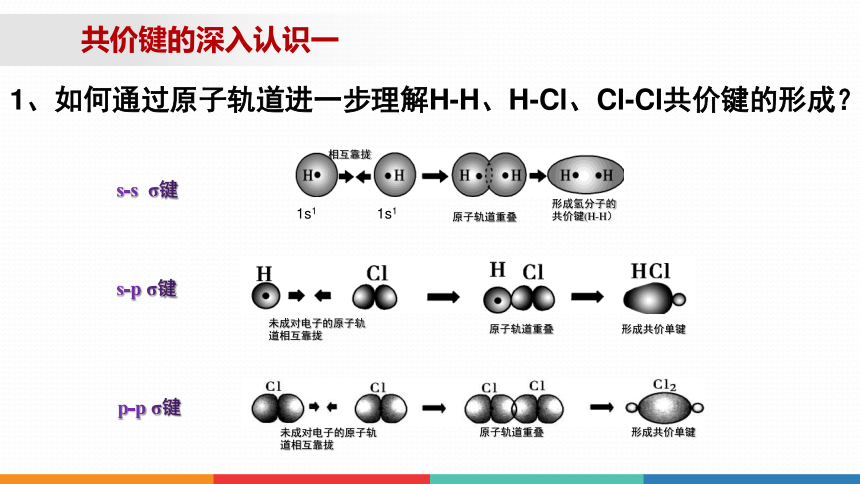
1、如何通过原子轨道进一步理解H-H、H-Cl、Cl-Cl共价键的形成?
共价键的深入认识一
s-p σ键
未成对电子的原子轨道相互靠拢
原子轨道重叠
形成共价单键
p-p σ键
未成对电子的原子轨道相互靠拢
原子轨道重叠
形成共价单键
1s1
1s1
相互靠拢
原子轨道重叠
形成氢分子的共价键(H-H)
s-s σ键
H-Cl
H-H
Cl-Cl
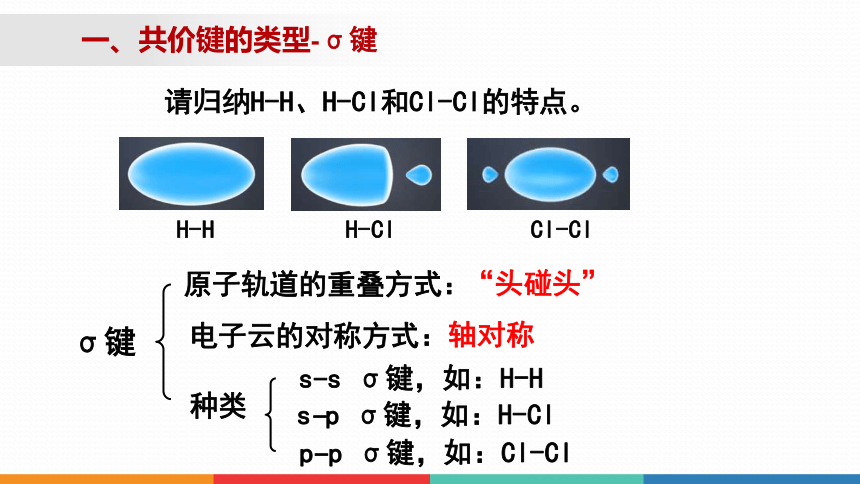
请归纳H-H、H-Cl和Cl-Cl的特点。
一、共价键的类型-σ键
σ键
s s σ键,如:H-H
-
s p σ键,如:H-Cl
-
p p σ键,如:Cl-Cl
-
“头碰头”
原子轨道的重叠方式:
种类
轴对称
电子云的对称方式:
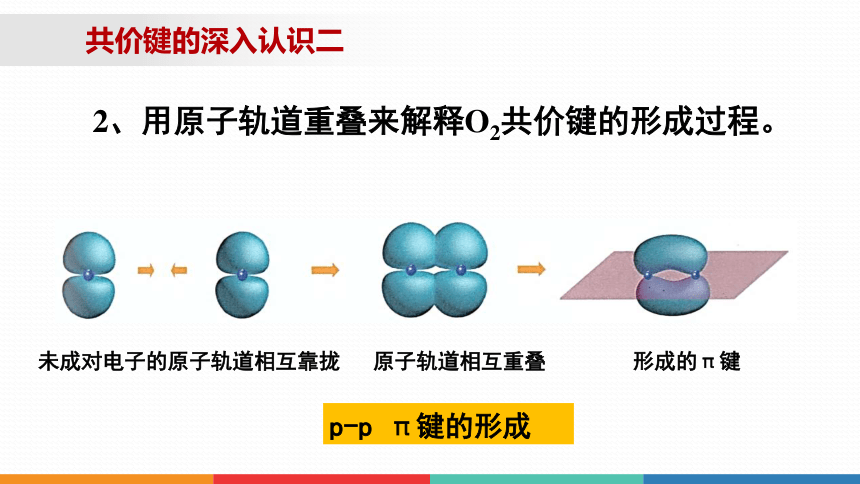
共价键的深入认识二
2、用原子轨道重叠来解释O2共价键的形成过程。
p-p π键的形成
未成对电子的原子轨道相互靠拢 原子轨道相互重叠 形成的π键
(1)概念:形成共价键的未成对电子的原子轨道,采取“肩并肩”的方式重叠,这种共价键叫π键,
(2)电子云的对称方式:镜面对称
(3)类型为 p-p π键
一、 共价键的类型-π键
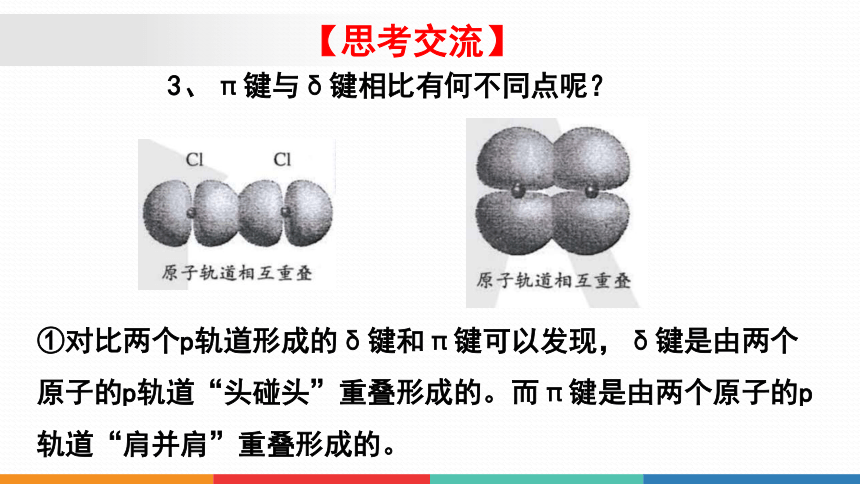
3、π键与δ键相比有何不同点呢?
①对比两个p轨道形成的δ键和π键可以发现,δ键是由两个原子的p轨道“头碰头”重叠形成的。而π键是由两个原子的p轨道“肩并肩”重叠形成的。
【思考交流】
②π键的电子云形状与δ键的电子云形状有明显差别:每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称。
③π键与δ键的强度不同。例如,乙炔、乙烯分子中的π键不如δ键牢固,比较容易断裂。因而含有π键的乙烯、乙炔与只有δ键的乙烷的化学性质不同。
二、δ键和π键的区别
4、如果将π键沿着键轴旋转,会发生什么情况呢?
【思考交流】
用电子式表示N2的形成过程,并用原子轨道重叠来解释其共价键的形成过程。
↑
↑
↑
↑↓
2s
2p
N
N
·
·
·
:
:
:
:
:
N
:
N
+
N
·
·
·
:
【思考交流】
x
y
z
N的2p轨道示意图
x
y
z
N2中共价三键的形成过程
“头碰头”
x
y
z
z
y
“肩并肩”
N2中共价三键的形成过程
“头碰头”
“肩并肩”
“肩并肩”
y
z
z
y
x
N2中共价三键的形成过程
p p σ键
p p π键
p p π键
y
z
z
y
x
N2中共价三键的形成过程
-
-
-
5、通过氮气中氮氮三键形成过程的分析,如何判断共价键是σ键或是π键?
【思考交流】
单键 双键 三键
σ键
1个σ键、1个π键
1个σ键、2个π键
观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
乙炔
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
③乙炔中含有1个三键和2个C-H键,即含有3个σ键和2个π键;
【问题探究】
共价键特征
方向性→由于原子轨道存在方向,因此成键时共价
键也有方向性
饱和性→一个原子有几个未成对电子,便可成几个
共价键(最外层电子数a≤4,成键数a;
a>4,成键数8-a)
三、共价键的特征
---决定分子的空间结构
---决定原子形成分子时相互结合的数量关系
微思考:为什么难以形成H3、H2Cl、Cl3等分子?
共价键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
特征
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
特征
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
【课堂小结】
【随堂小测】
练习1 下列关于共价键具有饱和性和方向性这两个特征的叙述中,不正确的是( )
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.共价键的方向性是由成键原子的轨道的方向性决定的
C.共价键的饱和性决定了分子内部的原子的数量关系
D.共价键的饱和性与原子轨道的重叠程度有关
练习2 下列说法中不正确的是( )
A.一般σ键比π键重叠程度大,形成的共价键强
B.两个原子间形成共价键时,最多有一个σ键
C.只含极性键的分子一定是极性分子
D.N2分子中有一个σ键,两个π键
D
C
①③
②④
⑤
①②③
④⑤
【随堂小测】
1. 绘制表格比较σ键和π键
2. 固学案第15,16页
【作业布置】
σ键和π键的比较
共价键类型 σ键 π键
原子轨道 重叠方式
原子轨道重叠部位
原子轨道重叠程度
键的强度
化学活泼性
成键规律判断
第二章 分子结构与性质
第一节 共价键
第一课时
1. 认识共价键的本质,原子间通过原子轨道重叠形成共价键。
2. 知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
TARGETS
学 习 目 标
3. 知道共价键的特征——具有饱和性和方向性。
情境微课堂
诺贝尔物理学奖得主理查德·费曼曾说过,假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,“万物皆由原子构成”。
知 识 回 顾
化学键:相邻原子之间强烈的相互作用
化学键
共价键
离子键
极性共价键
非极性共价键
本质?
原子之间通过共用电子对(或原子轨道重叠)形成共价键
1、如何通过原子轨道进一步理解H-H、H-Cl、Cl-Cl共价键的形成?
共价键的深入认识一
s-p σ键
未成对电子的原子轨道相互靠拢
原子轨道重叠
形成共价单键
p-p σ键
未成对电子的原子轨道相互靠拢
原子轨道重叠
形成共价单键
1s1
1s1
相互靠拢
原子轨道重叠
形成氢分子的共价键(H-H)
s-s σ键
H-Cl
H-H
Cl-Cl
请归纳H-H、H-Cl和Cl-Cl的特点。
一、共价键的类型-σ键
σ键
s s σ键,如:H-H
-
s p σ键,如:H-Cl
-
p p σ键,如:Cl-Cl
-
“头碰头”
原子轨道的重叠方式:
种类
轴对称
电子云的对称方式:
共价键的深入认识二
2、用原子轨道重叠来解释O2共价键的形成过程。
p-p π键的形成
未成对电子的原子轨道相互靠拢 原子轨道相互重叠 形成的π键
(1)概念:形成共价键的未成对电子的原子轨道,采取“肩并肩”的方式重叠,这种共价键叫π键,
(2)电子云的对称方式:镜面对称
(3)类型为 p-p π键
一、 共价键的类型-π键
3、π键与δ键相比有何不同点呢?
①对比两个p轨道形成的δ键和π键可以发现,δ键是由两个原子的p轨道“头碰头”重叠形成的。而π键是由两个原子的p轨道“肩并肩”重叠形成的。
【思考交流】
②π键的电子云形状与δ键的电子云形状有明显差别:每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称。
③π键与δ键的强度不同。例如,乙炔、乙烯分子中的π键不如δ键牢固,比较容易断裂。因而含有π键的乙烯、乙炔与只有δ键的乙烷的化学性质不同。
二、δ键和π键的区别
4、如果将π键沿着键轴旋转,会发生什么情况呢?
【思考交流】
用电子式表示N2的形成过程,并用原子轨道重叠来解释其共价键的形成过程。
↑
↑
↑
↑↓
2s
2p
N
N
·
·
·
:
:
:
:
:
N
:
N
+
N
·
·
·
:
【思考交流】
x
y
z
N的2p轨道示意图
x
y
z
N2中共价三键的形成过程
“头碰头”
x
y
z
z
y
“肩并肩”
N2中共价三键的形成过程
“头碰头”
“肩并肩”
“肩并肩”
y
z
z
y
x
N2中共价三键的形成过程
p p σ键
p p π键
p p π键
y
z
z
y
x
N2中共价三键的形成过程
-
-
-
5、通过氮气中氮氮三键形成过程的分析,如何判断共价键是σ键或是π键?
【思考交流】
单键 双键 三键
σ键
1个σ键、1个π键
1个σ键、2个π键
观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
乙炔
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
③乙炔中含有1个三键和2个C-H键,即含有3个σ键和2个π键;
【问题探究】
共价键特征
方向性→由于原子轨道存在方向,因此成键时共价
键也有方向性
饱和性→一个原子有几个未成对电子,便可成几个
共价键(最外层电子数a≤4,成键数a;
a>4,成键数8-a)
三、共价键的特征
---决定分子的空间结构
---决定原子形成分子时相互结合的数量关系
微思考:为什么难以形成H3、H2Cl、Cl3等分子?
共价键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
特征
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
特征
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
【课堂小结】
【随堂小测】
练习1 下列关于共价键具有饱和性和方向性这两个特征的叙述中,不正确的是( )
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.共价键的方向性是由成键原子的轨道的方向性决定的
C.共价键的饱和性决定了分子内部的原子的数量关系
D.共价键的饱和性与原子轨道的重叠程度有关
练习2 下列说法中不正确的是( )
A.一般σ键比π键重叠程度大,形成的共价键强
B.两个原子间形成共价键时,最多有一个σ键
C.只含极性键的分子一定是极性分子
D.N2分子中有一个σ键,两个π键
D
C
①③
②④
⑤
①②③
④⑤
【随堂小测】
1. 绘制表格比较σ键和π键
2. 固学案第15,16页
【作业布置】
σ键和π键的比较
共价键类型 σ键 π键
原子轨道 重叠方式
原子轨道重叠部位
原子轨道重叠程度
键的强度
化学活泼性
成键规律判断
