化学人教版(2019)必修第一册2.3.2气体摩尔体积(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.2气体摩尔体积(共18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-01 21:50:44 | ||
图片预览


文档简介
(共18张PPT)
第二章 海水中的重要元素——钠和氯
第三节 物质的量
第2课时 气体摩尔体积
上节课,我们已经学习了了两个计算物质的量的公式:n=N/NA和n=m/M,从而通过物质的量知道了微观粒子与宏观质量之间的联系。
那么,气体体积与物质的量之间有什么关系呢
【新课导入】
那么,如果已知某气体的体积,能否直接应用上面的公式计算出某气体的物质的量呢?或者已知某气体的物质的量,能否计算得到气体的体积呢?
答案显然是否定的。
物质的量
粒子数
n=N/NA
n=N/NA
质量
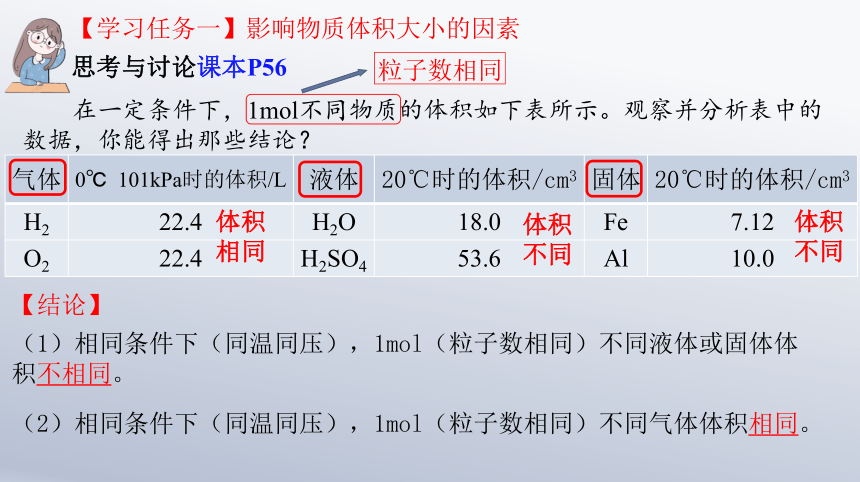
气体 0℃ 101kPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
体积相同
粒子数相同
体积不同
体积不同
【学习任务一】影响物质体积大小的因素
思考与讨论课本P56
在一定条件下,1mol不同物质的体积如下表所示。观察并分析表中的数据,你能得出那些结论?
【结论】
(1)相同条件下(同温同压),1mol(粒子数相同)不同液体或固体体积不相同。
(2)相同条件下(同温同压),1mol(粒子数相同)不同气体体积相同。
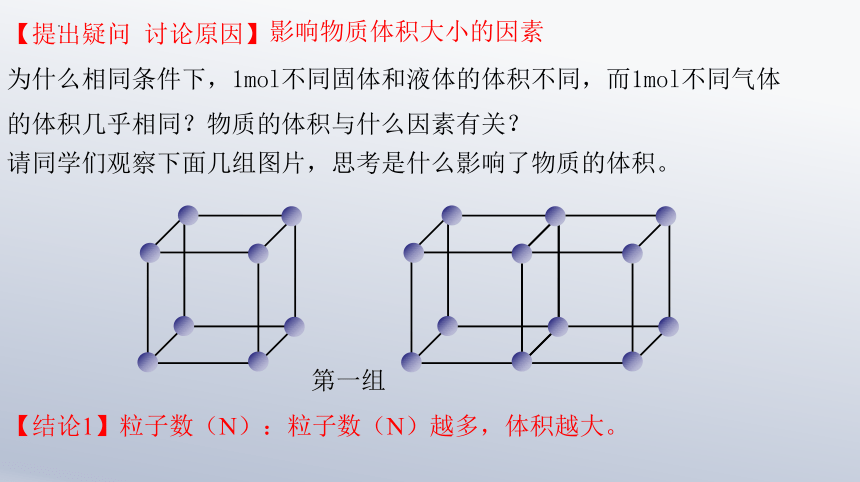
请同学们观察下面几组图片,思考是什么影响了物质的体积。
【提出疑问 讨论原因】
为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?物质的体积与什么因素有关?
影响物质体积大小的因素
第一组
【结论1】粒子数(N):粒子数(N)越多,体积越大。
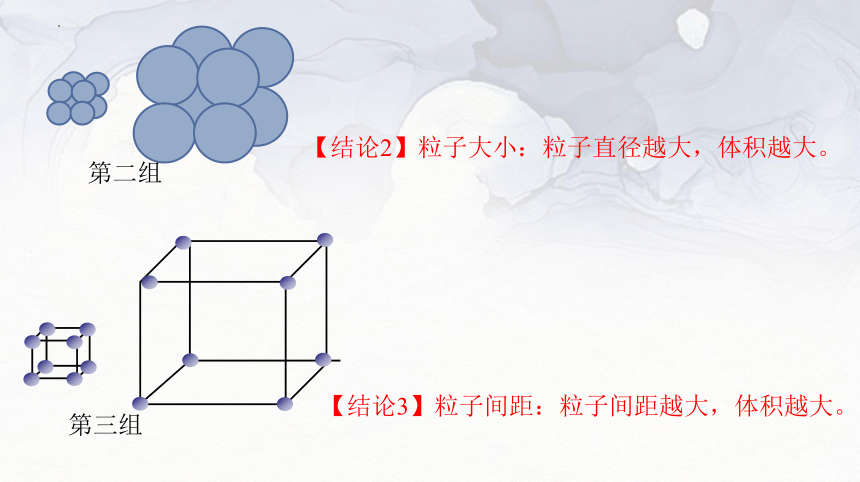
第二组
【结论2】粒子大小:粒子直径越大,体积越大。
第三组
【结论3】粒子间距:粒子间距越大,体积越大。
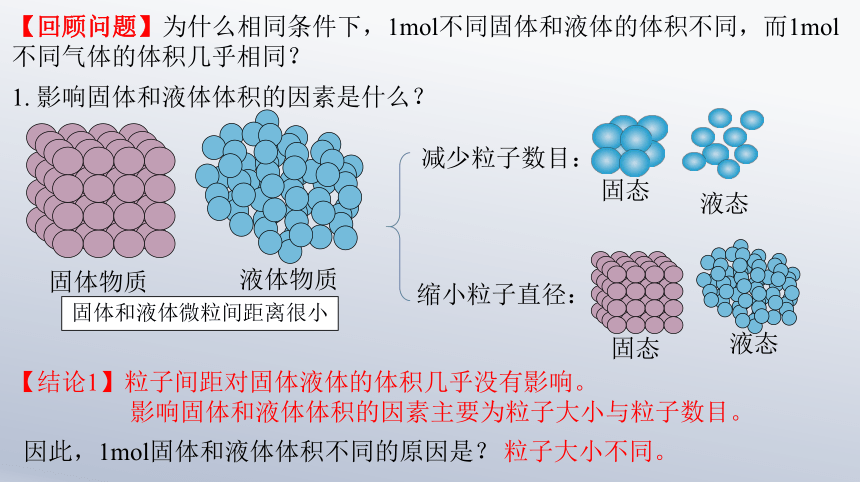
固体和液体微粒间距离很小
【回顾问题】为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?
1. 影响固体和液体体积的因素是什么?
【结论1】粒子间距对固体液体的体积几乎没有影响。
影响固体和液体体积的因素主要为粒子大小与粒子数目。
因此,1mol固体和液体体积不同的原因是?
粒子大小不同。
固态
液态
固体物质
液体物质
减少粒子数目:
缩小粒子直径:
固态
液态
2. 影响气体体积因素是什么?
液态(l)
气态(g)
变成
粒子间的距离增大
宏观现象:
微观探析:
体积增大
液态(粒子间距较小)
气态(粒子间距很大)
气化
【结论2】粒子大小对气体的体积几乎没有影响。(粒子间距远大于粒子直径)
影响气体体积的因素主要为粒子间距与粒子数目。
那么,1mol气体体积相同的原因是?
粒子间距相同。
升温
减压
升温
减压
3. 影响粒子间距因素是什么?
固体物质
液体物质
气体物质
【结论3】影响粒子间距的主要因素是温度和压强。
因此,1mol气体体积相同的原因是?
气体所处环境的温度和压强相同。
粒子数目
粒子间距
粒子大小
物质的体积
固体、液体体积
决定
决定
气体体积
受温度和压强影响
对于粒子数相同的气体来说,如果温度和压强相同,则微粒间的平均距离基本相同,体积也就相同。
【总结】
【规律】在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
阿伏加德罗定律
【学习任务二】气体摩尔体积
回顾课本P56【思考与讨论】
1mol
1、定义:
2、符号:
3、单位:
单位物质的量的气体所占的体积
【新概念】
——气体摩尔体积
Vm
L/mol(L·mol-1)
注意:
①气体摩尔体积的数值只受温度、压强影响。
②标准状况(0℃,101KPa)下,Vm≈22.4L/mol(记住)
阅读教材P56-57页内容,观察图2-22,思考什么是气体的摩尔体积?影响气体摩尔体积的因素是什么?
标准状况
观察图片,你能得到什么结论?
【结论】0℃、101kPa(标准状况下,1mol气体的体积总是22.4L,所含分子数为6.02×1023。
【小结】
“22.4L/mol”使用注意事项:
前提条件:
对 象:
任何气体,纯净气体或混合气体都可以(但混合气体间不能发生反应)
特别提醒:
1. 标准状况(0℃,101KPa)下,HF、H2O、SO3、CCl4、酒精等不属于气态。
2. 标准状况(0℃,101KPa)下,气体摩尔体积为22.4L/mol,但由于温度升高,体积增大,压强增大,体积减小,因此在温度和压强适宜的情况下气体摩尔体积也可能为22.4L/mol。
标准状况(0℃,101KPa)下
【例1】关于物质的体积的说法正确的是( )
A.1mol固体或液体的体积主要决定于微粒间的距离
B.固体和液体的微粒间的空隙很小,因此不能被压缩
C.气态物质微粒间的距离较大,因此气体体积决定于气体分子间的距离
D.气体的体积受温度和压强的影响较大,固体或液体的体积受温度和压
强的影响较小
D
【例2】下列关于气体摩尔体积的几种说法正确的是( )
A.1 mol任何气体的体积均为22.4 L
B.非标准状况下,1 mol气体的体积不可能是22.4 L
C.0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在
标准状况下的体积约为22.4 L
D.同温同压下,相同体积的任何气体单质所含分子数和原子数都相同
C
【思考】气体摩尔体积是指单位物质的量的气体的体积。气体摩尔体积(Vm)与气体体积(V)、物质的量(n)之间具有怎样的关系呢?
V=n·Vm
变式
n=
V
Vm
n
V
Vm=
【构建模型】以物质的量(n)为中心构建质量(m)、体积(V)、粒子
数(N)之间的认知模型:
我们已经学习了三个公式,尝试用物质的量将他们联系起来。
物质的量
粒子数(N)
n=N/NA
n=N/NA
质量(m)
物质的量
n=
V
Vm
【学习任务三】阿伏加德罗定律及其推论
阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
推论一:相同条件(同温同压)下,任何气体的体积之比等于物质的量之比,也等于粒子数之比
=
n1
n2
V1
V2
N1
N2
=
推导过程:
n=
V
Vm
=
V1
Vm
n1
n2
V2
Vm
同温同压下,Vm是定值(NA始终是定值)
=
n1
n2
V1
V2
N1
N2
=
M = ρVm
1mol气体的
质量:为摩尔质量(M)
【计算】在标准状况下,已知H2的密度是 0.0899g/L,求H2的摩尔质量是多少?
分析:
体积:为气体摩尔体积(Vm)
M(H2) = ρ(H2)Vm =0.0899g/ L×22.4L/mol≈2g/mol
例题1:在相同条件下,物质的量之比为1:4的H2与O2所含的分子个数比为_________,体积之比为__________。
1:4
1:4
推论二:同温同压下,Vm相同,气体的密度之比等于其摩尔质量之比。
=
M1
M2
ρ1
ρ2
例题2:已知在相同的条件下,某气体相对H2的密度是16,求该气体的摩尔质量。
根据 M = ρVm 可得
=
M(未知气体)
M(H2)
ρ(未知气体)
ρ(H2)
16=
M(未知气体)
2g/mol
M(未知气体)=32g/mol
相对密度 (d)
相对密度 (d)=
【补充】理想气体状态方程与阿伏伽德罗定律的推论
1.理想气体状态方程
由于同温同压下Vm一定,那么Vm的影响因素是?
温度和压强
其他条件相同时,T越大,Vm越大,T与Vm呈正相关
其他条件相同时,P越大,Vm越小,P与Vm呈负相关
Vm=
RT
P
=
P
V
n
RT
PV=nRT
R为气体常数
n 摩尔理想气体在开尔文温度T(单位为K,0℃=273.15K),压强P下,占有体积V。
由PV=nRT,可以推得:
1. 同温同压下,R是个常数,相同体积的任何气体否有相同的粒子数。
2. 同温同压下,任何气体都有:
=
n1
n2
P1
P2
3. 同温同压下,任何气体都有:
PVm=
RT
代入 M = ρVm
PM=ρ
RT
=
M1
M2
ρ1
ρ2
4. 同温同体积下,任何气体都有:
=
n1
n2
V1
V2
三同定一同,两同定比例
5. 同温同压同体积下,任何气体都有:
=
M1
M2
m1
m2
n1=n2
代入 n= m/M
第二章 海水中的重要元素——钠和氯
第三节 物质的量
第2课时 气体摩尔体积
上节课,我们已经学习了了两个计算物质的量的公式:n=N/NA和n=m/M,从而通过物质的量知道了微观粒子与宏观质量之间的联系。
那么,气体体积与物质的量之间有什么关系呢
【新课导入】
那么,如果已知某气体的体积,能否直接应用上面的公式计算出某气体的物质的量呢?或者已知某气体的物质的量,能否计算得到气体的体积呢?
答案显然是否定的。
物质的量
粒子数
n=N/NA
n=N/NA
质量
气体 0℃ 101kPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
体积相同
粒子数相同
体积不同
体积不同
【学习任务一】影响物质体积大小的因素
思考与讨论课本P56
在一定条件下,1mol不同物质的体积如下表所示。观察并分析表中的数据,你能得出那些结论?
【结论】
(1)相同条件下(同温同压),1mol(粒子数相同)不同液体或固体体积不相同。
(2)相同条件下(同温同压),1mol(粒子数相同)不同气体体积相同。
请同学们观察下面几组图片,思考是什么影响了物质的体积。
【提出疑问 讨论原因】
为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?物质的体积与什么因素有关?
影响物质体积大小的因素
第一组
【结论1】粒子数(N):粒子数(N)越多,体积越大。
第二组
【结论2】粒子大小:粒子直径越大,体积越大。
第三组
【结论3】粒子间距:粒子间距越大,体积越大。
固体和液体微粒间距离很小
【回顾问题】为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?
1. 影响固体和液体体积的因素是什么?
【结论1】粒子间距对固体液体的体积几乎没有影响。
影响固体和液体体积的因素主要为粒子大小与粒子数目。
因此,1mol固体和液体体积不同的原因是?
粒子大小不同。
固态
液态
固体物质
液体物质
减少粒子数目:
缩小粒子直径:
固态
液态
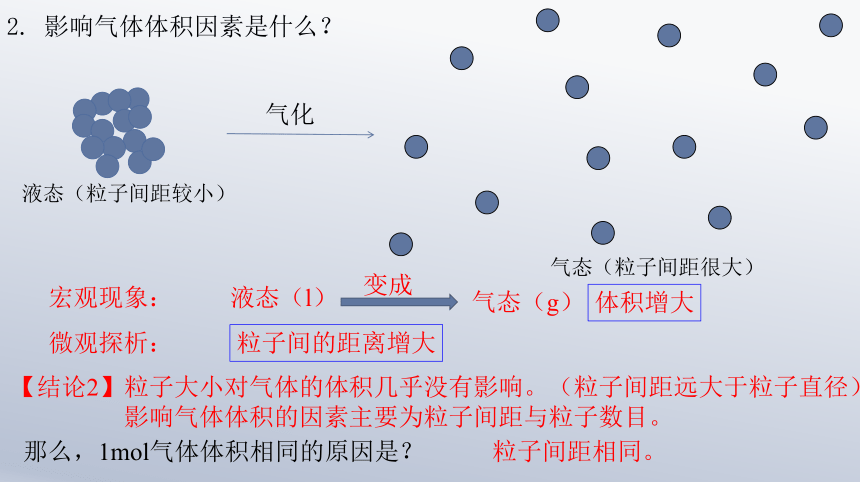
2. 影响气体体积因素是什么?
液态(l)
气态(g)
变成
粒子间的距离增大
宏观现象:
微观探析:
体积增大
液态(粒子间距较小)
气态(粒子间距很大)
气化
【结论2】粒子大小对气体的体积几乎没有影响。(粒子间距远大于粒子直径)
影响气体体积的因素主要为粒子间距与粒子数目。
那么,1mol气体体积相同的原因是?
粒子间距相同。
升温
减压
升温
减压
3. 影响粒子间距因素是什么?
固体物质
液体物质
气体物质
【结论3】影响粒子间距的主要因素是温度和压强。
因此,1mol气体体积相同的原因是?
气体所处环境的温度和压强相同。
粒子数目
粒子间距
粒子大小
物质的体积
固体、液体体积
决定
决定
气体体积
受温度和压强影响
对于粒子数相同的气体来说,如果温度和压强相同,则微粒间的平均距离基本相同,体积也就相同。
【总结】
【规律】在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
阿伏加德罗定律
【学习任务二】气体摩尔体积
回顾课本P56【思考与讨论】
1mol
1、定义:
2、符号:
3、单位:
单位物质的量的气体所占的体积
【新概念】
——气体摩尔体积
Vm
L/mol(L·mol-1)
注意:
①气体摩尔体积的数值只受温度、压强影响。
②标准状况(0℃,101KPa)下,Vm≈22.4L/mol(记住)
阅读教材P56-57页内容,观察图2-22,思考什么是气体的摩尔体积?影响气体摩尔体积的因素是什么?
标准状况
观察图片,你能得到什么结论?
【结论】0℃、101kPa(标准状况下,1mol气体的体积总是22.4L,所含分子数为6.02×1023。
【小结】
“22.4L/mol”使用注意事项:
前提条件:
对 象:
任何气体,纯净气体或混合气体都可以(但混合气体间不能发生反应)
特别提醒:
1. 标准状况(0℃,101KPa)下,HF、H2O、SO3、CCl4、酒精等不属于气态。
2. 标准状况(0℃,101KPa)下,气体摩尔体积为22.4L/mol,但由于温度升高,体积增大,压强增大,体积减小,因此在温度和压强适宜的情况下气体摩尔体积也可能为22.4L/mol。
标准状况(0℃,101KPa)下
【例1】关于物质的体积的说法正确的是( )
A.1mol固体或液体的体积主要决定于微粒间的距离
B.固体和液体的微粒间的空隙很小,因此不能被压缩
C.气态物质微粒间的距离较大,因此气体体积决定于气体分子间的距离
D.气体的体积受温度和压强的影响较大,固体或液体的体积受温度和压
强的影响较小
D
【例2】下列关于气体摩尔体积的几种说法正确的是( )
A.1 mol任何气体的体积均为22.4 L
B.非标准状况下,1 mol气体的体积不可能是22.4 L
C.0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在
标准状况下的体积约为22.4 L
D.同温同压下,相同体积的任何气体单质所含分子数和原子数都相同
C
【思考】气体摩尔体积是指单位物质的量的气体的体积。气体摩尔体积(Vm)与气体体积(V)、物质的量(n)之间具有怎样的关系呢?
V=n·Vm
变式
n=
V
Vm
n
V
Vm=
【构建模型】以物质的量(n)为中心构建质量(m)、体积(V)、粒子
数(N)之间的认知模型:
我们已经学习了三个公式,尝试用物质的量将他们联系起来。
物质的量
粒子数(N)
n=N/NA
n=N/NA
质量(m)
物质的量
n=
V
Vm
【学习任务三】阿伏加德罗定律及其推论
阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
推论一:相同条件(同温同压)下,任何气体的体积之比等于物质的量之比,也等于粒子数之比
=
n1
n2
V1
V2
N1
N2
=
推导过程:
n=
V
Vm
=
V1
Vm
n1
n2
V2
Vm
同温同压下,Vm是定值(NA始终是定值)
=
n1
n2
V1
V2
N1
N2
=
M = ρVm
1mol气体的
质量:为摩尔质量(M)
【计算】在标准状况下,已知H2的密度是 0.0899g/L,求H2的摩尔质量是多少?
分析:
体积:为气体摩尔体积(Vm)
M(H2) = ρ(H2)Vm =0.0899g/ L×22.4L/mol≈2g/mol
例题1:在相同条件下,物质的量之比为1:4的H2与O2所含的分子个数比为_________,体积之比为__________。
1:4
1:4
推论二:同温同压下,Vm相同,气体的密度之比等于其摩尔质量之比。
=
M1
M2
ρ1
ρ2
例题2:已知在相同的条件下,某气体相对H2的密度是16,求该气体的摩尔质量。
根据 M = ρVm 可得
=
M(未知气体)
M(H2)
ρ(未知气体)
ρ(H2)
16=
M(未知气体)
2g/mol
M(未知气体)=32g/mol
相对密度 (d)
相对密度 (d)=
【补充】理想气体状态方程与阿伏伽德罗定律的推论
1.理想气体状态方程
由于同温同压下Vm一定,那么Vm的影响因素是?
温度和压强
其他条件相同时,T越大,Vm越大,T与Vm呈正相关
其他条件相同时,P越大,Vm越小,P与Vm呈负相关
Vm=
RT
P
=
P
V
n
RT
PV=nRT
R为气体常数
n 摩尔理想气体在开尔文温度T(单位为K,0℃=273.15K),压强P下,占有体积V。
由PV=nRT,可以推得:
1. 同温同压下,R是个常数,相同体积的任何气体否有相同的粒子数。
2. 同温同压下,任何气体都有:
=
n1
n2
P1
P2
3. 同温同压下,任何气体都有:
PVm=
RT
代入 M = ρVm
PM=ρ
RT
=
M1
M2
ρ1
ρ2
4. 同温同体积下,任何气体都有:
=
n1
n2
V1
V2
三同定一同,两同定比例
5. 同温同压同体积下,任何气体都有:
=
M1
M2
m1
m2
n1=n2
代入 n= m/M
