化学人教版(2019)必修第一册3.1.2铁的氢氧化物与铁盐(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.2铁的氢氧化物与铁盐(共18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 117.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 11:29:48 | ||
图片预览


文档简介
(共18张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
第二课时 铁的氢氧化物与铁盐
【实验3-1】观察并描述发生的现象。
【学习任务一】铁的氢氧化物
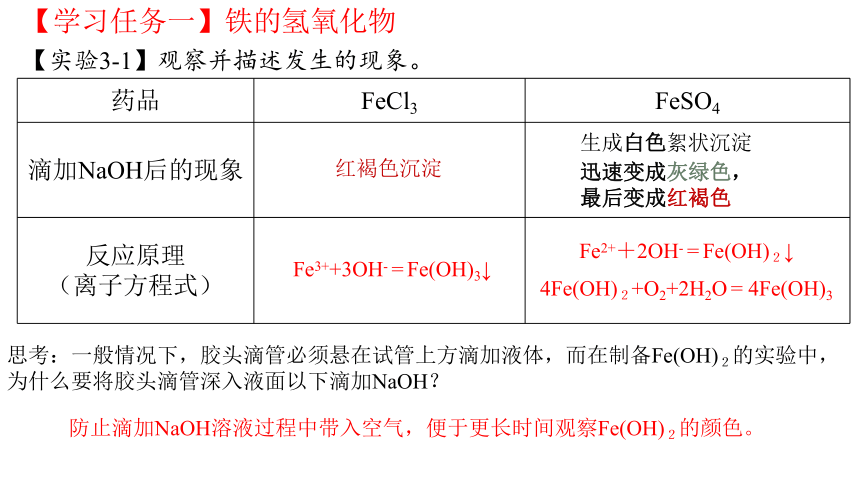
药品 FeCl3 FeSO4
滴加NaOH后的现象
反应原理 (离子方程式)
红褐色沉淀
生成白色絮状沉淀
Fe3++3OH- = Fe(OH)3↓
思考:一般情况下,胶头滴管必须悬在试管上方滴加液体,而在制备Fe(OH)2的实验中,为什么要将胶头滴管深入液面以下滴加NaOH?
防止滴加NaOH溶液过程中带入空气,便于更长时间观察Fe(OH)2的颜色。
迅速变成灰绿色,
最后变成红褐色
Fe2++2OH- = Fe(OH)2↓
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
【实验3-1】观察并描述发生的现象。
【学习任务一】铁的氢氧化物
【分析】 Fe(OH)2会被溶解在溶液中的氧气氧化,因此实验室中得到Fe(OH)2的关键是防止氧气的干扰。其中包括溶液中的氧气的干扰与空气中的氧气的干扰。
【措施】
1.使用新制的FeSO4溶液,并加入少量铁粉防止Fe2+被氧化;
2. 配置FeSO4溶液时使用的蒸馏水要煮沸,并将NaOH溶液煮沸,减少溶解在溶液中的氧气含量;
3. 将胶头滴管伸入到液面以下,减少带入空气中的氧气。
探究1:为了更长时间观察到Fe(OH)2的颜色,实验中还可以有哪些措施呢?
探究2:制备Fe(OH)2沉淀的实验过程中,实验试剂始终暴露在空气中,加快了Fe(OH)2沉淀的氧化速度,从改进实验装置的角度分析,实验应如何改进?
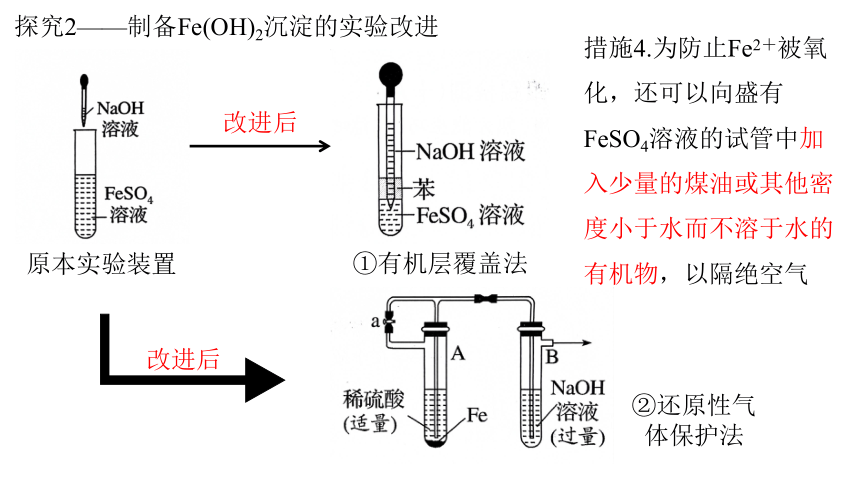
探究2——制备Fe(OH)2沉淀的实验改进
原本实验装置
①有机层覆盖法
改进后
改进后
②还原性气体保护法
措施4.为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气
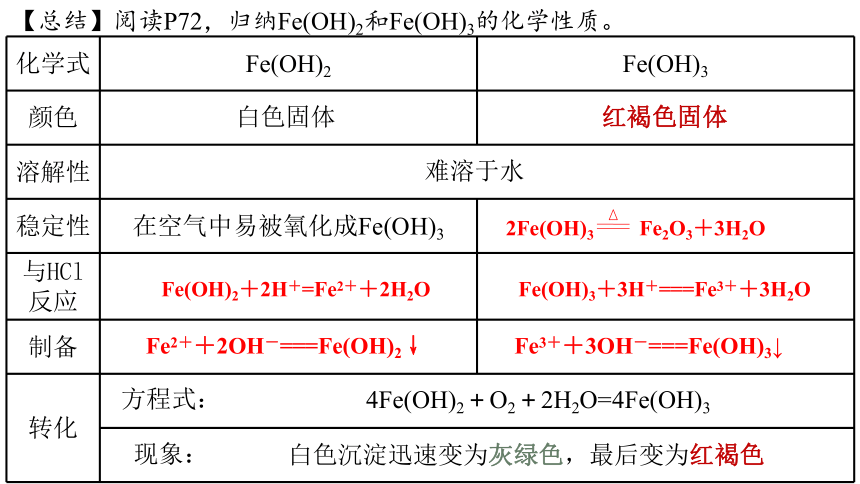
【总结】阅读P72,归纳Fe(OH)2和Fe(OH)3的化学性质。
化学式 Fe(OH)2 Fe(OH)3
颜色
溶解性 稳定性 在空气中易被氧化成Fe(OH)3
与HCl反应
制备
转化 难溶于水
白色固体
红褐色固体
Fe(OH)2+2H+=Fe2++2H2O
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
2Fe(OH)3 Fe2O3+3H2O
Fe(OH)3+3H+===Fe3++3H2O
方程式:
现象:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
白色沉淀迅速变为灰绿色,最后变为红褐色
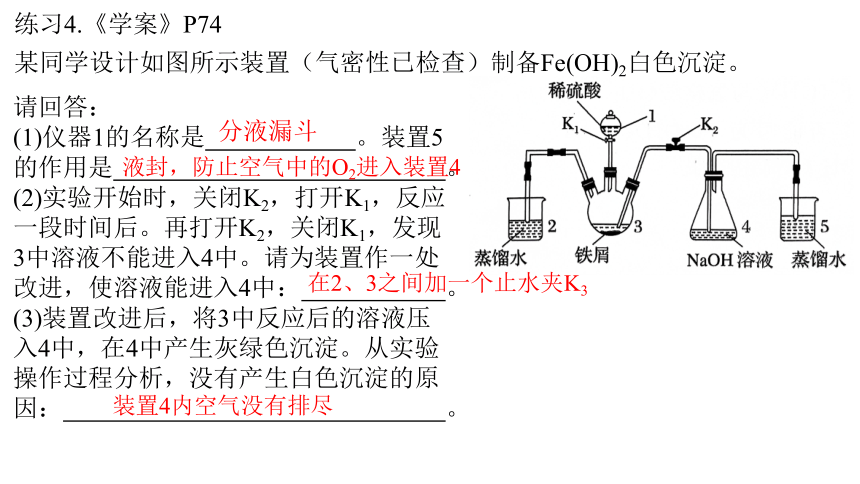
练习4.《学案》P74
某同学设计如图所示装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:
(1)仪器1的名称是 。装置5的作用是 。
(2)实验开始时,关闭K2,打开K1,反应一段时间后。再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中: 。
(3)装置改进后,将3中反应后的溶液压入4中,在4中产生灰绿色沉淀。从实验操作过程分析,没有产生白色沉淀的原因: 。
液封,防止空气中的O2进入装置4
分液漏斗
在2、3之间加一个止水夹K3
装置4内空气没有排尽
(一)Fe3+和Fe2+的检验——【实验3-2】观察并记录现象。
【学习任务二】铁盐和亚铁盐
离子 Fe3+ Fe2+
颜色
操作
现象
离子方程式
结论
棕黄色
浅绿色
溶液变为红色
开始无明显现象,滴加新制氯水后溶液变为红色
Fe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
2Fe2++Cl2=2Fe3++2Cl-
含有Fe3+的盐溶液遇到KSCN溶液时变为红色,我们可以利用这一反应检验Fe3+的存在。
Fe2+遇到KSCN溶液时不显红色,加入新制氯水后Fe2+被氧化为Fe3+,Fe3+遇到KSCN溶液时显红色。
【总结】Fe3+和Fe2+的检验
1. Fe3+的检验方法
①加KSCN溶液:
②加NaOH溶液:
Fe3+ + 3SCN- == Fe(SCN)3
溶液变为红色
③淀粉KI试纸:
Fe3+ + 3OH- == Fe(OH)3↓
2Fe3+ + 2I- == 3Fe2+ + I2
2. Fe2+的检验方法
②加NaOH溶液:产生白色沉淀,迅速变为灰绿色,最后变为红褐色
①加KSCN溶液:
KSCN
氯水/H2O2
无现象
红色溶液
Fe2+
③加入酸性KMnO4 溶液:溶液紫红色褪去
2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
Fe3+ + 3SCN- == Fe(SCN)3
5Fe2++MnO4- +8H+ = 5Fe3++Mn2++4H2O
红褐色沉淀
变蓝
④加K3[Fe(CN)6]溶液
特征蓝色沉淀
【思考】如何在Fe3+存在时检验Fe2+?《学案P》77 探究活动T2
①加KSCN溶液?
②加NaOH溶液?
③加入酸性KMnO4 溶液?
KMnO4酸性溶液褪色,说明原溶液中含有Fe2+
取两只试管,分别加入少量溶液
溶液变为红色,说明原溶液中含有Fe3+
一只试管滴加KSCN溶液
一只试管滴加
酸性KMnO4溶液
(二)Fe3+和Fe2+的性质与转化——从化合价预测Fe3+和Fe2+的性质
Fe2+:
Fe3+:
处于中间价态,既有氧化性,又有还原性
处于较高价态,只有氧化性
Fe2+
+3价,加氧化剂
0价,加还原剂
Fe3+
+2价,加还原剂
0价,加 强还原剂
实验操作 实验现象
离子方程式
实验结论 溶液由棕黄色变为浅绿色,滴入KSCN溶液后不变色
溶液变红
Fe3+ Fe2+
还原剂(如Fe等)
氧化剂(如Cl2等)
【总结】Fe3+和Fe2+的性质
Fe3+ Fe2+
还原剂(如Fe、Cu、I-、S2-等)
氧化剂(如Cl2、Br2、HNO3、MnO4-、H2O2等)
【补充】Fe3+和Fe2+的应用
(1)离子共存
Fe3+:
Fe2+:
(2)除杂
【现象】
【原理】
利用FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀。即把预先设计好的电路在覆铜板上用蜡或不透水的物料覆盖,以保护不被腐蚀;然后,把覆铜板放到FeCl3溶液中。
化学方程式:2FeCl3+Cu==2FeCl2+CuCl2
【应用】电子工业中常用覆铜板(以绝缘板为基材,一面或两面覆以铜箔,经热压而成的一种板状材料)为基础材料制作印刷电路板,印刷电路板广泛用于电视机、计算机、手机等电子产品中。
【问题】为使使用后的“腐蚀液” 能得到充分利用,如何回收得到 Cu 和 FeCl3
CuCl 2
FeCl 2
FeCl 3
腐蚀液
Fe
过滤
过滤
Cl2/H2O2
FeCl 3
Cu Fe
FeCl 2
盐酸
Cu
FeCl 2
(四)
(五)
Fe2+
Fe3+
Fe
只有还原性
既有氧化性又有还原性
有氧化性
强氧化剂:Cl2、H2O2、O2、HNO3、H2SO4(浓)、KMnO4(H+)
还原剂:Fe、Zn、Cu、H2S、KI等
Cl2、HNO3、H2SO4(浓)等
(强氧化剂)
Al 、CO等
Zn、Al等
(较弱氧化剂)
Cu2+、H+、S、I2等
第三章 铁 金属材料
第一节 铁及其化合物
第二课时 铁的氢氧化物与铁盐
【实验3-1】观察并描述发生的现象。
【学习任务一】铁的氢氧化物
药品 FeCl3 FeSO4
滴加NaOH后的现象
反应原理 (离子方程式)
红褐色沉淀
生成白色絮状沉淀
Fe3++3OH- = Fe(OH)3↓
思考:一般情况下,胶头滴管必须悬在试管上方滴加液体,而在制备Fe(OH)2的实验中,为什么要将胶头滴管深入液面以下滴加NaOH?
防止滴加NaOH溶液过程中带入空气,便于更长时间观察Fe(OH)2的颜色。
迅速变成灰绿色,
最后变成红褐色
Fe2++2OH- = Fe(OH)2↓
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
【实验3-1】观察并描述发生的现象。
【学习任务一】铁的氢氧化物
【分析】 Fe(OH)2会被溶解在溶液中的氧气氧化,因此实验室中得到Fe(OH)2的关键是防止氧气的干扰。其中包括溶液中的氧气的干扰与空气中的氧气的干扰。
【措施】
1.使用新制的FeSO4溶液,并加入少量铁粉防止Fe2+被氧化;
2. 配置FeSO4溶液时使用的蒸馏水要煮沸,并将NaOH溶液煮沸,减少溶解在溶液中的氧气含量;
3. 将胶头滴管伸入到液面以下,减少带入空气中的氧气。
探究1:为了更长时间观察到Fe(OH)2的颜色,实验中还可以有哪些措施呢?
探究2:制备Fe(OH)2沉淀的实验过程中,实验试剂始终暴露在空气中,加快了Fe(OH)2沉淀的氧化速度,从改进实验装置的角度分析,实验应如何改进?
探究2——制备Fe(OH)2沉淀的实验改进
原本实验装置
①有机层覆盖法
改进后
改进后
②还原性气体保护法
措施4.为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气
【总结】阅读P72,归纳Fe(OH)2和Fe(OH)3的化学性质。
化学式 Fe(OH)2 Fe(OH)3
颜色
溶解性 稳定性 在空气中易被氧化成Fe(OH)3
与HCl反应
制备
转化 难溶于水
白色固体
红褐色固体
Fe(OH)2+2H+=Fe2++2H2O
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
2Fe(OH)3 Fe2O3+3H2O
Fe(OH)3+3H+===Fe3++3H2O
方程式:
现象:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
白色沉淀迅速变为灰绿色,最后变为红褐色
练习4.《学案》P74
某同学设计如图所示装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:
(1)仪器1的名称是 。装置5的作用是 。
(2)实验开始时,关闭K2,打开K1,反应一段时间后。再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中: 。
(3)装置改进后,将3中反应后的溶液压入4中,在4中产生灰绿色沉淀。从实验操作过程分析,没有产生白色沉淀的原因: 。
液封,防止空气中的O2进入装置4
分液漏斗
在2、3之间加一个止水夹K3
装置4内空气没有排尽
(一)Fe3+和Fe2+的检验——【实验3-2】观察并记录现象。
【学习任务二】铁盐和亚铁盐
离子 Fe3+ Fe2+
颜色
操作
现象
离子方程式
结论
棕黄色
浅绿色
溶液变为红色
开始无明显现象,滴加新制氯水后溶液变为红色
Fe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
2Fe2++Cl2=2Fe3++2Cl-
含有Fe3+的盐溶液遇到KSCN溶液时变为红色,我们可以利用这一反应检验Fe3+的存在。
Fe2+遇到KSCN溶液时不显红色,加入新制氯水后Fe2+被氧化为Fe3+,Fe3+遇到KSCN溶液时显红色。
【总结】Fe3+和Fe2+的检验
1. Fe3+的检验方法
①加KSCN溶液:
②加NaOH溶液:
Fe3+ + 3SCN- == Fe(SCN)3
溶液变为红色
③淀粉KI试纸:
Fe3+ + 3OH- == Fe(OH)3↓
2Fe3+ + 2I- == 3Fe2+ + I2
2. Fe2+的检验方法
②加NaOH溶液:产生白色沉淀,迅速变为灰绿色,最后变为红褐色
①加KSCN溶液:
KSCN
氯水/H2O2
无现象
红色溶液
Fe2+
③加入酸性KMnO4 溶液:溶液紫红色褪去
2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
Fe3+ + 3SCN- == Fe(SCN)3
5Fe2++MnO4- +8H+ = 5Fe3++Mn2++4H2O
红褐色沉淀
变蓝
④加K3[Fe(CN)6]溶液
特征蓝色沉淀
【思考】如何在Fe3+存在时检验Fe2+?《学案P》77 探究活动T2
①加KSCN溶液?
②加NaOH溶液?
③加入酸性KMnO4 溶液?
KMnO4酸性溶液褪色,说明原溶液中含有Fe2+
取两只试管,分别加入少量溶液
溶液变为红色,说明原溶液中含有Fe3+
一只试管滴加KSCN溶液
一只试管滴加
酸性KMnO4溶液
(二)Fe3+和Fe2+的性质与转化——从化合价预测Fe3+和Fe2+的性质
Fe2+:
Fe3+:
处于中间价态,既有氧化性,又有还原性
处于较高价态,只有氧化性
Fe2+
+3价,加氧化剂
0价,加还原剂
Fe3+
+2价,加还原剂
0价,加 强还原剂
实验操作 实验现象
离子方程式
实验结论 溶液由棕黄色变为浅绿色,滴入KSCN溶液后不变色
溶液变红
Fe3+ Fe2+
还原剂(如Fe等)
氧化剂(如Cl2等)
【总结】Fe3+和Fe2+的性质
Fe3+ Fe2+
还原剂(如Fe、Cu、I-、S2-等)
氧化剂(如Cl2、Br2、HNO3、MnO4-、H2O2等)
【补充】Fe3+和Fe2+的应用
(1)离子共存
Fe3+:
Fe2+:
(2)除杂
【现象】
【原理】
利用FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀。即把预先设计好的电路在覆铜板上用蜡或不透水的物料覆盖,以保护不被腐蚀;然后,把覆铜板放到FeCl3溶液中。
化学方程式:2FeCl3+Cu==2FeCl2+CuCl2
【应用】电子工业中常用覆铜板(以绝缘板为基材,一面或两面覆以铜箔,经热压而成的一种板状材料)为基础材料制作印刷电路板,印刷电路板广泛用于电视机、计算机、手机等电子产品中。
【问题】为使使用后的“腐蚀液” 能得到充分利用,如何回收得到 Cu 和 FeCl3
CuCl 2
FeCl 2
FeCl 3
腐蚀液
Fe
过滤
过滤
Cl2/H2O2
FeCl 3
Cu Fe
FeCl 2
盐酸
Cu
FeCl 2
(四)
(五)
Fe2+
Fe3+
Fe
只有还原性
既有氧化性又有还原性
有氧化性
强氧化剂:Cl2、H2O2、O2、HNO3、H2SO4(浓)、KMnO4(H+)
还原剂:Fe、Zn、Cu、H2S、KI等
Cl2、HNO3、H2SO4(浓)等
(强氧化剂)
Al 、CO等
Zn、Al等
(较弱氧化剂)
Cu2+、H+、S、I2等
