高三化学氮及其化合物复习课《氮及其氧化物 氢化物和铵盐》优质课教学课件(共35张PPT)
文档属性
| 名称 | 高三化学氮及其化合物复习课《氮及其氧化物 氢化物和铵盐》优质课教学课件(共35张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-02 20:03:18 | ||
图片预览










文档简介
(共35张PPT)
氮及其氧化物 氢化物和铵盐
高三化学氮及其化合物复习课:
学习目标
学习目标1:了解氮及其氧化物的主要性质及应用。
学习目标2:了解NH3、N2H4、铵盐的性质及应用。
学习目标3:了解含氮化合物对环境的影响。
任务1:小组交流基础知识部分完成情况,对错误情况予以纠正。
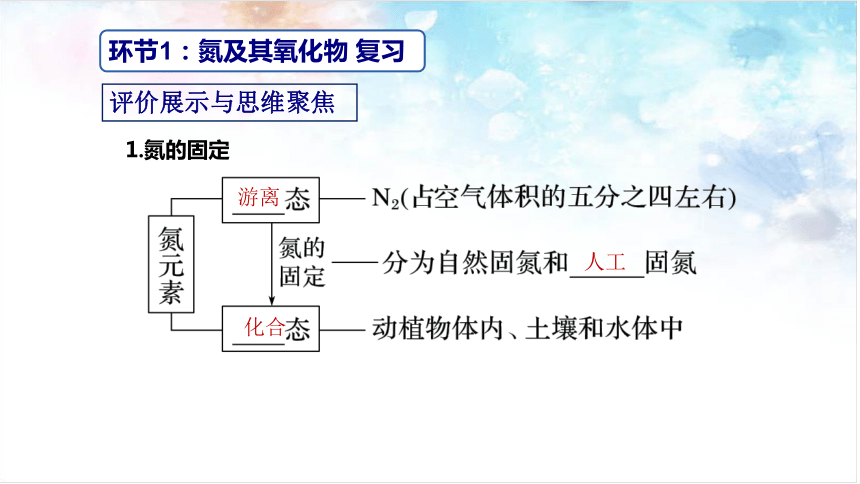
环节1:氮及其氧化物 复习
游离
人工
化合
1.氮的固定
评价展示与思维聚焦
环节1:氮及其氧化物 复习
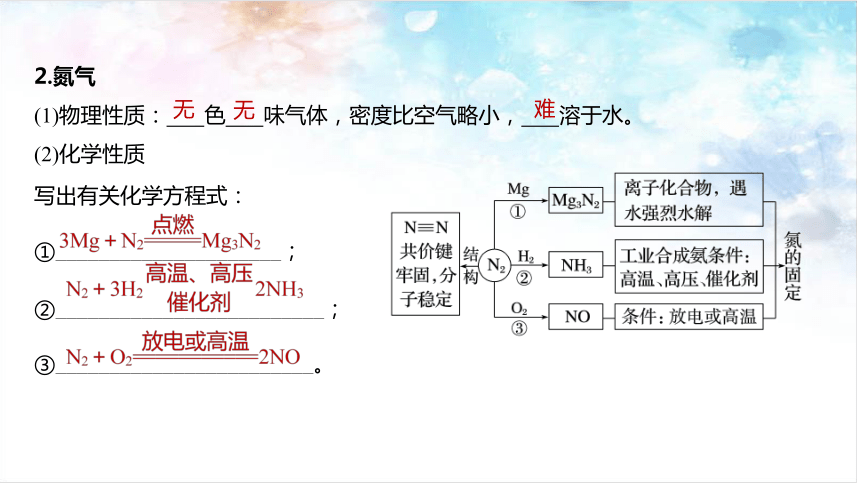
2.氮气
(1)物理性质: 色 味气体,密度比空气略小, 溶于水。
(2)化学性质
无
无
难
写出有关化学方程式:
①_____________________;
②_________________________;
③________________________。
(3)下列氮气的用途叙述中,分别应用了氮气的什么性质?
①文物馆将贵重文物保存在氮气中。
答案 N2的稳定性
②氮气是合成氨工业的重要原料。
答案 N2的氧化性
③雷电是自然界重要的固氮方式。
答案 N2的还原性
④医疗上,液氮是常见的冷冻剂。
答案 N2的沸点低,液氮易汽化,且汽化吸收热量
3.氮的氧化物
(1)氮有多种价态的氧化物,氮元素从+1→+5价都有对应的氧化物,如N2O、 、N2O3、NO2(或 )、N2O5,其中属于酸性氧化物的是N2O3、 。
(2)NO和NO2的比较
NO
N2O4
N2O5
性质 NO NO2
色、味、态 ____________________ __________________________
溶解性 ____________
毒性 有毒,大气污染物之一 有毒,大气污染物之一
与水反应 不反应 3NO2+H2O===2HNO3+NO
与氧气反应 ___________________ 不反应
无色、无味的气体
不溶于水
红棕色、有刺激性气味的气体
2NO+O2===2NO2
①NO2与N2O4存在下列平衡:2NO2 N2O4,因此实验测得NO2的平均相对分子质量总大于46。②验证某无色气体为NO的方法是向该无色气体中通入O2(或空气),无色气体变为红棕色。
4.氮氧化物对环境的污染及防治
(1)常见的污染类型
①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
(2)常见的NOx尾气处理方法
①碱液吸收法
工业尾气中NOx常用碱液吸收处理,NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。
②催化转化法
在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2),或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。
√
评价练习1
A项,该反应中S的化合价由0价变为-2价,所以只体现氧化性,正确;
B项,该反应中S的化合价由0价、+6价变为+4价,所以S体现还原性和氧化性,错误;
C项,该反应中S的化合价由-2价变为0价,所以S只体现还原性,错误;
D项,该反应中S的化合价由0价变为-2价、+4价,所以S体现氧化性和还原性,错误。
一、含氮化合物对环境的污染及防治
(1)生物硝化法处理废水,会导致水体pH逐渐下降,试用离子方程式表示__________
____________________。
(2)微生物保持活性的pH范围为7~8,可以加入____________________来调节溶液的pH。
石灰石(只要合理均可)
评价练习1
2.(1)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_________________
(2)用氨可将氮氧化物转化为无毒气体。如4NH3+6NO 5N2+6H2O,写出氨气
转化NO2的化学方程式:_________________________________,该反应中氧化产物与还原产物的质量之比为_________。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:_______________________________________。
②NO与NO2按物质的量之比为1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是_________。
N2+2CO2
4∶3
2NO2+2NaOH===NaNO3+NaNO2+H2O
NaNO2
评价练习2
NOx的常用处理方法
归纳总结
1.NaOH溶液吸收法
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO3+NaNO2+H2O
2.氨气吸收法
3.有一充有20 mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12 mL 无色气体,则原混合气体中NO和NO2体积比为________(气体体积均在相同状况下测得)。
二、氮的氧化物与O2、H2O反应的计算方法
2∶3
评价练习3
二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮和水不反应,所以剩余的气体为一氧化氮,设混合气体中二氧化氮的体积为V,则:
3NO2+H2O===2HNO3+NO 气体体积减少
3 1 2
V 8 mL
4.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体。
(1)若剩余的气体是______,则NO2、O2的体积分别是______________。
O2
8 mL、4 mL
解题依据的化学方程式:
4NO2+O2+2H2O===4HNO3;3NO2+H2O===2HNO3+NO。
设O2的体积为x,剩余的气体有两种可能:
评价练习4
(2)若剩余的气体是______,则NO2、O2的体积分别是_________________。
NO
10.8 mL、1.2 mL
返回
环节2:氮的氢化物(NH3和N2H4)和铵盐复习
任务1:小组交流基础知识部分完成情况,对错误情况予以纠正。
(一)二氧化硫
1.物理性质
色、味、态 密度 溶解性
____________________________ 比空气____ __________________________________________________
无色、有刺激性气味的有毒气体
大
易溶于水,通常状况下,1体积水溶解约40体积的SO2
评价展示与思维聚焦
电子式 密度 气味 水溶性
_____________ 比空气_____ _______性气味 极易溶于水(1∶700)
(一)氨
1.氨的分子结构和物理性质
小
刺激
评价展示与思维聚焦
3
2.氨的化学性质
提醒 ①NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,可在推断题中作为解题突破口。
②氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
3.氨的实验室制法
(1)加热固态铵盐和碱的混合物
反应装置
净化装置
用 干燥
碱石灰
收集装置
用 法。收集时,一般在试管口塞一团棉花球,可减小NH3与空气的对流速率,收集到纯净的NH3
向下排空气
验满方法
①将湿润的红色石蕊试纸置于试管口,试纸变 ;
②将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
蓝
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O NH3↑+H2O
浓氨水+固体NaOH NaOH溶于水放热,促使氨水分解。且OH-浓度的增大有利于NH3的生成
浓氨水+固体CaO CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为NH3·H2O+CaO===NH3↑+Ca(OH)2
(2)实验室制取氨的其他方法
1.铵盐的物理性质
铵盐大多数是 色固体,绝大多数易溶于水。
2.铵盐的化学性质
白
2NH3↑+2H2O
蓝色
(三)N2H4的结构与性质
1.无水N2H4为无色发烟液体,并有微弱氨的气味。它的稳定性比NH3小,受热即发生爆炸性分解,生成N2、NH3和H2。
2.燃烧
N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-622 kJ·mol-1
N2H4的主要用途是作导弹、宇宙飞船飞行的火箭燃料。
3.N2H4的水溶液呈弱碱性,其强度比氨水弱。
一、氨、铵盐、肼的性质应用
1.按要求回答下列问题。
(1)将氨与氯气混合也会产生白烟,用化学方程式解释产生白烟的过程:__________
__________________________________。
(2)在饱和NH4Cl溶液中滴加NaAlO2,产生刺激性气味的气体和白色沉淀,用离子方程式解释其现象:_____________________________________,体现_______________。
(3)实验室常用饱和氯化铵(NH4Cl)与亚硝酸钠(NaNO2)加热来制取氮气,写出发生反应的化学方程式:_____________________________________,体现_____________。
2NH3+3Cl2
===N2+6HCl,NH3+HCl===NH4Cl
评价练习1
2.写出铵盐下列用途的化学方程式(溶液中的反应写离子方程式)。
(1)实验室氯化铵与熟石灰反应制取氨气。
(2)检验某溶液中是否含有铵根离子。
(3)医疗上用氯化铵作尿液酸化剂。
(4)硝酸铵用作炸药,分解产物均为空气的成分。
评价练习2
3.联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
(1)联氨的电子式为_____________,其中氮的化合价为______。
-2
联氨分子中每个N原子和两个H原子形成共价键,氮原子之间存在氮氮单键,每
个N原子还含有一个孤电子对,则其电子式为 ;N元素对电子的吸
引能力更强,所以联氨分子中H为+1价,N为-2价。
评价练习3
(2)联氨为二元弱碱,在水中的电离方程式与氨相似。写出联氨的第一步电离方程式:_________________________,联氨与硫酸形成的酸式盐的化学式为_____________。
N2H6(HSO4)2
二、氨的制备与性质的综合实验探究
4.某化学兴趣小组为了制取并探究氨性质,用下列装置(部分夹持装置已略去)进行实验[制取氨的反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O]。
【实验探究】
(1)利用上述原理,实验室制取氨应选用_____(填字母)发生装置进行实验。
a
评价练习4
(2)B装置中的干燥剂可选用________。
(3)气体通过C、D装置时,试纸颜色会发生变化的是_____(填“C”或“D”)装置。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是____________。
(5)F装置中倒置漏斗的作用是___________。
碱石灰
D
产生白烟
防止倒吸
(6)氨的用途很广,如可用氨处理二氧化氮:8NH3+6NO2 7N2+12H2O,该反应中氨体现________(填“氧化性”或“还原性”)。请你列举出氨的另一种用途:______________________________________________________________________。
还原性
作制冷剂、制氮肥(或化肥)、制硝酸、作化工原料(任答一点,其他合理答案也可)
返回
课堂小结
谢谢大家!
氮及其氧化物 氢化物和铵盐
高三化学氮及其化合物复习课:
学习目标
学习目标1:了解氮及其氧化物的主要性质及应用。
学习目标2:了解NH3、N2H4、铵盐的性质及应用。
学习目标3:了解含氮化合物对环境的影响。
任务1:小组交流基础知识部分完成情况,对错误情况予以纠正。
环节1:氮及其氧化物 复习
游离
人工
化合
1.氮的固定
评价展示与思维聚焦
环节1:氮及其氧化物 复习
2.氮气
(1)物理性质: 色 味气体,密度比空气略小, 溶于水。
(2)化学性质
无
无
难
写出有关化学方程式:
①_____________________;
②_________________________;
③________________________。
(3)下列氮气的用途叙述中,分别应用了氮气的什么性质?
①文物馆将贵重文物保存在氮气中。
答案 N2的稳定性
②氮气是合成氨工业的重要原料。
答案 N2的氧化性
③雷电是自然界重要的固氮方式。
答案 N2的还原性
④医疗上,液氮是常见的冷冻剂。
答案 N2的沸点低,液氮易汽化,且汽化吸收热量
3.氮的氧化物
(1)氮有多种价态的氧化物,氮元素从+1→+5价都有对应的氧化物,如N2O、 、N2O3、NO2(或 )、N2O5,其中属于酸性氧化物的是N2O3、 。
(2)NO和NO2的比较
NO
N2O4
N2O5
性质 NO NO2
色、味、态 ____________________ __________________________
溶解性 ____________
毒性 有毒,大气污染物之一 有毒,大气污染物之一
与水反应 不反应 3NO2+H2O===2HNO3+NO
与氧气反应 ___________________ 不反应
无色、无味的气体
不溶于水
红棕色、有刺激性气味的气体
2NO+O2===2NO2
①NO2与N2O4存在下列平衡:2NO2 N2O4,因此实验测得NO2的平均相对分子质量总大于46。②验证某无色气体为NO的方法是向该无色气体中通入O2(或空气),无色气体变为红棕色。
4.氮氧化物对环境的污染及防治
(1)常见的污染类型
①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
(2)常见的NOx尾气处理方法
①碱液吸收法
工业尾气中NOx常用碱液吸收处理,NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。
②催化转化法
在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2),或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。
√
评价练习1
A项,该反应中S的化合价由0价变为-2价,所以只体现氧化性,正确;
B项,该反应中S的化合价由0价、+6价变为+4价,所以S体现还原性和氧化性,错误;
C项,该反应中S的化合价由-2价变为0价,所以S只体现还原性,错误;
D项,该反应中S的化合价由0价变为-2价、+4价,所以S体现氧化性和还原性,错误。
一、含氮化合物对环境的污染及防治
(1)生物硝化法处理废水,会导致水体pH逐渐下降,试用离子方程式表示__________
____________________。
(2)微生物保持活性的pH范围为7~8,可以加入____________________来调节溶液的pH。
石灰石(只要合理均可)
评价练习1
2.(1)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_________________
(2)用氨可将氮氧化物转化为无毒气体。如4NH3+6NO 5N2+6H2O,写出氨气
转化NO2的化学方程式:_________________________________,该反应中氧化产物与还原产物的质量之比为_________。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:_______________________________________。
②NO与NO2按物质的量之比为1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是_________。
N2+2CO2
4∶3
2NO2+2NaOH===NaNO3+NaNO2+H2O
NaNO2
评价练习2
NOx的常用处理方法
归纳总结
1.NaOH溶液吸收法
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO3+NaNO2+H2O
2.氨气吸收法
3.有一充有20 mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12 mL 无色气体,则原混合气体中NO和NO2体积比为________(气体体积均在相同状况下测得)。
二、氮的氧化物与O2、H2O反应的计算方法
2∶3
评价练习3
二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮和水不反应,所以剩余的气体为一氧化氮,设混合气体中二氧化氮的体积为V,则:
3NO2+H2O===2HNO3+NO 气体体积减少
3 1 2
V 8 mL
4.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体。
(1)若剩余的气体是______,则NO2、O2的体积分别是______________。
O2
8 mL、4 mL
解题依据的化学方程式:
4NO2+O2+2H2O===4HNO3;3NO2+H2O===2HNO3+NO。
设O2的体积为x,剩余的气体有两种可能:
评价练习4
(2)若剩余的气体是______,则NO2、O2的体积分别是_________________。
NO
10.8 mL、1.2 mL
返回
环节2:氮的氢化物(NH3和N2H4)和铵盐复习
任务1:小组交流基础知识部分完成情况,对错误情况予以纠正。
(一)二氧化硫
1.物理性质
色、味、态 密度 溶解性
____________________________ 比空气____ __________________________________________________
无色、有刺激性气味的有毒气体
大
易溶于水,通常状况下,1体积水溶解约40体积的SO2
评价展示与思维聚焦
电子式 密度 气味 水溶性
_____________ 比空气_____ _______性气味 极易溶于水(1∶700)
(一)氨
1.氨的分子结构和物理性质
小
刺激
评价展示与思维聚焦
3
2.氨的化学性质
提醒 ①NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,可在推断题中作为解题突破口。
②氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
3.氨的实验室制法
(1)加热固态铵盐和碱的混合物
反应装置
净化装置
用 干燥
碱石灰
收集装置
用 法。收集时,一般在试管口塞一团棉花球,可减小NH3与空气的对流速率,收集到纯净的NH3
向下排空气
验满方法
①将湿润的红色石蕊试纸置于试管口,试纸变 ;
②将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
蓝
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O NH3↑+H2O
浓氨水+固体NaOH NaOH溶于水放热,促使氨水分解。且OH-浓度的增大有利于NH3的生成
浓氨水+固体CaO CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为NH3·H2O+CaO===NH3↑+Ca(OH)2
(2)实验室制取氨的其他方法
1.铵盐的物理性质
铵盐大多数是 色固体,绝大多数易溶于水。
2.铵盐的化学性质
白
2NH3↑+2H2O
蓝色
(三)N2H4的结构与性质
1.无水N2H4为无色发烟液体,并有微弱氨的气味。它的稳定性比NH3小,受热即发生爆炸性分解,生成N2、NH3和H2。
2.燃烧
N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-622 kJ·mol-1
N2H4的主要用途是作导弹、宇宙飞船飞行的火箭燃料。
3.N2H4的水溶液呈弱碱性,其强度比氨水弱。
一、氨、铵盐、肼的性质应用
1.按要求回答下列问题。
(1)将氨与氯气混合也会产生白烟,用化学方程式解释产生白烟的过程:__________
__________________________________。
(2)在饱和NH4Cl溶液中滴加NaAlO2,产生刺激性气味的气体和白色沉淀,用离子方程式解释其现象:_____________________________________,体现_______________。
(3)实验室常用饱和氯化铵(NH4Cl)与亚硝酸钠(NaNO2)加热来制取氮气,写出发生反应的化学方程式:_____________________________________,体现_____________。
2NH3+3Cl2
===N2+6HCl,NH3+HCl===NH4Cl
评价练习1
2.写出铵盐下列用途的化学方程式(溶液中的反应写离子方程式)。
(1)实验室氯化铵与熟石灰反应制取氨气。
(2)检验某溶液中是否含有铵根离子。
(3)医疗上用氯化铵作尿液酸化剂。
(4)硝酸铵用作炸药,分解产物均为空气的成分。
评价练习2
3.联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
(1)联氨的电子式为_____________,其中氮的化合价为______。
-2
联氨分子中每个N原子和两个H原子形成共价键,氮原子之间存在氮氮单键,每
个N原子还含有一个孤电子对,则其电子式为 ;N元素对电子的吸
引能力更强,所以联氨分子中H为+1价,N为-2价。
评价练习3
(2)联氨为二元弱碱,在水中的电离方程式与氨相似。写出联氨的第一步电离方程式:_________________________,联氨与硫酸形成的酸式盐的化学式为_____________。
N2H6(HSO4)2
二、氨的制备与性质的综合实验探究
4.某化学兴趣小组为了制取并探究氨性质,用下列装置(部分夹持装置已略去)进行实验[制取氨的反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O]。
【实验探究】
(1)利用上述原理,实验室制取氨应选用_____(填字母)发生装置进行实验。
a
评价练习4
(2)B装置中的干燥剂可选用________。
(3)气体通过C、D装置时,试纸颜色会发生变化的是_____(填“C”或“D”)装置。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是____________。
(5)F装置中倒置漏斗的作用是___________。
碱石灰
D
产生白烟
防止倒吸
(6)氨的用途很广,如可用氨处理二氧化氮:8NH3+6NO2 7N2+12H2O,该反应中氨体现________(填“氧化性”或“还原性”)。请你列举出氨的另一种用途:______________________________________________________________________。
还原性
作制冷剂、制氮肥(或化肥)、制硝酸、作化工原料(任答一点,其他合理答案也可)
返回
课堂小结
谢谢大家!
同课章节目录
