高三化学复习课《富集在海水中的元素——氯》优质课教学课件(共48张PPT)(第1-2课时)
文档属性
| 名称 | 高三化学复习课《富集在海水中的元素——氯》优质课教学课件(共48张PPT)(第1-2课时) |  | |
| 格式 | ppt | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-02 20:12:16 | ||
图片预览






文档简介
(共48张PPT)
富集在海水中的元素——氯
第1课时
第2课时
高三化学复习课:
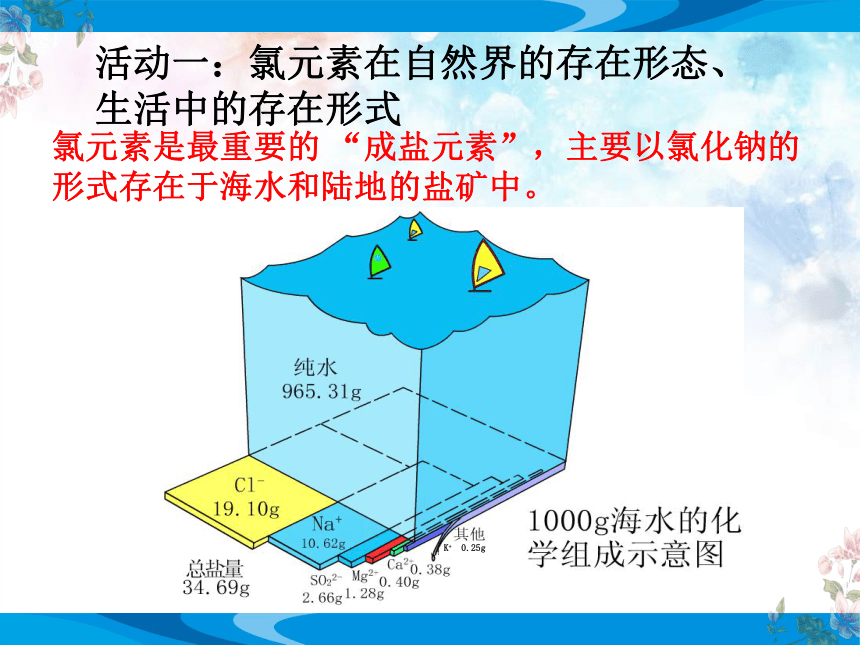
活动一:氯元素在自然界的存在形态、
生活中的存在形式
氯元素是最重要的 “成盐元素”,主要以氯化钠的形式存在于海水和陆地的盐矿中。
K+ 0.25g
日常生活中的“氯”:
一、氯气
阅读P82科学史话
思考:
(1)从发现氯气到确认其是一种新元素,长达三十多年你从这一史实中得到什么启示?
(2)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出此化学反应方程式,并指出氧化剂、还原剂、氧化产物、还原产物。
氯气的发现和确认
C.W.舍勒
瑞典化学家
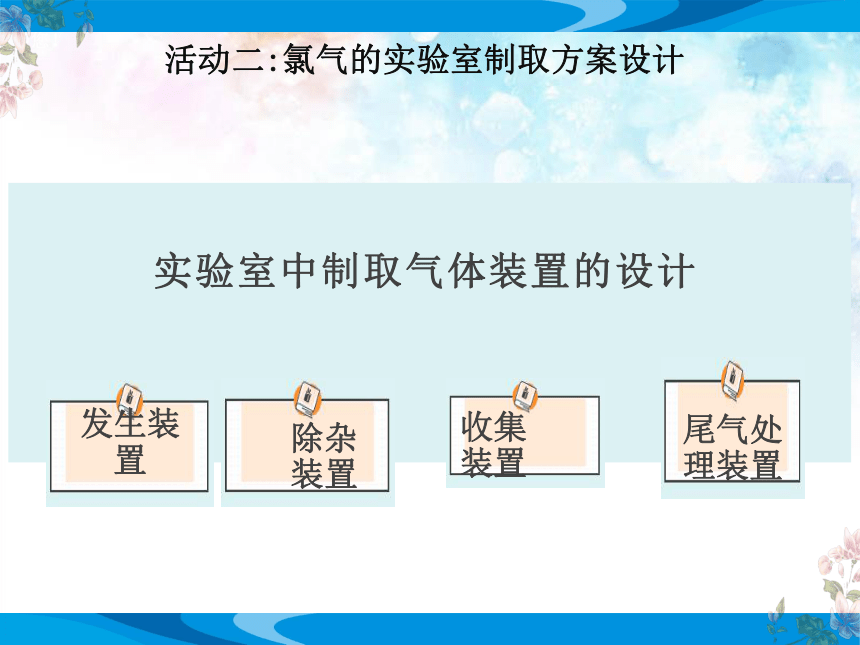
活动二:氯气的实验室制取方案设计
新课教授
例题讲解
课后作业
实验室中制取气体装置的设计
除杂装置
收集装置
尾气处理装置
发生装置
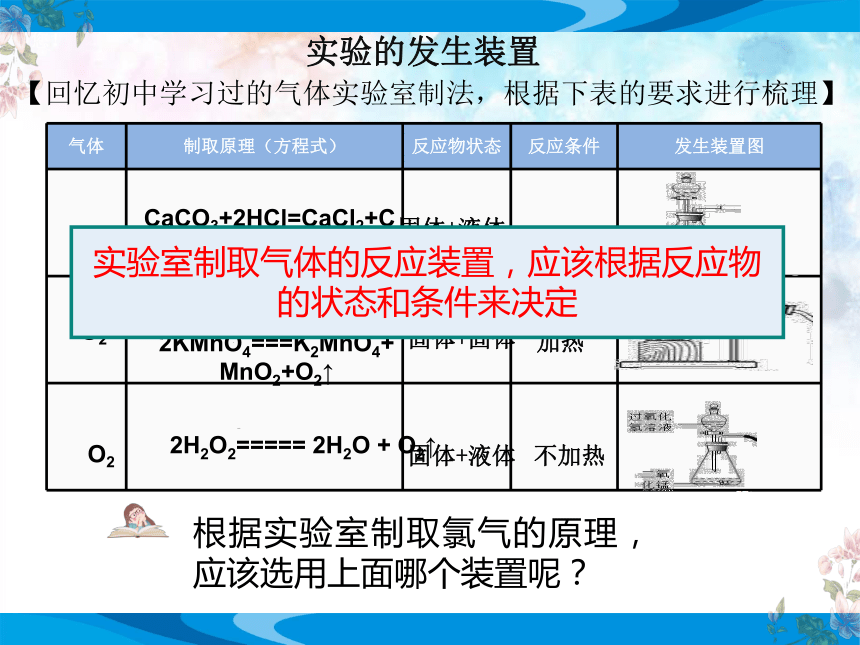
实验的发生装置
气体 制取原理(方程式) 反应物状态 反应条件 发生装置图
【回忆初中学习过的气体实验室制法,根据下表的要求进行梳理】
CO2
CaCO3+2HCl=CaCl2+CO2↑+H2O
固体+液体
2KMnO4===K2MnO4+MnO2+O2↑
Δ
固体+固体
固体+液体
不加热
加热
不加热
O2
O2
2H2O2===== 2H2O + O2↑
MnO2
实验室制取气体的反应装置,应该根据反应物的状态和条件来决定
根据实验室制取氯气的原理,应该选用上面哪个装置呢?
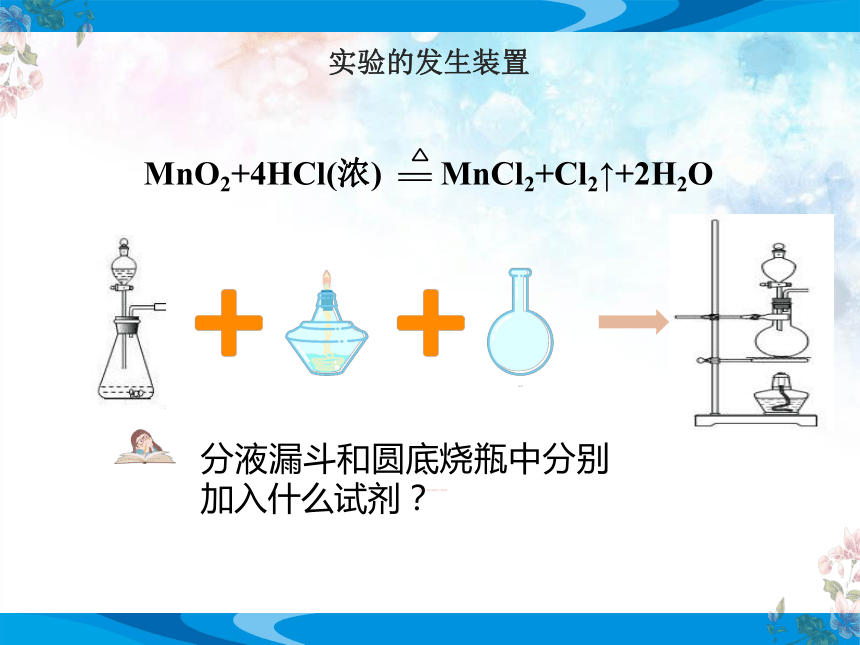
实验的发生装置
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
分液漏斗和圆底烧瓶中分别加入什么试剂?
分液漏斗中加入浓盐酸,圆底烧瓶中加入二氧化锰固体
圆底烧瓶
Cl2中混有哪些杂质气体?
如何除去?
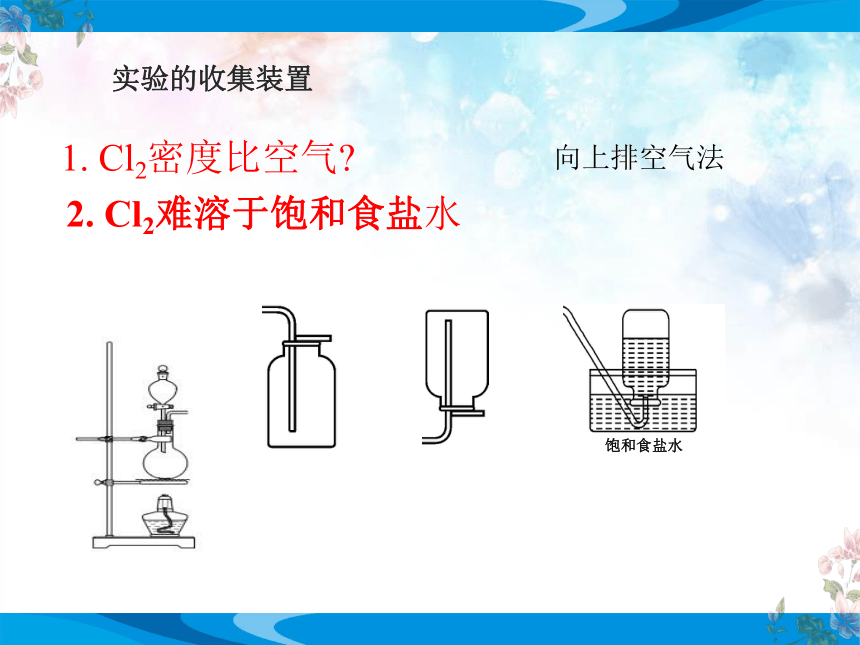
实验的收集装置
1. Cl2密度比空气
2. Cl2难溶于饱和食盐水
饱和食盐水
向上排空气法
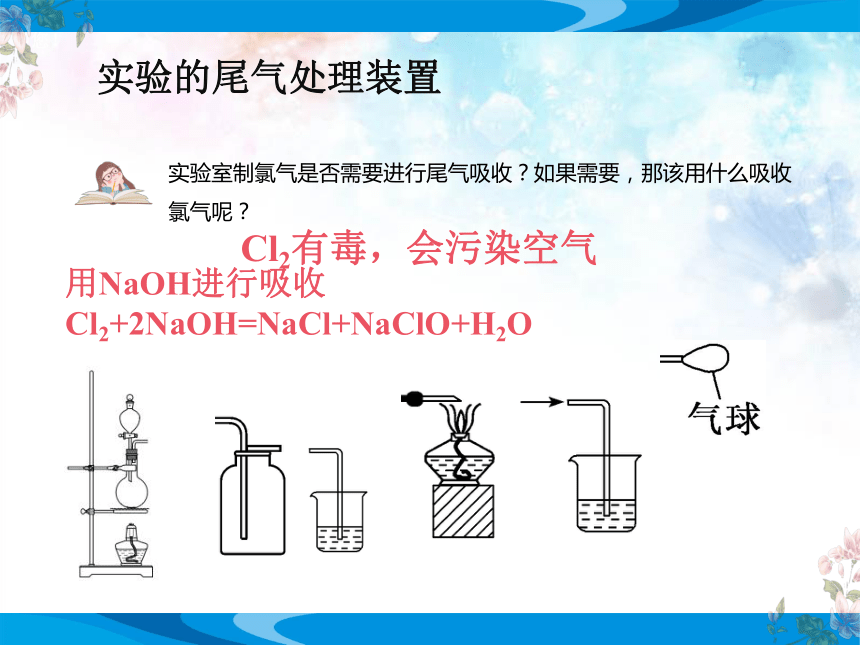
实验的尾气处理装置
用NaOH进行吸收Cl2+2NaOH=NaCl+NaClO+H2O
Cl2有毒,会污染空气
实验室制氯气是否需要进行尾气吸收?如果需要,那该用什么吸收氯气呢?
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
氯气的实验室制取
发生装置
除杂装置
收集装置
尾气处
理装置
装置:
分液漏斗、圆底烧瓶
除杂:
1.HCl
2.H2O(g)
收集:
1.向上排空气法
2.排饱和食盐水法
尾气处理:
NaOH溶液
饱和食盐水
浓硫酸
氯气有毒,能破坏环境、能剿灭触及的所有生命——所有植物和动物,尤其是动物致死率几乎100%,只有天上能高飞的鸟勉强得逃脱。
农田被氯气熏黄
第一次世界大战的伊普雷战役中,德国5分钟释放了180吨氯气,使15000人中毒,三分之一的人死去。
思考
1、氯气是什么颜色的呢?
2、氯气有什么气味?正确闻氯气的方法是什么呢?
3、你能猜出氯气的密度比空气的密度大还是小吗,依据是什么?
4、你认为氯气溶于水吗?你能设计什么实验来验证?
1.颜色:
2.状态:
3.气味:
4.密度:
5.毒性:
6.易液化:
7.溶解性:
氯气
液氯
固态氯
-101℃
-34.6℃
黄绿色
气体
刺激性气味
大于空气
有毒(怎么闻?)
能溶于水(1:2),形成 。
氯水
2.物理性质
氯原子结构
Cl
氯气有哪些化学性质?
思考预测
+17
8
7
2
+17
8
8
2
Cl-
分子式:Cl2
3.分子结构
铝与氧气
铁与氧气
铁与氯气
钠与硫粉
金属与非金属反应·实验视频
Cu与Cl2反应
铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。
Fe与Cl2反应
铁丝剧烈燃烧,产生————(棕红)—色的————
棕褐
烟
Na与Cl2反应
剧烈燃烧,火焰呈————色,生成————晶体
白色
反应规律:
黄
4.化学性质
(1)与金属单质反应
2Na + Cl2 2 NaCl
点燃
2Fe + 3 Cl2 2 FeCl3
点燃
Cu+Cl2 CuCl2
点燃
生成高价金属的氯化物
下列氯化物,不能用金属和氯气直接反应制得的是( )
A.CuCl2 B.FeCl2
C.MgCl2 D.KCl
B
课堂反馈
(2)与非金属单质反应
与H2反应
点燃
H2+ Cl2 2HCl
光照
H2+Cl2 2HCl
现象:爆炸,瓶口有白雾
安静的燃烧,发出苍白色的火焰,产生白雾。
现象:
思考与交流
通过H2在Cl2中的燃烧的实验,你对燃烧的条件及本质有什么新的认识?
所有的发光发热的剧烈的化学反应都称为燃烧。
谢谢聆听
富集在海水中的元素——氯
(第2课时)
高三化学复习课:
思考:
如何设计实验验证Cl2和水是否反应?
提出问题
Cl2与H2O会发生化学反应吗?
做出假设
如果反应,可能的产物:
HCl+O2、HCl+ 、……
设计实验
完成实验
得出结论
Cl2能与H2O反应,产物中有H+、Cl-、…
实验
目的 验证Cl2和水是否反应
实验用品
操作
步骤
现象
结果
方案1:检验溶液的酸碱性
方案2:检验Cl-
蓝色石蕊试纸先变红后褪色
出现白色沉淀
溶液显酸性
溶液中存在Cl-
用玻璃棒蘸取少量氯水滴到蓝色石蕊试纸上,观察现象
蓝色石蕊试纸、氯水
硝酸银溶液、小试管、
氯水
用胶头滴管吸取少量硝酸银溶液置于小试管中,再用胶头滴管吸取少量氯水滴加到硝酸银溶液里,观察现象。
产生新问题
氯水中具有漂白性的物质是什么?
提出问题
做出假设
设计实验
完成实验
得出结论
具有漂白性的物质是什么?
可能是氯水中溶解的氯气,
也可能氯气与水反应生成的新的物质
实验 检验氯水中具有漂白性的微粒
操作
现象
结论
氯气没有漂白性
具有漂白性的物质是
氯气与水反应生成的新的物质
产生新问题
新的物质是什么?
用预先装好干燥红纸条的注射器吸入干燥氯气,观察;然后再吸取少量蒸馏水,观察。
干燥红纸无明显变化,吸收水后褪色
Cl2 + H2O== HCl+HClO(次氯酸)
(3)与水反应
★次氯酸(HClO)的性质
1.一元弱酸(酸性比碳酸还弱)
2.强氧化性(杀菌、漂白、消毒)
3.不稳定易分解
2HClO 2HCl + O2↑
光照
Cl2 + H2O== H++Cl-+HClO
分子: ①Cl2 ②H2O ③HClO
离子: ①H+ ②Cl- ③ClO- ④OH-
★氯水的成分:
那么氯水的成分有哪些呢?
(新制)
★久置氯水的成分:
分子: H2O
离子: ①H+ ②Cl- ③ OH-
新制氯水的性质:
①Cl2的强氧化性
②HClO的强氧化性、漂白性
③H+的酸性
④Cl-的性质
请解释:
①硝酸银溶液——滴入新制氯水后有白色沉淀产生
②碳酸钠溶液——滴入新制氯水后有气体产生
③有色布条——滴入新制氯水后有色布条褪色
④氯化亚铁溶液——滴入新制氯水后颜色由浅绿色变为黄色
⑤石蕊溶液——滴入新制氯水溶液先变红后褪色
目前,很多自来水厂仍然用氯气来杀菌消毒。用氯气消毒的自来水养金鱼时,应先把自来水晒几天:
这样做的目的是____________________,
有关反应的方程式 ,
。
除去氯气和次氯酸
Cl2+ H2O = HCl +HClO
2HClO = 2HCl +O2↑
光
小知识
液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水
分类
成分
性质
纯净物
混合物
分子:
离子:
Cl2 ,HClO,H2O
H+,Cl-,ClO-,OH-
分子:H2O
离子:H+,Cl-, OH-
新制
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
久置
只有Cl2
★ 久置氯水相当于稀盐酸
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
只有酸性
1、自来水可以用氯气消毒。如果实验室中临时没有蒸馏水,可以用自来水配制某些急需的药品,但有些药品若用自来水配制,则明显会导致药品变质。下列哪些药品不能用自来水配制( )
A.Na2SO4 B.NaCl
C.AgNO3 D.AlCl3
课堂反馈
2.下列说法正确的是: A、Cl2有毒,Cl-也有毒
B、Cl2和Cl-化学性质一样
C、 Cl2和Cl-都是黄绿色
D、液氯并非氯水
(4)与碱溶液反应
Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸钠
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
氯化钙 次氯酸钙
漂白粉的主要成分: +
漂白粉的有效成分:
次氯酸钙
3Cl2+6NaOH(浓)=5NaCl+NaClO3+3H2O
漂白粉的漂白原理:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
漂白粉的失效原理:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO =2HCl+O2 ↑
光照
1.如图所示,A处通入湿润的Cl2,关闭B阀时,C处的红布看不到明显现象,当打开B阀后,C处红布条逐渐褪色,则D中装的是
A.浓H2SO4
B.NaOH溶液
C.H2O
D.饱和NaCl溶液
A
B
C
D
A B
1984年,北京传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,定名为“84消毒液”。其有效成分NaClO
洁厕灵和84消毒液不能混用,否则产生有毒气体,严重时致死!
原理如下:洁厕灵是酸性洗涤剂,主要成分是盐酸(HCl);84消毒液是碱性洗涤剂,主要成分是次氯酸钠(NaClO);二者结合,产生氯气。
小知识
漂粉精溶液中通入CO2
少量:
过量:
ClO- + CO2 + H2O HClO + HCO3-
Ca2++2ClO- + CO2 + H2O 2HClO +CaCO3
(5)与盐溶液的反应
与FeCl2 、NaBr、KI等盐溶液反应
Cl2 + 2 I- === 2Cl- + I2
2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
Cl2 + 2Br- === 2Cl- + Br2
探究
Cl2通入FeBr2溶液该怎样反应?
还原性:I->Fe2+>Br->Cl-
如果通入FeI2溶液又该怎样反应?
5.用途
杀菌消毒
制漂白粉(液)
作制高纯硅、锗和钛的中间物质
合成塑料、橡胶、农药、药品等
二、氯离子(Cl-)的检验
Ag+ + Cl– == AgCl
2Ag+ + CO32- == Ag2CO3
Ag2CO3 + 2H+ == 2Ag+ + CO2 + H2O
某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对?
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
(2)方法和结论:
(1)试剂:AgNO3溶液、稀硝酸
或 在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
小 结
?
有关反应的离子方程式是:
课堂反馈
1.下列气体中,既有颜色又有毒性的是( )
A.N2 B.CO C.Cl2 D.CO2
C
2.下列叙述中能证明次氯酸是一种弱酸的是( )
A.次氯酸不稳定,易分解
B.次氯酸是一种强氧化剂
C.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸
D.次氯酸能使染料和有机色质褪色
C
3.下列物质中,既含有氯分子,又含有氯离子的是( )
A.氯化钠溶液 B.新制氯水
C.漂白粉 D.液氯
B
4.下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物
B.液氯无酸性,氯水有酸性
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
AB
5.下列物质中能使干燥的有色布条褪色的是( )
A.氯水 B.液氯 C.氯气 D.次氯酸
A D
6.将一盛满Cl2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的( )
A.2/3 B.1/2 C.1/3 D.1/4
B
谢谢聆听
富集在海水中的元素——氯
第1课时
第2课时
高三化学复习课:
活动一:氯元素在自然界的存在形态、
生活中的存在形式
氯元素是最重要的 “成盐元素”,主要以氯化钠的形式存在于海水和陆地的盐矿中。
K+ 0.25g
日常生活中的“氯”:
一、氯气
阅读P82科学史话
思考:
(1)从发现氯气到确认其是一种新元素,长达三十多年你从这一史实中得到什么启示?
(2)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出此化学反应方程式,并指出氧化剂、还原剂、氧化产物、还原产物。
氯气的发现和确认
C.W.舍勒
瑞典化学家
活动二:氯气的实验室制取方案设计
新课教授
例题讲解
课后作业
实验室中制取气体装置的设计
除杂装置
收集装置
尾气处理装置
发生装置
实验的发生装置
气体 制取原理(方程式) 反应物状态 反应条件 发生装置图
【回忆初中学习过的气体实验室制法,根据下表的要求进行梳理】
CO2
CaCO3+2HCl=CaCl2+CO2↑+H2O
固体+液体
2KMnO4===K2MnO4+MnO2+O2↑
Δ
固体+固体
固体+液体
不加热
加热
不加热
O2
O2
2H2O2===== 2H2O + O2↑
MnO2
实验室制取气体的反应装置,应该根据反应物的状态和条件来决定
根据实验室制取氯气的原理,应该选用上面哪个装置呢?
实验的发生装置
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
分液漏斗和圆底烧瓶中分别加入什么试剂?
分液漏斗中加入浓盐酸,圆底烧瓶中加入二氧化锰固体
圆底烧瓶
Cl2中混有哪些杂质气体?
如何除去?
实验的收集装置
1. Cl2密度比空气
2. Cl2难溶于饱和食盐水
饱和食盐水
向上排空气法
实验的尾气处理装置
用NaOH进行吸收Cl2+2NaOH=NaCl+NaClO+H2O
Cl2有毒,会污染空气
实验室制氯气是否需要进行尾气吸收?如果需要,那该用什么吸收氯气呢?
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
氯气的实验室制取
发生装置
除杂装置
收集装置
尾气处
理装置
装置:
分液漏斗、圆底烧瓶
除杂:
1.HCl
2.H2O(g)
收集:
1.向上排空气法
2.排饱和食盐水法
尾气处理:
NaOH溶液
饱和食盐水
浓硫酸
氯气有毒,能破坏环境、能剿灭触及的所有生命——所有植物和动物,尤其是动物致死率几乎100%,只有天上能高飞的鸟勉强得逃脱。
农田被氯气熏黄
第一次世界大战的伊普雷战役中,德国5分钟释放了180吨氯气,使15000人中毒,三分之一的人死去。
思考
1、氯气是什么颜色的呢?
2、氯气有什么气味?正确闻氯气的方法是什么呢?
3、你能猜出氯气的密度比空气的密度大还是小吗,依据是什么?
4、你认为氯气溶于水吗?你能设计什么实验来验证?
1.颜色:
2.状态:
3.气味:
4.密度:
5.毒性:
6.易液化:
7.溶解性:
氯气
液氯
固态氯
-101℃
-34.6℃
黄绿色
气体
刺激性气味
大于空气
有毒(怎么闻?)
能溶于水(1:2),形成 。
氯水
2.物理性质
氯原子结构
Cl
氯气有哪些化学性质?
思考预测
+17
8
7
2
+17
8
8
2
Cl-
分子式:Cl2
3.分子结构
铝与氧气
铁与氧气
铁与氯气
钠与硫粉
金属与非金属反应·实验视频
Cu与Cl2反应
铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。
Fe与Cl2反应
铁丝剧烈燃烧,产生————(棕红)—色的————
棕褐
烟
Na与Cl2反应
剧烈燃烧,火焰呈————色,生成————晶体
白色
反应规律:
黄
4.化学性质
(1)与金属单质反应
2Na + Cl2 2 NaCl
点燃
2Fe + 3 Cl2 2 FeCl3
点燃
Cu+Cl2 CuCl2
点燃
生成高价金属的氯化物
下列氯化物,不能用金属和氯气直接反应制得的是( )
A.CuCl2 B.FeCl2
C.MgCl2 D.KCl
B
课堂反馈
(2)与非金属单质反应
与H2反应
点燃
H2+ Cl2 2HCl
光照
H2+Cl2 2HCl
现象:爆炸,瓶口有白雾
安静的燃烧,发出苍白色的火焰,产生白雾。
现象:
思考与交流
通过H2在Cl2中的燃烧的实验,你对燃烧的条件及本质有什么新的认识?
所有的发光发热的剧烈的化学反应都称为燃烧。
谢谢聆听
富集在海水中的元素——氯
(第2课时)
高三化学复习课:
思考:
如何设计实验验证Cl2和水是否反应?
提出问题
Cl2与H2O会发生化学反应吗?
做出假设
如果反应,可能的产物:
HCl+O2、HCl+ 、……
设计实验
完成实验
得出结论
Cl2能与H2O反应,产物中有H+、Cl-、…
实验
目的 验证Cl2和水是否反应
实验用品
操作
步骤
现象
结果
方案1:检验溶液的酸碱性
方案2:检验Cl-
蓝色石蕊试纸先变红后褪色
出现白色沉淀
溶液显酸性
溶液中存在Cl-
用玻璃棒蘸取少量氯水滴到蓝色石蕊试纸上,观察现象
蓝色石蕊试纸、氯水
硝酸银溶液、小试管、
氯水
用胶头滴管吸取少量硝酸银溶液置于小试管中,再用胶头滴管吸取少量氯水滴加到硝酸银溶液里,观察现象。
产生新问题
氯水中具有漂白性的物质是什么?
提出问题
做出假设
设计实验
完成实验
得出结论
具有漂白性的物质是什么?
可能是氯水中溶解的氯气,
也可能氯气与水反应生成的新的物质
实验 检验氯水中具有漂白性的微粒
操作
现象
结论
氯气没有漂白性
具有漂白性的物质是
氯气与水反应生成的新的物质
产生新问题
新的物质是什么?
用预先装好干燥红纸条的注射器吸入干燥氯气,观察;然后再吸取少量蒸馏水,观察。
干燥红纸无明显变化,吸收水后褪色
Cl2 + H2O== HCl+HClO(次氯酸)
(3)与水反应
★次氯酸(HClO)的性质
1.一元弱酸(酸性比碳酸还弱)
2.强氧化性(杀菌、漂白、消毒)
3.不稳定易分解
2HClO 2HCl + O2↑
光照
Cl2 + H2O== H++Cl-+HClO
分子: ①Cl2 ②H2O ③HClO
离子: ①H+ ②Cl- ③ClO- ④OH-
★氯水的成分:
那么氯水的成分有哪些呢?
(新制)
★久置氯水的成分:
分子: H2O
离子: ①H+ ②Cl- ③ OH-
新制氯水的性质:
①Cl2的强氧化性
②HClO的强氧化性、漂白性
③H+的酸性
④Cl-的性质
请解释:
①硝酸银溶液——滴入新制氯水后有白色沉淀产生
②碳酸钠溶液——滴入新制氯水后有气体产生
③有色布条——滴入新制氯水后有色布条褪色
④氯化亚铁溶液——滴入新制氯水后颜色由浅绿色变为黄色
⑤石蕊溶液——滴入新制氯水溶液先变红后褪色
目前,很多自来水厂仍然用氯气来杀菌消毒。用氯气消毒的自来水养金鱼时,应先把自来水晒几天:
这样做的目的是____________________,
有关反应的方程式 ,
。
除去氯气和次氯酸
Cl2+ H2O = HCl +HClO
2HClO = 2HCl +O2↑
光
小知识
液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水
分类
成分
性质
纯净物
混合物
分子:
离子:
Cl2 ,HClO,H2O
H+,Cl-,ClO-,OH-
分子:H2O
离子:H+,Cl-, OH-
新制
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
久置
只有Cl2
★ 久置氯水相当于稀盐酸
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
只有酸性
1、自来水可以用氯气消毒。如果实验室中临时没有蒸馏水,可以用自来水配制某些急需的药品,但有些药品若用自来水配制,则明显会导致药品变质。下列哪些药品不能用自来水配制( )
A.Na2SO4 B.NaCl
C.AgNO3 D.AlCl3
课堂反馈
2.下列说法正确的是: A、Cl2有毒,Cl-也有毒
B、Cl2和Cl-化学性质一样
C、 Cl2和Cl-都是黄绿色
D、液氯并非氯水
(4)与碱溶液反应
Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸钠
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
氯化钙 次氯酸钙
漂白粉的主要成分: +
漂白粉的有效成分:
次氯酸钙
3Cl2+6NaOH(浓)=5NaCl+NaClO3+3H2O
漂白粉的漂白原理:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
漂白粉的失效原理:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO =2HCl+O2 ↑
光照
1.如图所示,A处通入湿润的Cl2,关闭B阀时,C处的红布看不到明显现象,当打开B阀后,C处红布条逐渐褪色,则D中装的是
A.浓H2SO4
B.NaOH溶液
C.H2O
D.饱和NaCl溶液
A
B
C
D
A B
1984年,北京传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,定名为“84消毒液”。其有效成分NaClO
洁厕灵和84消毒液不能混用,否则产生有毒气体,严重时致死!
原理如下:洁厕灵是酸性洗涤剂,主要成分是盐酸(HCl);84消毒液是碱性洗涤剂,主要成分是次氯酸钠(NaClO);二者结合,产生氯气。
小知识
漂粉精溶液中通入CO2
少量:
过量:
ClO- + CO2 + H2O HClO + HCO3-
Ca2++2ClO- + CO2 + H2O 2HClO +CaCO3
(5)与盐溶液的反应
与FeCl2 、NaBr、KI等盐溶液反应
Cl2 + 2 I- === 2Cl- + I2
2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
Cl2 + 2Br- === 2Cl- + Br2
探究
Cl2通入FeBr2溶液该怎样反应?
还原性:I->Fe2+>Br->Cl-
如果通入FeI2溶液又该怎样反应?
5.用途
杀菌消毒
制漂白粉(液)
作制高纯硅、锗和钛的中间物质
合成塑料、橡胶、农药、药品等
二、氯离子(Cl-)的检验
Ag+ + Cl– == AgCl
2Ag+ + CO32- == Ag2CO3
Ag2CO3 + 2H+ == 2Ag+ + CO2 + H2O
某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对?
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
(2)方法和结论:
(1)试剂:AgNO3溶液、稀硝酸
或 在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
小 结
?
有关反应的离子方程式是:
课堂反馈
1.下列气体中,既有颜色又有毒性的是( )
A.N2 B.CO C.Cl2 D.CO2
C
2.下列叙述中能证明次氯酸是一种弱酸的是( )
A.次氯酸不稳定,易分解
B.次氯酸是一种强氧化剂
C.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸
D.次氯酸能使染料和有机色质褪色
C
3.下列物质中,既含有氯分子,又含有氯离子的是( )
A.氯化钠溶液 B.新制氯水
C.漂白粉 D.液氯
B
4.下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物
B.液氯无酸性,氯水有酸性
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
AB
5.下列物质中能使干燥的有色布条褪色的是( )
A.氯水 B.液氯 C.氯气 D.次氯酸
A D
6.将一盛满Cl2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的( )
A.2/3 B.1/2 C.1/3 D.1/4
B
谢谢聆听
同课章节目录
