福建省福州第一中学2023-2024学年高二上学期第二学段考试(期末)化学试题(PDF版含答案)
文档属性
| 名称 | 福建省福州第一中学2023-2024学年高二上学期第二学段考试(期末)化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 803.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 12:23:06 | ||
图片预览



文档简介
福州一中 2023~2024学年第一学期第二学段考试
高二化学《化学反应原理》模块考试
(完卷 75分钟 满分 100分)
【相对原子质量】H:1 C:12 O:16 Na:23 Mn:55 Cu:64 Zn:65
第Ⅰ卷 选择题(48 分)
一、选择题(本题包括 16 小题,每小题 3 分,共 48 分,每小题只有一个选项符合题
意。)
1.下列有关金属腐蚀与防护的说法不正确的是
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
2.下列事实能用勒夏特列原理解释的是
A.加入催化剂有利于 SO2 生成 SO3
B.黄绿色的氯水光照后颜色变浅
C.500℃比常温更有利于合成氨的反应
D.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
3.将两个铂电极插入 500mL CuSO4 溶液中进行电解,通电一定时间后,某一电极增
重 0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离
子浓度约为
. -3 -1 -3 -1A 4×10 mol·L B.2×10 mol·L
. -3 -1 -7 -1C 1×10 mol·L D.1×10 mol·L
4.能促进水的电离,并使溶液中 + -c(H )>c(OH )的操作是
①将水加热煮沸 ②向水中投入一小块金属钠
③向水中通 CO2 ④向水中通 NH3
⑤向水中加入明矾晶体 ⑥向水中加入 NaHCO3 固体
⑦向水中加 NaHSO4 固体
A.①③⑥⑦ B.①③⑥ C.⑤⑦ D.⑤
第 1 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
5.常温下,下列各组离子在制定溶液中一定能大量共存的是
+ 3+ - 2-
A.pH=7 的溶液:Na 、Fe 、Cl 、SO4
B.甲基橙呈红色的溶液: + 2+NH4 、Ba 、
-
AlO2 、
-
Cl
C.纯碱的稀溶液: +K 、 + - -Na 、CH3COO 、Br
D.与铝反应产生大量氢气的溶液: +Na 、 +、 2- -K CO3 、NO3
6.我国科研人员以 Zn 和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系
充电
锌离子电池。该电池的总反应方程式:ZnMn2O4 xZn+Zn放电 1 xMn2O4(0<x<1)。下
列说法正确的是
A.充电时, 2+Zn 向 ZnMn2O4 电极迁移
B.充电时,阳极反应: - 2+ZnMn2O4 2xe=Zn1-xMn2O4+xZn
C.放电时,每转移 -1mol e ,ZnMn2O4 电极质量增加 65g
D.充放电过程中,只有 Zn 元素的化合价发生变化
7.在常温常压下,向 -1 -15 mL 0.01 mol·L FeCl3 溶液中滴入 0.5 mL 0.01 mol·L 的 KSCN
溶液,发生如下反应:FeCl3+3KSCN Fe(SCN)3+3KCl
所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A.向溶液中加入少量的 KCl 晶体 B.向溶液中加入少量的水
C.设法移走溶液中的部分水 -1 D.向溶液中滴加 2 滴 1 mol·L FeCl3 溶液
8.将 pH=1 的盐酸平均分成 2 份,1 份加适量水,另 1 份加入与该盐酸物质的量浓度
相同的适量 NaOH 溶液后,pH 都升高了 1,则加入的水与 NaOH 溶液的体积比为
A.9 B.10 C.11 D.12
9.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g)。230℃时,该反应
的平衡常数 5K=2×10 。已知:Ni(CO)4 的沸点为 42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230℃制得高纯镍。
下列判断正确的是
A.增加 c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在 30℃和 50℃两者之间选择反应温度,选 50℃
C.第二阶段,Ni(CO)4 分解率较低
D.该反应达到平衡时,v 生成[Ni(CO)4]=4v 生成(CO)
第 2 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
10.现有室温下四种溶液,有关叙述不正确的是
序号 ① ② ③ ④
pH 11 11 3 3
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
A.③④中分别加入适量的醋酸钠晶体后,两溶液的 pH 均增大
B.②③两溶液等体积混合,所得溶液中 + -c(H )>c(OH )
C.分别加水稀释 10 倍,四种溶液的 pH:①>②>④>③
D.V1 L ④与 V2 L ①混合,若混合后溶液 pH=7,则 V1<V2
11.欲使 -10.1 mol·L 的 NaHCO3 溶液中
+ 2- -
c(H )、c(CO3 )、c(HCO3 )都减少其方法是
A.加水稀释 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
12.恒温、恒压下,向密闭容器中充入 2 体积 A 和 1 体积 B,发生如下反应:
2A(g)+B(g) 2C(g),平衡时,混合气体体积比起始时减少了 20%。若开始时充入 4 体
积 C,达到平衡时 C 的转化率为
A.50% B.40% C.30% D.20%
13.一定条件下,通过下列反应可以制备特种陶瓷的原料 MgO:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0。
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标 x 的值,重新达到平衡后,
纵坐标 y 随 x 变化趋势合理的是
选项 x y
y
A 温度 容器内混合气体的密度
B CO 的物质的量 CO2 与 CO 的物质的量之比
C SO2 的浓度 平衡常数 K
x
D MgSO4 的质量(忽略体积) CO 的转化率
14.某同学将光亮的镁条放入盛有 NH4Cl 溶液的试管中,有大量气泡产生。为探究该
反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是
选项 实验及现象 结论
A 将湿润的红色石蕊试纸放在试管口,试纸变蓝 反应中有 NH3 产生
B 收集产生的气体并点燃,火焰呈淡蓝色 反应中有 H2 产生
C 收集气体的同时测得溶液的 pH 为 8.0 弱碱性溶液中 Mg 也可被氧化
D 将光亮的镁条放入 -pH 为 8.6 的 NaHCO3溶液 弱碱性溶液中 OH 氧化了 Mg
中,有气泡产生
第 3 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
-1
15.25℃时,在 10mL 浓度均为 0.1 mol·L NaOH 和 NH3·H2O 混合溶液中,滴加 0.1
-1
mol·L 的盐酸,下列有关溶液中粒子浓度关系正确的是
A.未加盐酸时: - +c(OH )>c(Na )=c(NH3·H2O)
B.加入 + + -10mL 盐酸时:c(NH4 )+c(H )=c(OH )
C.加入盐酸至溶液 - +pH=7 时:c(Cl )=c(Na )
- + +
D.加入 20mL 盐酸时:c(Cl )=c(NH4 )+c(Na )
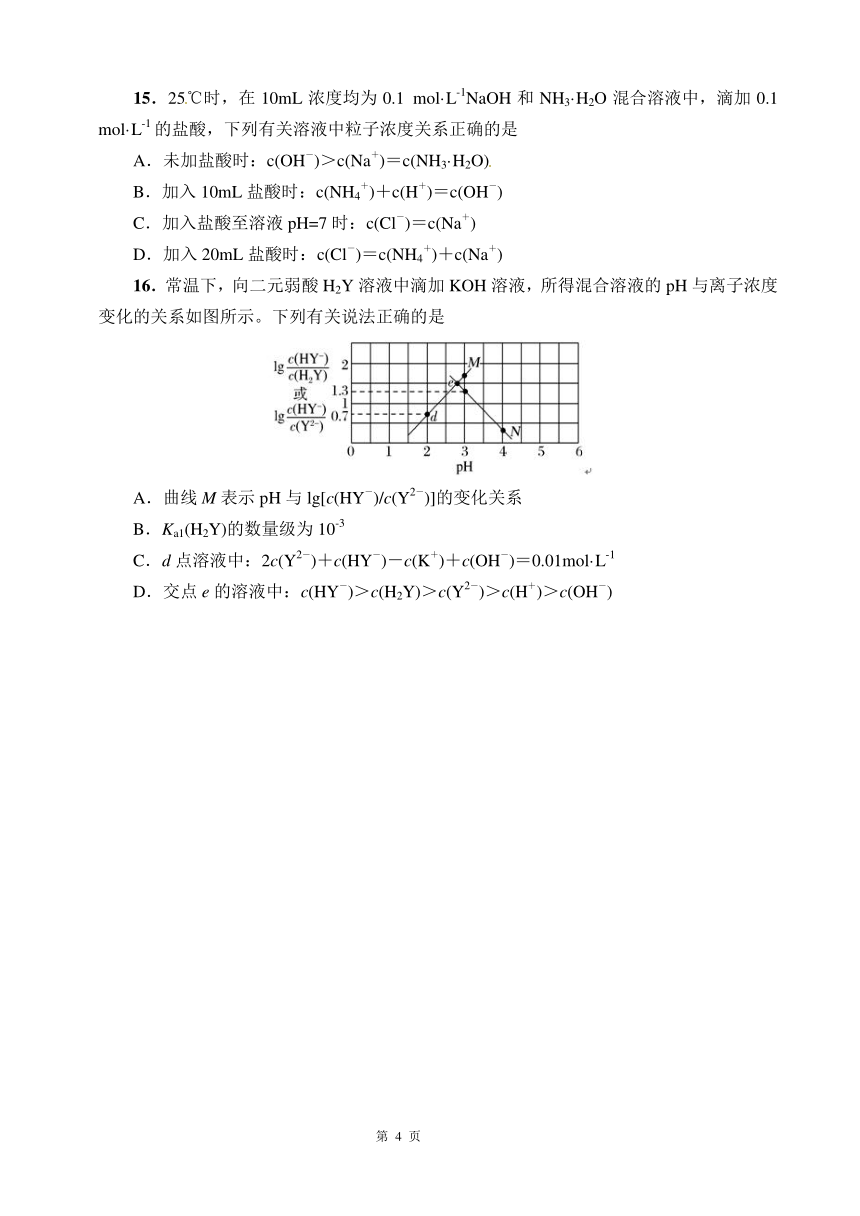
16.常温下,向二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度
变化的关系如图所示。下列有关说法正确的是
A.曲线 M 表示 pH 与 - 2-lg[c(HY )/c(Y )]的变化关系
. 的数量级为 -3 B Ka1(H2Y) 10
C. 点溶液中: 2-d 2c(Y )+ - + - -1c(HY )-c(K )+c(OH )=0.01mol·L
D.交点 e 的溶液中: - 2- + -c(HY )>c(H2Y)>c(Y )>c(H )>c(OH )
第 4 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
第Ⅱ卷 非选择题(52 分)
17.(8 分)回答下列问题:
(1)能证明 2- - -Na2SO3 溶液中存在 SO3 +H2O HSO3 +OH 水解平衡的事实是
(填序号)。
A.滴入酚酞溶液变红,再加入 H2SO4 溶液红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入 BaCl2 溶液后产生沉淀且红色退去
(2)恒温时,在一密闭容器进行反应 CaCO3(s) CaO(s)+CO2(g),达到平衡后,t1
时加压,重新建立平衡时 CO2 浓度将 (填“增大”、 反应速 率 v
“减小”或“不变”),在右图画出 t1 时加压后至 t2 时建立
新平衡的速率 v 随时间 t 变化的图像(新平衡速率用 V'正、
V'逆表示)。
V正 =V逆
t t
1 2 反应时间 t
(3)在恒容绝热(不与外界交换能量)条件下进行 2A(g)+B(g) 2C(g)+D(s)反应,
按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度
的变化关系 。
物 质 A B C D
起始投料/mol 2 1 2 0
18.(10 分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和
氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(1)反应 I 前需在 FeSO4 溶液中加入
3+
(填字母),以除去溶液中的 Fe ;
A.锌粉 B.铁屑 C.KI 溶液 D.H2
(2)反应 I 需控制反应温度低 35℃,其目的是 ;
第 5 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
(3)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳
极发生的电极反应可表示为 ;
(4)反应 I 的离子方程式为 。
(5)空气中煅烧的化学方程式为 。
19.(10 分)毒重石的主要成分 2+ 2+ 3+BaCO3(含 Ca 、Mg 、Fe 等杂质),实验室利用毒
重石制备 BaCl2·2H2O 的流程如下:
(1)毒重石用盐酸浸取,实验室用 37%的盐酸配制 15%的盐酸,除量筒外还需使用
下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
2+ 2+ 3+
Ca Mg Fe
开始沉淀时的 pH 11.9 9.1 1.9
完全沉淀时的 pH 13.9 11.1 3.2
加入 NH3·H2O 调节 pH=8 可除去 (填离子符号),加入 H2C2O4
时应避免过量,原因是 。
已知: -7 -9Ksp(BaC2O4)=1.6×10 ,Ksp(CaC2O4)=2.3×10
(3)利用简捷酸碱滴定法可测定 2+Ba 的含量,实验分两步进行。
已知: 2- + 2- 2+ 2-2CrO4 +2H =Cr2O7 +H2O Ba +CrO4 =BaCrO4↓
步骤Ⅰ 移取 x mL 一定浓度的 Na2CrO4 溶液与锥形瓶中,加入酸碱指示剂,用 b
-1
mol·L 盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ 移取 y mLBaCl2 溶液于锥形瓶中,加入 x mL 与步骤Ⅰ 相同浓度的 Na2CrO4
溶液,待 2+Ba 完全沉淀后,再加入酸碱指示剂,用 -1b mol·L 盐酸标准液滴定至终点,测得
滴加盐酸的体积为 V1 mL。
-1
则 BaCl2 溶液的浓度为 mol·L ,若步骤Ⅱ中滴加盐酸时有少量
待测液溅出, 2+Ba 浓度测量值将 (填“偏大”或“偏小”)。
第 6 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
20.(12 分)化学反应原理在科研和生产中有广泛的应用:
(1)利用“化学蒸气转移法”制备 TaS2 晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) △H>0 (I)
若反应(I)的平衡常数 K=1,向某恒容容器中加入 1mol I2(g)和足量 TaS2(s),I2(g)
的平衡转化率为 。
(2)如图所示,反应(I)在石英真空管中进行,先在温度为 T2 的一段放入未提纯的
TaS2粉末和少量 I2(g),一段时间后,在温度为T1 一端得到了纯净TaS2晶体,则温度T1 T2
(填“>”、“<”或“=”)。
(3)利用的 I2 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 H2SO3,
然后用一定浓度的 I2 溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式
为 。
( ) ℃时, 的电离常数 = -24 25 H2SO3 Ka1 1×10 , =
-8 -
Ka2 6×10 ,则该温度下 HSO3 水解反
c(H 2SO3 )
应的平衡常数 Kh= ,若向 NaHSO3 溶液中加入少量 I2,则溶液中 将
c(HSO 3 )
(填“增大”、“减小”或“不变”)。
21.(12 分)铁及其化合物在生产、生活中有广泛的应用。
(1)中科院兰州化学物理研究所用 Fe3(CO)12/ZSM-5 催化 CO2加氢合成低碳烯烃反应,
反应过程如图 21-1。
催化剂中添加助剂 Na、K、Cu(也起催化作用)后可改变反应的选择性。
慢 快 低聚反 应 C H3 6
RWGS
CO CO CO FTS (CH ) 异构化反 应
2 2 n (CH ) …… C H
2 n 2 4
第1步 第2步
ZSM-5 C H
4 8
Fe (CO)
3 12
图 21-1
下列说法正确的是 。
a.第 1 步所发生的反应为:CO2+H2 CO+H2O
b.第 1 步反应的活化能低于第 2 步
c.Fe3(CO)12/ZSM-5 使 CO2 加氢合成低碳烯烃的 ΔH 减小
d.添加不同助剂后,各反应的平衡常数不变
第 7 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
(2)纳米铁是重要的储氢材料,可用反应 Fe(s)+5CO(g) Fe(CO)5(g)制得。在 1L
恒容密闭容器中加入足量铁粉和 0.48molCO,在 T1、T2 不同温度下进行反应,测得 c(CO)
与温度、时间的关系如图 21-2 所示。
图 21-2
①△H 0(填“>”或“<”);
②T2 温度下,平衡时体系的压强为 p,反应的标准平衡常数
p Fe(CO)5
p θ
K = (已知:标准平衡常数 θK = ,
5
p(CO)
p
其中 θp 为标准压强( 51×10 Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。)
(3)高铁酸钾(K2FeO4)被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
图 21-3 图 21-4
①电解法可制得 K2FeO4,装置如图 21-3,阳极电极反应式为 。
②K2FeO4 在水解过程中铁元素形成的微粒分布分数与 pH 的关系如图 21-4 所示,向
pH=6 的溶液中加入 KOH 溶液,发生反应的离子方程式为 。
(4)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
x
①MnFe2O4(s)=MnFe2O(4-x)(s)+ O2(g) △H1
2
②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g) △H2
③2H2O(g)=2H2(g)+O2(g) △H3
则:△H3 与△H1、△H2 的关系为△H3 。
第 8 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
高二化学《化学反应原理》模块考试答案
1 2 3 4 5 6 7 8
B B A D C B B C
9 10 11 12 13 14 15 16
B D D B A D B C
17(1)C 反应速 率 v
(2)①不变; ②见右图 V逆
(3)平衡常数与温度成反比
V正 =V逆 V正' =V逆'
t t
1 2 反应时间 t
18(1)B
(2)防止 NH4HCO3 分解(还可以答“抑制”
2+
Fe 水解)
( ) 2- - 2- 3 2SO4 —2e =S2O8
( ) 2+ -4 Fe +2HCO3 =FeCO3↓+CO2↑+H2O
高温
(5)4Fe CO3+O2 2 Fe2O3+4CO2
19(1)ac
( ) 3+2 Fe ; H2C2O4过量导致 BaC2O4 沉淀,产品产量减少
V
(3) 0
b V1b 偏大
y
20(1)66.7%
(2)<
(3)淀粉溶液; + 2- -H2SO3+I2+H2O=4H +SO4 +2I
(4) -121×10 ;增大
21(1)ad
1.6 1021
(2)<;
p 4
( )① - - 2- 3 Fe—6e +8OH =FeO4 +4H2O
- - 2-
②HFeO4 +OH =FeO4 +H2O
2( H1 H )(4) 2
x
第 9 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
高二化学《化学反应原理》模块考试
(完卷 75分钟 满分 100分)
【相对原子质量】H:1 C:12 O:16 Na:23 Mn:55 Cu:64 Zn:65
第Ⅰ卷 选择题(48 分)
一、选择题(本题包括 16 小题,每小题 3 分,共 48 分,每小题只有一个选项符合题
意。)
1.下列有关金属腐蚀与防护的说法不正确的是
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
2.下列事实能用勒夏特列原理解释的是
A.加入催化剂有利于 SO2 生成 SO3
B.黄绿色的氯水光照后颜色变浅
C.500℃比常温更有利于合成氨的反应
D.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
3.将两个铂电极插入 500mL CuSO4 溶液中进行电解,通电一定时间后,某一电极增
重 0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离
子浓度约为
. -3 -1 -3 -1A 4×10 mol·L B.2×10 mol·L
. -3 -1 -7 -1C 1×10 mol·L D.1×10 mol·L
4.能促进水的电离,并使溶液中 + -c(H )>c(OH )的操作是
①将水加热煮沸 ②向水中投入一小块金属钠
③向水中通 CO2 ④向水中通 NH3
⑤向水中加入明矾晶体 ⑥向水中加入 NaHCO3 固体
⑦向水中加 NaHSO4 固体
A.①③⑥⑦ B.①③⑥ C.⑤⑦ D.⑤
第 1 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
5.常温下,下列各组离子在制定溶液中一定能大量共存的是
+ 3+ - 2-
A.pH=7 的溶液:Na 、Fe 、Cl 、SO4
B.甲基橙呈红色的溶液: + 2+NH4 、Ba 、
-
AlO2 、
-
Cl
C.纯碱的稀溶液: +K 、 + - -Na 、CH3COO 、Br
D.与铝反应产生大量氢气的溶液: +Na 、 +、 2- -K CO3 、NO3
6.我国科研人员以 Zn 和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系
充电
锌离子电池。该电池的总反应方程式:ZnMn2O4 xZn+Zn放电 1 xMn2O4(0<x<1)。下
列说法正确的是
A.充电时, 2+Zn 向 ZnMn2O4 电极迁移
B.充电时,阳极反应: - 2+ZnMn2O4 2xe=Zn1-xMn2O4+xZn
C.放电时,每转移 -1mol e ,ZnMn2O4 电极质量增加 65g
D.充放电过程中,只有 Zn 元素的化合价发生变化
7.在常温常压下,向 -1 -15 mL 0.01 mol·L FeCl3 溶液中滴入 0.5 mL 0.01 mol·L 的 KSCN
溶液,发生如下反应:FeCl3+3KSCN Fe(SCN)3+3KCl
所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A.向溶液中加入少量的 KCl 晶体 B.向溶液中加入少量的水
C.设法移走溶液中的部分水 -1 D.向溶液中滴加 2 滴 1 mol·L FeCl3 溶液
8.将 pH=1 的盐酸平均分成 2 份,1 份加适量水,另 1 份加入与该盐酸物质的量浓度
相同的适量 NaOH 溶液后,pH 都升高了 1,则加入的水与 NaOH 溶液的体积比为
A.9 B.10 C.11 D.12
9.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g)。230℃时,该反应
的平衡常数 5K=2×10 。已知:Ni(CO)4 的沸点为 42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230℃制得高纯镍。
下列判断正确的是
A.增加 c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在 30℃和 50℃两者之间选择反应温度,选 50℃
C.第二阶段,Ni(CO)4 分解率较低
D.该反应达到平衡时,v 生成[Ni(CO)4]=4v 生成(CO)
第 2 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
10.现有室温下四种溶液,有关叙述不正确的是
序号 ① ② ③ ④
pH 11 11 3 3
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
A.③④中分别加入适量的醋酸钠晶体后,两溶液的 pH 均增大
B.②③两溶液等体积混合,所得溶液中 + -c(H )>c(OH )
C.分别加水稀释 10 倍,四种溶液的 pH:①>②>④>③
D.V1 L ④与 V2 L ①混合,若混合后溶液 pH=7,则 V1<V2
11.欲使 -10.1 mol·L 的 NaHCO3 溶液中
+ 2- -
c(H )、c(CO3 )、c(HCO3 )都减少其方法是
A.加水稀释 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
12.恒温、恒压下,向密闭容器中充入 2 体积 A 和 1 体积 B,发生如下反应:
2A(g)+B(g) 2C(g),平衡时,混合气体体积比起始时减少了 20%。若开始时充入 4 体
积 C,达到平衡时 C 的转化率为
A.50% B.40% C.30% D.20%
13.一定条件下,通过下列反应可以制备特种陶瓷的原料 MgO:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0。
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标 x 的值,重新达到平衡后,
纵坐标 y 随 x 变化趋势合理的是
选项 x y
y
A 温度 容器内混合气体的密度
B CO 的物质的量 CO2 与 CO 的物质的量之比
C SO2 的浓度 平衡常数 K
x
D MgSO4 的质量(忽略体积) CO 的转化率
14.某同学将光亮的镁条放入盛有 NH4Cl 溶液的试管中,有大量气泡产生。为探究该
反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是
选项 实验及现象 结论
A 将湿润的红色石蕊试纸放在试管口,试纸变蓝 反应中有 NH3 产生
B 收集产生的气体并点燃,火焰呈淡蓝色 反应中有 H2 产生
C 收集气体的同时测得溶液的 pH 为 8.0 弱碱性溶液中 Mg 也可被氧化
D 将光亮的镁条放入 -pH 为 8.6 的 NaHCO3溶液 弱碱性溶液中 OH 氧化了 Mg
中,有气泡产生
第 3 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
-1
15.25℃时,在 10mL 浓度均为 0.1 mol·L NaOH 和 NH3·H2O 混合溶液中,滴加 0.1
-1
mol·L 的盐酸,下列有关溶液中粒子浓度关系正确的是
A.未加盐酸时: - +c(OH )>c(Na )=c(NH3·H2O)
B.加入 + + -10mL 盐酸时:c(NH4 )+c(H )=c(OH )
C.加入盐酸至溶液 - +pH=7 时:c(Cl )=c(Na )
- + +
D.加入 20mL 盐酸时:c(Cl )=c(NH4 )+c(Na )
16.常温下,向二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度
变化的关系如图所示。下列有关说法正确的是
A.曲线 M 表示 pH 与 - 2-lg[c(HY )/c(Y )]的变化关系
. 的数量级为 -3 B Ka1(H2Y) 10
C. 点溶液中: 2-d 2c(Y )+ - + - -1c(HY )-c(K )+c(OH )=0.01mol·L
D.交点 e 的溶液中: - 2- + -c(HY )>c(H2Y)>c(Y )>c(H )>c(OH )
第 4 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
第Ⅱ卷 非选择题(52 分)
17.(8 分)回答下列问题:
(1)能证明 2- - -Na2SO3 溶液中存在 SO3 +H2O HSO3 +OH 水解平衡的事实是
(填序号)。
A.滴入酚酞溶液变红,再加入 H2SO4 溶液红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入 BaCl2 溶液后产生沉淀且红色退去
(2)恒温时,在一密闭容器进行反应 CaCO3(s) CaO(s)+CO2(g),达到平衡后,t1
时加压,重新建立平衡时 CO2 浓度将 (填“增大”、 反应速 率 v
“减小”或“不变”),在右图画出 t1 时加压后至 t2 时建立
新平衡的速率 v 随时间 t 变化的图像(新平衡速率用 V'正、
V'逆表示)。
V正 =V逆
t t
1 2 反应时间 t
(3)在恒容绝热(不与外界交换能量)条件下进行 2A(g)+B(g) 2C(g)+D(s)反应,
按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度
的变化关系 。
物 质 A B C D
起始投料/mol 2 1 2 0
18.(10 分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和
氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(1)反应 I 前需在 FeSO4 溶液中加入
3+
(填字母),以除去溶液中的 Fe ;
A.锌粉 B.铁屑 C.KI 溶液 D.H2
(2)反应 I 需控制反应温度低 35℃,其目的是 ;
第 5 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
(3)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳
极发生的电极反应可表示为 ;
(4)反应 I 的离子方程式为 。
(5)空气中煅烧的化学方程式为 。
19.(10 分)毒重石的主要成分 2+ 2+ 3+BaCO3(含 Ca 、Mg 、Fe 等杂质),实验室利用毒
重石制备 BaCl2·2H2O 的流程如下:
(1)毒重石用盐酸浸取,实验室用 37%的盐酸配制 15%的盐酸,除量筒外还需使用
下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
2+ 2+ 3+
Ca Mg Fe
开始沉淀时的 pH 11.9 9.1 1.9
完全沉淀时的 pH 13.9 11.1 3.2
加入 NH3·H2O 调节 pH=8 可除去 (填离子符号),加入 H2C2O4
时应避免过量,原因是 。
已知: -7 -9Ksp(BaC2O4)=1.6×10 ,Ksp(CaC2O4)=2.3×10
(3)利用简捷酸碱滴定法可测定 2+Ba 的含量,实验分两步进行。
已知: 2- + 2- 2+ 2-2CrO4 +2H =Cr2O7 +H2O Ba +CrO4 =BaCrO4↓
步骤Ⅰ 移取 x mL 一定浓度的 Na2CrO4 溶液与锥形瓶中,加入酸碱指示剂,用 b
-1
mol·L 盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ 移取 y mLBaCl2 溶液于锥形瓶中,加入 x mL 与步骤Ⅰ 相同浓度的 Na2CrO4
溶液,待 2+Ba 完全沉淀后,再加入酸碱指示剂,用 -1b mol·L 盐酸标准液滴定至终点,测得
滴加盐酸的体积为 V1 mL。
-1
则 BaCl2 溶液的浓度为 mol·L ,若步骤Ⅱ中滴加盐酸时有少量
待测液溅出, 2+Ba 浓度测量值将 (填“偏大”或“偏小”)。
第 6 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
20.(12 分)化学反应原理在科研和生产中有广泛的应用:
(1)利用“化学蒸气转移法”制备 TaS2 晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) △H>0 (I)
若反应(I)的平衡常数 K=1,向某恒容容器中加入 1mol I2(g)和足量 TaS2(s),I2(g)
的平衡转化率为 。
(2)如图所示,反应(I)在石英真空管中进行,先在温度为 T2 的一段放入未提纯的
TaS2粉末和少量 I2(g),一段时间后,在温度为T1 一端得到了纯净TaS2晶体,则温度T1 T2
(填“>”、“<”或“=”)。
(3)利用的 I2 的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 H2SO3,
然后用一定浓度的 I2 溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式
为 。
( ) ℃时, 的电离常数 = -24 25 H2SO3 Ka1 1×10 , =
-8 -
Ka2 6×10 ,则该温度下 HSO3 水解反
c(H 2SO3 )
应的平衡常数 Kh= ,若向 NaHSO3 溶液中加入少量 I2,则溶液中 将
c(HSO 3 )
(填“增大”、“减小”或“不变”)。
21.(12 分)铁及其化合物在生产、生活中有广泛的应用。
(1)中科院兰州化学物理研究所用 Fe3(CO)12/ZSM-5 催化 CO2加氢合成低碳烯烃反应,
反应过程如图 21-1。
催化剂中添加助剂 Na、K、Cu(也起催化作用)后可改变反应的选择性。
慢 快 低聚反 应 C H3 6
RWGS
CO CO CO FTS (CH ) 异构化反 应
2 2 n (CH ) …… C H
2 n 2 4
第1步 第2步
ZSM-5 C H
4 8
Fe (CO)
3 12
图 21-1
下列说法正确的是 。
a.第 1 步所发生的反应为:CO2+H2 CO+H2O
b.第 1 步反应的活化能低于第 2 步
c.Fe3(CO)12/ZSM-5 使 CO2 加氢合成低碳烯烃的 ΔH 减小
d.添加不同助剂后,各反应的平衡常数不变
第 7 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
(2)纳米铁是重要的储氢材料,可用反应 Fe(s)+5CO(g) Fe(CO)5(g)制得。在 1L
恒容密闭容器中加入足量铁粉和 0.48molCO,在 T1、T2 不同温度下进行反应,测得 c(CO)
与温度、时间的关系如图 21-2 所示。
图 21-2
①△H 0(填“>”或“<”);
②T2 温度下,平衡时体系的压强为 p,反应的标准平衡常数
p Fe(CO)5
p θ
K = (已知:标准平衡常数 θK = ,
5
p(CO)
p
其中 θp 为标准压强( 51×10 Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。)
(3)高铁酸钾(K2FeO4)被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
图 21-3 图 21-4
①电解法可制得 K2FeO4,装置如图 21-3,阳极电极反应式为 。
②K2FeO4 在水解过程中铁元素形成的微粒分布分数与 pH 的关系如图 21-4 所示,向
pH=6 的溶液中加入 KOH 溶液,发生反应的离子方程式为 。
(4)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
x
①MnFe2O4(s)=MnFe2O(4-x)(s)+ O2(g) △H1
2
②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g) △H2
③2H2O(g)=2H2(g)+O2(g) △H3
则:△H3 与△H1、△H2 的关系为△H3 。
第 8 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
高二化学《化学反应原理》模块考试答案
1 2 3 4 5 6 7 8
B B A D C B B C
9 10 11 12 13 14 15 16
B D D B A D B C
17(1)C 反应速 率 v
(2)①不变; ②见右图 V逆
(3)平衡常数与温度成反比
V正 =V逆 V正' =V逆'
t t
1 2 反应时间 t
18(1)B
(2)防止 NH4HCO3 分解(还可以答“抑制”
2+
Fe 水解)
( ) 2- - 2- 3 2SO4 —2e =S2O8
( ) 2+ -4 Fe +2HCO3 =FeCO3↓+CO2↑+H2O
高温
(5)4Fe CO3+O2 2 Fe2O3+4CO2
19(1)ac
( ) 3+2 Fe ; H2C2O4过量导致 BaC2O4 沉淀,产品产量减少
V
(3) 0
b V1b 偏大
y
20(1)66.7%
(2)<
(3)淀粉溶液; + 2- -H2SO3+I2+H2O=4H +SO4 +2I
(4) -121×10 ;增大
21(1)ad
1.6 1021
(2)<;
p 4
( )① - - 2- 3 Fe—6e +8OH =FeO4 +4H2O
- - 2-
②HFeO4 +OH =FeO4 +H2O
2( H1 H )(4) 2
x
第 9 页
{#{QQABRQSUggAAAgAAAAhCAwHICAIQkBEAAIoORFAIIAAAyBNABAA=}#}
同课章节目录
