2023-2024学年厦门市高一年上学期期末测试化学试题(PDF版含答案)
文档属性
| 名称 | 2023-2024学年厦门市高一年上学期期末测试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 00:44:06 | ||
图片预览


文档简介
厦门市2023~2024学年第一学期高一年级质量检测
化
学试题
说明:
1.本试卷共6页。总分100分。考试时间75分钟。
2.请将符合题意的答案填入答题卷相应空格中
可能用到的相对原子质量:H1C12016Na23S32Cl35.5
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.化学科学技术的发展对人类文明的进步发挥了巨大的推动作用。下列有关说法错误的是
A.氮肥的工业生产促进粮食增产
B.芯片的研发推动信息技术发展
C.农药的过量使用有利环境保护
D.药物的合理使用有利人类健康
2.实验室制备S0,的常用方法之一为:Cu+2H,S0,(浓)△CuS0+S0,↑+2H,0。反应
涉及物质分类错误的是
A.Cu-电解质
B.H2S0,-酸
C.CuS0,-正盐
D.S0,-酸住氧化物
3.下列关于反应NaHCO,+HCl=NaCl+H,0+C0,↑的描述错误的是
A.NaHC(0,的摩尔质量为84gmol-
B.1L1mol-L-1NaCl溶液中含1 mol Na
C.1molH,0中约含6.02×103个水分子
D.常温常压下1molC0,的体积为22.4L
4.下列离子可能大量存在于同一所工厂废水中的是
A.Na、OH、HC03
B.K、H◆、NO
C.Fe3+、NHt、I
D.Ag*、C0、Cl
5.下列现象或应用中,不涉及胶体性质的是
A.利用活性炭净水
B.豆浆中加疏酸钙制成豆腐
C.利用静电去除工厂烟尘
D.清晨密林中的一缕缕光束
6.某电解质饮料中含有氯化钠、氯化钙、柠檬酸(化学式为H,CH0,,为三元弱酸)、谷甘酸钠
(化学式为C,H,NO,Na)等。下列有关电离方程式表示正确的是
A.NaCl Na*+Cl
B.CaCl=Ca2+Cl
C.H,C6H,0,=H*+H2C6H,0,
D.Cs Hs NO,Na Na*+CsHs NO;
7.下列有关氯气的离子方程式书写正确的是
A.氯气与水发生反应:Cl2+H,0=2H*+C0°+C
B.氯气通人Na,S0,溶液发生反应:2Cl2+S0+H,0=2Cl~+S0,↑+2HC0
C.氯气通人石灰乳中制备漂白粉:C2+20H=C1°+C10+H,0
D.氯气通人FS0,溶液发生反应:Cl,+2Fe2+一2Fe3++2Cl
高一化学第1页(共6页)
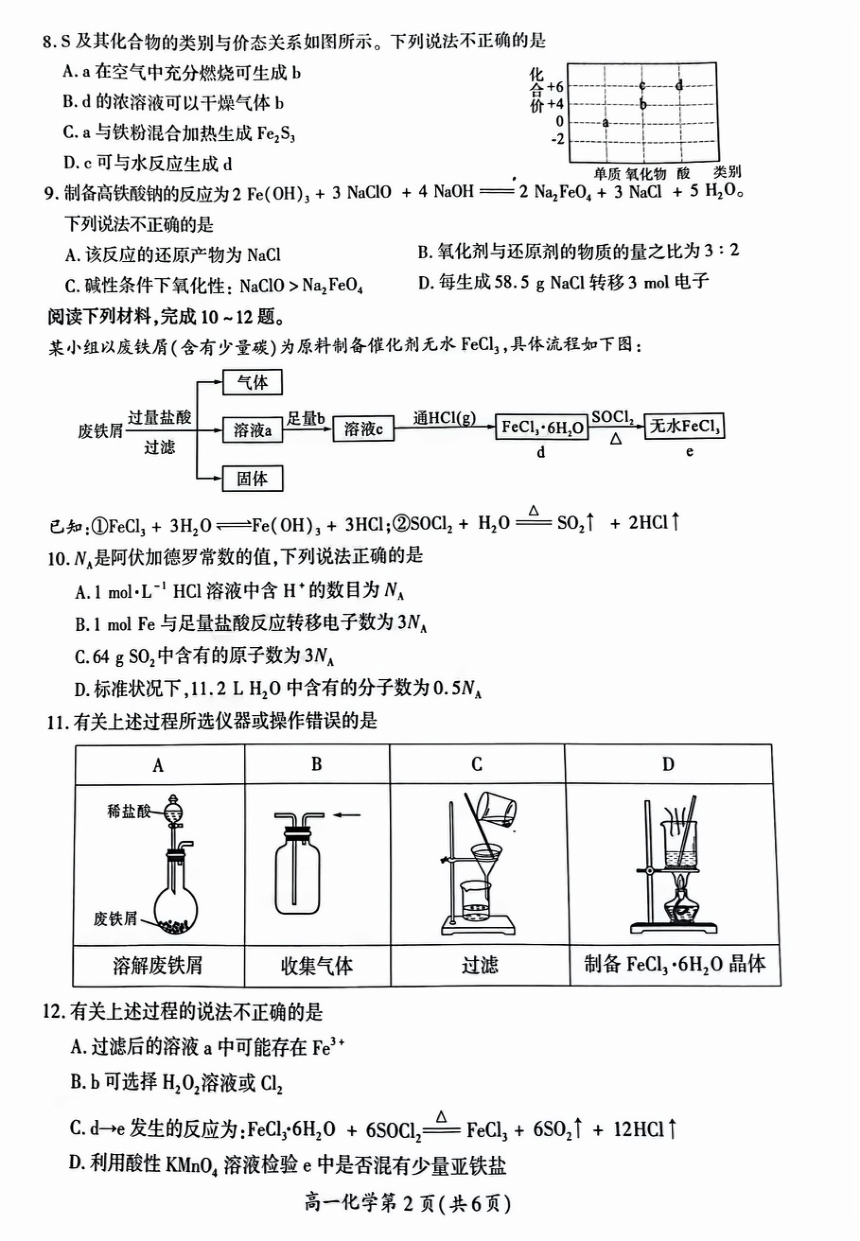
8.S及其化合物的类别与价态关系如图所示。下列说法不正确的是
A.a在空气中充分燃烧可生成b
B.d的浓溶液可以干燥气体b
合+6
价+4
C.a与铁粉混合加热生成FezS,
0
12
D.c可与水反应生成d
单质氧化物酸类别
9.制备高铁酸钠的反应为2Fe(OH),+3NaCI0+4Na0H一2Na,FeO4+3NaC+5H,0。
下列说法不正确的是
A.该反应的还原产物为NaCl
B.氧化剂与还原剂的物质的量之比为3:2
C.碱性条件下氧化性:NaClO>Na2FeO,
D.每生成58.5 g NaCl转移3mol电子
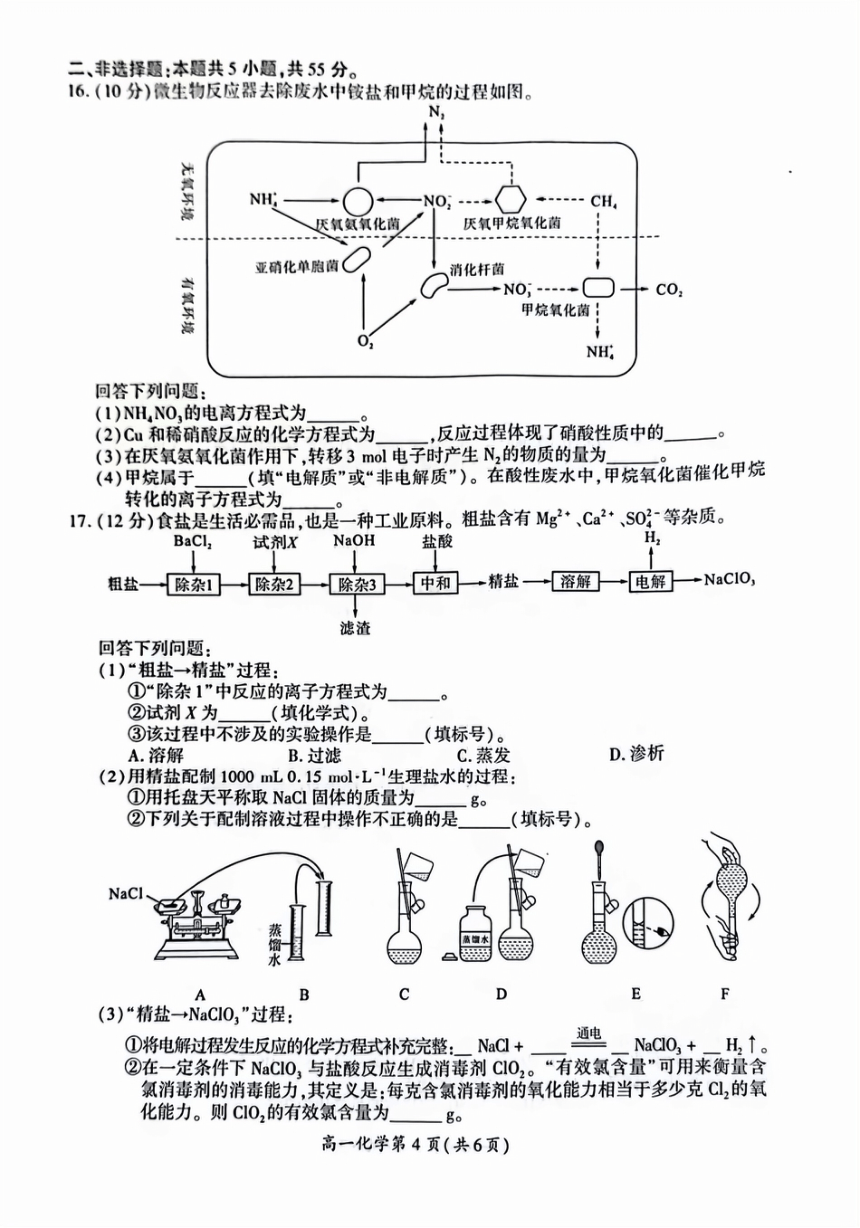
阅读下列材料,完成10~12题。
某小组以废铁屑(含有少量碳)为原料制备催化剂无水FCl3,具体流程如下图:
气体
过量盐酸
足量b
废铁屑
溶液a
溶液c
CA-Eec46Oog无水c
过滤
0
固体
已知:①FeCl,+3H,0-pe(0H),+3HCl;②s0CL,+H,0_△S0,↑+2HCl↑
10.N,是阿伏加德罗常数的值,下列说法正确的是
A.1 mol.L-HCl溶液中含H+的数目为N
B.1 mol Fe与足量盐酸反应转移电子数为3N
C.64gS02中含有的原子数为3N
D.标准状况下,11.2LH,0中含有的分子数为0.5N
11.有关上述过程所选仪器或操作错误的是
A
B
C
D
稀盐酸
废铁屑、
溶解废铁屑
收集气体
过滤
制备FeCl,6H,0晶体
12.有关上述过程的说法不正确的是
A.过滤后的溶液a中可能存在Fe3+
B.b可选择H,02溶液或Cl2
C.de发生的反应为:FeC,6H,0+6s0C,△FeCl,+6S0,↑+12HCt
D.利用酸性KMnO,溶液检验e中是否混有少量亚铁盐
高一化学第2页(共6页)
化
学试题
说明:
1.本试卷共6页。总分100分。考试时间75分钟。
2.请将符合题意的答案填入答题卷相应空格中
可能用到的相对原子质量:H1C12016Na23S32Cl35.5
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.化学科学技术的发展对人类文明的进步发挥了巨大的推动作用。下列有关说法错误的是
A.氮肥的工业生产促进粮食增产
B.芯片的研发推动信息技术发展
C.农药的过量使用有利环境保护
D.药物的合理使用有利人类健康
2.实验室制备S0,的常用方法之一为:Cu+2H,S0,(浓)△CuS0+S0,↑+2H,0。反应
涉及物质分类错误的是
A.Cu-电解质
B.H2S0,-酸
C.CuS0,-正盐
D.S0,-酸住氧化物
3.下列关于反应NaHCO,+HCl=NaCl+H,0+C0,↑的描述错误的是
A.NaHC(0,的摩尔质量为84gmol-
B.1L1mol-L-1NaCl溶液中含1 mol Na
C.1molH,0中约含6.02×103个水分子
D.常温常压下1molC0,的体积为22.4L
4.下列离子可能大量存在于同一所工厂废水中的是
A.Na、OH、HC03
B.K、H◆、NO
C.Fe3+、NHt、I
D.Ag*、C0、Cl
5.下列现象或应用中,不涉及胶体性质的是
A.利用活性炭净水
B.豆浆中加疏酸钙制成豆腐
C.利用静电去除工厂烟尘
D.清晨密林中的一缕缕光束
6.某电解质饮料中含有氯化钠、氯化钙、柠檬酸(化学式为H,CH0,,为三元弱酸)、谷甘酸钠
(化学式为C,H,NO,Na)等。下列有关电离方程式表示正确的是
A.NaCl Na*+Cl
B.CaCl=Ca2+Cl
C.H,C6H,0,=H*+H2C6H,0,
D.Cs Hs NO,Na Na*+CsHs NO;
7.下列有关氯气的离子方程式书写正确的是
A.氯气与水发生反应:Cl2+H,0=2H*+C0°+C
B.氯气通人Na,S0,溶液发生反应:2Cl2+S0+H,0=2Cl~+S0,↑+2HC0
C.氯气通人石灰乳中制备漂白粉:C2+20H=C1°+C10+H,0
D.氯气通人FS0,溶液发生反应:Cl,+2Fe2+一2Fe3++2Cl
高一化学第1页(共6页)
8.S及其化合物的类别与价态关系如图所示。下列说法不正确的是
A.a在空气中充分燃烧可生成b
B.d的浓溶液可以干燥气体b
合+6
价+4
C.a与铁粉混合加热生成FezS,
0
12
D.c可与水反应生成d
单质氧化物酸类别
9.制备高铁酸钠的反应为2Fe(OH),+3NaCI0+4Na0H一2Na,FeO4+3NaC+5H,0。
下列说法不正确的是
A.该反应的还原产物为NaCl
B.氧化剂与还原剂的物质的量之比为3:2
C.碱性条件下氧化性:NaClO>Na2FeO,
D.每生成58.5 g NaCl转移3mol电子
阅读下列材料,完成10~12题。
某小组以废铁屑(含有少量碳)为原料制备催化剂无水FCl3,具体流程如下图:
气体
过量盐酸
足量b
废铁屑
溶液a
溶液c
CA-Eec46Oog无水c
过滤
0
固体
已知:①FeCl,+3H,0-pe(0H),+3HCl;②s0CL,+H,0_△S0,↑+2HCl↑
10.N,是阿伏加德罗常数的值,下列说法正确的是
A.1 mol.L-HCl溶液中含H+的数目为N
B.1 mol Fe与足量盐酸反应转移电子数为3N
C.64gS02中含有的原子数为3N
D.标准状况下,11.2LH,0中含有的分子数为0.5N
11.有关上述过程所选仪器或操作错误的是
A
B
C
D
稀盐酸
废铁屑、
溶解废铁屑
收集气体
过滤
制备FeCl,6H,0晶体
12.有关上述过程的说法不正确的是
A.过滤后的溶液a中可能存在Fe3+
B.b可选择H,02溶液或Cl2
C.de发生的反应为:FeC,6H,0+6s0C,△FeCl,+6S0,↑+12HCt
D.利用酸性KMnO,溶液检验e中是否混有少量亚铁盐
高一化学第2页(共6页)
