第六章 微专题四 解答化学反应速率图像题的思路 学案(含答案)—2024春高中化学人教版必修二
文档属性
| 名称 | 第六章 微专题四 解答化学反应速率图像题的思路 学案(含答案)—2024春高中化学人教版必修二 |

|
|
| 格式 | docx | ||
| 文件大小 | 194.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 18:31:31 | ||
图片预览



文档简介
微专题四 解答化学反应速率图像题的思路
化学反应速率问题常以图像题的形式出现,在相关图像的平面直角坐标系中,可能出现的物理量有物质的量、浓度、时间等。解题时,重点是理解图像的意义和特点。
1.关注图像中的“点、线、面”
(1)关注“面”——明确研究对象
理解各坐标轴所代表量的意义及曲线所表示的是哪些量之间的关系。弄清楚是物质的量,还是物质的量浓度随时间的变化。
(2)关注“线”
①弄清曲线的走向,是增大还是减小,确定反应物和生成物,浓度减小的是反应物,浓度增大的是生成物。
②分清突变和渐变;理解曲线“平”与“陡”即斜率大小的意义。
(3)关注“点”
解题时要特别关注特殊点,如坐标轴的交点、几条曲线的交叉点、极值点、转折点等。深刻理解这些特殊点的意义。
2.联系规律
如各物质的转化量之比与化学计量数之比的关系,各物质的化学反应速率之比与化学计量数之比的关系,外界条件的改变对化学反应速率的影响规律等。
3.正确判断
根据题干和题目要求,结合图像信息,正确利用相关规律做出正确的判断。
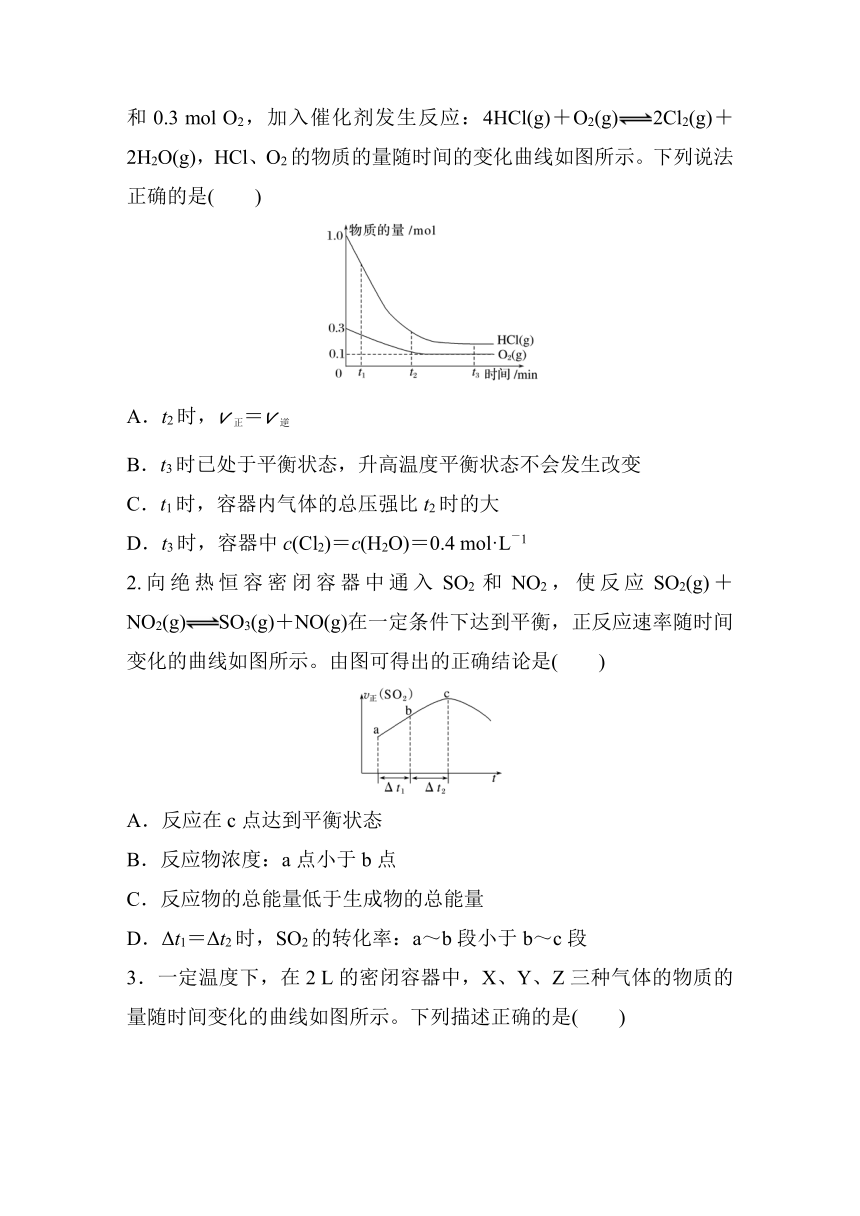
1.(2023·杭州高一检测)在2.0 L恒温恒容密闭容器中充入1.0 mol HCl和0.3 mol O2,加入催化剂发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是( )
A.t2时,v正=v逆
B.t3时已处于平衡状态,升高温度平衡状态不会发生改变
C.t1时,容器内气体的总压强比t2时的大
D.t3时,容器中c(Cl2)=c(H2O)=0.4 mol·L-1
2.向绝热恒容密闭容器中通入SO2和NO2,使反应SO2(g)+NO2(g)SO3(g)+NO(g)在一定条件下达到平衡,正反应速率随时间变化的曲线如图所示。由图可得出的正确结论是( )
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
3.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
A.t min时该反应达到化学平衡状态
B.反应开始到10 min,用X表示的反应速率为0.079 mol·L-1·min-1
C.反应开始到10 min时,Y的转化率为79%
D.反应的化学方程式为X(g)+2Y(g)3Z(g)
4.(2022·河北邯郸高一期中)某学生用纯净的Cu与50 mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。
回答下列问题:
(1)由图像可知0~A、A~B、B~C段的反应速率最大的是__________。1 min后A~B段反应速率逐渐加快,除产物可能有催化作用外,其主要原因还有:____________。2 min后B~C段反应速率又逐渐变慢的原因是_______________________________。
(2)计算在1~3 min内的反应速率: v(H+ )=____________ mol·L-1·min-1。
(3)若开始向反应溶液中加入固体KNO3,则1 min时测得V(NO2)________(填“大于”“小于”“等于”或“不确定”)84 mL。
(4)下列措施不能加快v(NO2)的是______(填字母)。
A.使用Cu粉代替Cu块
B.使用含有石墨的粗铜代替纯铜
C.使用稀硝酸代替浓硝酸
D.在硝酸中加入少量浓硫酸
5.(2023·山东烟台高一期中)恒温下在2 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
(1)该反应的化学方程式为__________________________________。
(2)从开始至5 min,Y的平均反应速率为____________;X的转化率为_____________。
(3)反应达平衡时体系的压强是开始时的__________倍。
(4)下列描述中能表明反应已达到平衡状态的是____________(填序号)。
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤Z(g)的物质的量浓度不变
⑥容器内X、Y、Z三种气体的浓度之比为3∶1∶2
⑦某时刻v(X)=3v(Y)且不等于零
⑧单位时间内生成2n mol Z,同时生成3n mol X
(5)在某一时刻采取下列措施能加快反应速率的是________(填字母)。
A.加催化剂
B.降低温度
C.体积不变,充入X
D.体积不变,从容器中分离出Y
微专题四 解答化学反应速率图像题的思路
跟踪训练
1.C [t2时反应还没有达到平衡,v正≠v逆,A项错误;t3时HCl和O2的物质的量不再发生变化,反应已经达到平衡,但升高温度改变了原有条件,旧平衡会被破坏,一段时间后达到新的平衡,故升温平衡状态会发生改变,B项错误;该反应反应物气体分子数大于生成物,t1时,反应物较多,气体总分子数较大,t2时,反应物较少,气体总分子数较小,故在恒温恒容密闭容器内,t1时气体的总压强比t2时的大,C项正确;t3时,列三段式:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
起始/mol 1 0.3 0 0
转化/mol 0.8 0.2 0.4 0.4
平衡/mol 0.2 0.1 0.4 0.4
容器中c(Cl2)=c(H2O)==0.2 mol·L-1,D项错误。]
2.D [化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,且保持不变,c点对应的正反应速率显然还在改变,故一定未达平衡,A错误;a点到b点正反应速率增加,反应物浓度不断减小,B错误;随着反应的进行,反应物浓度减小,但正反应速率增大,说明体系温度升高,正反应是放热反应,即反应物的总能量高于生成物的总能量,C错误;因为反应一直正向进行,且a~c段正反应速率一直在增大,故SO2的转化率:a~b段小于b~c段,D正确。]
3.C
4.(1)A~B 该反应是放热反应,1 min后溶液温度明显升高,反应速率加快 2 min后反应物硝酸浓度的减小成为影响反应速率的主要原因,反应物浓度逐渐减小,反应速率逐渐变慢 (2)0.225 (3)大于 (4)C
5.(1)3X(g)+Y(g)2Z(g) (2)0.02 mol·L-1·min-1 60% (3) (4)③④⑤⑧ (5)AC
解析 (1)根据图像可知,5 min内X的物质的量减少0.6 mol、Y的物质的量减少0.2 mol 、Z的物质的量增加0.4 mol,X、Y是反应物、Z是生成物,物质的量的变化量之比等于化学计量数之比,5 min后物质的量不再改变,说明该反应可逆,反应的化学方程式为3X(g)+Y(g)2Z(g)。(2)从反应开始至5 min,Y的物质的量减少0.2 mol,Y的平均反应速率为=0.02 mol·L-1·min-1;5 min内X的物质的量减少0.6 mol ,X的转化率为×100%=60%。(3)同温、同体积下,压强之比等于物质的量之比,反应达平衡时体系的压强是开始时的=倍。(4)恒温容器,温度是恒量,容器内温度不变,反应不一定达到平衡状态,故不选①;反应前后气体总质量不变、容器体积不变,密度是恒量,混合气体的密度不变,反应不一定达到平衡状态,故不选②;反应前后气体分子数之和不同,容器体积不变,压强是变量,混合气体的压强不变,反应一定达到平衡状态,故选③;反应前后气体总质量不变,反应前后气体分子数之和不同,混合气体的平均相对分子质量是变量,混合气体的平均相对分子质量不变,反应一定达到平衡状态,故选④;反应达到平衡状态,各物质浓度不再改变,Z(g)的物质的量浓度不变,反应一定达到平衡状态,故选⑤;容器内X、Y、Z三种气体的浓度之比为3∶1∶2,不能判断浓度是否改变,反应不一定达到平衡状态,故不选⑥;某时刻v(X)=3v(Y),不能判断正、逆反应速率是否相等,反应不一定达到平衡状态,故不选⑦;单位时间内生成2n mol Z,同时生成3n mol X,正、逆反应速率相等,反应一定达到平衡状态,故选⑧。(5)催化剂能加快反应速率,故选A;降低温度,反应速率减慢,故不选B;体积不变,充入X,反应物浓度增大,反应速率加快,故选C;体积不变,从容器中分离出Y,反应物浓度降低,反应速率减慢,故不选D。
化学反应速率问题常以图像题的形式出现,在相关图像的平面直角坐标系中,可能出现的物理量有物质的量、浓度、时间等。解题时,重点是理解图像的意义和特点。
1.关注图像中的“点、线、面”
(1)关注“面”——明确研究对象
理解各坐标轴所代表量的意义及曲线所表示的是哪些量之间的关系。弄清楚是物质的量,还是物质的量浓度随时间的变化。
(2)关注“线”
①弄清曲线的走向,是增大还是减小,确定反应物和生成物,浓度减小的是反应物,浓度增大的是生成物。
②分清突变和渐变;理解曲线“平”与“陡”即斜率大小的意义。
(3)关注“点”
解题时要特别关注特殊点,如坐标轴的交点、几条曲线的交叉点、极值点、转折点等。深刻理解这些特殊点的意义。
2.联系规律
如各物质的转化量之比与化学计量数之比的关系,各物质的化学反应速率之比与化学计量数之比的关系,外界条件的改变对化学反应速率的影响规律等。
3.正确判断
根据题干和题目要求,结合图像信息,正确利用相关规律做出正确的判断。
1.(2023·杭州高一检测)在2.0 L恒温恒容密闭容器中充入1.0 mol HCl和0.3 mol O2,加入催化剂发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是( )
A.t2时,v正=v逆
B.t3时已处于平衡状态,升高温度平衡状态不会发生改变
C.t1时,容器内气体的总压强比t2时的大
D.t3时,容器中c(Cl2)=c(H2O)=0.4 mol·L-1
2.向绝热恒容密闭容器中通入SO2和NO2,使反应SO2(g)+NO2(g)SO3(g)+NO(g)在一定条件下达到平衡,正反应速率随时间变化的曲线如图所示。由图可得出的正确结论是( )
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
3.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
A.t min时该反应达到化学平衡状态
B.反应开始到10 min,用X表示的反应速率为0.079 mol·L-1·min-1
C.反应开始到10 min时,Y的转化率为79%
D.反应的化学方程式为X(g)+2Y(g)3Z(g)
4.(2022·河北邯郸高一期中)某学生用纯净的Cu与50 mL过量浓HNO3反应制取NO2 (不考虑NO气体的影响),实验结果如图所示(气体体积均为标准状况下测定,且忽略溶液体积变化)。
回答下列问题:
(1)由图像可知0~A、A~B、B~C段的反应速率最大的是__________。1 min后A~B段反应速率逐渐加快,除产物可能有催化作用外,其主要原因还有:____________。2 min后B~C段反应速率又逐渐变慢的原因是_______________________________。
(2)计算在1~3 min内的反应速率: v(H+ )=____________ mol·L-1·min-1。
(3)若开始向反应溶液中加入固体KNO3,则1 min时测得V(NO2)________(填“大于”“小于”“等于”或“不确定”)84 mL。
(4)下列措施不能加快v(NO2)的是______(填字母)。
A.使用Cu粉代替Cu块
B.使用含有石墨的粗铜代替纯铜
C.使用稀硝酸代替浓硝酸
D.在硝酸中加入少量浓硫酸
5.(2023·山东烟台高一期中)恒温下在2 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
(1)该反应的化学方程式为__________________________________。
(2)从开始至5 min,Y的平均反应速率为____________;X的转化率为_____________。
(3)反应达平衡时体系的压强是开始时的__________倍。
(4)下列描述中能表明反应已达到平衡状态的是____________(填序号)。
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤Z(g)的物质的量浓度不变
⑥容器内X、Y、Z三种气体的浓度之比为3∶1∶2
⑦某时刻v(X)=3v(Y)且不等于零
⑧单位时间内生成2n mol Z,同时生成3n mol X
(5)在某一时刻采取下列措施能加快反应速率的是________(填字母)。
A.加催化剂
B.降低温度
C.体积不变,充入X
D.体积不变,从容器中分离出Y
微专题四 解答化学反应速率图像题的思路
跟踪训练
1.C [t2时反应还没有达到平衡,v正≠v逆,A项错误;t3时HCl和O2的物质的量不再发生变化,反应已经达到平衡,但升高温度改变了原有条件,旧平衡会被破坏,一段时间后达到新的平衡,故升温平衡状态会发生改变,B项错误;该反应反应物气体分子数大于生成物,t1时,反应物较多,气体总分子数较大,t2时,反应物较少,气体总分子数较小,故在恒温恒容密闭容器内,t1时气体的总压强比t2时的大,C项正确;t3时,列三段式:
4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
起始/mol 1 0.3 0 0
转化/mol 0.8 0.2 0.4 0.4
平衡/mol 0.2 0.1 0.4 0.4
容器中c(Cl2)=c(H2O)==0.2 mol·L-1,D项错误。]
2.D [化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,且保持不变,c点对应的正反应速率显然还在改变,故一定未达平衡,A错误;a点到b点正反应速率增加,反应物浓度不断减小,B错误;随着反应的进行,反应物浓度减小,但正反应速率增大,说明体系温度升高,正反应是放热反应,即反应物的总能量高于生成物的总能量,C错误;因为反应一直正向进行,且a~c段正反应速率一直在增大,故SO2的转化率:a~b段小于b~c段,D正确。]
3.C
4.(1)A~B 该反应是放热反应,1 min后溶液温度明显升高,反应速率加快 2 min后反应物硝酸浓度的减小成为影响反应速率的主要原因,反应物浓度逐渐减小,反应速率逐渐变慢 (2)0.225 (3)大于 (4)C
5.(1)3X(g)+Y(g)2Z(g) (2)0.02 mol·L-1·min-1 60% (3) (4)③④⑤⑧ (5)AC
解析 (1)根据图像可知,5 min内X的物质的量减少0.6 mol、Y的物质的量减少0.2 mol 、Z的物质的量增加0.4 mol,X、Y是反应物、Z是生成物,物质的量的变化量之比等于化学计量数之比,5 min后物质的量不再改变,说明该反应可逆,反应的化学方程式为3X(g)+Y(g)2Z(g)。(2)从反应开始至5 min,Y的物质的量减少0.2 mol,Y的平均反应速率为=0.02 mol·L-1·min-1;5 min内X的物质的量减少0.6 mol ,X的转化率为×100%=60%。(3)同温、同体积下,压强之比等于物质的量之比,反应达平衡时体系的压强是开始时的=倍。(4)恒温容器,温度是恒量,容器内温度不变,反应不一定达到平衡状态,故不选①;反应前后气体总质量不变、容器体积不变,密度是恒量,混合气体的密度不变,反应不一定达到平衡状态,故不选②;反应前后气体分子数之和不同,容器体积不变,压强是变量,混合气体的压强不变,反应一定达到平衡状态,故选③;反应前后气体总质量不变,反应前后气体分子数之和不同,混合气体的平均相对分子质量是变量,混合气体的平均相对分子质量不变,反应一定达到平衡状态,故选④;反应达到平衡状态,各物质浓度不再改变,Z(g)的物质的量浓度不变,反应一定达到平衡状态,故选⑤;容器内X、Y、Z三种气体的浓度之比为3∶1∶2,不能判断浓度是否改变,反应不一定达到平衡状态,故不选⑥;某时刻v(X)=3v(Y),不能判断正、逆反应速率是否相等,反应不一定达到平衡状态,故不选⑦;单位时间内生成2n mol Z,同时生成3n mol X,正、逆反应速率相等,反应一定达到平衡状态,故选⑧。(5)催化剂能加快反应速率,故选A;降低温度,反应速率减慢,故不选B;体积不变,充入X,反应物浓度增大,反应速率加快,故选C;体积不变,从容器中分离出Y,反应物浓度降低,反应速率减慢,故不选D。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
