安徽省安庆市怀宁县2023-2024学年高二上学期期末化学试题(含答案)
文档属性
| 名称 | 安徽省安庆市怀宁县2023-2024学年高二上学期期末化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 654.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 18:42:41 | ||
图片预览


文档简介
怀宁县2023-2024学年度第一学期期末考试
高二化学试题
一、单选题(每题2分,共38分)
1.下列生活中常用的方法,其原理与盐类的水解反应有关的是
A.用草木灰去除油污 B.用氢氢化铝中和过多胃酸
C.用食盐腌制腊肉 D.用白醋清洗水壶中的水垢
2.某反应过程中能量变化如下图,则该反应的ΔH值为
A.ΔH>0
B.ΔH<0
C.ΔH=0
D.无法判断
3.下列物质的水溶液在空气中小心加热蒸干至质量不再减少,能得到较纯净的原溶质的是
① ② ③ ④ ⑤ ⑥
A.全部 B.仅①② C.仅①⑤ D.仅①
4.下列根据反应原理设计的应用,不正确的是
A.CO+H2O HCO+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3(胶体)+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)=TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D.SnCl2+H2O Sn(OH)Cl↓+HCl配制氯化亚锡SnCl2溶液时,加入NaOH固体
5.采取下列措施后,溶液颜色变深的是
A.加热明矾溶液(滴有酚酞试液)
B.加热溶液(滴有酚酞试液)
C.氨水(滴有酚酞试液)中加入少量固体
D.小苏打溶液(滴有酚酞试液)中加入少量固体
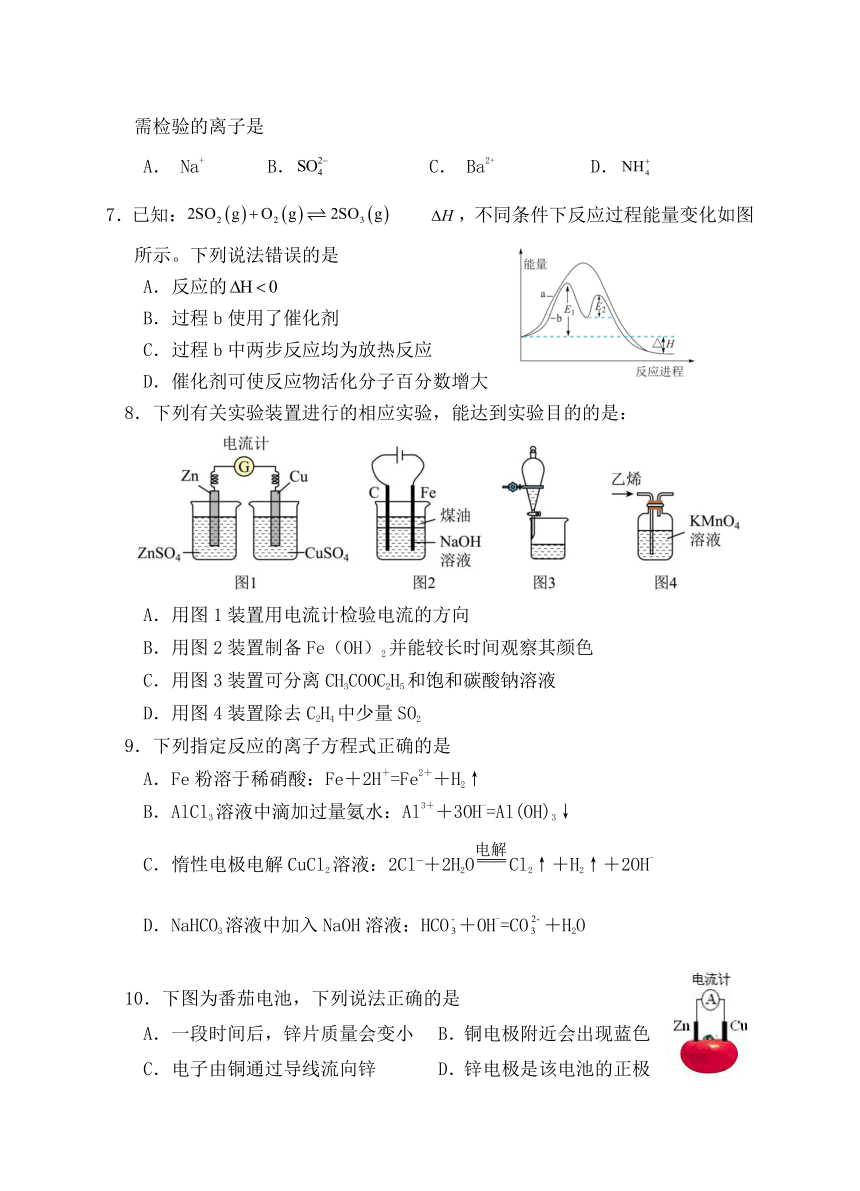
6.某溶液中可能含有Na+、、Ba2+、、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. Na+ B. C. Ba2+ D.
7.已知: ,不同条件下反应过程能量变化如图所示。下列说法错误的是
A.反应的
B.过程b使用了催化剂
C.过程b中两步反应均为放热反应
D.催化剂可使反应物活化分子百分数增大
8.下列有关实验装置进行的相应实验,能达到实验目的的是:
A.用图1装置用电流计检验电流的方向
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置除去C2H4中少量SO2
9.下列指定反应的离子方程式正确的是
A.Fe粉溶于稀硝酸:Fe+2H+=Fe2++H2↑
B.AlCl3溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓
C.惰性电极电解CuCl2溶液:2Cl +2H2OCl2↑+H2↑+2OH-
D.NaHCO3溶液中加入NaOH溶液:HCO+OH-=CO+H2O
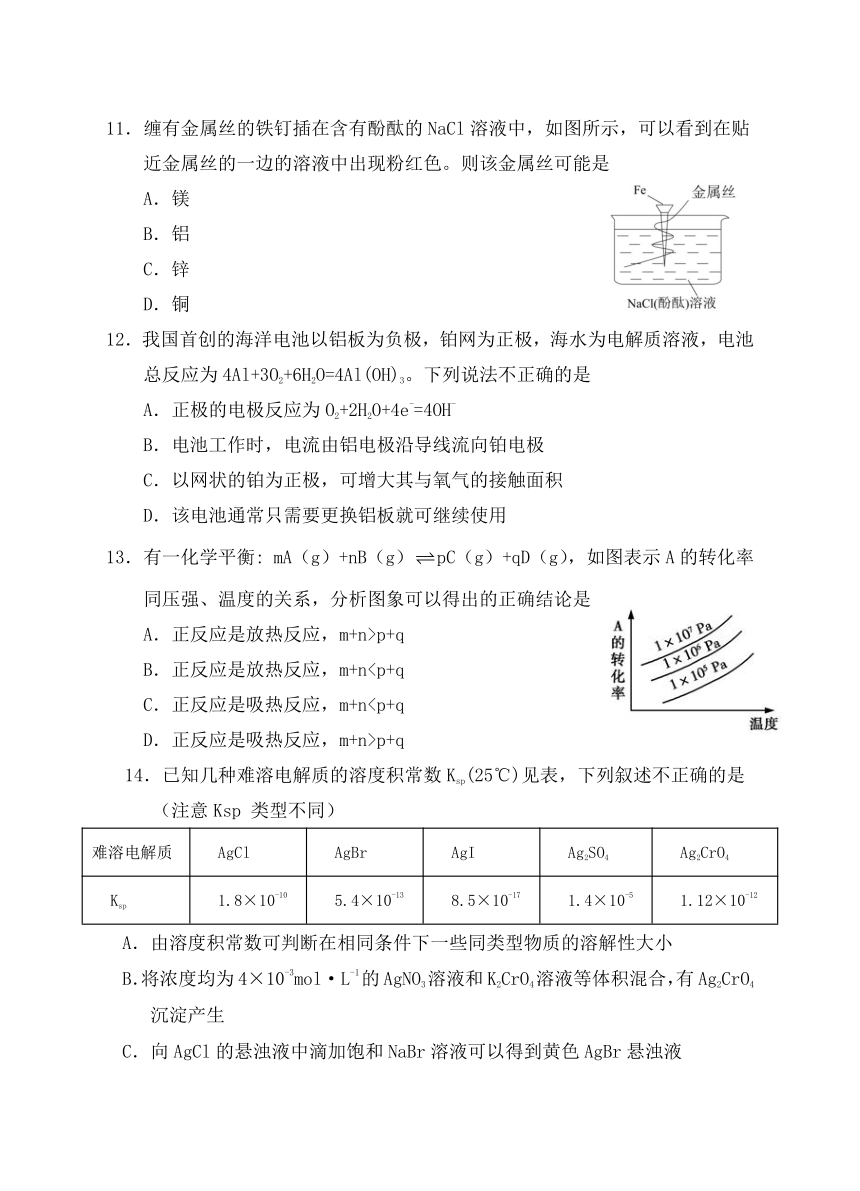
10.下图为番茄电池,下列说法正确的是
A.一段时间后,锌片质量会变小 B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌 D.锌电极是该电池的正极
11.缠有金属丝的铁钉插在含有酚酞的NaCl溶液中,如图所示,可以看到在贴近金属丝的一边的溶液中出现粉红色。则该金属丝可能是
A.镁
B.铝
C.锌
D.铜
12.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是
A.正极的电极反应为O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大其与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
13.有一化学平衡: mA(g)+nB(g)pC(g)+qD(g),如图表示A的转化率同压强、温度的关系,分析图象可以得出的正确结论是
A.正反应是放热反应,m+n>p+q
B.正反应是放热反应,m+nC.正反应是吸热反应,m+nD.正反应是吸热反应,m+n>p+q
14.已知几种难溶电解质的溶度积常数Ksp(25℃)见表,下列叙述不正确的是
(注意Ksp 类型不同)
难溶电解质 AgCl AgBr AgI Ag2SO4 Ag2CrO4
Ksp 1.8×10-10 5.4×10-13 8.5×10-17 1.4×10-5 1.12×10-12
A.由溶度积常数可判断在相同条件下一些同类型物质的溶解性大小
B.将浓度均为4×10-3mol·L-1的AgNO3溶液和K2CrO4溶液等体积混合,有Ag2CrO4沉淀产生
C.向AgCl的悬浊液中滴加饱和NaBr溶液可以得到黄色AgBr悬浊液
D.向100mL0.1mol·L-1的Na2SO4溶液中加入1mL0.lmol·L-1的AgNO3溶液,有白色沉淀生成
15.已知,则在的NaOH溶液中的溶解度为
A. B.
C. D.
16.已知,。下列关于难溶物之间转化的说法中错误的是
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于×10-11
17.某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)
+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):
c(Mn2+)为2×10-23:1
D.a点对应的Ksp大于b点对应的Ksp
18.下列实验装置图正确且能达到相应实验目的的是
A.比较铜、铁金属活动性强弱 B.制备含较多NaClO的消毒液 C.铁钥匙上镀铜 D.验证铁的吸氧腐蚀
A.A B.B C.C D.D
19.25℃时,向10mL0.10mol/L的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10mol/LNaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示,理论上刚好反应点和滴定终点都在b点之前,下列说法不正确的是
A.V=10mL时,c(OH-)=c(HA)+c(H+)
B.b点时,c(Na+)>c(A-)>c(OH-)>c(H+)
C.溶液在a点和b点时水的电离程度相同,b点水电离的氢
离子都是自由的。
D.a点时,二
二、非选择题(62分)
20.(20分)我国向国际社会承诺,2023年买现“碳达峰”,2060年实现“碳中和”
已知500℃时,在2L恒容密闭容器中充入2mol 和6mol ,发生反应:, H=-49kJ/mol平衡时体系压强为,测得和的浓度随时间变化如图所示。
(1)0~4min,平均反应速率_______mol/(L min)。
H2和CO2转化率关系_______(相等、不相等),15分钟后平衡,平衡时H2的转化率为_______。
(2)下列能说明该反应已达到平衡状态的是_________。
A.气体的密度不再变化
B.容器内气体的压强不再变化
C.
D.、、和浓度之比为1:3:1:1
该温度下平衡常数________ (用各气体分压代入K的公式,用含的代数式表示,为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)一定比例的和在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点________(填是或不是)处于平衡状态,如果P不是平衡的,继续反应则平衡转化率________。490K之后,甲醇产率下降的原因是________________。
(4)电解法转化可实现的资源化利用,电解制的原理示意图如图所示:装置中Pt片应与电源的______极相连,反应时阴极电极反应式为______________________。
21.(10分)氧氯化铜[Cu2(OH)3Cl]可用作农药,氧化亚铜(Cu2O)可作杀虫剂。
(1)利用工业铜渣(主要成分为Cu、CuS、FeS等)制得氧氯化铜的流程如下:
①“氧化”时,Cu、CuS、FeS都被氧化,其中CuS与浓硫酸在加热条件下反应的化学方程式为___________。
②“转化”过程的化学方程式为___________。
③“氧化”产生的SO2可以用石灰石浆(主要为碳酸钙浑浊物)吸收,同时鼓入空气可以制得石膏(CaSO4)。该反应的化学方程式为___________。
(2)用铜作阳极,电解一定浓度的NaCl和NaOH溶
液可得到氧化亚铜,相关转化如下图所示。
①阳极(转化Ⅰ)的电极反应式为________。
②转化Ⅱ的离子方程式为________。
22.(18分)I、根据表中数据(常温下),完成下列填空。
物质 HCN HClO
电离常数(K)
(1)常温下,NaCN溶液呈________(填“酸”、“碱”或“中”)性,其原因是___________(用离子方程式表示)。
(2)常温下,有浓度均为0.1 mol/L的下列4种溶液:①溶液②NaCN溶液
③溶液④NaClO溶液;这4种溶液pH由大到小的顺序是_______(填序号)。
(3)常温下,向NaClO溶液中通入少量,所发生反应的离子方程式为_________。
(4)常温下,工业上采用氨水除去。将通入氨水中,常温下,若混合溶液中mol/L时,溶液中_____________。在溶液中___________。
Ⅱ、我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 mg/L。处理含镉废水可采用化学沉淀法[已知:,]。回答下列问题:
(5)向某含镉废水中加入,当浓度达到 mol/L时,废水中的浓度为______mol/L,此时是否符合生活饮用水卫生标准?______ (填“是”或“否”)Cd相对原子质量为 122单位。
(6)室温下,反应达到平衡,该反应的平衡常数为__________(保留2位有效数字)。
23.(14分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过
程中的电极反应式为:正极_________, 负极_________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸门上的固体材料R可以采用_________。A铜 B钠 C锌 D石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的_________极。
(4)现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
①若溶液的pH=7,则该溶液中c(NH)_________c(Cl—)。
②若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
③若c(NH)高二化学期末答案
一、单选题(38分)
1-5 ABDDB 6-10 ACCDA 11-15 DBDDA 16-19 ADAC
20、
(1)0.125mol/(L min) 相等 75%
(2) B
(3) 不平衡 上升 CO2(g)+3H2(g)CH3OH(g)+H2O(g)的化学平衡逆向移动,消耗甲醇
(4) 正 CO2++2e-=HCOO-+或CO2+H++2e-=HCOO-
21. CuS+4H2SO4(浓) CuSO4+4SO2↑+4H2O 3NaOH+NaCl+2CuSO4=Cu2 (OH)3Cl↓+2Na2SO4 2SO2+2CaCO3+O2=2CaSO4+2CO2 Cu-e-+2Cl=CuCl 2CuCl+2OH=Cu2O↓+4Cl+H2O
22.(1) 碱
(2)②>④>③>①
(3)
(4) 10
(5) 是
(6)
23. C 负
= > <
高二化学试题
一、单选题(每题2分,共38分)
1.下列生活中常用的方法,其原理与盐类的水解反应有关的是
A.用草木灰去除油污 B.用氢氢化铝中和过多胃酸
C.用食盐腌制腊肉 D.用白醋清洗水壶中的水垢
2.某反应过程中能量变化如下图,则该反应的ΔH值为
A.ΔH>0
B.ΔH<0
C.ΔH=0
D.无法判断
3.下列物质的水溶液在空气中小心加热蒸干至质量不再减少,能得到较纯净的原溶质的是
① ② ③ ④ ⑤ ⑥
A.全部 B.仅①② C.仅①⑤ D.仅①
4.下列根据反应原理设计的应用,不正确的是
A.CO+H2O HCO+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3(胶体)+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)=TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D.SnCl2+H2O Sn(OH)Cl↓+HCl配制氯化亚锡SnCl2溶液时,加入NaOH固体
5.采取下列措施后,溶液颜色变深的是
A.加热明矾溶液(滴有酚酞试液)
B.加热溶液(滴有酚酞试液)
C.氨水(滴有酚酞试液)中加入少量固体
D.小苏打溶液(滴有酚酞试液)中加入少量固体
6.某溶液中可能含有Na+、、Ba2+、、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. Na+ B. C. Ba2+ D.
7.已知: ,不同条件下反应过程能量变化如图所示。下列说法错误的是
A.反应的
B.过程b使用了催化剂
C.过程b中两步反应均为放热反应
D.催化剂可使反应物活化分子百分数增大
8.下列有关实验装置进行的相应实验,能达到实验目的的是:
A.用图1装置用电流计检验电流的方向
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置除去C2H4中少量SO2
9.下列指定反应的离子方程式正确的是
A.Fe粉溶于稀硝酸:Fe+2H+=Fe2++H2↑
B.AlCl3溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓
C.惰性电极电解CuCl2溶液:2Cl +2H2OCl2↑+H2↑+2OH-
D.NaHCO3溶液中加入NaOH溶液:HCO+OH-=CO+H2O
10.下图为番茄电池,下列说法正确的是
A.一段时间后,锌片质量会变小 B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌 D.锌电极是该电池的正极
11.缠有金属丝的铁钉插在含有酚酞的NaCl溶液中,如图所示,可以看到在贴近金属丝的一边的溶液中出现粉红色。则该金属丝可能是
A.镁
B.铝
C.锌
D.铜
12.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是
A.正极的电极反应为O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大其与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
13.有一化学平衡: mA(g)+nB(g)pC(g)+qD(g),如图表示A的转化率同压强、温度的关系,分析图象可以得出的正确结论是
A.正反应是放热反应,m+n>p+q
B.正反应是放热反应,m+n
14.已知几种难溶电解质的溶度积常数Ksp(25℃)见表,下列叙述不正确的是
(注意Ksp 类型不同)
难溶电解质 AgCl AgBr AgI Ag2SO4 Ag2CrO4
Ksp 1.8×10-10 5.4×10-13 8.5×10-17 1.4×10-5 1.12×10-12
A.由溶度积常数可判断在相同条件下一些同类型物质的溶解性大小
B.将浓度均为4×10-3mol·L-1的AgNO3溶液和K2CrO4溶液等体积混合,有Ag2CrO4沉淀产生
C.向AgCl的悬浊液中滴加饱和NaBr溶液可以得到黄色AgBr悬浊液
D.向100mL0.1mol·L-1的Na2SO4溶液中加入1mL0.lmol·L-1的AgNO3溶液,有白色沉淀生成
15.已知,则在的NaOH溶液中的溶解度为
A. B.
C. D.
16.已知,。下列关于难溶物之间转化的说法中错误的是
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于×10-11
17.某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)
+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):
c(Mn2+)为2×10-23:1
D.a点对应的Ksp大于b点对应的Ksp
18.下列实验装置图正确且能达到相应实验目的的是
A.比较铜、铁金属活动性强弱 B.制备含较多NaClO的消毒液 C.铁钥匙上镀铜 D.验证铁的吸氧腐蚀
A.A B.B C.C D.D
19.25℃时,向10mL0.10mol/L的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10mol/LNaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示,理论上刚好反应点和滴定终点都在b点之前,下列说法不正确的是
A.V=10mL时,c(OH-)=c(HA)+c(H+)
B.b点时,c(Na+)>c(A-)>c(OH-)>c(H+)
C.溶液在a点和b点时水的电离程度相同,b点水电离的氢
离子都是自由的。
D.a点时,二
二、非选择题(62分)
20.(20分)我国向国际社会承诺,2023年买现“碳达峰”,2060年实现“碳中和”
已知500℃时,在2L恒容密闭容器中充入2mol 和6mol ,发生反应:, H=-49kJ/mol平衡时体系压强为,测得和的浓度随时间变化如图所示。
(1)0~4min,平均反应速率_______mol/(L min)。
H2和CO2转化率关系_______(相等、不相等),15分钟后平衡,平衡时H2的转化率为_______。
(2)下列能说明该反应已达到平衡状态的是_________。
A.气体的密度不再变化
B.容器内气体的压强不再变化
C.
D.、、和浓度之比为1:3:1:1
该温度下平衡常数________ (用各气体分压代入K的公式,用含的代数式表示,为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)一定比例的和在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点________(填是或不是)处于平衡状态,如果P不是平衡的,继续反应则平衡转化率________。490K之后,甲醇产率下降的原因是________________。
(4)电解法转化可实现的资源化利用,电解制的原理示意图如图所示:装置中Pt片应与电源的______极相连,反应时阴极电极反应式为______________________。
21.(10分)氧氯化铜[Cu2(OH)3Cl]可用作农药,氧化亚铜(Cu2O)可作杀虫剂。
(1)利用工业铜渣(主要成分为Cu、CuS、FeS等)制得氧氯化铜的流程如下:
①“氧化”时,Cu、CuS、FeS都被氧化,其中CuS与浓硫酸在加热条件下反应的化学方程式为___________。
②“转化”过程的化学方程式为___________。
③“氧化”产生的SO2可以用石灰石浆(主要为碳酸钙浑浊物)吸收,同时鼓入空气可以制得石膏(CaSO4)。该反应的化学方程式为___________。
(2)用铜作阳极,电解一定浓度的NaCl和NaOH溶
液可得到氧化亚铜,相关转化如下图所示。
①阳极(转化Ⅰ)的电极反应式为________。
②转化Ⅱ的离子方程式为________。
22.(18分)I、根据表中数据(常温下),完成下列填空。
物质 HCN HClO
电离常数(K)
(1)常温下,NaCN溶液呈________(填“酸”、“碱”或“中”)性,其原因是___________(用离子方程式表示)。
(2)常温下,有浓度均为0.1 mol/L的下列4种溶液:①溶液②NaCN溶液
③溶液④NaClO溶液;这4种溶液pH由大到小的顺序是_______(填序号)。
(3)常温下,向NaClO溶液中通入少量,所发生反应的离子方程式为_________。
(4)常温下,工业上采用氨水除去。将通入氨水中,常温下,若混合溶液中mol/L时,溶液中_____________。在溶液中___________。
Ⅱ、我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 mg/L。处理含镉废水可采用化学沉淀法[已知:,]。回答下列问题:
(5)向某含镉废水中加入,当浓度达到 mol/L时,废水中的浓度为______mol/L,此时是否符合生活饮用水卫生标准?______ (填“是”或“否”)Cd相对原子质量为 122单位。
(6)室温下,反应达到平衡,该反应的平衡常数为__________(保留2位有效数字)。
23.(14分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过
程中的电极反应式为:正极_________, 负极_________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸门上的固体材料R可以采用_________。A铜 B钠 C锌 D石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的_________极。
(4)现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
①若溶液的pH=7,则该溶液中c(NH)_________c(Cl—)。
②若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
③若c(NH)
一、单选题(38分)
1-5 ABDDB 6-10 ACCDA 11-15 DBDDA 16-19 ADAC
20、
(1)0.125mol/(L min) 相等 75%
(2) B
(3) 不平衡 上升 CO2(g)+3H2(g)CH3OH(g)+H2O(g)的化学平衡逆向移动,消耗甲醇
(4) 正 CO2++2e-=HCOO-+或CO2+H++2e-=HCOO-
21. CuS+4H2SO4(浓) CuSO4+4SO2↑+4H2O 3NaOH+NaCl+2CuSO4=Cu2 (OH)3Cl↓+2Na2SO4 2SO2+2CaCO3+O2=2CaSO4+2CO2 Cu-e-+2Cl=CuCl 2CuCl+2OH=Cu2O↓+4Cl+H2O
22.(1) 碱
(2)②>④>③>①
(3)
(4) 10
(5) 是
(6)
23. C 负
= > <
同课章节目录
