江苏省扬州市2023-2024学年高三上学期1月期末检测化学试题(含答案)
文档属性
| 名称 | 江苏省扬州市2023-2024学年高三上学期1月期末检测化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 21:28:17 | ||
图片预览


文档简介
扬州市2023-2024学年高三上学期1月期末检测
化学
2024.01
注意事项:
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6页,包含选择题[第1题~第13题,共39分]、非选择题[第14题~第17题,共61分]两部分。本次考试时间为75分钟,满分100分。考试结束后,请将答题卡交回。
2.答题前,请考生务必将自己的学校、姓名、准考证号用0.5毫米的黑色签字笔写在答题卡上相应的位置,在相应区域贴好条形码。
3.选择题每小题选出答案后,请用2B铅笔在答题卡指定区域填涂,如需改动,用橡皮擦干净后,再填涂其它答案。非选择题请用0.5毫米的黑色签字笔在答题卡指定区域作答。
在试卷或草稿纸上作答一律无效。
4.如有作图需要,可用2B铅笔作答,并请加黑加粗,描写清楚。
选择题(共39分)
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
1.近日,科学家研制出了由石墨烯(结构模型如图所示)材料制成的功能性半导体。这主要是利用了石墨烯的( )
A.导电性 B.导热性 C.高熔点 D.高沸点
2.反应可用于制备。下列说法正确的是( )
A.中子数为37的锌原子: B.中硫元素的化合价:
C.的结构示意图: D.的电子式:
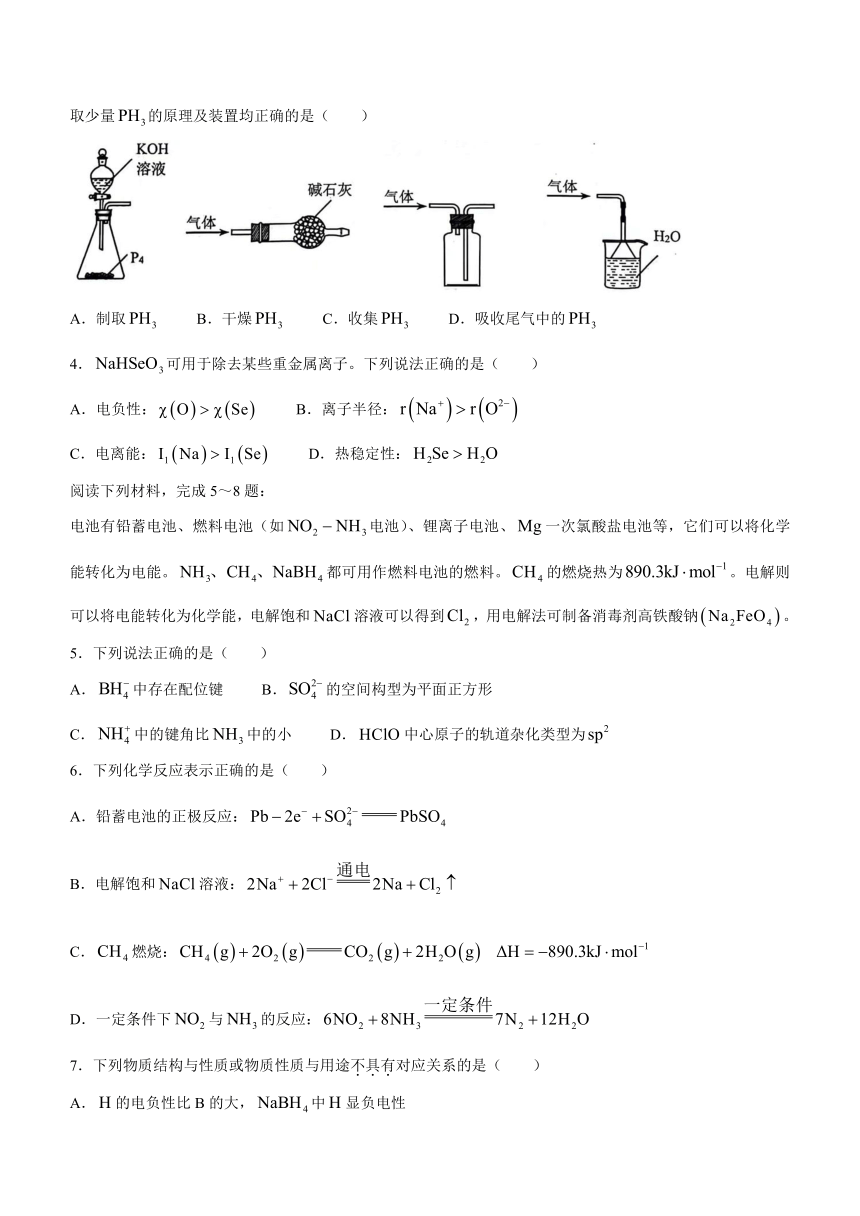
3.气体微溶于水,有强还原性,可由反应制得。实验室制取少量的原理及装置均正确的是( )
A.制取 B.干燥 C.收集 D.吸收尾气中的
4.可用于除去某些重金属离子。下列说法正确的是( )
A.电负性: B.离子半径:
C.电离能: D.热稳定性:
阅读下列材料,完成5~8题:
电池有铅蓄电池、燃料电池(如电池)、锂离子电池、一次氯酸盐电池等,它们可以将化学能转化为电能。都可用作燃料电池的燃料。的燃烧热为。电解则可以将电能转化为化学能,电解饱和溶液可以得到,用电解法可制备消毒剂高铁酸钠。
5.下列说法正确的是( )
A.中存在配位键 B.的空间构型为平面正方形
C.中的键角比中的小 D.中心原子的轨道杂化类型为
6.下列化学反应表示正确的是( )
A.铅蓄电池的正极反应:
B.电解饱和溶液:
C.燃烧:
D.一定条件下与的反应:
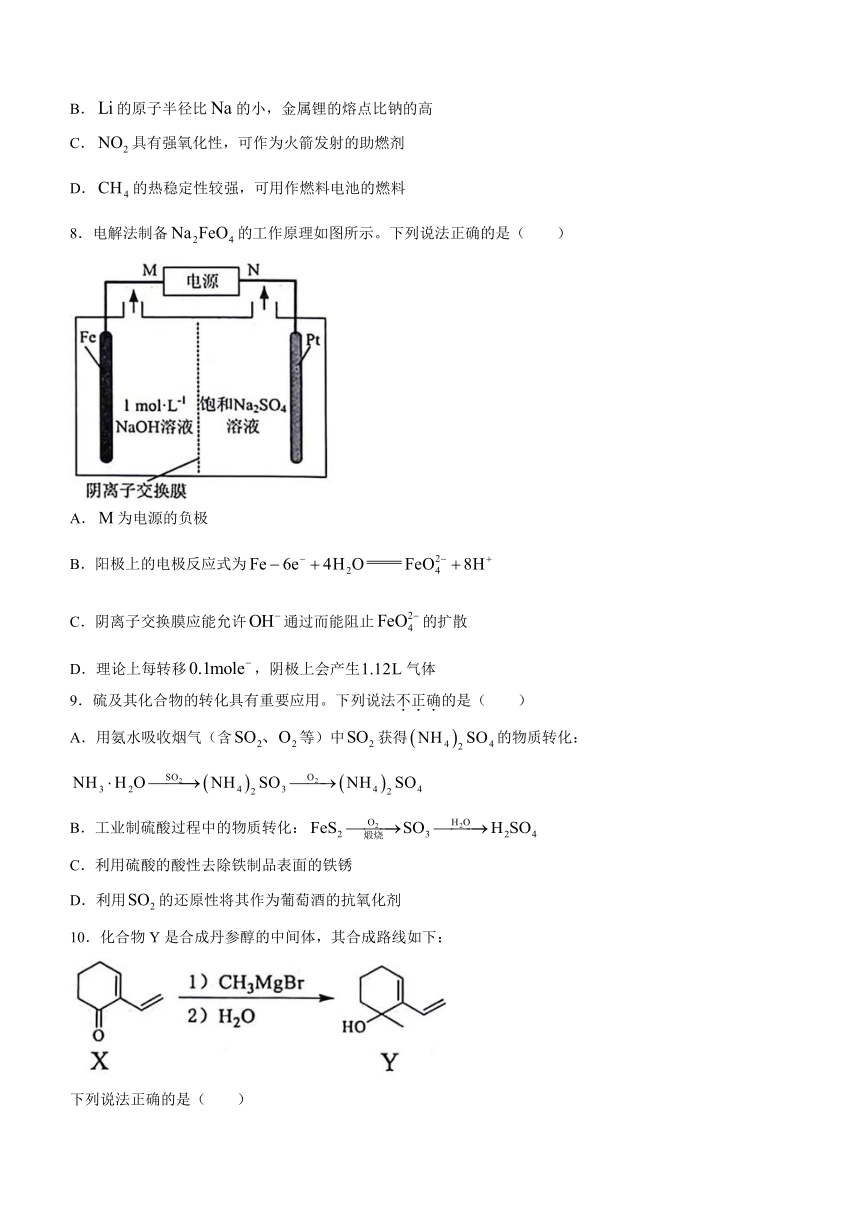
7.下列物质结构与性质或物质性质与用途不具有对应关系的是( )
A.的电负性比B的大,中显负电性
B.的原子半径比的小,金属锂的熔点比钠的高
C.具有强氧化性,可作为火箭发射的助燃剂
D.的热稳定性较强,可用作燃料电池的燃料
8.电解法制备的工作原理如图所示。下列说法正确的是( )
A.为电源的负极
B.阳极上的电极反应式为
C.阴离子交换膜应能允许通过而能阻止的扩散
D.理论上每转移,阴极上会产生气体
9.硫及其化合物的转化具有重要应用。下列说法不正确的是( )
A.用氨水吸收烟气(含等)中获得的物质转化:
B.工业制硫酸过程中的物质转化:
C.利用硫酸的酸性去除铁制品表面的铁锈
D.利用的还原性将其作为葡萄酒的抗氧化剂
10.化合物Y是合成丹参醇的中间体,其合成路线如下:
下列说法正确的是( )
A.X分子中含手性碳原子
B.X转化为的过程中与反应生成
C.与以物质的量发生加成反应时可得3种产物
D.X、Y可用酸性溶液进行鉴别
11.,探究溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 钾元素的焰色试验 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
B 是否有还原性 向溶液中滴加氯水,再滴入溶液,观察是否有白色沉淀产生
C 是否水解 向溶液中滴加2~3滴酚酞试液,观察溶液颜色的变化
D 比较溶液中与的大小 用计测量溶液的
A.A B.B C.C D.D
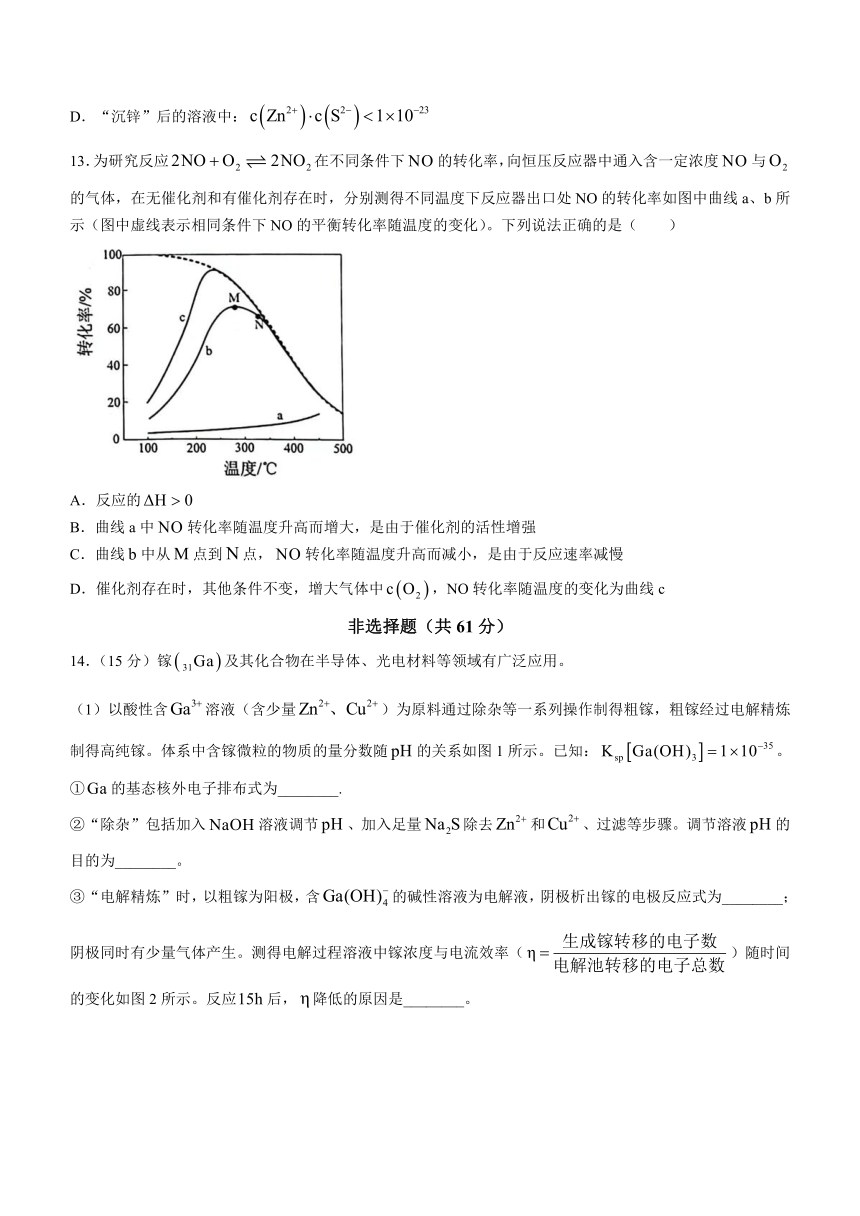
12.从炼钢粉尘(主要含)中回收锌的过程如图所示。“浸取”过程转化为,并有少量铁元素浸出。已知:,。下列说法正确的是( )
A.的溶液中:
B.溶液中:
C.“沉锌”过程中,溶液的减小
D.“沉锌”后的溶液中:
13.为研究反应在不同条件下的转化率,向恒压反应器中通入含一定浓度与的气体,在无催化剂和有催化剂存在时,分别测得不同温度下反应器出口处NO的转化率如图中曲线a、b所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应的
B.曲线a中转化率随温度升高而增大,是由于催化剂的活性增强
C.曲线中从点到点,转化率随温度升高而减小,是由于反应速率减慢
D.催化剂存在时,其他条件不变,增大气体中,NO转化率随温度的变化为曲线c
非选择题(共61分)
14.(15分)镓及其化合物在半导体、光电材料等领域有广泛应用。
(1)以酸性含溶液(含少量)为原料通过除杂等一系列操作制得粗镓,粗镓经过电解精炼制得高纯镓。体系中含镓微粒的物质的量分数随的关系如图1所示。已知:。
①的基态核外电子排布式为________.
②“除杂”包括加入溶液调节、加入足量除去和、过滤等步骤。调节溶液的目的为________。
③“电解精炼”时,以粗镓为阳极,含的碱性溶液为电解液,阴极析出镓的电极反应式为________;阴极同时有少量气体产生。测得电解过程溶液中镓浓度与电流效率()随时间的变化如图2所示。反应后,降低的原因是________。
图1 图2
(2)具有优异的光电性能,可由与发生反应制得。
①制得GaN时生成一种有机物的化学式为________。
②的一种晶胞如图3所示。晶体中距离最近且相等的的数目为________。
图3
③准确称取样品,加入溶液,加热使固体充分溶解,用足量溶液吸收产生的。向吸收液中滴加指示剂,用的盐酸滴定至终点,消耗盐酸。
过程中涉及反应:;,计算样品的纯度(写出计算过程)。
15.(15分)化合物是合成一种激酶抑制剂的中间体,其合成路线如下:
(1)反应涉及的反应物有;a.溶液;b.盐酸;c.浓、浓。
①加入反应物的正确顺序是:c、________、________(填字母)。
②硝化反应的机理可表示为:
反应中浓硫酸的作用是________。
(2)的分子式为,结构简式为________。
(3)已知:,TEA为,能促进该反应的进行。能促进反应进行的原因是________。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式________。
碱性条件水解后酸化生成两种产物,产物之一能与溶液发生显色反应,两种产物的核磁共振氢谱中都有2个峰。
(5)写出以、为原料制备的合成路线流程图(无机试剂和有机溶剂任用)。
16.(15分)深共晶溶剂(DESs)可从中回收锂。
(1)DESs的制备。将乙二醇()与氯化胆碱()按一定比例混合搅拌至形成均一透明液体,制得DESs。
如1
①DESs由含氢键供体(能形成氢键的氢原子)的组分与含氢键受体(能与氢原子形成氢键的原子)的组分混合。乙二醇分子中氢键供体的数目为________。
②不同配比氯化胆碱与乙二醇混合的二元相图如图1所示。相同条件下,氯乙二醇的熔点________乙二醇的熔点(填“>”“二”或“<”)。制备熔点达到最低值的DESs时,氯化胆碱与乙二醇的物质的量之比为________。
(2)氧化浸出锂。将与按照一定比例混合,再通入。实验装置如图所示。
①冷凝管的作用为________。
图2 图3
②主要反应机理如图3所示:
Ⅰ中碳原子轨道杂化类型的变化为________;M的化学式为________。
(3)碳酸锂的制备。
已知:,完全沉淀时离子浓度小于;易溶于水;的溶解度:为为为。补充完整由粗溶液(含少量)制备的实验方案:向粗溶液中________,得到固体。
(须使用的试剂:溶液、溶液)
(16分)水合肼在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
(1)分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示分子交互式的是________(填序号)。
(2)肼分解制氢的主要反应为,肼的理论储氢密度。测得肼实际分解时产生的气体中含,肼实际储氢密度小于理论值的原因是________(用化学方程式表示)。
(3)水合肼制氢过程中涉及肼在催化剂表面分解,如图1所示。
图1
①X的结构简式为________。
②催化剂表面存在和两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于________(填“”或“”)活性位点。已知:键、键的键能分别是。肼在该催化剂表面反应断裂的化学键不是键,而是键,原因是________。
③催化剂存在下,不同浓度的分解时,测得随时间的变化如图2所示。当浓度从增加到时,反应速率加快;从增加到时,反应速率几乎不变。其原因是________。
图2
扬州市2023-2024学年高三上学期1月期末检测
化学参考答案与评分建议
单项选择题(本题包括13小题,每题3分,共39分。每小题只有一个选项符合题意)
1.A 2.B 3.B 4.A 5.A 6.D 7.D 8. C 9.B 10.C
11.D 12.B 13.C
非选择题(包括4小题,共61分)
14.(15分)
(1)①[Ar]3d104s24p1(2分)
②避免Na2S在强酸性条件下产生有毒气体H2S[或产生H2S使溶液中c(S2 )减小] (2分)
③Ga(OH)+3e-=Ga+4OH-(2分)
溶液中Ga(OH)浓度增大使电流效率趋向于增大;阴极发生产生H2的反应时溶液中c(H+)增大,电流效率趋向于减小。15 h后,后者为影响电流效率的主要因素。(3分)
(2)①CH4(2分) ②4(2分)
③根据电子守恒和元素守恒可建立反应关系如下
GaN ~ NH3 ~ NH3·H3BO3 ~ HCl
n(GaN) = n(HCl) = 0.1000 mol·L-1×23.80 ×10-3L =2.380×10-4 mol(1分)
GaN样品的纯度= ×100% = 99.96%(1分)
15.(15分)
(1)①a、b (2分)
②促进NO的生成、吸收生成水(提供H+、避免HNO3浓度降低、促使平衡正向移动生成更多NO)(2分)
(2)(2分)
(3)(C2H5)3N具有孤电子对,能结合H+,使平衡正向移动(或(C2H5)3N具有碱性,能消耗HBr,使平衡正向移动)(2分)
(4) (2分)
(5)(5分)
16.(15分)
(1)①2(2分) ②>(1分) 1∶4(2分)
(2)①冷凝回流乙二醇 (2分)
② sp3→sp2 (2分) FeHPO4 (2分,答LinH(1-n)FePO4、HFePO4也可得分)
(3)滴加0.1 mol·L-1NaOH溶液至溶液的pH为3(1分),过滤(1分),向滤液中加入0.1 mol·L-1Na2CO3
溶液至不再产生沉淀(1分),过滤,用热水洗涤沉淀2到3次(1分),干燥(共4分)
(若析出Li2CO3晶体采用蒸发结晶、趁热过滤的方法也可得分)
17.(16分)
(1)A(2分)
(2)3N2H4N2+4NH3或N2H4+H22NH3 (3分)(正确写出一个即可得分,答N2+3H22NH3不得分)
(3)①HN=NH (3分)
②Pt (2分)
N-N为非极性键,N-H键极性较强。N、H分别与催化剂表面原子形成作用力,削弱了N与H之间的作用力。(3分)
③0.1mol·L 1时,催化剂表面仅部分活性位点吸附了N2H4·H2O;浓度增大至0.5mol·L 1时,有更多活性位点吸附N2H4·H2O;浓度达0.5mol·L 1时,催化剂表面的活性位点几乎全部吸附了N2H4·H2O。(3分)
化学
2024.01
注意事项:
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6页,包含选择题[第1题~第13题,共39分]、非选择题[第14题~第17题,共61分]两部分。本次考试时间为75分钟,满分100分。考试结束后,请将答题卡交回。
2.答题前,请考生务必将自己的学校、姓名、准考证号用0.5毫米的黑色签字笔写在答题卡上相应的位置,在相应区域贴好条形码。
3.选择题每小题选出答案后,请用2B铅笔在答题卡指定区域填涂,如需改动,用橡皮擦干净后,再填涂其它答案。非选择题请用0.5毫米的黑色签字笔在答题卡指定区域作答。
在试卷或草稿纸上作答一律无效。
4.如有作图需要,可用2B铅笔作答,并请加黑加粗,描写清楚。
选择题(共39分)
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
1.近日,科学家研制出了由石墨烯(结构模型如图所示)材料制成的功能性半导体。这主要是利用了石墨烯的( )
A.导电性 B.导热性 C.高熔点 D.高沸点
2.反应可用于制备。下列说法正确的是( )
A.中子数为37的锌原子: B.中硫元素的化合价:
C.的结构示意图: D.的电子式:
3.气体微溶于水,有强还原性,可由反应制得。实验室制取少量的原理及装置均正确的是( )
A.制取 B.干燥 C.收集 D.吸收尾气中的
4.可用于除去某些重金属离子。下列说法正确的是( )
A.电负性: B.离子半径:
C.电离能: D.热稳定性:
阅读下列材料,完成5~8题:
电池有铅蓄电池、燃料电池(如电池)、锂离子电池、一次氯酸盐电池等,它们可以将化学能转化为电能。都可用作燃料电池的燃料。的燃烧热为。电解则可以将电能转化为化学能,电解饱和溶液可以得到,用电解法可制备消毒剂高铁酸钠。
5.下列说法正确的是( )
A.中存在配位键 B.的空间构型为平面正方形
C.中的键角比中的小 D.中心原子的轨道杂化类型为
6.下列化学反应表示正确的是( )
A.铅蓄电池的正极反应:
B.电解饱和溶液:
C.燃烧:
D.一定条件下与的反应:
7.下列物质结构与性质或物质性质与用途不具有对应关系的是( )
A.的电负性比B的大,中显负电性
B.的原子半径比的小,金属锂的熔点比钠的高
C.具有强氧化性,可作为火箭发射的助燃剂
D.的热稳定性较强,可用作燃料电池的燃料
8.电解法制备的工作原理如图所示。下列说法正确的是( )
A.为电源的负极
B.阳极上的电极反应式为
C.阴离子交换膜应能允许通过而能阻止的扩散
D.理论上每转移,阴极上会产生气体
9.硫及其化合物的转化具有重要应用。下列说法不正确的是( )
A.用氨水吸收烟气(含等)中获得的物质转化:
B.工业制硫酸过程中的物质转化:
C.利用硫酸的酸性去除铁制品表面的铁锈
D.利用的还原性将其作为葡萄酒的抗氧化剂
10.化合物Y是合成丹参醇的中间体,其合成路线如下:
下列说法正确的是( )
A.X分子中含手性碳原子
B.X转化为的过程中与反应生成
C.与以物质的量发生加成反应时可得3种产物
D.X、Y可用酸性溶液进行鉴别
11.,探究溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 钾元素的焰色试验 用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
B 是否有还原性 向溶液中滴加氯水,再滴入溶液,观察是否有白色沉淀产生
C 是否水解 向溶液中滴加2~3滴酚酞试液,观察溶液颜色的变化
D 比较溶液中与的大小 用计测量溶液的
A.A B.B C.C D.D
12.从炼钢粉尘(主要含)中回收锌的过程如图所示。“浸取”过程转化为,并有少量铁元素浸出。已知:,。下列说法正确的是( )
A.的溶液中:
B.溶液中:
C.“沉锌”过程中,溶液的减小
D.“沉锌”后的溶液中:
13.为研究反应在不同条件下的转化率,向恒压反应器中通入含一定浓度与的气体,在无催化剂和有催化剂存在时,分别测得不同温度下反应器出口处NO的转化率如图中曲线a、b所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应的
B.曲线a中转化率随温度升高而增大,是由于催化剂的活性增强
C.曲线中从点到点,转化率随温度升高而减小,是由于反应速率减慢
D.催化剂存在时,其他条件不变,增大气体中,NO转化率随温度的变化为曲线c
非选择题(共61分)
14.(15分)镓及其化合物在半导体、光电材料等领域有广泛应用。
(1)以酸性含溶液(含少量)为原料通过除杂等一系列操作制得粗镓,粗镓经过电解精炼制得高纯镓。体系中含镓微粒的物质的量分数随的关系如图1所示。已知:。
①的基态核外电子排布式为________.
②“除杂”包括加入溶液调节、加入足量除去和、过滤等步骤。调节溶液的目的为________。
③“电解精炼”时,以粗镓为阳极,含的碱性溶液为电解液,阴极析出镓的电极反应式为________;阴极同时有少量气体产生。测得电解过程溶液中镓浓度与电流效率()随时间的变化如图2所示。反应后,降低的原因是________。
图1 图2
(2)具有优异的光电性能,可由与发生反应制得。
①制得GaN时生成一种有机物的化学式为________。
②的一种晶胞如图3所示。晶体中距离最近且相等的的数目为________。
图3
③准确称取样品,加入溶液,加热使固体充分溶解,用足量溶液吸收产生的。向吸收液中滴加指示剂,用的盐酸滴定至终点,消耗盐酸。
过程中涉及反应:;,计算样品的纯度(写出计算过程)。
15.(15分)化合物是合成一种激酶抑制剂的中间体,其合成路线如下:
(1)反应涉及的反应物有;a.溶液;b.盐酸;c.浓、浓。
①加入反应物的正确顺序是:c、________、________(填字母)。
②硝化反应的机理可表示为:
反应中浓硫酸的作用是________。
(2)的分子式为,结构简式为________。
(3)已知:,TEA为,能促进该反应的进行。能促进反应进行的原因是________。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式________。
碱性条件水解后酸化生成两种产物,产物之一能与溶液发生显色反应,两种产物的核磁共振氢谱中都有2个峰。
(5)写出以、为原料制备的合成路线流程图(无机试剂和有机溶剂任用)。
16.(15分)深共晶溶剂(DESs)可从中回收锂。
(1)DESs的制备。将乙二醇()与氯化胆碱()按一定比例混合搅拌至形成均一透明液体,制得DESs。
如1
①DESs由含氢键供体(能形成氢键的氢原子)的组分与含氢键受体(能与氢原子形成氢键的原子)的组分混合。乙二醇分子中氢键供体的数目为________。
②不同配比氯化胆碱与乙二醇混合的二元相图如图1所示。相同条件下,氯乙二醇的熔点________乙二醇的熔点(填“>”“二”或“<”)。制备熔点达到最低值的DESs时,氯化胆碱与乙二醇的物质的量之比为________。
(2)氧化浸出锂。将与按照一定比例混合,再通入。实验装置如图所示。
①冷凝管的作用为________。
图2 图3
②主要反应机理如图3所示:
Ⅰ中碳原子轨道杂化类型的变化为________;M的化学式为________。
(3)碳酸锂的制备。
已知:,完全沉淀时离子浓度小于;易溶于水;的溶解度:为为为。补充完整由粗溶液(含少量)制备的实验方案:向粗溶液中________,得到固体。
(须使用的试剂:溶液、溶液)
(16分)水合肼在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
(1)分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示分子交互式的是________(填序号)。
(2)肼分解制氢的主要反应为,肼的理论储氢密度。测得肼实际分解时产生的气体中含,肼实际储氢密度小于理论值的原因是________(用化学方程式表示)。
(3)水合肼制氢过程中涉及肼在催化剂表面分解,如图1所示。
图1
①X的结构简式为________。
②催化剂表面存在和两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于________(填“”或“”)活性位点。已知:键、键的键能分别是。肼在该催化剂表面反应断裂的化学键不是键,而是键,原因是________。
③催化剂存在下,不同浓度的分解时,测得随时间的变化如图2所示。当浓度从增加到时,反应速率加快;从增加到时,反应速率几乎不变。其原因是________。
图2
扬州市2023-2024学年高三上学期1月期末检测
化学参考答案与评分建议
单项选择题(本题包括13小题,每题3分,共39分。每小题只有一个选项符合题意)
1.A 2.B 3.B 4.A 5.A 6.D 7.D 8. C 9.B 10.C
11.D 12.B 13.C
非选择题(包括4小题,共61分)
14.(15分)
(1)①[Ar]3d104s24p1(2分)
②避免Na2S在强酸性条件下产生有毒气体H2S[或产生H2S使溶液中c(S2 )减小] (2分)
③Ga(OH)+3e-=Ga+4OH-(2分)
溶液中Ga(OH)浓度增大使电流效率趋向于增大;阴极发生产生H2的反应时溶液中c(H+)增大,电流效率趋向于减小。15 h后,后者为影响电流效率的主要因素。(3分)
(2)①CH4(2分) ②4(2分)
③根据电子守恒和元素守恒可建立反应关系如下
GaN ~ NH3 ~ NH3·H3BO3 ~ HCl
n(GaN) = n(HCl) = 0.1000 mol·L-1×23.80 ×10-3L =2.380×10-4 mol(1分)
GaN样品的纯度= ×100% = 99.96%(1分)
15.(15分)
(1)①a、b (2分)
②促进NO的生成、吸收生成水(提供H+、避免HNO3浓度降低、促使平衡正向移动生成更多NO)(2分)
(2)(2分)
(3)(C2H5)3N具有孤电子对,能结合H+,使平衡正向移动(或(C2H5)3N具有碱性,能消耗HBr,使平衡正向移动)(2分)
(4) (2分)
(5)(5分)
16.(15分)
(1)①2(2分) ②>(1分) 1∶4(2分)
(2)①冷凝回流乙二醇 (2分)
② sp3→sp2 (2分) FeHPO4 (2分,答LinH(1-n)FePO4、HFePO4也可得分)
(3)滴加0.1 mol·L-1NaOH溶液至溶液的pH为3(1分),过滤(1分),向滤液中加入0.1 mol·L-1Na2CO3
溶液至不再产生沉淀(1分),过滤,用热水洗涤沉淀2到3次(1分),干燥(共4分)
(若析出Li2CO3晶体采用蒸发结晶、趁热过滤的方法也可得分)
17.(16分)
(1)A(2分)
(2)3N2H4N2+4NH3或N2H4+H22NH3 (3分)(正确写出一个即可得分,答N2+3H22NH3不得分)
(3)①HN=NH (3分)
②Pt (2分)
N-N为非极性键,N-H键极性较强。N、H分别与催化剂表面原子形成作用力,削弱了N与H之间的作用力。(3分)
③0.1mol·L 1时,催化剂表面仅部分活性位点吸附了N2H4·H2O;浓度增大至0.5mol·L 1时,有更多活性位点吸附N2H4·H2O;浓度达0.5mol·L 1时,催化剂表面的活性位点几乎全部吸附了N2H4·H2O。(3分)
同课章节目录
