广东省茂名市电白区2023-2024学年高二上学期期末质量监测化学试题(含答案)
文档属性
| 名称 | 广东省茂名市电白区2023-2024学年高二上学期期末质量监测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 999.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 21:59:34 | ||
图片预览


文档简介
电白区2023-2024学年高二上学期期末质量监测
化学
说明:
(1)请用黑色钢笔或签字笔将答案写在答题卡上,考试结束时只交答题卡.
(2)全卷满分100分,考试时间75分钟
(3)可能用到的相对原子质量:
H-1,C-12,N-14,O-16,Na-23,C1-35.5
一、选择题:本题共16小题,共44分.第1~10小题,每小题2分;第11~16小题,每题4分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列各电子层中不包含p原子轨道的是( )
A.K B.L C.M D.N
2.下列设备工作时,把化学能转化为电能的是( )
A B C D
砷化镓太阳能电池 燃气灶 风力发电机 燃料电池
A.A B.B C.C D.D
3.元素性质呈现周期性变化的根本原因是( )
A.元素的电负性呈周期性变化
B.元素的第一电离能呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性、非金属性呈周期性变化
4.下列关于电子云和电子云的叙述正确的是( )
A.都是圆形 B.都是球形 C.都是哑铃形 D.大小相同
5.下列说法正确的是( )
A.焰色试验是化学变化
B.自然界的所有原子都是基态
C.在一定条件下,碳原子的电子排布式可能是
D.电子从基态跃迁到激发态放出能量,产生发射光谱
下列表达方式正确的是( )
A.的价电子排布式:
B.键电子云轮廓图
C.基态碳原子的价电子的轨道表示式为
D.的电子式:
7.水的电离过程为,在不同温度下其离子积常数不同,.则下列关于纯水的叙述不正确的是( )
A.随着温度升高而升高
B.在时,
C.时水的电离程度小于时水的电离程度
D.水的电离是吸热的
8.下列方程式与所给事实不相符的是( )
A.用硫化钠溶液除去废水中的
B.酚酞滴入醋酸钠溶液中变为浅红色:
C.用饱和溶液处理锅炉水垢中的
D.用明矾作净水剂:
9.下列各组物质中,都是由极性键构成的极性分子的是( )
A.和 B.和 C.和 D.和
10.第三周期主族元素(或物质)某一性质随原子序数的递变规律如图所示,该性质可以为( )
A.原子半径 B.元素的第一电离能 C.单质的熔点 D.元素的电负性
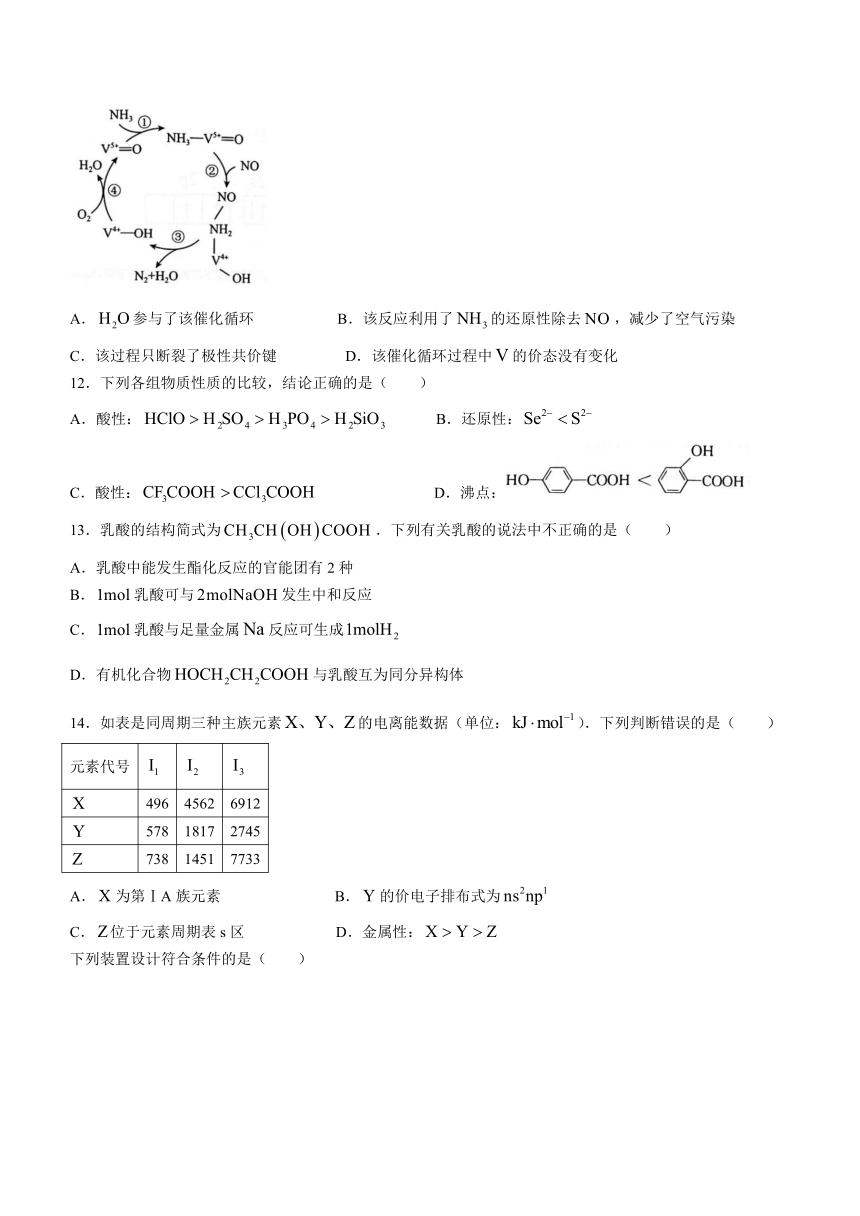
11.据文献报道,钒催化某反应的反应机理如图所示,下列叙述正确的是( )
A.参与了该催化循环 B.该反应利用了的还原性除去,减少了空气污染
C.该过程只断裂了极性共价键 D.该催化循环过程中的价态没有变化
12.下列各组物质性质的比较,结论正确的是( )
A.酸性: B.还原性:
C.酸性: D.沸点:
13.乳酸的结构简式为.下列有关乳酸的说法中不正确的是( )
A.乳酸中能发生酯化反应的官能团有2种
B.乳酸可与发生中和反应
C.乳酸与足量金属反应可生成
D.有机化合物与乳酸互为同分异构体
14.如表是同周期三种主族元素的电离能数据(单位:).下列判断错误的是( )
元素代号
496 4562 6912
578 1817 2745
738 1451 7733
A.为第ⅠA族元素 B.的价电子排布式为
C.位于元素周期表s区 D.金属性:
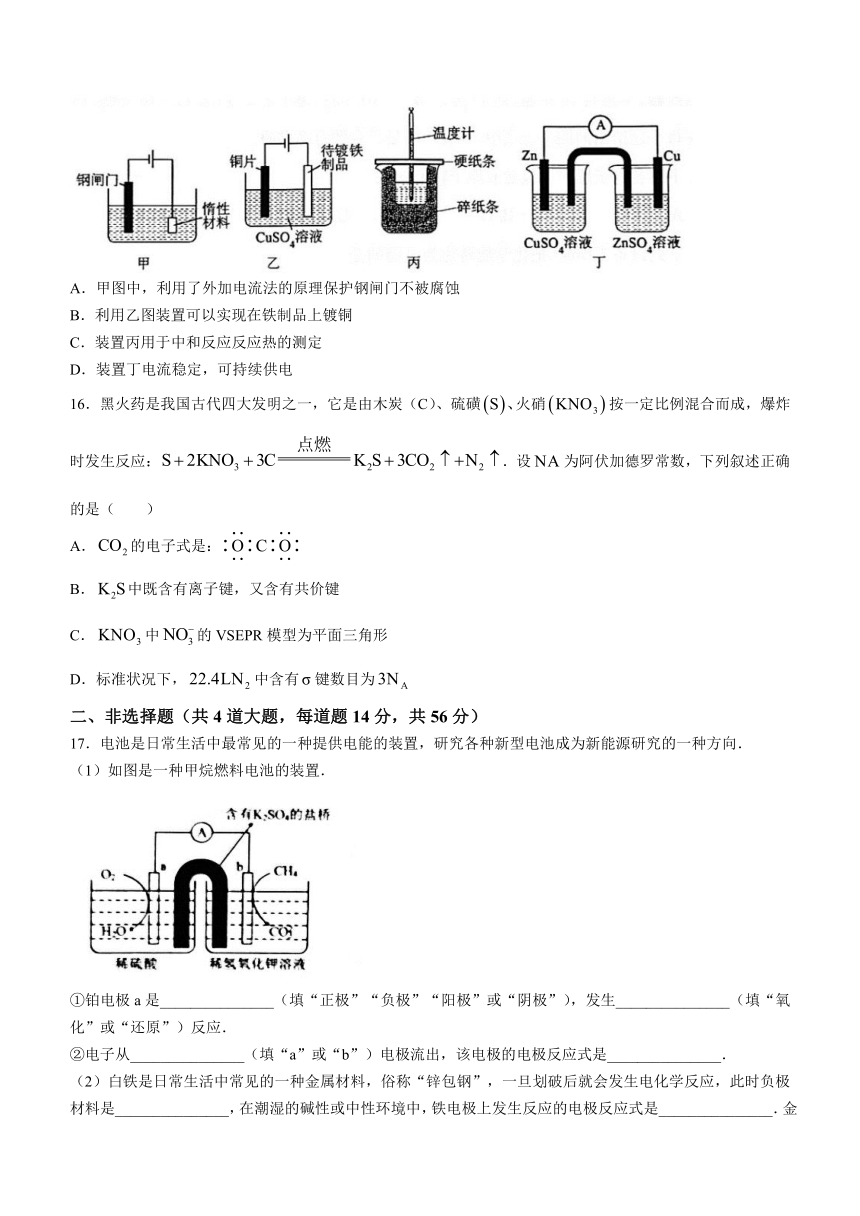
下列装置设计符合条件的是( )
A.甲图中,利用了外加电流法的原理保护钢闸门不被腐蚀
B.利用乙图装置可以实现在铁制品上镀铜
C.装置丙用于中和反应反应热的测定
D.装置丁电流稳定,可持续供电
16.黑火药是我国古代四大发明之一,它是由木炭(C)、硫磺火硝按一定比例混合而成,爆炸时发生反应:.设为阿伏加德罗常数,下列叙述正确的是( )
A.的电子式是:
B.中既含有离子键,又含有共价键
C.中的VSEPR模型为平面三角形
D.标准状况下,中含有键数目为
二、非选择题(共4道大题,每道题14分,共56分)
17.电池是日常生活中最常见的一种提供电能的装置,研究各种新型电池成为新能源研究的一种方向.
(1)如图是一种甲烷燃料电池的装置.
①铂电极a是_______________(填“正极”“负极”“阳极”或“阴极”),发生_______________(填“氧化”或“还原”)反应.
②电子从_______________(填“a”或“b”)电极流出,该电极的电极反应式是_______________.
(2)白铁是日常生活中常见的一种金属材料,俗称“锌包钢”,一旦划破后就会发生电化学反应,此时负极材料是_______________,在潮湿的碱性或中性环境中,铁电极上发生反应的电极反应式是_______________.金属铁被保护而不易腐蚀,这种防腐的方法叫_______________(填名称).
(3)用下图所示装置研究铁的防腐蚀过程:
①只关闭一个,则铁腐蚀的速度最块的是只闭合_______________(填“”、“”或“”);石墨电极的电极反应式_______________.
②为减缓铁的腐蚀,应只闭合_______________(填“”“”或“”),该防护法称为_______________.
18.下列表格是元素周期表的一部分,请按要求填空.
(1)写出①⑤⑦的原子半径由大到小的顺序为_______________.(用元素符号表示)
(2)写出由①和⑥形成的化合物的电子式_______________.
(3)元素 基态原子的核外电子排布式为_______________.
(4)写出⑥⑧的最高价氧化物的水化物发生反应的化学方程式_______________.
(5)写出元素②基态原子的核外电子占据的能量最高的原子轨道的形状为_______________,该基态原子的价层电子轨道表示式为_______________.
(6)元素④的气态氢化物的分子的空间结构为_______________.
19.在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等.实验室中可用和混合溶液吸收的方法制取,现利用如下装置及试剂制备晶体:
已知:①饱和溶液在温度低于时析出的晶体是,高于时析出的晶体是,高于时分解成和.
②气体浓度较大时易发生爆炸.
(1)装置A中生成的化学方程式为_______________.
(2)仪器中需稍微过量,原因是_______________.
(3)装置B的作用_______________.
(4)关于装置C及后续操作的下列说法中,错误的是_______________.
A.装置C中作氧化剂
B.为获得晶体,可将试管中的溶液在蒸发浓缩结晶并趁热过滤
C.用左右温水洗涤所得晶体
(5)实验过程中,常需要打开,鼓入一定量空气.该操作的目的是_______________.
(6)和可形成另一种化合物,中心原子为的中心原子杂化类型为_______________;
(7)纯度的测定:用“间接碘 法”测定样品(杂质与不发生反应)的纯度,过程如下:取样品配制成溶液,从中取出;加入足量固体和适量稀,再滴加几滴淀粉溶液(已知:),然后用标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为(已知:).样品中的纯度为_______________(用含的代数式表示).
20.水是清洁、可持续的氢能来源.利用太阳能从水中获取氢气符合可持续发展的理念.
(1)“太阳能直接热分解水制氢”通过集中阳光产生以上高温,促使分解为和;若温度进一步升高至与会分解为气态原子.
在相同条件下,同时存在如下两个过程:
ⅰ. ⅱ.
比较两个过程放出热题的相对大小(从选项中选择):_______________.
A.ⅰ>ⅱ B.ⅰ=ⅱ C.ⅰ<ⅱ
(2)“太阳能光催化分解水制氢”原理可以表示为:.
①能说明氯的非金属性比硫强的事实是_______________.
A.溶解性: B.氧化性:
C.热稳定性: D.酸性:
②与结构相似,但的沸点高于,原因是_______________.
③反应开始一段时间后,取出一定是溶液,写出检验溶液中的操作方法:_______________.
(3)“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生.如常见的铁氧化物循环制氢过程如图所示.
①写出反应Ⅰ的化学方程式:_______________.
②科学家想要用组成相似的钴氧化物代替铁氧化物进行循环制氢.查阅资料发现,使用钴氧化物后反应Ⅰ和反应Ⅱ的值随温度变化如图所示.
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由_______________.
(4)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:_______________(简述即可,不必展开).
电白区2023-2024学年高二上学期期末质量监测
化学参考答案
序号 1 2 3 4 5 6 7 8
答案 A D C B C C B C
序号 9 10 11 12 13 14 15 16
答案 A D B C B D A C
17.(共14分)
(1)①正极 (1分) ,还原(1分) ② b (1分), (2分) (2)Zn (1分), (2分), 牺牲阳极法(1分)
(3)① K1 (1分),2H2O+2e-=H2↑+2OH- (2分) ② K2 (1分),外加电流法 (1分)
18.(共14分,每空2分)
(1)r(Mg) > r(N)> r(O)
(2)
(3)1s22s22p63s23p63d64s2或 [Ar]3d64s2
(4)Al(OH)3 + NaOH = NaAlO2+ 2H2O
(5)哑铃形
(6)三角锥形
19.(共14分,每空2分)
(1) 2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
(2)防止过量的Na2SO3与硫酸发生反应生成SO2混入到ClO2中,导致后续生成杂质(合理即可得分)
(3)防倒吸 (4)AD (5)防止ClO2气体浓度过大导致爆炸 (6) sp3 (7)
20.(共14分,每空2分)
(1)A (2) ① C ②分子间能形成氢键
③取少量待测溶液与试管中,先滴加稀盐酸,无现象,再滴加BaCl2溶液,产生白色沉淀,说明溶液中含有
(3)①
②由图可知,找不到在哪一温度下,反应I和反应II都能自发进行,故不能用钴氧化物代替铁氧化物进行热化学循环制氢
(4)可以将太阳能先转化为电能,再利用电解水的方法制得H2
化学
说明:
(1)请用黑色钢笔或签字笔将答案写在答题卡上,考试结束时只交答题卡.
(2)全卷满分100分,考试时间75分钟
(3)可能用到的相对原子质量:
H-1,C-12,N-14,O-16,Na-23,C1-35.5
一、选择题:本题共16小题,共44分.第1~10小题,每小题2分;第11~16小题,每题4分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列各电子层中不包含p原子轨道的是( )
A.K B.L C.M D.N
2.下列设备工作时,把化学能转化为电能的是( )
A B C D
砷化镓太阳能电池 燃气灶 风力发电机 燃料电池
A.A B.B C.C D.D
3.元素性质呈现周期性变化的根本原因是( )
A.元素的电负性呈周期性变化
B.元素的第一电离能呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性、非金属性呈周期性变化
4.下列关于电子云和电子云的叙述正确的是( )
A.都是圆形 B.都是球形 C.都是哑铃形 D.大小相同
5.下列说法正确的是( )
A.焰色试验是化学变化
B.自然界的所有原子都是基态
C.在一定条件下,碳原子的电子排布式可能是
D.电子从基态跃迁到激发态放出能量,产生发射光谱
下列表达方式正确的是( )
A.的价电子排布式:
B.键电子云轮廓图
C.基态碳原子的价电子的轨道表示式为
D.的电子式:
7.水的电离过程为,在不同温度下其离子积常数不同,.则下列关于纯水的叙述不正确的是( )
A.随着温度升高而升高
B.在时,
C.时水的电离程度小于时水的电离程度
D.水的电离是吸热的
8.下列方程式与所给事实不相符的是( )
A.用硫化钠溶液除去废水中的
B.酚酞滴入醋酸钠溶液中变为浅红色:
C.用饱和溶液处理锅炉水垢中的
D.用明矾作净水剂:
9.下列各组物质中,都是由极性键构成的极性分子的是( )
A.和 B.和 C.和 D.和
10.第三周期主族元素(或物质)某一性质随原子序数的递变规律如图所示,该性质可以为( )
A.原子半径 B.元素的第一电离能 C.单质的熔点 D.元素的电负性
11.据文献报道,钒催化某反应的反应机理如图所示,下列叙述正确的是( )
A.参与了该催化循环 B.该反应利用了的还原性除去,减少了空气污染
C.该过程只断裂了极性共价键 D.该催化循环过程中的价态没有变化
12.下列各组物质性质的比较,结论正确的是( )
A.酸性: B.还原性:
C.酸性: D.沸点:
13.乳酸的结构简式为.下列有关乳酸的说法中不正确的是( )
A.乳酸中能发生酯化反应的官能团有2种
B.乳酸可与发生中和反应
C.乳酸与足量金属反应可生成
D.有机化合物与乳酸互为同分异构体
14.如表是同周期三种主族元素的电离能数据(单位:).下列判断错误的是( )
元素代号
496 4562 6912
578 1817 2745
738 1451 7733
A.为第ⅠA族元素 B.的价电子排布式为
C.位于元素周期表s区 D.金属性:
下列装置设计符合条件的是( )
A.甲图中,利用了外加电流法的原理保护钢闸门不被腐蚀
B.利用乙图装置可以实现在铁制品上镀铜
C.装置丙用于中和反应反应热的测定
D.装置丁电流稳定,可持续供电
16.黑火药是我国古代四大发明之一,它是由木炭(C)、硫磺火硝按一定比例混合而成,爆炸时发生反应:.设为阿伏加德罗常数,下列叙述正确的是( )
A.的电子式是:
B.中既含有离子键,又含有共价键
C.中的VSEPR模型为平面三角形
D.标准状况下,中含有键数目为
二、非选择题(共4道大题,每道题14分,共56分)
17.电池是日常生活中最常见的一种提供电能的装置,研究各种新型电池成为新能源研究的一种方向.
(1)如图是一种甲烷燃料电池的装置.
①铂电极a是_______________(填“正极”“负极”“阳极”或“阴极”),发生_______________(填“氧化”或“还原”)反应.
②电子从_______________(填“a”或“b”)电极流出,该电极的电极反应式是_______________.
(2)白铁是日常生活中常见的一种金属材料,俗称“锌包钢”,一旦划破后就会发生电化学反应,此时负极材料是_______________,在潮湿的碱性或中性环境中,铁电极上发生反应的电极反应式是_______________.金属铁被保护而不易腐蚀,这种防腐的方法叫_______________(填名称).
(3)用下图所示装置研究铁的防腐蚀过程:
①只关闭一个,则铁腐蚀的速度最块的是只闭合_______________(填“”、“”或“”);石墨电极的电极反应式_______________.
②为减缓铁的腐蚀,应只闭合_______________(填“”“”或“”),该防护法称为_______________.
18.下列表格是元素周期表的一部分,请按要求填空.
(1)写出①⑤⑦的原子半径由大到小的顺序为_______________.(用元素符号表示)
(2)写出由①和⑥形成的化合物的电子式_______________.
(3)元素 基态原子的核外电子排布式为_______________.
(4)写出⑥⑧的最高价氧化物的水化物发生反应的化学方程式_______________.
(5)写出元素②基态原子的核外电子占据的能量最高的原子轨道的形状为_______________,该基态原子的价层电子轨道表示式为_______________.
(6)元素④的气态氢化物的分子的空间结构为_______________.
19.在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等.实验室中可用和混合溶液吸收的方法制取,现利用如下装置及试剂制备晶体:
已知:①饱和溶液在温度低于时析出的晶体是,高于时析出的晶体是,高于时分解成和.
②气体浓度较大时易发生爆炸.
(1)装置A中生成的化学方程式为_______________.
(2)仪器中需稍微过量,原因是_______________.
(3)装置B的作用_______________.
(4)关于装置C及后续操作的下列说法中,错误的是_______________.
A.装置C中作氧化剂
B.为获得晶体,可将试管中的溶液在蒸发浓缩结晶并趁热过滤
C.用左右温水洗涤所得晶体
(5)实验过程中,常需要打开,鼓入一定量空气.该操作的目的是_______________.
(6)和可形成另一种化合物,中心原子为的中心原子杂化类型为_______________;
(7)纯度的测定:用“间接碘 法”测定样品(杂质与不发生反应)的纯度,过程如下:取样品配制成溶液,从中取出;加入足量固体和适量稀,再滴加几滴淀粉溶液(已知:),然后用标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为(已知:).样品中的纯度为_______________(用含的代数式表示).
20.水是清洁、可持续的氢能来源.利用太阳能从水中获取氢气符合可持续发展的理念.
(1)“太阳能直接热分解水制氢”通过集中阳光产生以上高温,促使分解为和;若温度进一步升高至与会分解为气态原子.
在相同条件下,同时存在如下两个过程:
ⅰ. ⅱ.
比较两个过程放出热题的相对大小(从选项中选择):_______________.
A.ⅰ>ⅱ B.ⅰ=ⅱ C.ⅰ<ⅱ
(2)“太阳能光催化分解水制氢”原理可以表示为:.
①能说明氯的非金属性比硫强的事实是_______________.
A.溶解性: B.氧化性:
C.热稳定性: D.酸性:
②与结构相似,但的沸点高于,原因是_______________.
③反应开始一段时间后,取出一定是溶液,写出检验溶液中的操作方法:_______________.
(3)“太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生.如常见的铁氧化物循环制氢过程如图所示.
①写出反应Ⅰ的化学方程式:_______________.
②科学家想要用组成相似的钴氧化物代替铁氧化物进行循环制氢.查阅资料发现,使用钴氧化物后反应Ⅰ和反应Ⅱ的值随温度变化如图所示.
结合图像判断能否用钴氧化物代替铁氧化物进行热化学循环制氢?若可行,举出采用钴氧化物的一个优势;若不可行,说明理由_______________.
(4)除了上述“直接热分解”、“光催化分解”和“热化学循环”外,请再设计一种利用太阳能从水中获取氢气的方法:_______________(简述即可,不必展开).
电白区2023-2024学年高二上学期期末质量监测
化学参考答案
序号 1 2 3 4 5 6 7 8
答案 A D C B C C B C
序号 9 10 11 12 13 14 15 16
答案 A D B C B D A C
17.(共14分)
(1)①正极 (1分) ,还原(1分) ② b (1分), (2分) (2)Zn (1分), (2分), 牺牲阳极法(1分)
(3)① K1 (1分),2H2O+2e-=H2↑+2OH- (2分) ② K2 (1分),外加电流法 (1分)
18.(共14分,每空2分)
(1)r(Mg) > r(N)> r(O)
(2)
(3)1s22s22p63s23p63d64s2或 [Ar]3d64s2
(4)Al(OH)3 + NaOH = NaAlO2+ 2H2O
(5)哑铃形
(6)三角锥形
19.(共14分,每空2分)
(1) 2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
(2)防止过量的Na2SO3与硫酸发生反应生成SO2混入到ClO2中,导致后续生成杂质(合理即可得分)
(3)防倒吸 (4)AD (5)防止ClO2气体浓度过大导致爆炸 (6) sp3 (7)
20.(共14分,每空2分)
(1)A (2) ① C ②分子间能形成氢键
③取少量待测溶液与试管中,先滴加稀盐酸,无现象,再滴加BaCl2溶液,产生白色沉淀,说明溶液中含有
(3)①
②由图可知,找不到在哪一温度下,反应I和反应II都能自发进行,故不能用钴氧化物代替铁氧化物进行热化学循环制氢
(4)可以将太阳能先转化为电能,再利用电解水的方法制得H2
同课章节目录
