四川省乐山市2023-2024学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 四川省乐山市2023-2024学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 545.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 23:20:27 | ||
图片预览




文档简介
乐山市2023-2024学年高二上学期期末考试
化学
本试卷共两大题,共6页,满分100分,考试时间75分钟。考生作答时,须将答案正确填涂在答题卡上,在本试题卷、草稿纸上答题无效。考试结束后,请将答题卡交回,试卷自行保存。
注意事项:
1.答题前,考生务必将自己的姓名、准考证号在答题卷上填写清楚。
2.选择题必须使用2B铅笔将答案填涂在答题卡对应题目标号的位置上。
3.考试结束后,请监考人员将答题卡回收并装袋。
可能用到的相对原子质量:C12 O16 Na23 K39 Mn55 Cu64
一、选择题(共14小题,每小题3分,共42分,每小题只有一个正确选项)
1.化学与生活密切相关,下列说法错误的是( )
A.电动汽车使用的磷酸铁锂电池属于二次电池
B.合成氨工业的原料气须净化以防催化剂“中毒”
C.浑浊的泥水可用适量饱和溶液净化
D.可直接电解海水获得Mg和等单质
2.下列表示正确的是( )
A.基态硅原子价电子的轨道表示式:
B.镁原子最外层电子的电子云轮廓图:
C.基态硫原子核外电子占据的最高能层符号为:p
D.的离子结构示意图为:
3.现有3种元素基态原子的电子排布式如下:①;②;③。则下列比较中正确的是( )
A.第一电离能:①>②>③ B.原子半径:③>②>①
C.未成对电子数:①>②>③ D.电负性:①>②>③
4.代表阿伏加德罗常数的值,下列说法正确的是( )
A.精炼铜过程中阳极质量减轻64g,转移电子数为
B.1 L 1 mol L 溶液中所含的数目为
C.氯碱工业阳极产生22.4 L气体,转移电子数为
D.常温下,1 L 的溶液中含数目为
5.某同学在学习“金属腐蚀与防护”知识后,设计如图所示装置以减少潮湿地面下钢铁输水管的腐蚀。下列说法正确的是( )
A.钢铁输水管主要发生化学腐蚀 B.镁极发生还原反应
C.导线中由镁流向钢铁输水管 D.该防护方法为外加电流法
6.已知 kJ·mol,向100 mL 1 mol L的NaOH溶液中加入0.5 mol L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如图所示(不考虑热量的散失),则该酸可能是()
A.硝酸 B.氢硫酸() C.硫酸 D.醋酸
7.与在催化剂((简写为HAP)表面催化生成和的历程示意图如图所示。已知该反应,下列有关该反应的说法正确的是( )
A.该反应发生时,环境温度升高
B.HAP的作用是降低反应的反应热
C.任何条件下,HCHO和的内能大于和的内能
D.在高温条件自发进行
8.已知① kJ mol ;
② kJ mol ;
③ kJ mol 下列说法正确的是( )
A.C的燃烧热 kJ
B.2 g 完全燃烧生成液态水放出的热量为241.8 kJ
C.反应的反应热为+41.2 kJ mol
D.反应的平衡常数
9.下列实验操作与对应现象描述匹配的是( )
A.加热0.5 mol L 溶液,溶液由黄色变为蓝色
B.向溶液中滴加少量溶液,有蓝色沉淀生成
C.向AgI悬浊液中滴加少许溶液,黄色沉淀转化为白色
D.向溶液中加入溶液:溶液由橙色变为黄色
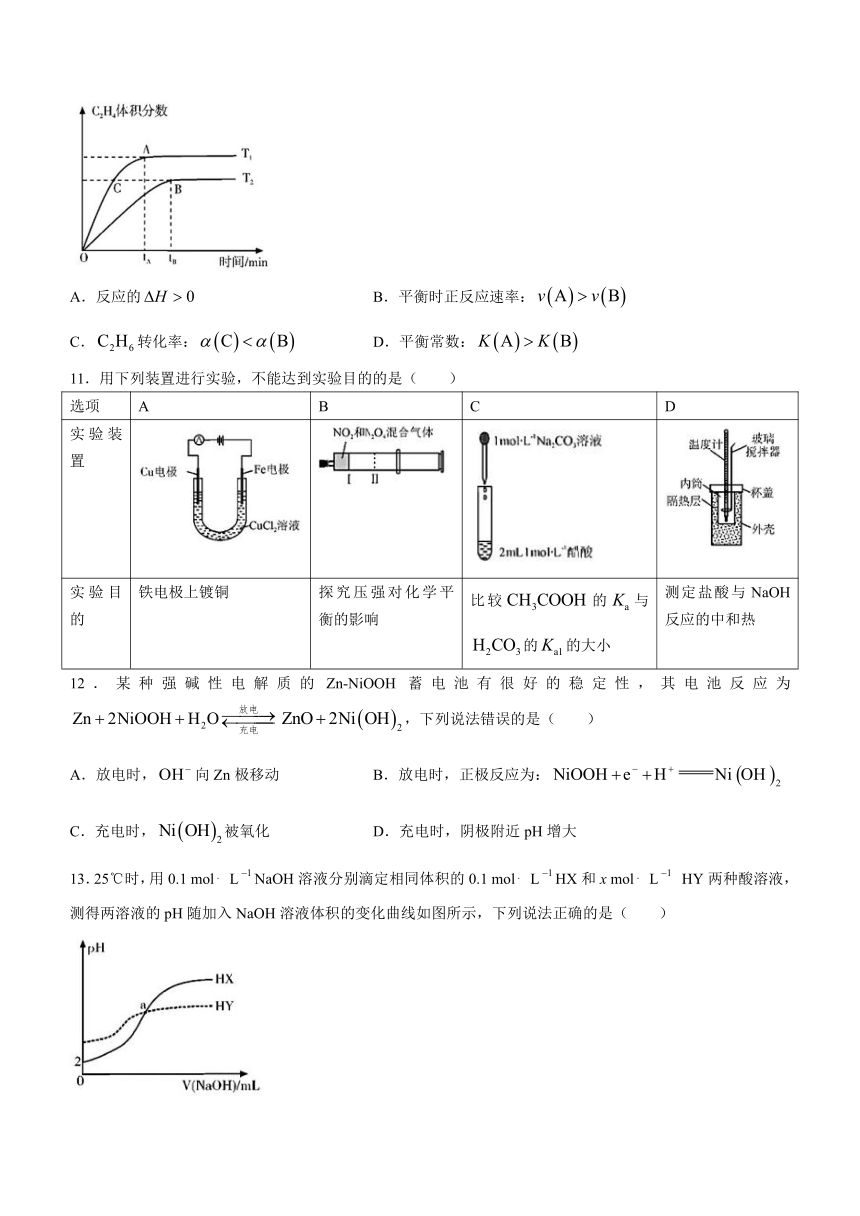
10.在恒容密闭容器中,充入一定量发生反应 ,在其它条件不变的情况下,测得温度对体积分数的影响如图所示。下列说法错误的是( )
A.反应的 B.平衡时正反应速率:
C.转化率: D.平衡常数:
11.用下列装置进行实验,不能达到实验目的的是( )
选项 A B C D
实验装置
实验目的 铁电极上镀铜 探究压强对化学平衡的影响 比较的与的的大小 测定盐酸与NaOH反应的中和热
12.某种强碱性电解质的Zn-NiOOH蓄电池有很好的稳定性,其电池反应为,下列说法错误的是( )
A.放电时,向Zn极移动 B.放电时,正极反应为:
C.充电时,被氧化 D.充电时,阴极附近pH增大
13.25℃时,用0.1 mol LNaOH溶液分别滴定相同体积的0.1 mol LHX和x mol L HY两种酸溶液,测得两溶液的pH随加入NaOH溶液体积的变化曲线如图所示,下列说法正确的是( )
A. B.
C.a点两溶液中,不相等 D.a点两溶液中,水电离出的相等
14.常温下,改变某含溶液的pH,测得或与pH的关系如图所示。常温下,下列说法正确的是( )
A.
B.时,向体系中加入固体,溶液中不变
C., mol L
D.时发生的反应:
二、非选择题(共4小题,共58分)
15.(16分)草酸钠()常用作还原剂。已知常温下,草酸的电离常数,,碳酸的电离常数,。
回答下列问题:
(1)发生第一步水解的离子方程式为______。
(2)相同条件下,同浓度的①,②,③,④四种溶液的pH由大到小的顺序为______(用编号表示)。
(3)将等浓度、等体积的溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是______。
a.
b.
C.
d.
(4)溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol L的溶液。
①需称取固体______g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有______。
(5)用标准液测定某高锰酸钾样品的纯度
步骤Ⅰ:称取2.0 g高锰酸钾样品,配成100 mL溶液,取20 mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的标准液进行滴定,平行滴定三次,记录消耗溶液的体积如下表:
第1次 第2次 第3次
消耗溶液的体积/mL 49.80 46.75 50.20
①滴定终点判断的依据是______。
②平均消耗溶液的体积为______mL,样品中的质量分数为______。
③若(4)中称取的固体已部分吸水潮解,会使测得的样品中的质量分数______(填“偏高”、“偏低”或“不变”)。
16.(16分)氮氧化合物的排放造成了一系列环境问题,研究氮氧化合物的治理有利于环境保护。回答下列问题:
图1
(1)在催化剂作用下,用还原NO能较好消除烟气中的NO,发生反应的过程如图1所示。
①铁元素在周期表中位于______族,属于______区,基态的价电子排布式为______。
②该反应的催化剂是______,用还原NO的总反应为______。
(2)为实现NO再利用,可以用烟气中NO制作燃料电池,其工作原理如图2所示,其中电极a和电极b均为石墨电极,在电池反应中可以循环使用。
①电极b为燃料电池的______极,放电时熔融中向______(填“左”或“右”)移动。
图2
②电极a上的电极反应式为______。
(3)工业上还可以通过电解NO制备,其工作原理如图3所示,其中电极均为石墨电极。
①M为电源的______极,NO在M极发生______反应。
②N电极上的电极反应式为______。
③电解结束后,为使电解产物完全转化为,需补充物质______。
图3
17.(14分)天然气高温条件下可以转化为氢气,发生反应的热化学方程式为: 。
回答下列问题:
(1)反应的平衡常数表达式为______;已知几种物质的燃烧热如下表所示,则反应的______kJ·mol。
可燃物
燃烧热/kJ·mol -890.3 -393.5 -285.8
(2)一定温度下,在容积不变的密闭容器中充入适量发生上述反应,下列情况能说明反应达到平衡状态的是______(填序号)。
a.反应总压强不随时间变化 b.气体密度不随时间变化
c.CH 体积分数不随时间变化 d.的消耗速率与的生成速率之比为1∶2
(3)在体积为2L的密闭容器中充入1 mol 发生上述反应,不同温度下测得的转化率随时间的变化关系如下表所示:
时间/min 转化率 温度/℃ 2 4 6 8 10
40% 60% 80% 80% 80%
20% 30% 40% 60% 60%
①______(填“>”、“<”或“=”)。
②条件下,前2 min内,用表示的化学反应速率______mol L min;达平衡时的体积分数为______%(结果保留1位小数)。
(4)一定温度,100kPa条件下,向密闭容器中充入、
Ar气混合气体,的转化率与的关系如图所示。
①增大,平衡转化率减小的原因是__________________。
②此温度下,该反应的分压平衡常数______。
18.(12分)镓(Ga)是一种重要金属,常用于制造低温合金和半导体材料等。一种从炼锌矿渣[主要含铁酸镓和铁酸锌]回收镓的工艺流程如下:
已知:①Ga与Al同主族,化学性质相似。
②铁酸镓和铁酸锌均为易溶于水的强电解质。
③常温下,工艺中相关金属离子在水溶液中沉淀的pH范围如下表所示:
物质
开始沉淀的pH 1.9 3.0 5.5
完全沉淀的pH 3.2 4.8 8.0
回答下列问题:
(1)“预处理”时需将炼锌矿渣粉碎,其目的是____________。
(2)“酸浸”时转化为和,写出该反应的离子方程式__________________。
(3)“调pH”时应控制溶液的pH范围为__________________。
(4)“碱浸”时发生反应的离子方程式为__________________。
(5)用惰性电极电解“滤液1”,可回收金属______,电解后的电解液经处理后可返回____________
工序循环利用。
(6)用惰性电极电解“滤液2”回收镓时,镓主要附着在电解池的______极。
乐山市2023-2024学年高二上学期期末考试
化学参考答案
一、选择题(共14小题,每小题3分,共42分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D D A D C B A C B C A B B C
二、非选择题(共4小题,共58分)
15.(16分)
(1)(1分)
(2)③④①②(2分)
(3)bd(2分)
(4)①3.35/3.4(2分)②250 mL容量瓶和胶头滴管(2分)
(5)①当加入最后半滴溶液后,溶液从紫色刚好变为无色,且半分钟内不变色(2分)
②50.00(1分) 79%(2分)
③偏高(2分)
16.(16分)
(1)①Ⅷ(1分) d(1分) (1分)
②(1分) (2分)
(2)①正(1分)左(1分)
②(2分)
(3)①正(1分) 氧化(1分)
②(2分)
③(2分)
17.(14分)
(1)(1分) +74.8(2分)
(2)ac(2分)
(3)①>(1分);
②0.1(2分) 54.5(2分)
(4)①压强不变,增大,Ar分压减小,反应中各物质所占压强增大,平衡逆向移动,平衡转化率减小(2分)
②(2分)
18.(12分)
(1)增大酸与矿渣的接触面积,提高浸取率(1分)
(2)(2分)
(3)4.8~5.5/4.8≤pH<5.5/4.8(4)(2分)
(5)Zn(1分) 酸浸(2分)
(6)阴(2分)
化学
本试卷共两大题,共6页,满分100分,考试时间75分钟。考生作答时,须将答案正确填涂在答题卡上,在本试题卷、草稿纸上答题无效。考试结束后,请将答题卡交回,试卷自行保存。
注意事项:
1.答题前,考生务必将自己的姓名、准考证号在答题卷上填写清楚。
2.选择题必须使用2B铅笔将答案填涂在答题卡对应题目标号的位置上。
3.考试结束后,请监考人员将答题卡回收并装袋。
可能用到的相对原子质量:C12 O16 Na23 K39 Mn55 Cu64
一、选择题(共14小题,每小题3分,共42分,每小题只有一个正确选项)
1.化学与生活密切相关,下列说法错误的是( )
A.电动汽车使用的磷酸铁锂电池属于二次电池
B.合成氨工业的原料气须净化以防催化剂“中毒”
C.浑浊的泥水可用适量饱和溶液净化
D.可直接电解海水获得Mg和等单质
2.下列表示正确的是( )
A.基态硅原子价电子的轨道表示式:
B.镁原子最外层电子的电子云轮廓图:
C.基态硫原子核外电子占据的最高能层符号为:p
D.的离子结构示意图为:
3.现有3种元素基态原子的电子排布式如下:①;②;③。则下列比较中正确的是( )
A.第一电离能:①>②>③ B.原子半径:③>②>①
C.未成对电子数:①>②>③ D.电负性:①>②>③
4.代表阿伏加德罗常数的值,下列说法正确的是( )
A.精炼铜过程中阳极质量减轻64g,转移电子数为
B.1 L 1 mol L 溶液中所含的数目为
C.氯碱工业阳极产生22.4 L气体,转移电子数为
D.常温下,1 L 的溶液中含数目为
5.某同学在学习“金属腐蚀与防护”知识后,设计如图所示装置以减少潮湿地面下钢铁输水管的腐蚀。下列说法正确的是( )
A.钢铁输水管主要发生化学腐蚀 B.镁极发生还原反应
C.导线中由镁流向钢铁输水管 D.该防护方法为外加电流法
6.已知 kJ·mol,向100 mL 1 mol L的NaOH溶液中加入0.5 mol L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如图所示(不考虑热量的散失),则该酸可能是()
A.硝酸 B.氢硫酸() C.硫酸 D.醋酸
7.与在催化剂((简写为HAP)表面催化生成和的历程示意图如图所示。已知该反应,下列有关该反应的说法正确的是( )
A.该反应发生时,环境温度升高
B.HAP的作用是降低反应的反应热
C.任何条件下,HCHO和的内能大于和的内能
D.在高温条件自发进行
8.已知① kJ mol ;
② kJ mol ;
③ kJ mol 下列说法正确的是( )
A.C的燃烧热 kJ
B.2 g 完全燃烧生成液态水放出的热量为241.8 kJ
C.反应的反应热为+41.2 kJ mol
D.反应的平衡常数
9.下列实验操作与对应现象描述匹配的是( )
A.加热0.5 mol L 溶液,溶液由黄色变为蓝色
B.向溶液中滴加少量溶液,有蓝色沉淀生成
C.向AgI悬浊液中滴加少许溶液,黄色沉淀转化为白色
D.向溶液中加入溶液:溶液由橙色变为黄色
10.在恒容密闭容器中,充入一定量发生反应 ,在其它条件不变的情况下,测得温度对体积分数的影响如图所示。下列说法错误的是( )
A.反应的 B.平衡时正反应速率:
C.转化率: D.平衡常数:
11.用下列装置进行实验,不能达到实验目的的是( )
选项 A B C D
实验装置
实验目的 铁电极上镀铜 探究压强对化学平衡的影响 比较的与的的大小 测定盐酸与NaOH反应的中和热
12.某种强碱性电解质的Zn-NiOOH蓄电池有很好的稳定性,其电池反应为,下列说法错误的是( )
A.放电时,向Zn极移动 B.放电时,正极反应为:
C.充电时,被氧化 D.充电时,阴极附近pH增大
13.25℃时,用0.1 mol LNaOH溶液分别滴定相同体积的0.1 mol LHX和x mol L HY两种酸溶液,测得两溶液的pH随加入NaOH溶液体积的变化曲线如图所示,下列说法正确的是( )
A. B.
C.a点两溶液中,不相等 D.a点两溶液中,水电离出的相等
14.常温下,改变某含溶液的pH,测得或与pH的关系如图所示。常温下,下列说法正确的是( )
A.
B.时,向体系中加入固体,溶液中不变
C., mol L
D.时发生的反应:
二、非选择题(共4小题,共58分)
15.(16分)草酸钠()常用作还原剂。已知常温下,草酸的电离常数,,碳酸的电离常数,。
回答下列问题:
(1)发生第一步水解的离子方程式为______。
(2)相同条件下,同浓度的①,②,③,④四种溶液的pH由大到小的顺序为______(用编号表示)。
(3)将等浓度、等体积的溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是______。
a.
b.
C.
d.
(4)溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol L的溶液。
①需称取固体______g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有______。
(5)用标准液测定某高锰酸钾样品的纯度
步骤Ⅰ:称取2.0 g高锰酸钾样品,配成100 mL溶液,取20 mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的标准液进行滴定,平行滴定三次,记录消耗溶液的体积如下表:
第1次 第2次 第3次
消耗溶液的体积/mL 49.80 46.75 50.20
①滴定终点判断的依据是______。
②平均消耗溶液的体积为______mL,样品中的质量分数为______。
③若(4)中称取的固体已部分吸水潮解,会使测得的样品中的质量分数______(填“偏高”、“偏低”或“不变”)。
16.(16分)氮氧化合物的排放造成了一系列环境问题,研究氮氧化合物的治理有利于环境保护。回答下列问题:
图1
(1)在催化剂作用下,用还原NO能较好消除烟气中的NO,发生反应的过程如图1所示。
①铁元素在周期表中位于______族,属于______区,基态的价电子排布式为______。
②该反应的催化剂是______,用还原NO的总反应为______。
(2)为实现NO再利用,可以用烟气中NO制作燃料电池,其工作原理如图2所示,其中电极a和电极b均为石墨电极,在电池反应中可以循环使用。
①电极b为燃料电池的______极,放电时熔融中向______(填“左”或“右”)移动。
图2
②电极a上的电极反应式为______。
(3)工业上还可以通过电解NO制备,其工作原理如图3所示,其中电极均为石墨电极。
①M为电源的______极,NO在M极发生______反应。
②N电极上的电极反应式为______。
③电解结束后,为使电解产物完全转化为,需补充物质______。
图3
17.(14分)天然气高温条件下可以转化为氢气,发生反应的热化学方程式为: 。
回答下列问题:
(1)反应的平衡常数表达式为______;已知几种物质的燃烧热如下表所示,则反应的______kJ·mol。
可燃物
燃烧热/kJ·mol -890.3 -393.5 -285.8
(2)一定温度下,在容积不变的密闭容器中充入适量发生上述反应,下列情况能说明反应达到平衡状态的是______(填序号)。
a.反应总压强不随时间变化 b.气体密度不随时间变化
c.CH 体积分数不随时间变化 d.的消耗速率与的生成速率之比为1∶2
(3)在体积为2L的密闭容器中充入1 mol 发生上述反应,不同温度下测得的转化率随时间的变化关系如下表所示:
时间/min 转化率 温度/℃ 2 4 6 8 10
40% 60% 80% 80% 80%
20% 30% 40% 60% 60%
①______(填“>”、“<”或“=”)。
②条件下,前2 min内,用表示的化学反应速率______mol L min;达平衡时的体积分数为______%(结果保留1位小数)。
(4)一定温度,100kPa条件下,向密闭容器中充入、
Ar气混合气体,的转化率与的关系如图所示。
①增大,平衡转化率减小的原因是__________________。
②此温度下,该反应的分压平衡常数______。
18.(12分)镓(Ga)是一种重要金属,常用于制造低温合金和半导体材料等。一种从炼锌矿渣[主要含铁酸镓和铁酸锌]回收镓的工艺流程如下:
已知:①Ga与Al同主族,化学性质相似。
②铁酸镓和铁酸锌均为易溶于水的强电解质。
③常温下,工艺中相关金属离子在水溶液中沉淀的pH范围如下表所示:
物质
开始沉淀的pH 1.9 3.0 5.5
完全沉淀的pH 3.2 4.8 8.0
回答下列问题:
(1)“预处理”时需将炼锌矿渣粉碎,其目的是____________。
(2)“酸浸”时转化为和,写出该反应的离子方程式__________________。
(3)“调pH”时应控制溶液的pH范围为__________________。
(4)“碱浸”时发生反应的离子方程式为__________________。
(5)用惰性电极电解“滤液1”,可回收金属______,电解后的电解液经处理后可返回____________
工序循环利用。
(6)用惰性电极电解“滤液2”回收镓时,镓主要附着在电解池的______极。
乐山市2023-2024学年高二上学期期末考试
化学参考答案
一、选择题(共14小题,每小题3分,共42分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D D A D C B A C B C A B B C
二、非选择题(共4小题,共58分)
15.(16分)
(1)(1分)
(2)③④①②(2分)
(3)bd(2分)
(4)①3.35/3.4(2分)②250 mL容量瓶和胶头滴管(2分)
(5)①当加入最后半滴溶液后,溶液从紫色刚好变为无色,且半分钟内不变色(2分)
②50.00(1分) 79%(2分)
③偏高(2分)
16.(16分)
(1)①Ⅷ(1分) d(1分) (1分)
②(1分) (2分)
(2)①正(1分)左(1分)
②(2分)
(3)①正(1分) 氧化(1分)
②(2分)
③(2分)
17.(14分)
(1)(1分) +74.8(2分)
(2)ac(2分)
(3)①>(1分);
②0.1(2分) 54.5(2分)
(4)①压强不变,增大,Ar分压减小,反应中各物质所占压强增大,平衡逆向移动,平衡转化率减小(2分)
②(2分)
18.(12分)
(1)增大酸与矿渣的接触面积,提高浸取率(1分)
(2)(2分)
(3)4.8~5.5/4.8≤pH<5.5/4.8
(5)Zn(1分) 酸浸(2分)
(6)阴(2分)
同课章节目录
