湖北省武汉市新洲区部分学校2023-2024学年高三上学期期末质量检测化学试题(含答案)
文档属性
| 名称 | 湖北省武汉市新洲区部分学校2023-2024学年高三上学期期末质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 23:35:50 | ||
图片预览




文档简介
武汉市新洲区部分学校2023-2024学年高三上学期期末质量检测
化学试卷
试卷满分:100分 时间75分钟 2024.1
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:Na 23 Cu 64 Zn 65 Mn 55
一、选择题(每小题只有一个选项符合题意,每小题3分,共45分)
1.《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列分析不正确的是( )
A.李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华现象
B.刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C.王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D.曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
2.下列化学用语正确的是( )
A.的电子式
B.铁原子的原子结构示意图:
C.分子的球棍模型:
D.空间填充模型,可表示分子,也可表示分子
3.已知为阿伏加德罗常数的值,下列说法正确的是( )
A.固体溶于稀醋酸至溶液呈中性,的数目为
B.中含有键的数目为
C.1.12L乙烷和丙烯的混合气体中所含键数为
D.与足量充分反应生成的分子数为
4.抗坏血酸(即维生素C,结构如图)是常用的抗氧化剂,下列有关说法正确的是( )
A.分子式是
B.存在4种官能团,能发生取代反应、氧化反应
C.维生素C分子内存在2个手性碳原子
D.该物质最多能与反应
5.下列离子方程式正确的是( )
A.实验室配制的亚铁盐溶液在空气中被氧化:
B.漂白粉溶液在空气中失效:
C.向硫酸铜溶液中加入溶液生成黑色沉淀:
D.长期放置的溶液出现黄色:
6.下列关于物质的结构或性质的描述及解释都正确的是( )
A.键角:,是由于中O上孤电子对数比分中O上的少
B.沸点:对羟基苯甲醛>邻羟基苯甲醛,是由于对羟基苯甲醛分子间范德华力更强
C.稳定性:,是由于水分子间存在氢键
D.酸性:,是由于的羧基中羟基极性更弱
7.某实验小组依据反应设计如图所示的原电池装置,探究pH对氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是( )
A.调节pH可以改变反应的方向 B.时,反应处于平衡状态
C.时,氧化性 D.时,负极电极反应式为
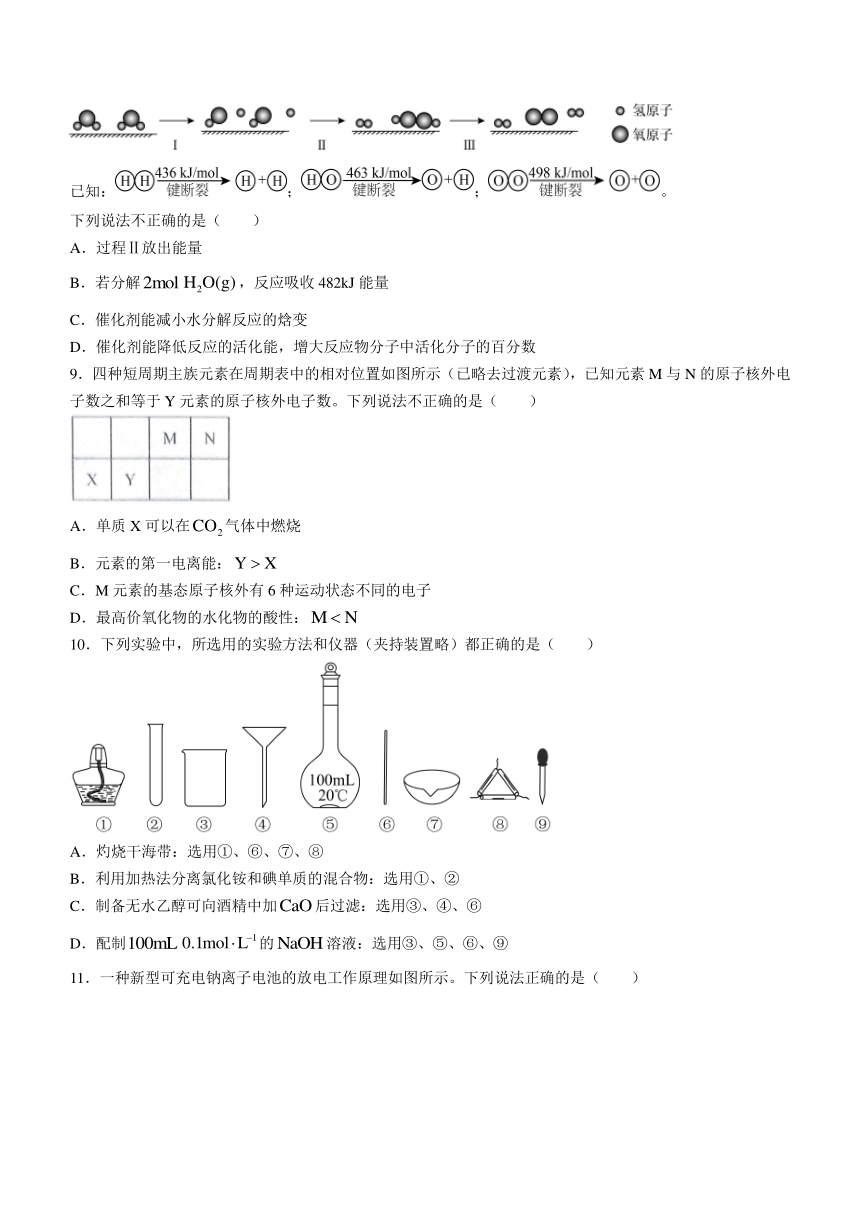
8.我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如图所示。
已知:;;。
下列说法不正确的是( )
A.过程Ⅱ放出能量
B.若分解,反应吸收482kJ能量
C.催化剂能减小水分解反应的焓变
D.催化剂能降低反应的活化能,增大反应物分子中活化分子的百分数
9.四种短周期主族元素在周期表中的相对位置如图所示(已略去过渡元素),已知元素M与N的原子核外电子数之和等于Y元素的原子核外电子数。下列说法不正确的是( )
A.单质X可以在气体中燃烧
B.元素的第一电离能:
C.M元素的基态原子核外有6种运动状态不同的电子
D.最高价氧化物的水化物的酸性:
10.下列实验中,所选用的实验方法和仪器(夹持装置略)都正确的是( )
A.灼烧干海带:选用①、⑥、⑦、⑧
B.利用加热法分离氯化铵和碘单质的混合物:选用①、②
C.制备无水乙醇可向酒精中加后过滤:选用③、④、⑥
D.配制的溶液:选用③、⑤、⑥、⑨
11.一种新型可充电钠离子电池的放电工作原理如图所示。下列说法正确的是( )
A.放电时,通过离子交换膜从左室移向右室
B.充电时,电源的负极应与Mg箔连接
C.充电时,溶液中通过电子时,阳极质量变化2.3g
D.放电时,负极反应式为
12.我国学者首次发现非水相氮还原过程中的多米诺效应。如图所示,一旦完成反应①,反应②③自发完成。下列叙述错误的是( )
A.整个过程中反应①活化能最高
B.反应②断裂氮氮三键形成离子键
C.微粒半径:
D.该还原过程难以在水溶液中实现
13.砷化镓()是优良的半导体材料,熔点为1238℃,用于制作太阳能电池的材料,其结构如图所示,其中以原子1为原点,原子2的坐标为(1,1,1)。下列有关说法中错误的是( )
A.原子3的坐标为 B.Ga的配位数为4
C.为共价晶体 D.若将Ga换成Al,则晶胞参数将变小
14.实验小组探究双氧水与的反应,实验方案如表:
序号 ① ② ③
实验装置及操作
实验现象 无明显变化 溶液立即变为黄色,产生大量无色气体;溶液温度升高;最终溶液仍为黄色 溶液立即变为棕黄色,产生少量无色气体,溶液颜色逐渐加深,温度无明显变化;最终有紫黑色物质析出
下列说法不正确的是( )
A.对的分解有催化作用
B.对比②和③,酸性条件下氧化的速率更大
C.实验②③中的温度差异说明过氧化氢催化分解的反应为放热反应
D.对比②和③,③中的现象可能是因为分解的速率大于氧化的速率
15.25℃时,向弱酸的溶液中加入溶液,含R元素的三种微粒的关系如图所示。下列叙述正确的是( )
已知:①;
②a、b、c三点的坐标:、、。
A.与足量溶液反应,生成的盐为
B.a点溶液中,
C.曲线①表示随的变化
D.反应的平衡常数
二、解答题(本题共4小题,共55分)
16.(14分)连二硫酸锰()常用于灭菌以及水果、蔬菜的保鲜,利用悬浊液吸收气体制取连二硫酸锰的装置(部分夹持、控温仪器已省略)如图所示:
已知:
ⅰ.易溶于水,其在pH为2.8~3.5时最稳定,温度超过30℃时会快速分解生成易溶于水的;
ⅱ.连二硫酸的结构式:
(1)中S的化合价为________。
(2)仪器a的名称是________,仪器b装入的药品是________(填标号)。
A.浓盐酸 B.浓硝酸 C.稀硝酸 D.70%硫酸溶液
(3)装置B的作用是________________________________________。
(4)实验时,控制好装置C中的反应温度后,需通入稍过量的,原因是________________;表明C中反应已完成的现象是________________________。
(5)测定产品中Mn元素的质量分数:称取产品充分加热使其分解为,然后加水溶解,用的酸性溶液进行滴定(Mn元素均转化为)。滴定过程中发生反应的离子方程式为________________。若多次滴定平均消耗溶液的体积为,则产品中Mn元素的质量分数为________(用含a、c、V的代数式表示)。
17.(14分)活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备,工艺流程图所示:
(1)为了提高“溶浸”效果,可采取的措施有________________________。(任写两条)
(2)“除铁”时,先加入溶液发生的离子方程式为________________,如果用代替,恰好完全反应时,理论上消耗________。
(3)常温下,“调”时,的浓度降到了,此时的溶度积常数的数值为________。
(4)“沉锌”时,在近中性条件下加入,可得碱式碳酸锌固体,同时产生大量的气体。该反应的离子方程式为________________________________________。
(5)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为。
①基态Zn原子价电子排布式为________________。
②与Cu原子等距离且最近的Cu原子有________个。
③该铜锌合金晶体密度为________(设为阿伏加德罗常数的值)。
18.(14分)一种高分子功能材料W的合成路线如下图所示:
请回答下列问题:
(1)D按系统命名法的名称是________________.
(2)C中官能团名称是________________;D→E的反应类型为________________。
(3)F的结构简式为________________。
(4)G→W的化学反应方程式为________________。
(5)M是G的同分异构体,同时满足下列条件的结构有________种(不考虑立体异构)。
①遇氯化铁溶液能发生显色反应;
②能与反应产生气体。
其中核磁共振氢谱上有5组峰且峰的面积比为1:2:2:2:1的结构简式为________。
(6)设计以2,3-二氯丁烷()、丙烯醛()为原料合成苯甲醛的合成路线________________________。(无机试剂任选择)
19.(13分)汽车尾气中含有、,排气管内的催化转化器可实现将污染性气体转化为和。
(1)已知:①
②
③
则与反应生成和的热化学方程式为________________________。该反应在________(填“高温”或“低温”)下可自发进行。
(2)的反应历程如图(图中所有物质均为气态)。
该反应的决速步骤是反应________(填对应序号);总反应的中间产物的化学式为________________。
(3)一定温度下,起始时向2L的恒容密闭容器中充入、,仅发生反应,起始气体总压强为180kPa,20min时反应达到平衡,此时气体总压强为起始压强的,
①0~20min内,________,NO转化率为________(保留三位有效数字)。
②此温度下,该反应的平衡常数________
参考答案
1 2 3 4 5 6 7 8
A B A C D A D C
9 10 11 12 13 14 15
B D B C A D B
有关反应式的书写中,化学式错误或未配平,不得分;
同一反应中的“条件、=、↑、↓”等一处或多处错误合计扣一分。
16题答案.(共14分)
(1)(2分)
(2)圆底烧瓶(1分);D(2分)
(3)作安全瓶,防止倒吸(没有“防止倒吸”不得分)(2分)
(4)调节为2.8~3.5,使连二硫酸锰更稳定存在(“调节”1分+“使更稳定”1分,共2分)(2分);悬浊液变澄清(1分)
(5)(2分);(2分)
17题答案.(共14分)
(1)搅拌、适当升高温度、适当增加、将矿石粉碎等(有错答不得分)(2分)
(2)(2分);1:3(2分)
(3)(2分)
(4)(2分)
(5)①(1分) ②8(1分) ③(2分)
18题答案.(共14分)
(1)4-甲基苯甲醛(答“对甲基苯甲醛”不得分)(1分)
(2)碳碳双键、醛基(1个1分,有错答不得分)(2分);氧化反应(1分)
(3)(2分)
(4)(2分)
(5)13(2分);(2分)
(6)(2分)(起始物应为,此处不好更改)
19题答案.(共13分)
(1) (2分);低温(1分)
(2)①(2分);、(1个1分,有错答不得分)(2分)
(3)①(没有单位不得分)(2分);66.7%(0.667不得分)(2分)
②()(没有单位不得分)(2分)
化学试卷
试卷满分:100分 时间75分钟 2024.1
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:Na 23 Cu 64 Zn 65 Mn 55
一、选择题(每小题只有一个选项符合题意,每小题3分,共45分)
1.《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列分析不正确的是( )
A.李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华现象
B.刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C.王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D.曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
2.下列化学用语正确的是( )
A.的电子式
B.铁原子的原子结构示意图:
C.分子的球棍模型:
D.空间填充模型,可表示分子,也可表示分子
3.已知为阿伏加德罗常数的值,下列说法正确的是( )
A.固体溶于稀醋酸至溶液呈中性,的数目为
B.中含有键的数目为
C.1.12L乙烷和丙烯的混合气体中所含键数为
D.与足量充分反应生成的分子数为
4.抗坏血酸(即维生素C,结构如图)是常用的抗氧化剂,下列有关说法正确的是( )
A.分子式是
B.存在4种官能团,能发生取代反应、氧化反应
C.维生素C分子内存在2个手性碳原子
D.该物质最多能与反应
5.下列离子方程式正确的是( )
A.实验室配制的亚铁盐溶液在空气中被氧化:
B.漂白粉溶液在空气中失效:
C.向硫酸铜溶液中加入溶液生成黑色沉淀:
D.长期放置的溶液出现黄色:
6.下列关于物质的结构或性质的描述及解释都正确的是( )
A.键角:,是由于中O上孤电子对数比分中O上的少
B.沸点:对羟基苯甲醛>邻羟基苯甲醛,是由于对羟基苯甲醛分子间范德华力更强
C.稳定性:,是由于水分子间存在氢键
D.酸性:,是由于的羧基中羟基极性更弱
7.某实验小组依据反应设计如图所示的原电池装置,探究pH对氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是( )
A.调节pH可以改变反应的方向 B.时,反应处于平衡状态
C.时,氧化性 D.时,负极电极反应式为
8.我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如图所示。
已知:;;。
下列说法不正确的是( )
A.过程Ⅱ放出能量
B.若分解,反应吸收482kJ能量
C.催化剂能减小水分解反应的焓变
D.催化剂能降低反应的活化能,增大反应物分子中活化分子的百分数
9.四种短周期主族元素在周期表中的相对位置如图所示(已略去过渡元素),已知元素M与N的原子核外电子数之和等于Y元素的原子核外电子数。下列说法不正确的是( )
A.单质X可以在气体中燃烧
B.元素的第一电离能:
C.M元素的基态原子核外有6种运动状态不同的电子
D.最高价氧化物的水化物的酸性:
10.下列实验中,所选用的实验方法和仪器(夹持装置略)都正确的是( )
A.灼烧干海带:选用①、⑥、⑦、⑧
B.利用加热法分离氯化铵和碘单质的混合物:选用①、②
C.制备无水乙醇可向酒精中加后过滤:选用③、④、⑥
D.配制的溶液:选用③、⑤、⑥、⑨
11.一种新型可充电钠离子电池的放电工作原理如图所示。下列说法正确的是( )
A.放电时,通过离子交换膜从左室移向右室
B.充电时,电源的负极应与Mg箔连接
C.充电时,溶液中通过电子时,阳极质量变化2.3g
D.放电时,负极反应式为
12.我国学者首次发现非水相氮还原过程中的多米诺效应。如图所示,一旦完成反应①,反应②③自发完成。下列叙述错误的是( )
A.整个过程中反应①活化能最高
B.反应②断裂氮氮三键形成离子键
C.微粒半径:
D.该还原过程难以在水溶液中实现
13.砷化镓()是优良的半导体材料,熔点为1238℃,用于制作太阳能电池的材料,其结构如图所示,其中以原子1为原点,原子2的坐标为(1,1,1)。下列有关说法中错误的是( )
A.原子3的坐标为 B.Ga的配位数为4
C.为共价晶体 D.若将Ga换成Al,则晶胞参数将变小
14.实验小组探究双氧水与的反应,实验方案如表:
序号 ① ② ③
实验装置及操作
实验现象 无明显变化 溶液立即变为黄色,产生大量无色气体;溶液温度升高;最终溶液仍为黄色 溶液立即变为棕黄色,产生少量无色气体,溶液颜色逐渐加深,温度无明显变化;最终有紫黑色物质析出
下列说法不正确的是( )
A.对的分解有催化作用
B.对比②和③,酸性条件下氧化的速率更大
C.实验②③中的温度差异说明过氧化氢催化分解的反应为放热反应
D.对比②和③,③中的现象可能是因为分解的速率大于氧化的速率
15.25℃时,向弱酸的溶液中加入溶液,含R元素的三种微粒的关系如图所示。下列叙述正确的是( )
已知:①;
②a、b、c三点的坐标:、、。
A.与足量溶液反应,生成的盐为
B.a点溶液中,
C.曲线①表示随的变化
D.反应的平衡常数
二、解答题(本题共4小题,共55分)
16.(14分)连二硫酸锰()常用于灭菌以及水果、蔬菜的保鲜,利用悬浊液吸收气体制取连二硫酸锰的装置(部分夹持、控温仪器已省略)如图所示:
已知:
ⅰ.易溶于水,其在pH为2.8~3.5时最稳定,温度超过30℃时会快速分解生成易溶于水的;
ⅱ.连二硫酸的结构式:
(1)中S的化合价为________。
(2)仪器a的名称是________,仪器b装入的药品是________(填标号)。
A.浓盐酸 B.浓硝酸 C.稀硝酸 D.70%硫酸溶液
(3)装置B的作用是________________________________________。
(4)实验时,控制好装置C中的反应温度后,需通入稍过量的,原因是________________;表明C中反应已完成的现象是________________________。
(5)测定产品中Mn元素的质量分数:称取产品充分加热使其分解为,然后加水溶解,用的酸性溶液进行滴定(Mn元素均转化为)。滴定过程中发生反应的离子方程式为________________。若多次滴定平均消耗溶液的体积为,则产品中Mn元素的质量分数为________(用含a、c、V的代数式表示)。
17.(14分)活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为,还含有Ni、Cd、Fe、Cu等元素及少量不溶于成的杂质)制备,工艺流程图所示:
(1)为了提高“溶浸”效果,可采取的措施有________________________。(任写两条)
(2)“除铁”时,先加入溶液发生的离子方程式为________________,如果用代替,恰好完全反应时,理论上消耗________。
(3)常温下,“调”时,的浓度降到了,此时的溶度积常数的数值为________。
(4)“沉锌”时,在近中性条件下加入,可得碱式碳酸锌固体,同时产生大量的气体。该反应的离子方程式为________________________________________。
(5)用锌与铜制得的高纯铜锌合金滤料被广泛应用于各种水处理设备。一种铜锌合金的晶胞结构如图,已知:晶胞参数为。
①基态Zn原子价电子排布式为________________。
②与Cu原子等距离且最近的Cu原子有________个。
③该铜锌合金晶体密度为________(设为阿伏加德罗常数的值)。
18.(14分)一种高分子功能材料W的合成路线如下图所示:
请回答下列问题:
(1)D按系统命名法的名称是________________.
(2)C中官能团名称是________________;D→E的反应类型为________________。
(3)F的结构简式为________________。
(4)G→W的化学反应方程式为________________。
(5)M是G的同分异构体,同时满足下列条件的结构有________种(不考虑立体异构)。
①遇氯化铁溶液能发生显色反应;
②能与反应产生气体。
其中核磁共振氢谱上有5组峰且峰的面积比为1:2:2:2:1的结构简式为________。
(6)设计以2,3-二氯丁烷()、丙烯醛()为原料合成苯甲醛的合成路线________________________。(无机试剂任选择)
19.(13分)汽车尾气中含有、,排气管内的催化转化器可实现将污染性气体转化为和。
(1)已知:①
②
③
则与反应生成和的热化学方程式为________________________。该反应在________(填“高温”或“低温”)下可自发进行。
(2)的反应历程如图(图中所有物质均为气态)。
该反应的决速步骤是反应________(填对应序号);总反应的中间产物的化学式为________________。
(3)一定温度下,起始时向2L的恒容密闭容器中充入、,仅发生反应,起始气体总压强为180kPa,20min时反应达到平衡,此时气体总压强为起始压强的,
①0~20min内,________,NO转化率为________(保留三位有效数字)。
②此温度下,该反应的平衡常数________
参考答案
1 2 3 4 5 6 7 8
A B A C D A D C
9 10 11 12 13 14 15
B D B C A D B
有关反应式的书写中,化学式错误或未配平,不得分;
同一反应中的“条件、=、↑、↓”等一处或多处错误合计扣一分。
16题答案.(共14分)
(1)(2分)
(2)圆底烧瓶(1分);D(2分)
(3)作安全瓶,防止倒吸(没有“防止倒吸”不得分)(2分)
(4)调节为2.8~3.5,使连二硫酸锰更稳定存在(“调节”1分+“使更稳定”1分,共2分)(2分);悬浊液变澄清(1分)
(5)(2分);(2分)
17题答案.(共14分)
(1)搅拌、适当升高温度、适当增加、将矿石粉碎等(有错答不得分)(2分)
(2)(2分);1:3(2分)
(3)(2分)
(4)(2分)
(5)①(1分) ②8(1分) ③(2分)
18题答案.(共14分)
(1)4-甲基苯甲醛(答“对甲基苯甲醛”不得分)(1分)
(2)碳碳双键、醛基(1个1分,有错答不得分)(2分);氧化反应(1分)
(3)(2分)
(4)(2分)
(5)13(2分);(2分)
(6)(2分)(起始物应为,此处不好更改)
19题答案.(共13分)
(1) (2分);低温(1分)
(2)①(2分);、(1个1分,有错答不得分)(2分)
(3)①(没有单位不得分)(2分);66.7%(0.667不得分)(2分)
②()(没有单位不得分)(2分)
同课章节目录
