辽宁省本溪市第一中学2023-2024学年高二上学期1月期末考试化学试题(含解析)
文档属性
| 名称 | 辽宁省本溪市第一中学2023-2024学年高二上学期1月期末考试化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-03 23:38:45 | ||
图片预览


文档简介
本溪市第一中学2023-2024学年高二上学期1月期末考试
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号、考场号、座位号填写在答题卡上,
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
考试时间为75分钟,满分100分
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.某元素的最外层电子数为2,价电子数为3,并且是同族中原子序数最小的元素,关于该元素的判断,错误的是( )
A.电子排布式为: B.该元素为
C.该元素为ⅢB族元素 D.该元素位于d区
2.一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是( )
A.为逆反应活化能,为正反应活化能
B.该反应为放热反应,
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,反应速率增大,活化能不变
3.下列说法中,正确的是( )
A.凡是放热反应都是自发反应
B.凡是熵增大的反应都是自发反应
C.要判断反应自发进行的方向,必须综合考虑体系的焓变和熵变
D.过程的自发性不仅能用于判断过程方向,还能确定反应的快慢
4.对于反应,下列表示化学反应速率最快的是( )
A. B.
C. D.
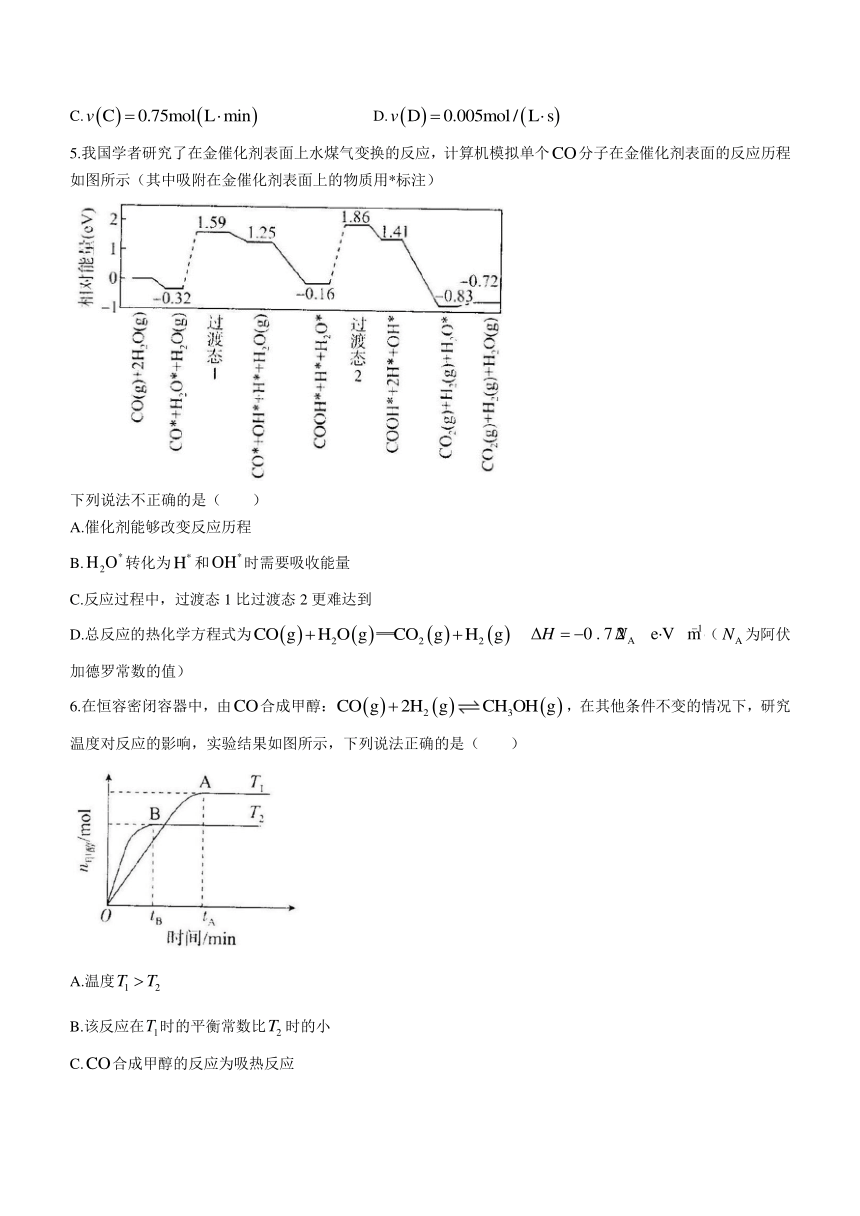
5.我国学者研究了在金催化剂表面上水煤气变换的反应,计算机模拟单个分子在金催化剂表面的反应历程如图所示(其中吸附在金催化剂表面上的物质用*标注)
下列说法不正确的是( )
A.催化剂能够改变反应历程
B.转化为和时需要吸收能量
C.反应过程中,过渡态1比过渡态2更难达到
D.总反应的热化学方程式为 (为阿伏加德罗常数的值)
6.在恒容密闭容器中,由合成甲醇:,在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
A.温度
B.该反应在时的平衡常数比时的小
C.合成甲醇的反应为吸热反应
D.处于A点的反应体系从变到,达到平衡时增大
7.下表所示实验、现象和结论均正确的是( )
选项 实验 现象 结论
A 向均为0.1和混合溶液中滴加少量溶液 先出现黄色沉淀
B 常温下,测定等物质的量浓度的和溶液的 前者的比后者的大 的酸性强于的
C 向某溶液中加入硝酸酸化的氯化钡溶液 溶液中有白色沉淀 溶液中含有
D 向和混合溶液中,加入少量的固体 溶液颜色变浅 平衡向逆反应方向移动
8.下面表示锂原子结构的化学用语中,对核外电子运动状态描述最详尽的是( )
A. B. C. D.
9.用价层电子对互斥模型预测和的空间结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是
B.W、X、Y、Z的原子半径大小顺序可能是
C.Y、Z形成的分子空间结构可能是正四面体形
D.分子中键与键的数目之比是2∶1
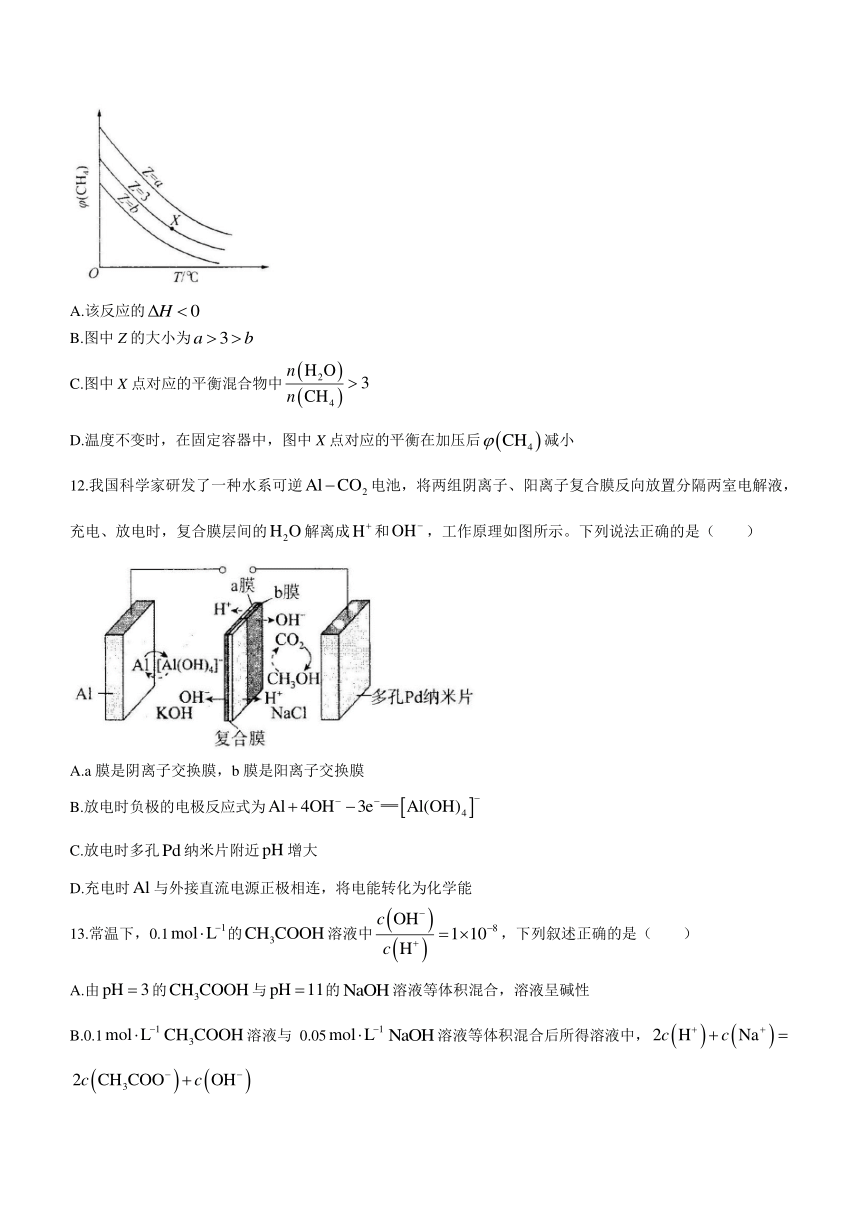
11.一定条件下,与发生反应:,设起始,在恒压下,平衡时的体积分数[]与Z和温度(T)的关系如图所示。下列说法正确的是( )
A.该反应的
B.图中Z的大小为
C.图中X点对应的平衡混合物中
D.温度不变时,在固定容器中,图中X点对应的平衡在加压后减小
12.我国科学家研发了一种水系可逆电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的解离成和,工作原理如图所示。下列说法正确的是( )
A.a膜是阴离子交换膜,b膜是阳离子交换膜
B.放电时负极的电极反应式为
C.放电时多孔纳米片附近增大
D.充电时与外接直流电源正极相连,将电能转化为化学能
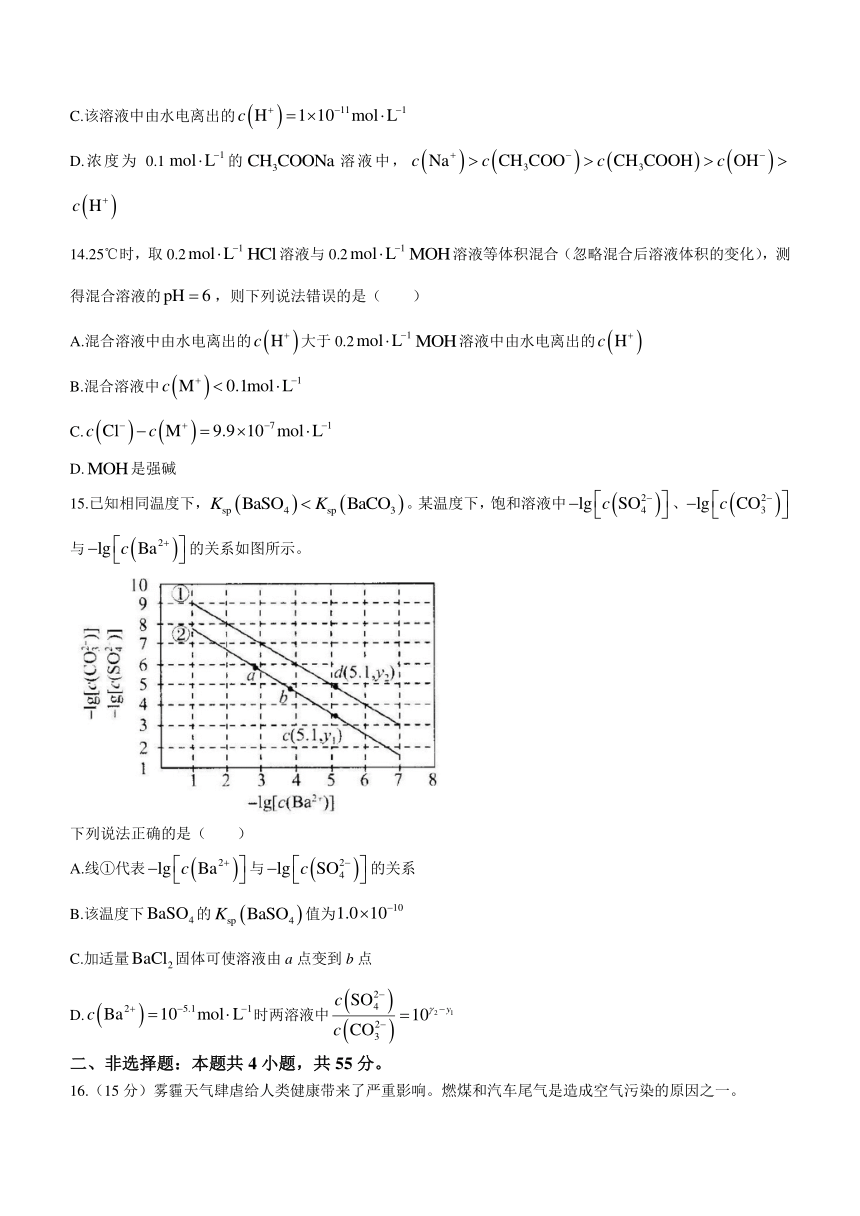
13.常温下,0.1的溶液中,下列叙述正确的是( )
A.由的与的溶液等体积混合,溶液呈碱性
B.0.1溶液与0.05溶液等体积混合后所得溶液中,
C.该溶液中由水电离出的
D.浓度为0.1的溶液中,
14.25℃时,取0.2溶液与0.2溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的,则下列说法错误的是( )
A.混合溶液中由水电离出的大于0.2溶液中由水电离出的
B.混合溶液中
C.
D.是强碱
15.已知相同温度下,。某温度下,饱和溶液中、与的关系如图所示。
下列说法正确的是( )
A.线①代表与的关系
B.该温度下的值为
C.加适量固体可使溶液由a点变到b点
D.时两溶液中
二、非选择题:本题共4小题,共55分。
16.(15分)雾霾天气肆虐给人类健康带来了严重影响。燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为: 。
①反应的图像如图1所示。若其他条件不变,仅在反应前加入合适的催化剂,其图像如图2所示。以下说法正确的是__________(填字母)。
图1 图2
A. B. C.
D.图2中阴影部分面积更大 E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是__________(填字母):
A B C D
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用催化还原可以消除氮氧化物的污染。
已知:
写出催化还原生成和的热化学方程式:_______________________________。
(3)和在催化剂表面发生反应,该反应在不同温度下的化学平衡常数如表:
温度/C 800 1000 1200 1400
平衡常数 0.45 1.92 276.5 1771.5
①该反应是___________反应(填“吸热”或“放热”)。
②某温度下,向1L密闭容器中投入1和1,平衡时,该温度下反应的平衡常数_________________。
(4)甲烷燃料电池可以提升能量利用率。如图是常温下利用甲烷燃料电池电解1001食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
①甲烷燃料电池的负极反应式为_________________。
②电解后溶液的_______________(忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下是_______________L。
17.(13分)蛋壳是一种很好的绿色钙源,其主要成分为。以蛋壳为原料制备葡萄糖酸钙晶体,并对其纯度进行测定,过程如下。
步骤Ⅰ.葡萄糖酸钙晶体的制备
步骤Ⅱ.产品纯度测定——间接滴定法
①称取步骤Ⅰ中制得的产品0.600g置于烧杯中,加入蒸馏水及适量稀盐酸溶解;
②加入足量溶液,用氨水调节为4~5,生成白色沉淀,过滤、洗涤;
③将②洗涤后所得的固体溶于稀硫酸中,用0.02000标准溶液滴定,消耗标准溶液25.00。
根据以上两个步骤,回答下列问题。
(1)以上两个步骤中不需要使用的仪器有___________(填字母)。
(2)步骤Ⅰ中“操作a”是______________________、过滤、洗涤、干燥。
(3)步骤Ⅱ中用氨水调节为4~5的目的为______________________。
(4)用标准溶液滴定待测液的反应原理为______________________(用离子方程式表示),判断滴定达到终点的现象为_________________________________。
(5)根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为_______________(保留三位有效数字)。
18.(12分)常温下,向浓度为0.1、体积为L的氨水中逐滴加入一定浓度的盐酸,用计测溶液的,得滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题。
(1)该温度时的电离平衡常数_____________。
(2)b、c、d三点时的溶液中,由水电离出的由大到小顺序为_____________。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是____________(填字母)。
A. B.
C. D.
(4)根据以上滴定曲线判断下列说法正确的是(溶液中氮元素只存在和两种形式)____________(填字母)。
A.点b所示溶液中:
B.点c所示溶液中:
C.点d所示溶液中:
D.滴定过程中可能有:
(5)25℃时,将a的氨水与b盐酸等体积混合,反应后溶液恰好显中性,则a_________b(填“>”、“<”或“=”),用a、b表示的电离平衡常数为_________。
19.(15分)依据原子结构知识回答下列问题。
(1)基态硅原子的电子排布式是__________________;基态硫原子的价电子排布式是__________________。
(2)基态铁原子有___________个未成对电子,基态的价电子排布图为_________________。
(3)、K、O、F四种元素中第一电离能最小的是__________,电负性最大的是____________。
(4)下列说法错误的是__________。
A.元素的电负性: B.元素的第一电离能:
C.离子半径: D.原子的未成对电子数:
(5)过氧化氢()是一种医用消毒杀菌剂。已知的结构如图所示。不是直线形的,两个氢原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个与的夹角均为96°52′。
①的电子式为_______________,结构式为______________。
②中存在____________键和____________键,为______________(填“极性”或“非极性”)分子。
本溪市第一中学2023-2024学年高二上学期1月期末考试
化学试题
参考答案及评分意见
1.A 【解析】该元素为同族元素中原子序数最小的,所以该元素为第二周期或第四周期元素。又因其价电子数最外层电子数,可推出该元素应为第四周期元素,价电子排布式为,故为21号元素,位于d区,A项错误,B、C、D项正确。
2.D 【解析】为逆反应活化能,为正反应活化能,A项错误;该反应为放热反应,,B项错误;反应中能量较高且能发生有效碰橦的分子叫做活化分子,活化分子的平均能量高于所有分子的平均能量,C项错误;温度升高,反应速率增大,活化能不变,D项正确。
3.C 【解析】放热反应有利于反应的自发进行,但是不一定所有的放热反应都是自发反应,比如放热减的反应在高温下不能自发进行,A错误:熵增有利于反应的自发进行,但增不一定都是自发反应,比如吸热熵增的反应在低温下不能自发进行,B错误;判断反应能否自发进行,需要使用复合判据进行判断,即综合考虑体系的焓变和熵变,C正确;过程的自发性只能用于判断过程的方向,不能确定反应的快慢,D错误。
4.A 【解析】时,,所以;时,,所以;时,,所以。综上所述反应速率最快的为A项。
5.C 【解析】中反应历程图可知,在过渡态中,催化剂能够改变反应过程中的相对能量,改变的是反应的历榻,但是反应物和最终生成物不会改变,A正确;的相对能量为,的相对能量为1.25,所以转化为和时需要吸收能量,B正确;反应过程中生成过渡态1需要吸收的相对能量(1.91)比过渡态2的(2.02)小,所以过渡态1易达到,C错误:0.72为单个分子反应时放出的能量,则1发生反应放出0.72的能量,总反应的热化学方程式为 ,D正确。
6.D 【解析】“先拐先平”所以温度,A错误;时生成甲醇的物质的量大,该反应在时的平衡常数比时的大,B错误;,升高温度,甲醇的物质的量减小,平衡逆向移动,合成甲醇的反应为放热反应,C错误;处于A点的反应体系从变到时,升高温度,平衡逆向移动,达到平衡时增大,D正确。
7.A 【解析】小的先沉淀,先生成黄色沉淀可知,A正确;盐溶液的碱性越强,说明酸根离子易水解,对应得到的酸越强,所以的酸性弱于的,B错误;加入硝酸酸化的氯化钡溶液产生白色沉淀,原溶液中可能含或,C错误:加入少量固体,对铁离子与的配位反位无影响,平衡不移动,颜色不变,D错误。
8.D 【解析】A项只能表达元素是什么,包含信息最少;B项可以表达出原子核内有三个质子及原子核外电子的分层排布情况;C项可以进一步表达出能层和能级以及能级所容纳的电子数;D项则更进一步表达出每个能级对应的轨道、每个轨道所容纳的电子数目以及电子的自旋方向,D项符合题意,
9.D 【解析】中S的孤电子对数为,键电子对数为2,S的价层电子对数为4,VSEPR模型为四面体形,去掉孤电子对,的空间结构为V形;中B的孤电子对数为,键电子对数为3,B的价层电子对数为3,VSEPR模型为平面三角形,由于B没有孤电子对,的空间结构为平面三角形,D项正确。
10.C 【解析】短周期主族元素W,X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,由于最外层电子数不超过8,W的最外层电子数为4,W处于第ⅣA族,X的最外层电子数为3,X处于第ⅢA族,原子序数X大于W,W为C,X为;Z原子比X原子的核外电子数多4,Z的核外电子数为17,则Z为;Y的原子序数大于的,小于的,故Y为或P或S。同主族元素自上而下电负性逐渐减小,Y若为,则电负性,A项错误;同周期主族元素自左而右原子半径逐渐减小,一般来说电子层越多原子半径越大,故原子半径,B项错误;若Y、Z形成的分子为,中心原子形成4个键,无孤电子对,为杂化,正四面体形,C项正确;分子为,分子结构式为,每个双键中含有1个键、1个键,故键与键的数目之比为1∶1,D项错误。
11.C 【解析】由题图可知,温度越高,越小,则升高温度,平衡正向移动,则正反应为吸热反应,该反应的,A错误;起始越大,即促进转化的程度越大、越小,则图中Z的大小为,B错误;起始,转化时、以等物质的量转化,则X点对应的平衡混合物中,C正确;该反应为气体体积增大的反应,增大压强,平衡逆向移动,则温度不变时,图中X点对应的平衡在加压后增大,D错误。
12.B 【解析】由图可知,a膜释放出氢离子,是阳离子交换膜,b膜释放出氢氧根离子,是阴离子交换膜,故A项错误:放电时是原电泡,负极为铝,铝在负极失去电子生成铝离子,铝离子结合复合膜层电离出的氢氧根离子生成,负极的电极反应式为,故B项正确;放电时多孔纳米片为正极,二氧化碳在正极得到电子转化为甲醇,电极反应为,溶液仍呈中性,不变,故C项错误;放电时为负极,充电时与外接直流电源负极相评,将电能转化为化学能,故D项错误。
13.C 【解析】的容液浓度大于的溶液浓度,等体积混合后有大量剩余,溶液呈酸性,A错误;混合溶液中溶质为等物质的量浓度的和,溶液中存在电荷守恒和物料守恒,根据电荷守恒得,根据物料守恒得,所以得,B错误;常温下,该溶液中,,所以,,,C正确;为强碱弱酸盐,小部分在溶液中会发生水解,离子方程式为,则,又由于水会电离出部分,则,是由水电离出来的,量很少,则溶液中粒子浓度大小为,D错误。
14.D 【解析】25℃时,0.2溶液与0.2溶液等体积混合,两者恰好完全反应生成,混合溶液是盐溶液,溶液的,说明能发生水解,的水解能促进水的电离,酸或碱能抑制水的电离,所以混合溶液中由水电离出的大于0.2溶液中由水电离出的,A项正确;溶液等体积混合后,,能发生水解,所以,B项正确;溶液呈电中性,有,所以,C项正确:为弱碱,D项错。
15.B 【解析】、均为难溶物,饱和溶液中,同理可知溶液中,因,则,由此可知线①为与的关系,曲线②为与的关系,A项错误;当溶液中时,,则,因此,B项正确:向饱和溶液中加入适量固体后,溶液中增大,根据温度不变则不变可知,溶液中将减小,因此将由a点沿线②向左上方移动,C项错误;由图可知,当溶液中时,两溶液中,D项错误。
16.(15分)
(1)①BC(2分) ②BD(2分)
(2) (2分)
(3)①吸热(1分) ②6.75(2分
(4)①(2分) ②14(2分) ③1.68(2分)
【解析】(1)①使用催化剂,只增大反应速率,达到平衡所用时间少,因此,,,催化剂对化学平衡无影响,两个阴影面积相等,故B、C正确。②正反应是放热反应,容器是绝热容器,随着反应进行,温度升高,反应速率增大,当达到平衡反应速率不再改变,但根据图像,时刻后反应速率还在改变,说明时刻没有达到平衡,A错误;时刻后K不再改变,说明反应达到平衡,B正确;达到平衡时物质的量不再改变,但根据图像,时刻后物质的量还在发生变化,说明没有达到平衡,C错误:根据化学平衡状态的定义,达到平衡时体积分数不再改变,根据图像,时刻达到平衡,D正确。(2)①,②,③,①②③得: 。(3)①化学平衡常数只受温度的影响,根据表格数据,随着温度的升高,平衡常数增大,说明升高温度使平衡正向移动,即正反应是吸热反应。②列“三段式”:
1 1 0 0
0.5 0.5 0.5 1.5
0.5 0.5 0.5 0.5
。(4)①电解质呈酸性,因此负极反应式为 ②,0.1全部电解,产生氢气的物质的量为0.05,然后电解一部分水,又产生0.05。电解溶液产生,,则,即。③根据②的分析,阳极上产生气体为0.05和0.025,其体积为。
17.(13分)
(1)C(2分)
(2)蒸发浓缩、冷却结晶(2分)
(3)中和溶液中的,使完全沉淀(2分)
(4)(2分) 滴入最后半滴高锰酸钾标准溶液,溶液由无色变为粉红色,且半分钟内不褪色(2分)
(5)93.3%(3分)
【解析】(1)过滤时要用到漏斗,灼烧时要用到坩埚,滴定时要用到酸式滴定管,则步骤Ⅰ和Ⅱ中不需要使用的仪器是圆底烧瓶。
(2)从滤液中得到固体,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到。
(3)加入蒸馏水及适量稀盐酸溶解产品后所得溶液为酸性溶液,酸性溶液中加入溶液,会与氢离子反应导致浓度降低而不能生成沉淀,则向溶液中滴加氨水调节为4~5的目的是中和溶液中的氢离子,有利于钙离子完全转化为草酸钙沉淀。
(4)用高锰酸钾标准溶液滴定待测液的反应原理为;当完全反应时,再滴入半滴高锰酸钾溶液,溶液由无色变为粉红色,且半分钟内不褪色,说明达到滴定终点。
(5)由题意可得如下关系式:,则的物质的量为,产品中葡萄糖酸钙晶体的纯度为。
18.(每空2分,共12分)
(1)
(2)
(3)ACD
(4)D
(5)>
【解析】(1)滴定前氨水中,利用水的离子积常数可得,一水合氨的电离平衡常数。(2)在b点时,溶质为和氯化铵,的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用;在c点时,溶质为和氯化铵,溶液为中性,对水的电离平衡无影响;在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡起到促进作用;所以b、c、d三点时的溶液中,水电离的大小顺序是。(3)温度不变,水的离子积常数不变,所以不变,A项正确;由b点到c点的过程中,增大,不断减小,故增大,B项错误,,温度不变,电离平衡常数不变,C项正确;,温度不变,该比值也不变,D项正确。(4)由图像可知,点b所示溶液中溶质为等物质的量的和,溶液呈碱性,说明的电离程度大于的水解程度,由电荷守恒可知:,物料守恒为:,质子守恒为:;A项错误;点c时,即,由电荷守恒可知:,故,B项错误;点d恰好完全反应生成,溶液呈酸性,则,C项错误;当较多,滴入的盐酸较少时,生成较少,溶液中浓度远大于浓度,可能出现,D项正确。(5)溶液显中性,所以,根据电荷守恒可得:,故,氯化铵水溶液呈酸性,要使溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则镀水的物质的量浓度大于盐酸的,溶液中,,,电离常数只与温度有关,则此时的电离常数。
19.(15分)
(1)(或)(1分) (1分)
(2)4(1分)(2分)
(3)K(1分) F(1分)
(4)B(1分
(5)①(2分) (1分)
②极性(1分) 非极性(1分) 极性(2分)
【解析】(1)硅元素为14号元素,原子核外有14个电子,其基态原子核外电子排布式为(或);硫元素为16号元素,原子核外有16个电子,所以其基态原子核外电子排布式为,则其价电子排布式为。
(2)为26号元素,原子核外有26个电子,基态铁原子核外电子排布式为,则有4个未成对电子;的价电子排布式为,其价电子排布图为。
(3)通常情况下,元素的金属性越强,其第一电离能越小,则、K、O、F四种元素中K的第一电离能最小;元素的非金属性越强,其电负性越大,所以的电负性最大。
(4)得电子能力,所以元素的电负性:,A正确;C的电子排布式为,N的电子排布式为,p轨道处于半充满状态,O的电子排布式为,第一电离能应该是N的最大,则元素的第一电离能:,B错误;电子层数相同时,核电荷数越大半径越小,则离子半径:,C正确;原子、、的未成对电子数分别为5、2、1,即原子的未成对电子数:,D正确。
(5)的空间结构为不对称结构,应为极性分子,含有非极性键和极性键。
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号、考场号、座位号填写在答题卡上,
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
考试时间为75分钟,满分100分
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.某元素的最外层电子数为2,价电子数为3,并且是同族中原子序数最小的元素,关于该元素的判断,错误的是( )
A.电子排布式为: B.该元素为
C.该元素为ⅢB族元素 D.该元素位于d区
2.一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是( )
A.为逆反应活化能,为正反应活化能
B.该反应为放热反应,
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,反应速率增大,活化能不变
3.下列说法中,正确的是( )
A.凡是放热反应都是自发反应
B.凡是熵增大的反应都是自发反应
C.要判断反应自发进行的方向,必须综合考虑体系的焓变和熵变
D.过程的自发性不仅能用于判断过程方向,还能确定反应的快慢
4.对于反应,下列表示化学反应速率最快的是( )
A. B.
C. D.
5.我国学者研究了在金催化剂表面上水煤气变换的反应,计算机模拟单个分子在金催化剂表面的反应历程如图所示(其中吸附在金催化剂表面上的物质用*标注)
下列说法不正确的是( )
A.催化剂能够改变反应历程
B.转化为和时需要吸收能量
C.反应过程中,过渡态1比过渡态2更难达到
D.总反应的热化学方程式为 (为阿伏加德罗常数的值)
6.在恒容密闭容器中,由合成甲醇:,在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
A.温度
B.该反应在时的平衡常数比时的小
C.合成甲醇的反应为吸热反应
D.处于A点的反应体系从变到,达到平衡时增大
7.下表所示实验、现象和结论均正确的是( )
选项 实验 现象 结论
A 向均为0.1和混合溶液中滴加少量溶液 先出现黄色沉淀
B 常温下,测定等物质的量浓度的和溶液的 前者的比后者的大 的酸性强于的
C 向某溶液中加入硝酸酸化的氯化钡溶液 溶液中有白色沉淀 溶液中含有
D 向和混合溶液中,加入少量的固体 溶液颜色变浅 平衡向逆反应方向移动
8.下面表示锂原子结构的化学用语中,对核外电子运动状态描述最详尽的是( )
A. B. C. D.
9.用价层电子对互斥模型预测和的空间结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是
B.W、X、Y、Z的原子半径大小顺序可能是
C.Y、Z形成的分子空间结构可能是正四面体形
D.分子中键与键的数目之比是2∶1
11.一定条件下,与发生反应:,设起始,在恒压下,平衡时的体积分数[]与Z和温度(T)的关系如图所示。下列说法正确的是( )
A.该反应的
B.图中Z的大小为
C.图中X点对应的平衡混合物中
D.温度不变时,在固定容器中,图中X点对应的平衡在加压后减小
12.我国科学家研发了一种水系可逆电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的解离成和,工作原理如图所示。下列说法正确的是( )
A.a膜是阴离子交换膜,b膜是阳离子交换膜
B.放电时负极的电极反应式为
C.放电时多孔纳米片附近增大
D.充电时与外接直流电源正极相连,将电能转化为化学能
13.常温下,0.1的溶液中,下列叙述正确的是( )
A.由的与的溶液等体积混合,溶液呈碱性
B.0.1溶液与0.05溶液等体积混合后所得溶液中,
C.该溶液中由水电离出的
D.浓度为0.1的溶液中,
14.25℃时,取0.2溶液与0.2溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的,则下列说法错误的是( )
A.混合溶液中由水电离出的大于0.2溶液中由水电离出的
B.混合溶液中
C.
D.是强碱
15.已知相同温度下,。某温度下,饱和溶液中、与的关系如图所示。
下列说法正确的是( )
A.线①代表与的关系
B.该温度下的值为
C.加适量固体可使溶液由a点变到b点
D.时两溶液中
二、非选择题:本题共4小题,共55分。
16.(15分)雾霾天气肆虐给人类健康带来了严重影响。燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为: 。
①反应的图像如图1所示。若其他条件不变,仅在反应前加入合适的催化剂,其图像如图2所示。以下说法正确的是__________(填字母)。
图1 图2
A. B. C.
D.图2中阴影部分面积更大 E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是__________(填字母):
A B C D
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用催化还原可以消除氮氧化物的污染。
已知:
写出催化还原生成和的热化学方程式:_______________________________。
(3)和在催化剂表面发生反应,该反应在不同温度下的化学平衡常数如表:
温度/C 800 1000 1200 1400
平衡常数 0.45 1.92 276.5 1771.5
①该反应是___________反应(填“吸热”或“放热”)。
②某温度下,向1L密闭容器中投入1和1,平衡时,该温度下反应的平衡常数_________________。
(4)甲烷燃料电池可以提升能量利用率。如图是常温下利用甲烷燃料电池电解1001食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
①甲烷燃料电池的负极反应式为_________________。
②电解后溶液的_______________(忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下是_______________L。
17.(13分)蛋壳是一种很好的绿色钙源,其主要成分为。以蛋壳为原料制备葡萄糖酸钙晶体,并对其纯度进行测定,过程如下。
步骤Ⅰ.葡萄糖酸钙晶体的制备
步骤Ⅱ.产品纯度测定——间接滴定法
①称取步骤Ⅰ中制得的产品0.600g置于烧杯中,加入蒸馏水及适量稀盐酸溶解;
②加入足量溶液,用氨水调节为4~5,生成白色沉淀,过滤、洗涤;
③将②洗涤后所得的固体溶于稀硫酸中,用0.02000标准溶液滴定,消耗标准溶液25.00。
根据以上两个步骤,回答下列问题。
(1)以上两个步骤中不需要使用的仪器有___________(填字母)。
(2)步骤Ⅰ中“操作a”是______________________、过滤、洗涤、干燥。
(3)步骤Ⅱ中用氨水调节为4~5的目的为______________________。
(4)用标准溶液滴定待测液的反应原理为______________________(用离子方程式表示),判断滴定达到终点的现象为_________________________________。
(5)根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为_______________(保留三位有效数字)。
18.(12分)常温下,向浓度为0.1、体积为L的氨水中逐滴加入一定浓度的盐酸,用计测溶液的,得滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题。
(1)该温度时的电离平衡常数_____________。
(2)b、c、d三点时的溶液中,由水电离出的由大到小顺序为_____________。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是____________(填字母)。
A. B.
C. D.
(4)根据以上滴定曲线判断下列说法正确的是(溶液中氮元素只存在和两种形式)____________(填字母)。
A.点b所示溶液中:
B.点c所示溶液中:
C.点d所示溶液中:
D.滴定过程中可能有:
(5)25℃时,将a的氨水与b盐酸等体积混合,反应后溶液恰好显中性,则a_________b(填“>”、“<”或“=”),用a、b表示的电离平衡常数为_________。
19.(15分)依据原子结构知识回答下列问题。
(1)基态硅原子的电子排布式是__________________;基态硫原子的价电子排布式是__________________。
(2)基态铁原子有___________个未成对电子,基态的价电子排布图为_________________。
(3)、K、O、F四种元素中第一电离能最小的是__________,电负性最大的是____________。
(4)下列说法错误的是__________。
A.元素的电负性: B.元素的第一电离能:
C.离子半径: D.原子的未成对电子数:
(5)过氧化氢()是一种医用消毒杀菌剂。已知的结构如图所示。不是直线形的,两个氢原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个与的夹角均为96°52′。
①的电子式为_______________,结构式为______________。
②中存在____________键和____________键,为______________(填“极性”或“非极性”)分子。
本溪市第一中学2023-2024学年高二上学期1月期末考试
化学试题
参考答案及评分意见
1.A 【解析】该元素为同族元素中原子序数最小的,所以该元素为第二周期或第四周期元素。又因其价电子数最外层电子数,可推出该元素应为第四周期元素,价电子排布式为,故为21号元素,位于d区,A项错误,B、C、D项正确。
2.D 【解析】为逆反应活化能,为正反应活化能,A项错误;该反应为放热反应,,B项错误;反应中能量较高且能发生有效碰橦的分子叫做活化分子,活化分子的平均能量高于所有分子的平均能量,C项错误;温度升高,反应速率增大,活化能不变,D项正确。
3.C 【解析】放热反应有利于反应的自发进行,但是不一定所有的放热反应都是自发反应,比如放热减的反应在高温下不能自发进行,A错误:熵增有利于反应的自发进行,但增不一定都是自发反应,比如吸热熵增的反应在低温下不能自发进行,B错误;判断反应能否自发进行,需要使用复合判据进行判断,即综合考虑体系的焓变和熵变,C正确;过程的自发性只能用于判断过程的方向,不能确定反应的快慢,D错误。
4.A 【解析】时,,所以;时,,所以;时,,所以。综上所述反应速率最快的为A项。
5.C 【解析】中反应历程图可知,在过渡态中,催化剂能够改变反应过程中的相对能量,改变的是反应的历榻,但是反应物和最终生成物不会改变,A正确;的相对能量为,的相对能量为1.25,所以转化为和时需要吸收能量,B正确;反应过程中生成过渡态1需要吸收的相对能量(1.91)比过渡态2的(2.02)小,所以过渡态1易达到,C错误:0.72为单个分子反应时放出的能量,则1发生反应放出0.72的能量,总反应的热化学方程式为 ,D正确。
6.D 【解析】“先拐先平”所以温度,A错误;时生成甲醇的物质的量大,该反应在时的平衡常数比时的大,B错误;,升高温度,甲醇的物质的量减小,平衡逆向移动,合成甲醇的反应为放热反应,C错误;处于A点的反应体系从变到时,升高温度,平衡逆向移动,达到平衡时增大,D正确。
7.A 【解析】小的先沉淀,先生成黄色沉淀可知,A正确;盐溶液的碱性越强,说明酸根离子易水解,对应得到的酸越强,所以的酸性弱于的,B错误;加入硝酸酸化的氯化钡溶液产生白色沉淀,原溶液中可能含或,C错误:加入少量固体,对铁离子与的配位反位无影响,平衡不移动,颜色不变,D错误。
8.D 【解析】A项只能表达元素是什么,包含信息最少;B项可以表达出原子核内有三个质子及原子核外电子的分层排布情况;C项可以进一步表达出能层和能级以及能级所容纳的电子数;D项则更进一步表达出每个能级对应的轨道、每个轨道所容纳的电子数目以及电子的自旋方向,D项符合题意,
9.D 【解析】中S的孤电子对数为,键电子对数为2,S的价层电子对数为4,VSEPR模型为四面体形,去掉孤电子对,的空间结构为V形;中B的孤电子对数为,键电子对数为3,B的价层电子对数为3,VSEPR模型为平面三角形,由于B没有孤电子对,的空间结构为平面三角形,D项正确。
10.C 【解析】短周期主族元素W,X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,由于最外层电子数不超过8,W的最外层电子数为4,W处于第ⅣA族,X的最外层电子数为3,X处于第ⅢA族,原子序数X大于W,W为C,X为;Z原子比X原子的核外电子数多4,Z的核外电子数为17,则Z为;Y的原子序数大于的,小于的,故Y为或P或S。同主族元素自上而下电负性逐渐减小,Y若为,则电负性,A项错误;同周期主族元素自左而右原子半径逐渐减小,一般来说电子层越多原子半径越大,故原子半径,B项错误;若Y、Z形成的分子为,中心原子形成4个键,无孤电子对,为杂化,正四面体形,C项正确;分子为,分子结构式为,每个双键中含有1个键、1个键,故键与键的数目之比为1∶1,D项错误。
11.C 【解析】由题图可知,温度越高,越小,则升高温度,平衡正向移动,则正反应为吸热反应,该反应的,A错误;起始越大,即促进转化的程度越大、越小,则图中Z的大小为,B错误;起始,转化时、以等物质的量转化,则X点对应的平衡混合物中,C正确;该反应为气体体积增大的反应,增大压强,平衡逆向移动,则温度不变时,图中X点对应的平衡在加压后增大,D错误。
12.B 【解析】由图可知,a膜释放出氢离子,是阳离子交换膜,b膜释放出氢氧根离子,是阴离子交换膜,故A项错误:放电时是原电泡,负极为铝,铝在负极失去电子生成铝离子,铝离子结合复合膜层电离出的氢氧根离子生成,负极的电极反应式为,故B项正确;放电时多孔纳米片为正极,二氧化碳在正极得到电子转化为甲醇,电极反应为,溶液仍呈中性,不变,故C项错误;放电时为负极,充电时与外接直流电源负极相评,将电能转化为化学能,故D项错误。
13.C 【解析】的容液浓度大于的溶液浓度,等体积混合后有大量剩余,溶液呈酸性,A错误;混合溶液中溶质为等物质的量浓度的和,溶液中存在电荷守恒和物料守恒,根据电荷守恒得,根据物料守恒得,所以得,B错误;常温下,该溶液中,,所以,,,C正确;为强碱弱酸盐,小部分在溶液中会发生水解,离子方程式为,则,又由于水会电离出部分,则,是由水电离出来的,量很少,则溶液中粒子浓度大小为,D错误。
14.D 【解析】25℃时,0.2溶液与0.2溶液等体积混合,两者恰好完全反应生成,混合溶液是盐溶液,溶液的,说明能发生水解,的水解能促进水的电离,酸或碱能抑制水的电离,所以混合溶液中由水电离出的大于0.2溶液中由水电离出的,A项正确;溶液等体积混合后,,能发生水解,所以,B项正确;溶液呈电中性,有,所以,C项正确:为弱碱,D项错。
15.B 【解析】、均为难溶物,饱和溶液中,同理可知溶液中,因,则,由此可知线①为与的关系,曲线②为与的关系,A项错误;当溶液中时,,则,因此,B项正确:向饱和溶液中加入适量固体后,溶液中增大,根据温度不变则不变可知,溶液中将减小,因此将由a点沿线②向左上方移动,C项错误;由图可知,当溶液中时,两溶液中,D项错误。
16.(15分)
(1)①BC(2分) ②BD(2分)
(2) (2分)
(3)①吸热(1分) ②6.75(2分
(4)①(2分) ②14(2分) ③1.68(2分)
【解析】(1)①使用催化剂,只增大反应速率,达到平衡所用时间少,因此,,,催化剂对化学平衡无影响,两个阴影面积相等,故B、C正确。②正反应是放热反应,容器是绝热容器,随着反应进行,温度升高,反应速率增大,当达到平衡反应速率不再改变,但根据图像,时刻后反应速率还在改变,说明时刻没有达到平衡,A错误;时刻后K不再改变,说明反应达到平衡,B正确;达到平衡时物质的量不再改变,但根据图像,时刻后物质的量还在发生变化,说明没有达到平衡,C错误:根据化学平衡状态的定义,达到平衡时体积分数不再改变,根据图像,时刻达到平衡,D正确。(2)①,②,③,①②③得: 。(3)①化学平衡常数只受温度的影响,根据表格数据,随着温度的升高,平衡常数增大,说明升高温度使平衡正向移动,即正反应是吸热反应。②列“三段式”:
1 1 0 0
0.5 0.5 0.5 1.5
0.5 0.5 0.5 0.5
。(4)①电解质呈酸性,因此负极反应式为 ②,0.1全部电解,产生氢气的物质的量为0.05,然后电解一部分水,又产生0.05。电解溶液产生,,则,即。③根据②的分析,阳极上产生气体为0.05和0.025,其体积为。
17.(13分)
(1)C(2分)
(2)蒸发浓缩、冷却结晶(2分)
(3)中和溶液中的,使完全沉淀(2分)
(4)(2分) 滴入最后半滴高锰酸钾标准溶液,溶液由无色变为粉红色,且半分钟内不褪色(2分)
(5)93.3%(3分)
【解析】(1)过滤时要用到漏斗,灼烧时要用到坩埚,滴定时要用到酸式滴定管,则步骤Ⅰ和Ⅱ中不需要使用的仪器是圆底烧瓶。
(2)从滤液中得到固体,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到。
(3)加入蒸馏水及适量稀盐酸溶解产品后所得溶液为酸性溶液,酸性溶液中加入溶液,会与氢离子反应导致浓度降低而不能生成沉淀,则向溶液中滴加氨水调节为4~5的目的是中和溶液中的氢离子,有利于钙离子完全转化为草酸钙沉淀。
(4)用高锰酸钾标准溶液滴定待测液的反应原理为;当完全反应时,再滴入半滴高锰酸钾溶液,溶液由无色变为粉红色,且半分钟内不褪色,说明达到滴定终点。
(5)由题意可得如下关系式:,则的物质的量为,产品中葡萄糖酸钙晶体的纯度为。
18.(每空2分,共12分)
(1)
(2)
(3)ACD
(4)D
(5)>
【解析】(1)滴定前氨水中,利用水的离子积常数可得,一水合氨的电离平衡常数。(2)在b点时,溶质为和氯化铵,的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用;在c点时,溶质为和氯化铵,溶液为中性,对水的电离平衡无影响;在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡起到促进作用;所以b、c、d三点时的溶液中,水电离的大小顺序是。(3)温度不变,水的离子积常数不变,所以不变,A项正确;由b点到c点的过程中,增大,不断减小,故增大,B项错误,,温度不变,电离平衡常数不变,C项正确;,温度不变,该比值也不变,D项正确。(4)由图像可知,点b所示溶液中溶质为等物质的量的和,溶液呈碱性,说明的电离程度大于的水解程度,由电荷守恒可知:,物料守恒为:,质子守恒为:;A项错误;点c时,即,由电荷守恒可知:,故,B项错误;点d恰好完全反应生成,溶液呈酸性,则,C项错误;当较多,滴入的盐酸较少时,生成较少,溶液中浓度远大于浓度,可能出现,D项正确。(5)溶液显中性,所以,根据电荷守恒可得:,故,氯化铵水溶液呈酸性,要使溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则镀水的物质的量浓度大于盐酸的,溶液中,,,电离常数只与温度有关,则此时的电离常数。
19.(15分)
(1)(或)(1分) (1分)
(2)4(1分)(2分)
(3)K(1分) F(1分)
(4)B(1分
(5)①(2分) (1分)
②极性(1分) 非极性(1分) 极性(2分)
【解析】(1)硅元素为14号元素,原子核外有14个电子,其基态原子核外电子排布式为(或);硫元素为16号元素,原子核外有16个电子,所以其基态原子核外电子排布式为,则其价电子排布式为。
(2)为26号元素,原子核外有26个电子,基态铁原子核外电子排布式为,则有4个未成对电子;的价电子排布式为,其价电子排布图为。
(3)通常情况下,元素的金属性越强,其第一电离能越小,则、K、O、F四种元素中K的第一电离能最小;元素的非金属性越强,其电负性越大,所以的电负性最大。
(4)得电子能力,所以元素的电负性:,A正确;C的电子排布式为,N的电子排布式为,p轨道处于半充满状态,O的电子排布式为,第一电离能应该是N的最大,则元素的第一电离能:,B错误;电子层数相同时,核电荷数越大半径越小,则离子半径:,C正确;原子、、的未成对电子数分别为5、2、1,即原子的未成对电子数:,D正确。
(5)的空间结构为不对称结构,应为极性分子,含有非极性键和极性键。
同课章节目录
