北京市第四中学2023-2024学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 北京市第四中学2023-2024学年高二上学期期末考试化学试题(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 613.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-05 11:36:48 | ||
图片预览

文档简介
北京四中2023-2024学年度第一学期期末试卷
高二化学
(试卷满分为150分,考试时间为90分钟)
(本试卷共两部分,第一部分100分,第二部分50分。以下为第二部分内容)
一、单项选择题(本大题共5小题,每小题4分,共20分。在每小题给出的四个选项中,只有一个选项正确)
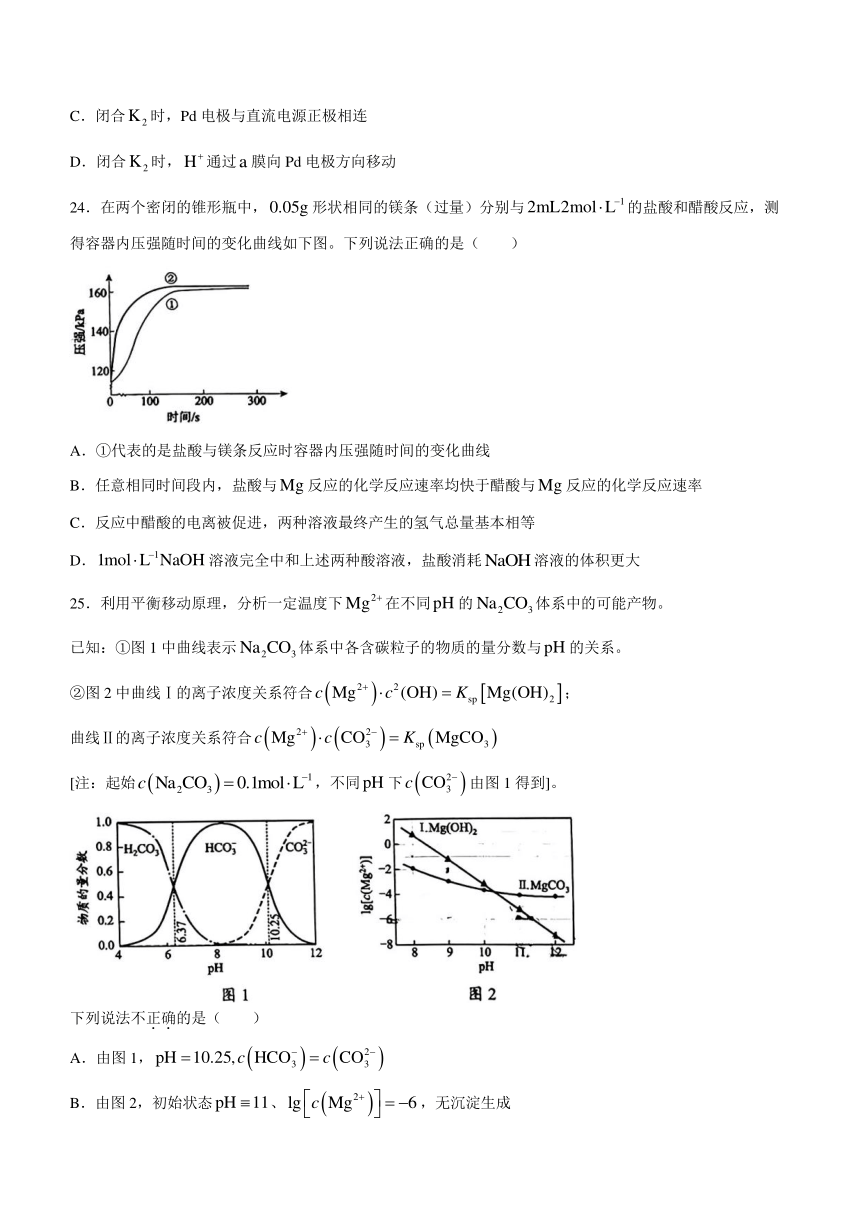
21.下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )
A.键的键能小于键的键能
B.三氟乙酸的大于三氯乙酸的
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在,而气态氯化氢中是分子
22.可以以单体、二聚体和多聚体的形式存在。下列关于的说法不正确的是( )
单体 二聚体 多聚体
A.单体是非极性分子 B.二聚体的沸点比单体更高
C.多聚体是平面结构 D.二聚体和多聚体中均存在配位键
23.我国科学家研发了一种水系可逆电池,电池工作时,复合膜(由、膜复合而成)层间的解离成和,在外加电场中可透过相应的离子膜定向移动。当闭合时,电池工作原理如图所示:
下列说法不正确的是( )
A.闭合时,表面的电极反应式为
B.闭合时,反应一段时间后,溶液的减小
C.闭合时,Pd电极与直流电源正极相连
D.闭合时,通过膜向Pd电极方向移动
24.在两个密闭的锥形瓶中,形状相同的镁条(过量)分别与的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法正确的是( )
A.①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线
B.任意相同时间段内,盐酸与反应的化学反应速率均快于醋酸与反应的化学反应速率
C.反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等
D.溶液完全中和上述两种酸溶液,盐酸消耗溶液的体积更大
25.利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。
已知:①图1中曲线表示体系中各含碳粒子的物质的量分数与的关系。
②图2中曲线Ⅰ的离子浓度关系符合;
曲线Ⅱ的离子浓度关系符合
[注:起始,不同下由图1得到]。
下列说法不正确的是( )
A.由图1,
B.由图2,初始状态、,无沉淀生成
C.由图2,初始状态、,平衡后溶液中存在
D.由图1和图2,初始状态、,发生反应:
二、填空题(共30分)
26.(14分)碳酸二甲酯
26.(14分)碳酸二甲酯()是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
i.
ii.
(1)碳酸二甲酯分子中1号碳原子的杂化类型是______。
(2)中,基态的价电子排布式为______,在生产碳酸二甲酯的反应过程中所起的作用是______。
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受(价铜元素)浓度的影响。
ii.在甲醇中溶解度较小,且其中的易被氧化为难溶的。
iii.加入4甲基咪唑()可与形成配合物,可提高甲醇的转化率。
4-甲基咪唑中,1号原子的孤电子对因参与形成大键,电子云密度降低。请结合信息回答以下问题。
①4-甲基咪唑中,1-4号原子(填“在”或“不在”)同一平面上,______(填“1”或“3”)号原子更容易与形成配位键。1号原子的杂化类型是______。
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是______(填序号)。
a.配合物中的-结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免被氧化为难溶的
c.形成的配合物能增大反应的限度
27.(16分)黄铜矿(主要成分为)可用于冶炼,主要物质转化过程如下:
(1)与共热制备的反应中,化合价升高的元素是______。
(2)中心原子的杂化方式是______,用价层电子对互斥理论解释的空间结构______。
(3)下图中,表示晶胞的是______(填“图1”或“图2”)。
(4)与都可视为离子晶体,且结构相似,但的熔点比的高约,原因是______。
(5)的晶胞如图3所示。
①图4所示结构单元不能作为晶胞的原因是______。
②从图3可以看出,每个晶胞中含有的原子个数为______。
③已知:晶体的密度是,阿伏伽德罗常数的值为。
晶胞中底边边长______(用计算式表示;的摩尔质量为)。
参考答案
第二部分 共 50 分
一、单项选择题(共 5 小题,每小题 4 分,共 20 分)
题号 21 -25
答案 A C D C C
二、填空题(共 2 小题,共 30 分)
26. (14 分)
(1)sp2
(2)3d10 催化剂
(3)①在 3 sp3 ② b
27. (16 分)
(1)S
(2)sp2
中心 S 原子的价层电子对数为 3,VSEPR 模型为平面三角形,中心 S 原子的孤电子对数为 1,空间结构为 V 形
(3)图 1
(4)二者同属离子晶体,且结构相似,但离子半径 O 2-<S 2-,晶体中的离子间距 Cu2O<Cu2S,离子键作用强度(或晶格能) Cu2O>Cu2S,因此熔点 Cu2O>Cu2S
(5)①图 4 中上底面中心的黑色原子(Fe)无法与下底面中心的白色原子(Cu)在平移之后实现无隙并置
②
高二化学
(试卷满分为150分,考试时间为90分钟)
(本试卷共两部分,第一部分100分,第二部分50分。以下为第二部分内容)
一、单项选择题(本大题共5小题,每小题4分,共20分。在每小题给出的四个选项中,只有一个选项正确)
21.下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )
A.键的键能小于键的键能
B.三氟乙酸的大于三氯乙酸的
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在,而气态氯化氢中是分子
22.可以以单体、二聚体和多聚体的形式存在。下列关于的说法不正确的是( )
单体 二聚体 多聚体
A.单体是非极性分子 B.二聚体的沸点比单体更高
C.多聚体是平面结构 D.二聚体和多聚体中均存在配位键
23.我国科学家研发了一种水系可逆电池,电池工作时,复合膜(由、膜复合而成)层间的解离成和,在外加电场中可透过相应的离子膜定向移动。当闭合时,电池工作原理如图所示:
下列说法不正确的是( )
A.闭合时,表面的电极反应式为
B.闭合时,反应一段时间后,溶液的减小
C.闭合时,Pd电极与直流电源正极相连
D.闭合时,通过膜向Pd电极方向移动
24.在两个密闭的锥形瓶中,形状相同的镁条(过量)分别与的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法正确的是( )
A.①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线
B.任意相同时间段内,盐酸与反应的化学反应速率均快于醋酸与反应的化学反应速率
C.反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等
D.溶液完全中和上述两种酸溶液,盐酸消耗溶液的体积更大
25.利用平衡移动原理,分析一定温度下在不同的体系中的可能产物。
已知:①图1中曲线表示体系中各含碳粒子的物质的量分数与的关系。
②图2中曲线Ⅰ的离子浓度关系符合;
曲线Ⅱ的离子浓度关系符合
[注:起始,不同下由图1得到]。
下列说法不正确的是( )
A.由图1,
B.由图2,初始状态、,无沉淀生成
C.由图2,初始状态、,平衡后溶液中存在
D.由图1和图2,初始状态、,发生反应:
二、填空题(共30分)
26.(14分)碳酸二甲酯
26.(14分)碳酸二甲酯()是一种绿色化工原料。用于汽车、医疗器械等领域。以甲醇为原料生产碳酸二甲酯的反应过程如下。
i.
ii.
(1)碳酸二甲酯分子中1号碳原子的杂化类型是______。
(2)中,基态的价电子排布式为______,在生产碳酸二甲酯的反应过程中所起的作用是______。
(3)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受(价铜元素)浓度的影响。
ii.在甲醇中溶解度较小,且其中的易被氧化为难溶的。
iii.加入4甲基咪唑()可与形成配合物,可提高甲醇的转化率。
4-甲基咪唑中,1号原子的孤电子对因参与形成大键,电子云密度降低。请结合信息回答以下问题。
①4-甲基咪唑中,1-4号原子(填“在”或“不在”)同一平面上,______(填“1”或“3”)号原子更容易与形成配位键。1号原子的杂化类型是______。
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是______(填序号)。
a.配合物中的-结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免被氧化为难溶的
c.形成的配合物能增大反应的限度
27.(16分)黄铜矿(主要成分为)可用于冶炼,主要物质转化过程如下:
(1)与共热制备的反应中,化合价升高的元素是______。
(2)中心原子的杂化方式是______,用价层电子对互斥理论解释的空间结构______。
(3)下图中,表示晶胞的是______(填“图1”或“图2”)。
(4)与都可视为离子晶体,且结构相似,但的熔点比的高约,原因是______。
(5)的晶胞如图3所示。
①图4所示结构单元不能作为晶胞的原因是______。
②从图3可以看出,每个晶胞中含有的原子个数为______。
③已知:晶体的密度是,阿伏伽德罗常数的值为。
晶胞中底边边长______(用计算式表示;的摩尔质量为)。
参考答案
第二部分 共 50 分
一、单项选择题(共 5 小题,每小题 4 分,共 20 分)
题号 21 -25
答案 A C D C C
二、填空题(共 2 小题,共 30 分)
26. (14 分)
(1)sp2
(2)3d10 催化剂
(3)①在 3 sp3 ② b
27. (16 分)
(1)S
(2)sp2
中心 S 原子的价层电子对数为 3,VSEPR 模型为平面三角形,中心 S 原子的孤电子对数为 1,空间结构为 V 形
(3)图 1
(4)二者同属离子晶体,且结构相似,但离子半径 O 2-<S 2-,晶体中的离子间距 Cu2O<Cu2S,离子键作用强度(或晶格能) Cu2O>Cu2S,因此熔点 Cu2O>Cu2S
(5)①图 4 中上底面中心的黑色原子(Fe)无法与下底面中心的白色原子(Cu)在平移之后实现无隙并置
②
同课章节目录
