广东省江门市2023-2024学年高二上学期1月期末考试化学试题(含答案)
文档属性
| 名称 | 广东省江门市2023-2024学年高二上学期1月期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 664.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-05 12:00:14 | ||
图片预览



文档简介
江门市2023-2024学年高二上学期1月期末考试
化学
本试卷9页,20小题,满分100分.考试时间75分钟.
注意事项:
1.答题前,务必将自己的姓名、准考证号填写在答题卡规定的位置上.
2.做选择题时,必须用2B铅笔将答题卷上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号.
3.答非选择题时,必须用黑色字迹钢笔或签字笔,将答案写在答题卡规定的位置上.
4.所有题目必须在答题卡上作答,在试题卷上作答无效.
5.考试结束后,将答题卡交回.
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 C1 35.5 Fe 56 Cu 64
一、选择题:本题共16小题,第1~10题每小题2分;第11~16题每小题4分,共44分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.《天工开物》记载火药涉及的主要反应为:.下列相关微粒的化学用语正确的是( )
A.中子数为8的碳原子:
B.基态原子能级电子轨道表示式:
C.的结构示意图:
D.钾原子价层电子排布式:
2.常见的非金属元素和金属元素及其化合物是中学化学核心知识.下列说法正确的是( )
A.第一电离能: B.电负性:
C.最高正化合价: D.离子半径:
3.能量以各种不同的形式呈现在人们面前.下列说法不正确的是( )
A.利用液氢作为火箭发射的燃料,液氢燃烧的过程实现了电能转化为化学能
B.北京冬奥会多个场馆引入光伏发电系统,该系统能将太阳能直接转化为电能
C.曹植诗句“竟豆燃豆其,豆在釜中泣”,“燃豆其”的过程中化学能转化为热能
D.水能、风能、潮汐能均属于可再生能源
4.与反应能量转化关系如下图所示,一下列说法不正确的是( )
A.化学键断裂吸收能量,化学键形成放出能量
B.中的化学键断裂时需要吸收的能量
C.化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因
D.该反应的热化学方程式为:
5.在一定条件下的密闭容器中发生反应,当达到平衡时,下列各项措施中,既能提高反应速率又能提高乙烷平衡转化率的是( )
A.减小容器的容积 B.升高反应的温度 C.分离出部分氢气 D.恒容下通入氦气
6.硫酸工业中涉及反应:.下表为不同温度和压强下的平衡转化率,下列说法正确的是( )
温度 的平衡转化率/%
450 97.5 99.2 99.7
550 85.6 94.9 98.3
A.工业上通入过量空气的主要目的是加快反应速率
B.回收尾气中的仅为了防止空气污染
C.采用常压生产是因为平衡时的转化率已足够高,增大压强会增加设备成本
D.选择的较高温度既提高反应速率也提高平衡转化率
7.溶液中,如果要使更接近于,可以采取的措施是( )
A.加入适量水 B.加入少量溶液 C.通入适量气体 D.加热
8.被完全沉淀时溶液的如下表.某硫酸锌酸性溶液中含有少量杂质,为制得纯净的,应加入的试剂是( )
金属离子
完全沉淀时的 8.3 3.2 8.2
A. B.氨水 C. D.溶液
9.我国科学家发明一种新型电池,该电池以碳纳米管为正极,锌线为负极,放电时消耗二氧化碳,同时生成天然气.放电时,下列说法正确的是( )
A.将电能转化为化学能 B.负极发生还原反应
C.阳离子由正极移向负极 D.正极产物为
10.城镇地面下常埋有纵横交错的金属管道,地面上还铺有铁轨.一定条件下,某含碳钢腐蚀情况与溶液的关系如下表:
2 4 6 6.5 8 13.5 14
腐蚀快慢 较快 慢 较快
主要产物
下列说法正确的是( )
A.含碳钢在中性环境腐蚀较慢
B.当时,主要发生析氢腐蚀
C.当时,负极的电极反应式为:
D.采用外加电流法时,需外接镁、锌等作辅助阳极
11.硒是人体健康必需的一种微量元素,在元素周期表中第四周期第ⅥA族.下列说法不正确的是( )
A.位于周期表区
B.基态原子核外电子排布式是
C.硒原子的核外电子共占据18个原子轨道
D.硒元素的最高正化合价是
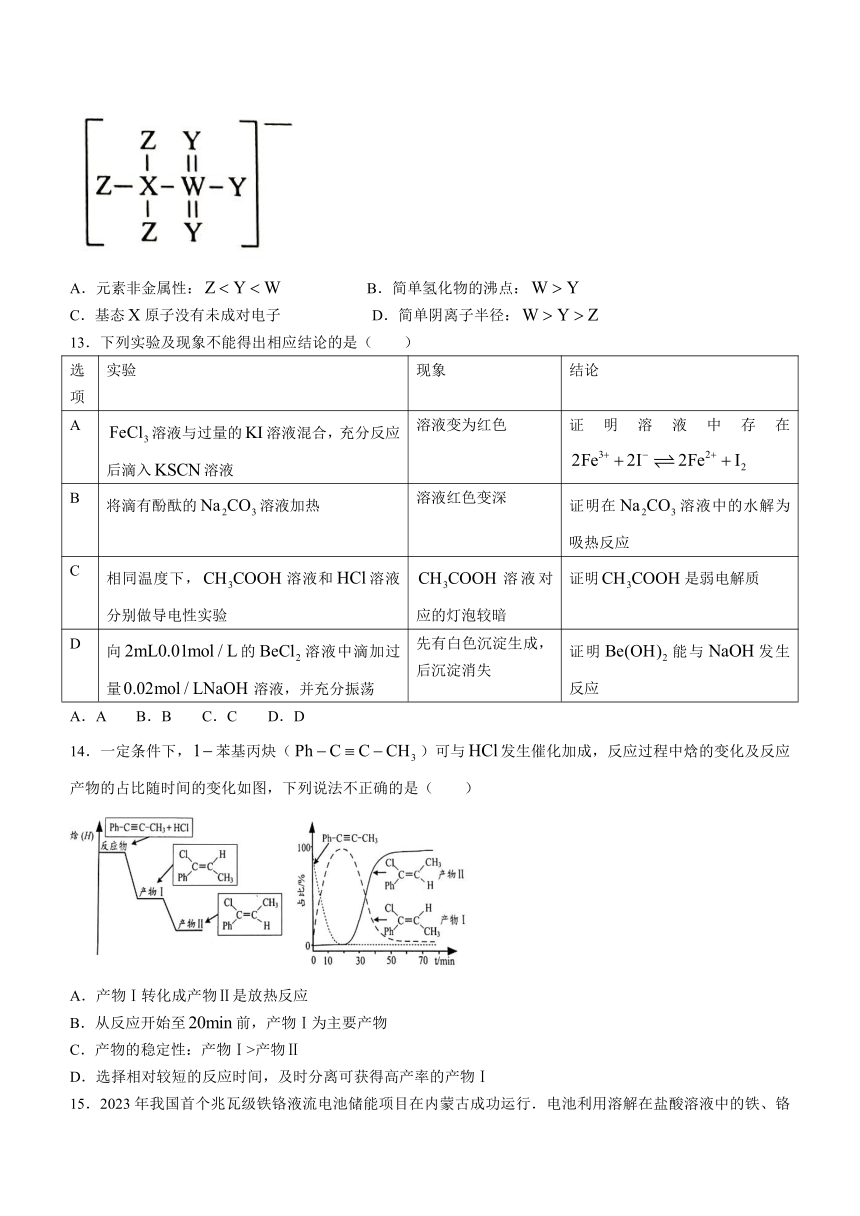
12.我国科学家用大阴离子(如图所示)的锌盐溶液作电解液,设计制备了水系锌离子电池,均为短周期元素,位于同一周期,最外层电子数相等.下列叙述正确的是( )
A.元素非金属性: B.简单氢化物的沸点:
C.基态原子没有未成对电子 D.简单阴离子半径:
13.下列实验及现象不能得出相应结论的是( )
选项 实验 现象 结论
A 溶液与过量的溶液混合,充分反应后滴入溶液 溶液变为红色 证明溶液中存在
B 将滴有酚酞的溶液加热 溶液红色变深 证明在溶液中的水解为吸热反应
C 相同温度下,溶液和溶液分别做导电性实验 溶液对应的灯泡较暗 证明是弱电解质
D 向的溶液中滴加过量溶液,并充分振荡 先有白色沉淀生成,后沉淀消失 证明能与发生反应
A.A B.B C.C D.D
14.一定条件下,苯基丙炔()可与发生催化加成,反应过程中焓的变化及反应产物的占比随时间的变化如图,下列说法不正确的是( )
A.产物Ⅰ转化成产物Ⅱ是放热反应
B.从反应开始至前,产物Ⅰ为主要产物
C.产物的稳定性:产物Ⅰ>产物Ⅱ
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
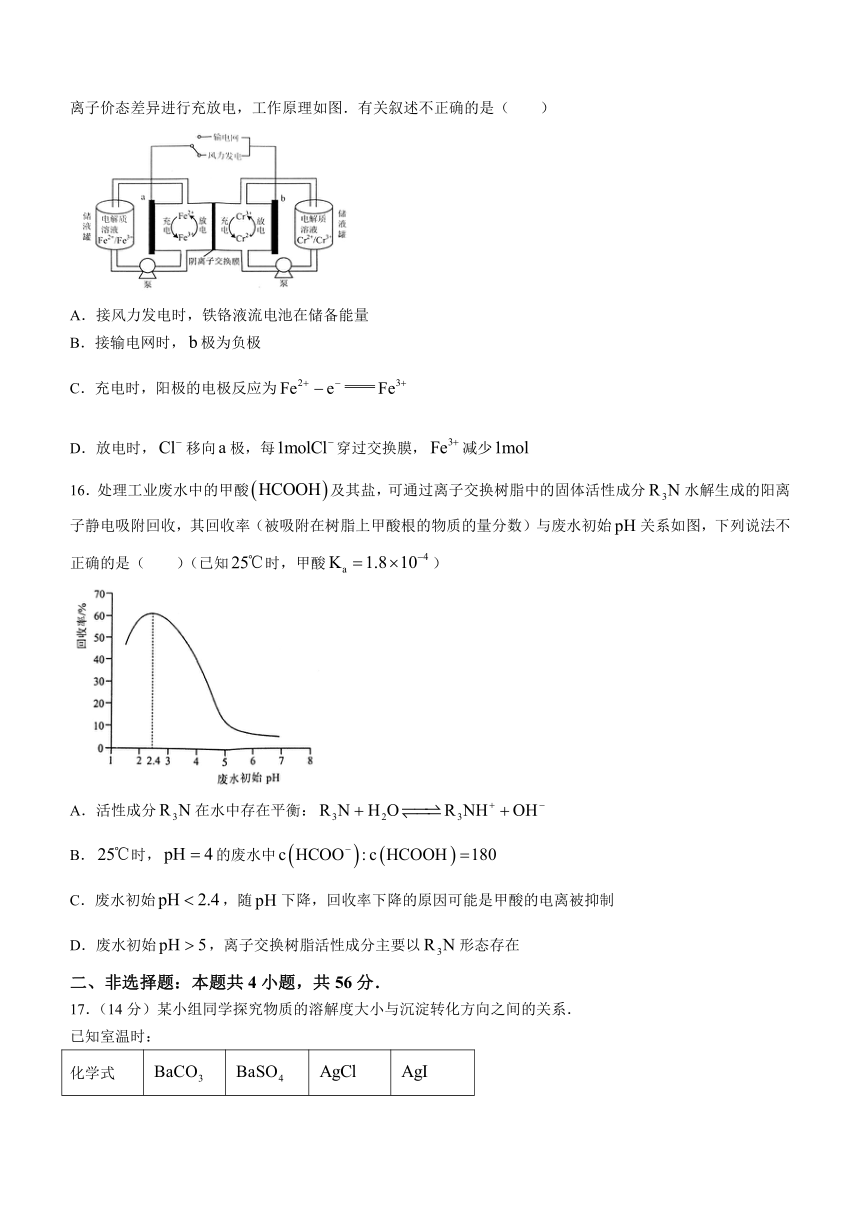
15.2023年我国首个兆瓦级铁铬液流电池储能项目在内蒙古成功运行.电池利用溶解在盐酸溶液中的铁、铬离子价态差异进行充放电,工作原理如图.有关叙述不正确的是( )
A.接风力发电时,铁铬液流电池在储备能量
B.接输电网时,极为负极
C.充电时,阳极的电极反应为
D.放电时,移向极,每穿过交换膜,减少
16.处理工业废水中的甲酸及其盐,可通过离子交换树脂中的固体活性成分水解生成的阳离子静电吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图,下列说法不正确的是( )(已知时,甲酸)
A.活性成分在水中存在平衡:
B.时,的废水中
C.废水初始,随下降,回收率下降的原因可能是甲酸的电离被抑制
D.废水初始,离子交换树脂活性成分主要以形态存在
二、非选择题:本题共4小题,共56分.
17.(14分)某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系.
已知室温时:
化学式
溶解度
(1)探究和之间的转化
试剂 试剂 试剂 加入盐酸后的现象
实验Ⅰ ……
实验Ⅱ 有少量气泡产生,沉淀部分溶解
①上述实验过滤操作中不需要用到的实验仪器是_______________(写仪器名称).
②实验Ⅰ中,往试剂加入试剂后发生反应的离子方程式是_______________.
③实验Ⅰ说明全部转化为,依据的现象是加入盐酸后,_______________.
④实验Ⅱ说明沉淀部分转化为,结合平衡移动原理,解释生成的原因:_______________.
(2)探究和之间的转化
实验Ⅲ:
①实验Ⅲ为了探究转化为,甲溶液可以是_______________(填序号).
A.溶液 B.溶液 C.溶液
②请通过计算说明转化成的反应程度:_______________(写出主要计算过程,已知室温时:).
(3)结合上述实验探究,可得出结论:_______________(写出其中一个).
18.(15分)
尿素合成的发展体现了化学科学与技术的不断进步.
(1)十九世纪初,用氰酸银与在一定条件下反应制得,实现了由无机物到有机物的合成.该反应的化学方程式是_______________.
(2)二十世纪初,工业上以和为原料在一定温度和压强下合成尿素.反应分两步:
ⅰ.和生成:
ⅱ.分解生成尿素.反应过程中能量变化如图所示
①工业上以和为原料合成尿素反应为_______________反应.(填“吸热”或“放热”)
②反应ⅰ和反应ⅱ活化能大小比较:反应ⅰ_______________反应ii.(填“>”、“<”或“=”)
③_______________.(用等表示)
(3)尿素样品含氮量的测定方法如下.
已知:溶液中不能直接用溶液准确滴定.
①消化液中的含氮粒子是,步骤2反应的离子方程式为:_______________.
②步骤4中标准溶液的浓度和消耗的体积分别为和,计算样品含氮量时,除了需要知道样品的质量外,还需要的实验数据有_______________.(填编号)
A.步骤1所加入溶液的体积和浓度
B.步骤2所加入溶液的体积和浓度
C.步骤3所加入溶液的体积和浓度
(4)①N元素的第一电离能比O元素的第一电离能高原因是_______________.
②焰色试验中,钠元素产生的火焰呈_______________色,钠元素产生的火焰与钾的不同,原因是_______________.
19.(13分)“碳中和”是国家战略,其目的是实现的排放量和利用量达到相等,将资源化是实现“碳中和”目标的重要手段.回答下列问题:
(1)下列措施有利于“碳中和”的是_______________(填标号).
A.植树造林,发展绿色经济 B.通过裂化将重油转化为汽油
C.在燃煤中添加或 D.大力开采和使用可燃冰
(2)和在催化剂作用下发生反应可合成清洁能源甲醇:
①已知该反应的正反应率(为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中_______________.
1 0.02 0.01
2 0.04 0.01
②在一定条件下,体系中的平衡转化率与和的关系如图所示,和分别表示温度或压强.表示的物理量是_______________(填“温度”或“压强”),_______________(填“>”或“<”).
③为探究该反应原理,进行如下实验:在一恒温,体积为恒容密闭容器中,充入和,进行该反应(不考虑其它副反应),平衡时测得的物质的量为.则该温度下平衡常数_______________(保留2位有效数字).
(3)若和按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为时,图中点_______________(填“是”或“不是”)处于平衡状态.之后,甲醇产率下降,请分析其变化产生可能的原因:_______________.(写出其中一种).
(4)是一种廉价的碳资源,其综合利用具有重要意义.可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______________极,该电极反应式是:_______________.
20.(14分)硫及其化合物在生产生活中具有广泛的应用,根据所学知识,回答下列问题:
(1)溶液显_______________性,判断的理由是_______________(用离子方程式表示),若将该溶液蒸干,最终所得固体为_______________(填化学式).
(2)的溶液中,各离子浓度由大到小的关系为_______________.
(3)常温下,在某混合溶液中,部分含硫微粒的物质的量分数随的变化曲线如图所示,根据图示,的水解平衡常数_______________.
(4)常温下,某浓度的溶液中:
①为_______________(填“强”或“弱”)电解质.
②往溶液中滴加少量的溶液,发生反应的离子方程式为_______________,此时所得溶液的_______________(填“变大”、“变小”或“不变”).
(5)在的溶液中加入等体积溶液,有黑色沉淀生成,反应后溶液中_______________[已知:](忽略溶液混合时体积的变化).
江门市2023-2024学年高二上学期1月期末考试
化学参考答案
一、选择题:本题共16小题,第1~10题每小题2分;第11~16题每小题4分,共44分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.B 2.A 3.A 4.D 5.B 6.C 7.C 8.A 9.D 10.A
11.D 12.D 13.C 14. C 15.D 16.B
二、非选择题:本题共4小题,共56分。
1、无机化学方程式、离子方程式、电极反应式:化学式错给0分;化学式全对给1分;配平错漏、“↑”“↓”符号、条件、等号等其他错漏每式合扣1分。
2、有机方程式:结构简式书写错误给0分;结构简式全对给1分,配平错漏、条件、“H2O”、“↑”、“↓”用等号等其他错漏每式合扣1分。
3、对文字表述的其他合理答案同样给分,但关键字词错误不给分。
4、下列情况不给分:答错位置,作答小题序号与原题不一致。
17.(14分)
(1)① 酸式滴定管、分液漏斗
(2分,其中每个仪器名称1分,有错别字不给分,漏写“酸式”不给分,多写答案0分)
②Ba2++CO2- 3 = BaCO3↓ (2分,漏“↓”扣1分)
③ 无气泡产生,沉淀不溶解。
(2分,“沉淀不溶解”或“无气泡产生”均得2分)
④ BaSO4在溶液中存在BaSO4(s) Ba2+(aq) +SO2-4(aq),当加入浓度较高的Na2CO3溶液, CO2-3与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动。
或:BaSO4(s)+ CO2-3(aq) BaCO3(s) + SO2-4(aq),当加入较浓的Na2CO3溶液时,该转化反应平衡正移,BaSO4 转化为BaCO3。
(2分,利用沉淀转化平衡解释合理的得2分;正确书写沉淀溶解平衡方程式可得1分,合理即可)
(2)① B(2分)
②转化反应 AgCl (s)+ I- (aq) AgI (s) + Cl- (aq)
其平衡常数 K== (1分)
说明该反应平衡常数K>105(很大),即该转化反应正向进行程度大(1分)。
(计算过程列式或代入数值和计算结果正确得1分,计算结果为2×106也给分;说明结论正确得1分。其他合理的计算与说明也给2分。若K计算错误,但结论正确的可得1分)
(3)溶解度小的沉淀容易转化成溶解度更小的沉淀。
或:溶解度小的沉淀难以转化成溶解度大的沉淀。
或:溶解度差别越大,由溶解度大的沉淀转化为溶解度较小的沉淀越容易实现。
(2分,写其中一点即可,其他合理也给分,“溶解度”写作“Ksp”也给2分)
18.(15分)
(1)AgCNO+NH4ClCO(NH2)2+AgCl (2分,“一定条件”、“↓”不作要求)
(2)① 放热(1分) ② < (1分)
③ E1-E2+ E3-E4或E1+ E3-(E2+E4)或E1+ E3-E2-E4 (2分,合理即可)
(3)① NH+ 4+OH-H2O+ NH3↑ (2分) ② c(2分)
(4)① N的电子排布是半充满(1分),比较稳定,电离能较高(1分)。
或O失去的是已经配对的电子,配对的电子相互排斥,电离能较低(合理即可)
② 黄(1分)钠与钾的原子结构不同(1分),电子跃迁时能量的变化不同,放出的光波长不同(1分)(合理即可)
19.(13分)
(1)A(1分)
(2)① 4.0×10 4或4×10 4(2分)
②压强 (1分) <(1分)
③ 3.1 (2分,有效数字错漏扣1分)
(3)不是 (1分)
该反应是放热反应,达到平衡后升高温度,平衡逆向移动,产率下降。
或:温度升高,催化剂活性降低,导致速率下降,产率下降(2分,合理即可)
(4)阴(1分) CO2+6H++6e-=CH3OH+H2O (2分)
20.(14分)
(1)酸(1分);Al3++3H2OAl(OH)3+3H+(2分) Al2(SO4)3(1分)
(2)c(NH+ 4)>c(SO2-4)>c(H+)>c(OH )(2分,不写“c”,离子排序正确给1分)
(3)1.0×10 6.8 或1×10 6.8或10 6.8(2分)
(4)①强(1分)
② 2SO2-3+HClO=SO2-4+HSO- 3+Cl (2分,写SO2-3+HClO=SO2-4+H++Cl 给1分) 变小(1分)
(5)6.3×10 34mol/L(2分,错漏单位扣1分)
化学
本试卷9页,20小题,满分100分.考试时间75分钟.
注意事项:
1.答题前,务必将自己的姓名、准考证号填写在答题卡规定的位置上.
2.做选择题时,必须用2B铅笔将答题卷上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号.
3.答非选择题时,必须用黑色字迹钢笔或签字笔,将答案写在答题卡规定的位置上.
4.所有题目必须在答题卡上作答,在试题卷上作答无效.
5.考试结束后,将答题卡交回.
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 C1 35.5 Fe 56 Cu 64
一、选择题:本题共16小题,第1~10题每小题2分;第11~16题每小题4分,共44分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.《天工开物》记载火药涉及的主要反应为:.下列相关微粒的化学用语正确的是( )
A.中子数为8的碳原子:
B.基态原子能级电子轨道表示式:
C.的结构示意图:
D.钾原子价层电子排布式:
2.常见的非金属元素和金属元素及其化合物是中学化学核心知识.下列说法正确的是( )
A.第一电离能: B.电负性:
C.最高正化合价: D.离子半径:
3.能量以各种不同的形式呈现在人们面前.下列说法不正确的是( )
A.利用液氢作为火箭发射的燃料,液氢燃烧的过程实现了电能转化为化学能
B.北京冬奥会多个场馆引入光伏发电系统,该系统能将太阳能直接转化为电能
C.曹植诗句“竟豆燃豆其,豆在釜中泣”,“燃豆其”的过程中化学能转化为热能
D.水能、风能、潮汐能均属于可再生能源
4.与反应能量转化关系如下图所示,一下列说法不正确的是( )
A.化学键断裂吸收能量,化学键形成放出能量
B.中的化学键断裂时需要吸收的能量
C.化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因
D.该反应的热化学方程式为:
5.在一定条件下的密闭容器中发生反应,当达到平衡时,下列各项措施中,既能提高反应速率又能提高乙烷平衡转化率的是( )
A.减小容器的容积 B.升高反应的温度 C.分离出部分氢气 D.恒容下通入氦气
6.硫酸工业中涉及反应:.下表为不同温度和压强下的平衡转化率,下列说法正确的是( )
温度 的平衡转化率/%
450 97.5 99.2 99.7
550 85.6 94.9 98.3
A.工业上通入过量空气的主要目的是加快反应速率
B.回收尾气中的仅为了防止空气污染
C.采用常压生产是因为平衡时的转化率已足够高,增大压强会增加设备成本
D.选择的较高温度既提高反应速率也提高平衡转化率
7.溶液中,如果要使更接近于,可以采取的措施是( )
A.加入适量水 B.加入少量溶液 C.通入适量气体 D.加热
8.被完全沉淀时溶液的如下表.某硫酸锌酸性溶液中含有少量杂质,为制得纯净的,应加入的试剂是( )
金属离子
完全沉淀时的 8.3 3.2 8.2
A. B.氨水 C. D.溶液
9.我国科学家发明一种新型电池,该电池以碳纳米管为正极,锌线为负极,放电时消耗二氧化碳,同时生成天然气.放电时,下列说法正确的是( )
A.将电能转化为化学能 B.负极发生还原反应
C.阳离子由正极移向负极 D.正极产物为
10.城镇地面下常埋有纵横交错的金属管道,地面上还铺有铁轨.一定条件下,某含碳钢腐蚀情况与溶液的关系如下表:
2 4 6 6.5 8 13.5 14
腐蚀快慢 较快 慢 较快
主要产物
下列说法正确的是( )
A.含碳钢在中性环境腐蚀较慢
B.当时,主要发生析氢腐蚀
C.当时,负极的电极反应式为:
D.采用外加电流法时,需外接镁、锌等作辅助阳极
11.硒是人体健康必需的一种微量元素,在元素周期表中第四周期第ⅥA族.下列说法不正确的是( )
A.位于周期表区
B.基态原子核外电子排布式是
C.硒原子的核外电子共占据18个原子轨道
D.硒元素的最高正化合价是
12.我国科学家用大阴离子(如图所示)的锌盐溶液作电解液,设计制备了水系锌离子电池,均为短周期元素,位于同一周期,最外层电子数相等.下列叙述正确的是( )
A.元素非金属性: B.简单氢化物的沸点:
C.基态原子没有未成对电子 D.简单阴离子半径:
13.下列实验及现象不能得出相应结论的是( )
选项 实验 现象 结论
A 溶液与过量的溶液混合,充分反应后滴入溶液 溶液变为红色 证明溶液中存在
B 将滴有酚酞的溶液加热 溶液红色变深 证明在溶液中的水解为吸热反应
C 相同温度下,溶液和溶液分别做导电性实验 溶液对应的灯泡较暗 证明是弱电解质
D 向的溶液中滴加过量溶液,并充分振荡 先有白色沉淀生成,后沉淀消失 证明能与发生反应
A.A B.B C.C D.D
14.一定条件下,苯基丙炔()可与发生催化加成,反应过程中焓的变化及反应产物的占比随时间的变化如图,下列说法不正确的是( )
A.产物Ⅰ转化成产物Ⅱ是放热反应
B.从反应开始至前,产物Ⅰ为主要产物
C.产物的稳定性:产物Ⅰ>产物Ⅱ
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
15.2023年我国首个兆瓦级铁铬液流电池储能项目在内蒙古成功运行.电池利用溶解在盐酸溶液中的铁、铬离子价态差异进行充放电,工作原理如图.有关叙述不正确的是( )
A.接风力发电时,铁铬液流电池在储备能量
B.接输电网时,极为负极
C.充电时,阳极的电极反应为
D.放电时,移向极,每穿过交换膜,减少
16.处理工业废水中的甲酸及其盐,可通过离子交换树脂中的固体活性成分水解生成的阳离子静电吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图,下列说法不正确的是( )(已知时,甲酸)
A.活性成分在水中存在平衡:
B.时,的废水中
C.废水初始,随下降,回收率下降的原因可能是甲酸的电离被抑制
D.废水初始,离子交换树脂活性成分主要以形态存在
二、非选择题:本题共4小题,共56分.
17.(14分)某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系.
已知室温时:
化学式
溶解度
(1)探究和之间的转化
试剂 试剂 试剂 加入盐酸后的现象
实验Ⅰ ……
实验Ⅱ 有少量气泡产生,沉淀部分溶解
①上述实验过滤操作中不需要用到的实验仪器是_______________(写仪器名称).
②实验Ⅰ中,往试剂加入试剂后发生反应的离子方程式是_______________.
③实验Ⅰ说明全部转化为,依据的现象是加入盐酸后,_______________.
④实验Ⅱ说明沉淀部分转化为,结合平衡移动原理,解释生成的原因:_______________.
(2)探究和之间的转化
实验Ⅲ:
①实验Ⅲ为了探究转化为,甲溶液可以是_______________(填序号).
A.溶液 B.溶液 C.溶液
②请通过计算说明转化成的反应程度:_______________(写出主要计算过程,已知室温时:).
(3)结合上述实验探究,可得出结论:_______________(写出其中一个).
18.(15分)
尿素合成的发展体现了化学科学与技术的不断进步.
(1)十九世纪初,用氰酸银与在一定条件下反应制得,实现了由无机物到有机物的合成.该反应的化学方程式是_______________.
(2)二十世纪初,工业上以和为原料在一定温度和压强下合成尿素.反应分两步:
ⅰ.和生成:
ⅱ.分解生成尿素.反应过程中能量变化如图所示
①工业上以和为原料合成尿素反应为_______________反应.(填“吸热”或“放热”)
②反应ⅰ和反应ⅱ活化能大小比较:反应ⅰ_______________反应ii.(填“>”、“<”或“=”)
③_______________.(用等表示)
(3)尿素样品含氮量的测定方法如下.
已知:溶液中不能直接用溶液准确滴定.
①消化液中的含氮粒子是,步骤2反应的离子方程式为:_______________.
②步骤4中标准溶液的浓度和消耗的体积分别为和,计算样品含氮量时,除了需要知道样品的质量外,还需要的实验数据有_______________.(填编号)
A.步骤1所加入溶液的体积和浓度
B.步骤2所加入溶液的体积和浓度
C.步骤3所加入溶液的体积和浓度
(4)①N元素的第一电离能比O元素的第一电离能高原因是_______________.
②焰色试验中,钠元素产生的火焰呈_______________色,钠元素产生的火焰与钾的不同,原因是_______________.
19.(13分)“碳中和”是国家战略,其目的是实现的排放量和利用量达到相等,将资源化是实现“碳中和”目标的重要手段.回答下列问题:
(1)下列措施有利于“碳中和”的是_______________(填标号).
A.植树造林,发展绿色经济 B.通过裂化将重油转化为汽油
C.在燃煤中添加或 D.大力开采和使用可燃冰
(2)和在催化剂作用下发生反应可合成清洁能源甲醇:
①已知该反应的正反应率(为正反应的速率常数),某温度时测得数据如表中所示.则此温度下表中_______________.
1 0.02 0.01
2 0.04 0.01
②在一定条件下,体系中的平衡转化率与和的关系如图所示,和分别表示温度或压强.表示的物理量是_______________(填“温度”或“压强”),_______________(填“>”或“<”).
③为探究该反应原理,进行如下实验:在一恒温,体积为恒容密闭容器中,充入和,进行该反应(不考虑其它副反应),平衡时测得的物质的量为.则该温度下平衡常数_______________(保留2位有效数字).
(3)若和按一定比例反应,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示.当温度为时,图中点_______________(填“是”或“不是”)处于平衡状态.之后,甲醇产率下降,请分析其变化产生可能的原因:_______________.(写出其中一种).
(4)是一种廉价的碳资源,其综合利用具有重要意义.可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______________极,该电极反应式是:_______________.
20.(14分)硫及其化合物在生产生活中具有广泛的应用,根据所学知识,回答下列问题:
(1)溶液显_______________性,判断的理由是_______________(用离子方程式表示),若将该溶液蒸干,最终所得固体为_______________(填化学式).
(2)的溶液中,各离子浓度由大到小的关系为_______________.
(3)常温下,在某混合溶液中,部分含硫微粒的物质的量分数随的变化曲线如图所示,根据图示,的水解平衡常数_______________.
(4)常温下,某浓度的溶液中:
①为_______________(填“强”或“弱”)电解质.
②往溶液中滴加少量的溶液,发生反应的离子方程式为_______________,此时所得溶液的_______________(填“变大”、“变小”或“不变”).
(5)在的溶液中加入等体积溶液,有黑色沉淀生成,反应后溶液中_______________[已知:](忽略溶液混合时体积的变化).
江门市2023-2024学年高二上学期1月期末考试
化学参考答案
一、选择题:本题共16小题,第1~10题每小题2分;第11~16题每小题4分,共44分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.B 2.A 3.A 4.D 5.B 6.C 7.C 8.A 9.D 10.A
11.D 12.D 13.C 14. C 15.D 16.B
二、非选择题:本题共4小题,共56分。
1、无机化学方程式、离子方程式、电极反应式:化学式错给0分;化学式全对给1分;配平错漏、“↑”“↓”符号、条件、等号等其他错漏每式合扣1分。
2、有机方程式:结构简式书写错误给0分;结构简式全对给1分,配平错漏、条件、“H2O”、“↑”、“↓”用等号等其他错漏每式合扣1分。
3、对文字表述的其他合理答案同样给分,但关键字词错误不给分。
4、下列情况不给分:答错位置,作答小题序号与原题不一致。
17.(14分)
(1)① 酸式滴定管、分液漏斗
(2分,其中每个仪器名称1分,有错别字不给分,漏写“酸式”不给分,多写答案0分)
②Ba2++CO2- 3 = BaCO3↓ (2分,漏“↓”扣1分)
③ 无气泡产生,沉淀不溶解。
(2分,“沉淀不溶解”或“无气泡产生”均得2分)
④ BaSO4在溶液中存在BaSO4(s) Ba2+(aq) +SO2-4(aq),当加入浓度较高的Na2CO3溶液, CO2-3与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动。
或:BaSO4(s)+ CO2-3(aq) BaCO3(s) + SO2-4(aq),当加入较浓的Na2CO3溶液时,该转化反应平衡正移,BaSO4 转化为BaCO3。
(2分,利用沉淀转化平衡解释合理的得2分;正确书写沉淀溶解平衡方程式可得1分,合理即可)
(2)① B(2分)
②转化反应 AgCl (s)+ I- (aq) AgI (s) + Cl- (aq)
其平衡常数 K== (1分)
说明该反应平衡常数K>105(很大),即该转化反应正向进行程度大(1分)。
(计算过程列式或代入数值和计算结果正确得1分,计算结果为2×106也给分;说明结论正确得1分。其他合理的计算与说明也给2分。若K计算错误,但结论正确的可得1分)
(3)溶解度小的沉淀容易转化成溶解度更小的沉淀。
或:溶解度小的沉淀难以转化成溶解度大的沉淀。
或:溶解度差别越大,由溶解度大的沉淀转化为溶解度较小的沉淀越容易实现。
(2分,写其中一点即可,其他合理也给分,“溶解度”写作“Ksp”也给2分)
18.(15分)
(1)AgCNO+NH4ClCO(NH2)2+AgCl (2分,“一定条件”、“↓”不作要求)
(2)① 放热(1分) ② < (1分)
③ E1-E2+ E3-E4或E1+ E3-(E2+E4)或E1+ E3-E2-E4 (2分,合理即可)
(3)① NH+ 4+OH-H2O+ NH3↑ (2分) ② c(2分)
(4)① N的电子排布是半充满(1分),比较稳定,电离能较高(1分)。
或O失去的是已经配对的电子,配对的电子相互排斥,电离能较低(合理即可)
② 黄(1分)钠与钾的原子结构不同(1分),电子跃迁时能量的变化不同,放出的光波长不同(1分)(合理即可)
19.(13分)
(1)A(1分)
(2)① 4.0×10 4或4×10 4(2分)
②压强 (1分) <(1分)
③ 3.1 (2分,有效数字错漏扣1分)
(3)不是 (1分)
该反应是放热反应,达到平衡后升高温度,平衡逆向移动,产率下降。
或:温度升高,催化剂活性降低,导致速率下降,产率下降(2分,合理即可)
(4)阴(1分) CO2+6H++6e-=CH3OH+H2O (2分)
20.(14分)
(1)酸(1分);Al3++3H2OAl(OH)3+3H+(2分) Al2(SO4)3(1分)
(2)c(NH+ 4)>c(SO2-4)>c(H+)>c(OH )(2分,不写“c”,离子排序正确给1分)
(3)1.0×10 6.8 或1×10 6.8或10 6.8(2分)
(4)①强(1分)
② 2SO2-3+HClO=SO2-4+HSO- 3+Cl (2分,写SO2-3+HClO=SO2-4+H++Cl 给1分) 变小(1分)
(5)6.3×10 34mol/L(2分,错漏单位扣1分)
同课章节目录
