云南省保山市、文山州2023-2024学年高二上学期期末质量监测化学试题(含答案)
文档属性
| 名称 | 云南省保山市、文山州2023-2024学年高二上学期期末质量监测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 680.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-05 11:55:44 | ||
图片预览




文档简介
【考试时间:2024年1月20日21:00~23:00】
保山市文山州2023~2024学年上学期期末质量监测
高二化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1页至第5页,第Ⅱ卷第5页至第8页。考试结束后,请将答题卡交回。满分100分,考试用时60分钟。
以下数据可供解题时参考。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5
第Ⅰ卷(选择题,共56分)
注意事项:
1.答题前,考生务必用黑色碳素笔将自己的学校、班级、姓名、考场号、座位号、准考证号在答题卡上填写清楚。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。在试题卷上作答无效。
一、选择题(本大题共14小题,每小题4分,共56分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与我们的生活密切相关,下列说法错误的是( )
A.对超快速化学反应的研究被形象地称为飞秒化学,
B.在船体上镶嵌锌块可以避免船体遭受腐蚀
C.研究发现在饮用水、食物或牙膏中添加氟化物能起到预防龋齿的作用
D.把铬、镍等加入普通钢中制成不锈钢产品
2.下列化学用语或图示表达不正确的是( )
A.基态原子的价层电子排布图:
B.的名称:1,2-二溴乙烷
C.的电子式:
D.的电子云轮廓图:
3.为阿伏加德罗常数的值,下列说法正确的是( )
A.氢气与碘蒸气在密闭容器中充分反应,生成碘化氢分子数为
B.的氯气与足量氢氧化钠溶液充分反应,转移电子数为
C.钠与氧气完全反应,反应转移电子数介于和之间
D.乙烯和丙烯混合气体中,含碳氢键的数目为
4.下列离子方程式书写正确的是( )
A.溶液中通入足量氯气:
B.溶液与足量溶液反应:
C.漂白液吸收少量气体:
D.用惰性电极电解溶液:
5.某有机物的结构简式如图所示,下列关于该有机物的描述不正确的是( )
A.该有机物中有3种官能团
B.标准状况下,该物质与足量的钠反应生成的氢气
C.该物质可发生加聚反应
D.该有机物可以发生加成反应、取代反应、氧化反应
6.为原子序数依次增大的短周期主族元素,的简单氢化物能与它的最高价氧化物的水化物反应生成盐,原子核外能级上的电子总数与能级上的电子总数相等,原子核外没有未成对电子,与位于同一主族。下列说法正确的是( )
A.简单离子半径: B.的第一电离能比第一电离能小
C.用电解的氧化物制备单质 D.的简单氢化物比的简单氢化物稳定
7.下列说法错误的是( )
A.,恒温时,缩小容积,气体颜色变浅
B.若压强不再随时间变化能说明反应已达平衡,则一定为气体
C.,加入与充分反应后,放出热量小于
D.该反应
8.一定温度下,在的恒容密闭容器中发生反应: ,反应过程中的部分数据如下表所示:
0 2.0 1.0 0
10 0.6
20 1.4
30 0.6
下列说法正确的是( )
A.用B表示的平均反应速率为
B.其它条件不变,达平衡后移走C物质使正反应速率减小
C.后已达到平衡状态
D.平衡时A的转化率为30%
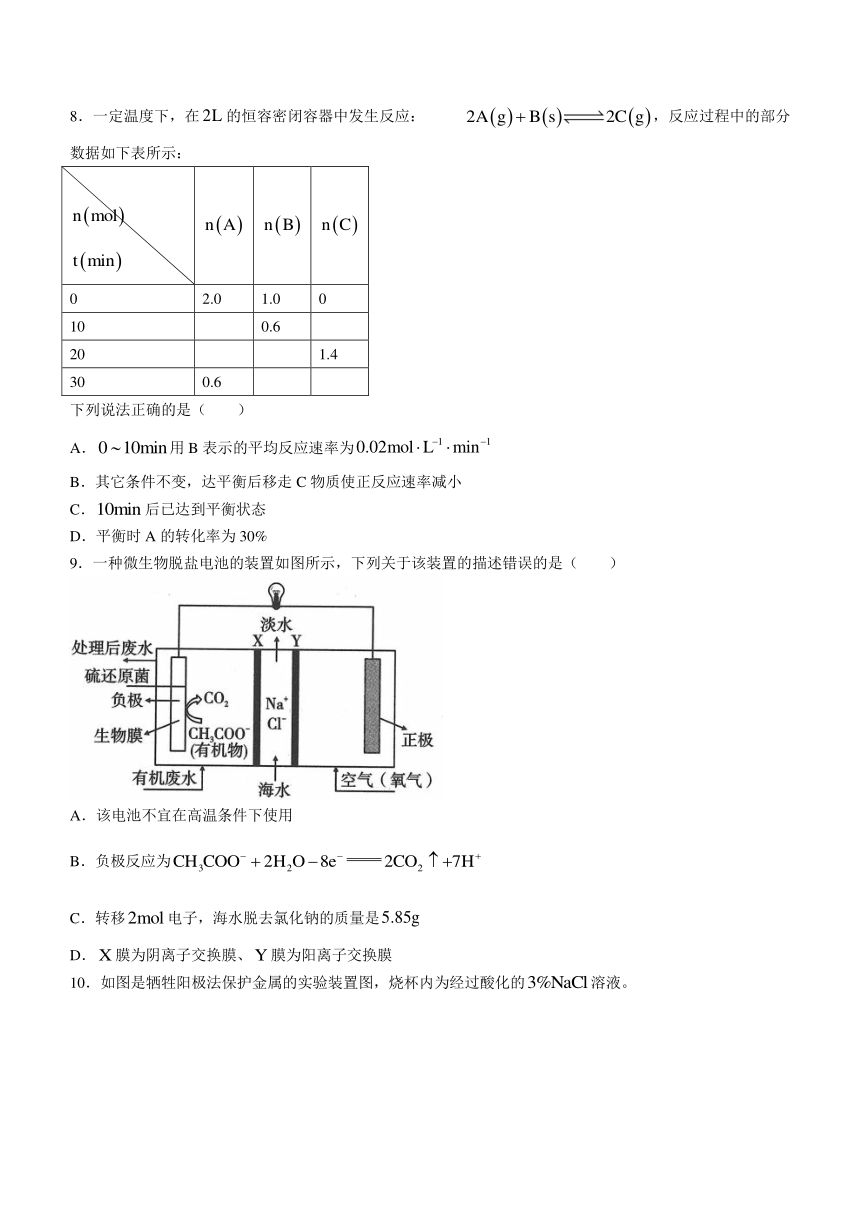
9.一种微生物脱盐电池的装置如图所示,下列关于该装置的描述错误的是( )
A.该电池不宜在高温条件下使用
B.负极反应为
C.转移电子,海水脱去氯化钠的质量是
D.膜为阴离子交换膜、膜为阳离子交换膜
10.如图是牺牲阳极法保护金属的实验装置图,烧杯内为经过酸化的溶液。
下列关于该装置的叙述错误的是( )
A.铁作正极被保护
B.将换成,也可以保护铁不被腐蚀
C.向试管中加入溶液,无明显现象
D.正极反应式为
11.下列实验操作、现象及结论均正确的是( )
选项 实验操作 现象 结论
A 将磁性氧化铁溶于浓盐酸,滴入溶液 溶液紫色褪去 磁性氧化铁中含有二价铁
B 常温下,分别测定同浓度的溶液和溶液的 溶液的pH前者大 于后者
C 向溶液中缓慢滴加氢氧化钠 溶液由橙红色变为黄色 平衡向生成的方向移动
D 某温度下,用计分别测定和的醋酸铵溶液的 pH都等于6 醋酸铵溶液中水的电离程度与其浓度无关
A.A B.B C.C D.D
12.铑的配合物离子可催化甲醇羰基化,反应过程如图4所示。下列叙述错误的是( )
A.是反应中间体
B.甲醇湠基化反应是化合反应
C.反应过程中的成键数目有4、5、6三种情况
D.反应中碳元素的化合价从未发生反应
13.时,下列说法正确的是( )
A.溶液呈酸性,可以推测为强酸
B.溶液中:
C.可溶性正盐溶液呈中性,可以推测为强酸强碱盐
D.的醋酸溶液的电离度分别为,则
14.某温度下,分别向浓度均为的溶液和溶液中滴加溶液,滴加过程中或与加入溶液体积的关系如图所示(已知)。下列说法不正确的是( )
A. B.曲线Ⅰ代表溶液
C.约为 D.
第Ⅱ卷(非选择题,共44分)
注意事项
第Ⅱ卷用黑色碳素笔在答题卡上各题的答题区域内作答,在试题卷上作答无效。
二、填空题(本大题共3小题,共44分)
15.(15分)皓矾主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为,还含有少量以及等的化合物)制备,制备流程图如图所示:
已知:常温下,金属离子开始沉淀和完全沉淀时的如下表所示:
金属离子
开始沉淀时 1.9 6.4 4.7 7.0 9.1
沉淀完全时 3.4 8.4 6.7 9.0 11.1
回答下列问题:
(1)写出基态铜原子的价层电子排布式____________。
(2)滤渣①的主要成分为______;“浸取”工序中,能加快浸取效率的措施有______(任写一种作答)。
(3)“氧化”时该步骤离子方程式为____________。
(4)若“调过滤”工序中,调节溶液,所得“滤渣②的主要成分为______,氢氧化铁的溶度积常数______。
(5)“转化过滤”中加入锌粉的目的是____________。
(6)从滤液④获得皓矾晶体的具体操作为______、______、过滤、洗涤、干燥。
16.(15分)化学消毒剂能够有效阻断病毒的传播与扩散。本题中,将探讨2种常见的消毒剂:
Ⅰ.二氧化氯是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组按照文献中制备的方法设计了如图所示的实验装置用于制备。
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是______。
②装置A中,装溶液的仪器名称为______。
(2)测定装置中溶液的浓度:取中溶液于锥形瓶中,加入足量的溶液和酸化(),然后加入______作指示剂,用的标准液滴定锥形瓶中的溶液(),当看到______现象时,测得标准液消耗的体积为,通过计算可知中溶液的浓度为______。
Ⅱ.84消毒液在生活中有广泛的应用,其主要成分是和。
资料:的电离常数;的电离常数,;的氧化性和杀菌消毒效果强于。
(1)84消毒液溶液呈______(填“酸性”或“碱性”)。
(2)84消毒液可由氯气与溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的,请运用平衡移动原理解释的作用______。
(3)待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为____________。
17.(14分)科学家开发催化剂实现催化还原制备附加值高的产品。利用制备甲醇的有关反应如下:
Ⅰ.
Ⅱ.
(1)已知几种共价键的键能如下:
共价键
键能 799 436 413 358 467
利用键能数据计算:______。
(2)一定温度下,在恒容密闭容器中充入等体积的,仅发生反应Ⅰ。下列叙述正确的是______(填序号)。
A.平衡后充入氩气,正反应速率增大
B.反应过程中断裂键的同时生成
C.平衡后充入少量平衡转化率增大
(3)在一恒容反应器中充入一定量的,仅发生反应Ⅱ,平衡常数与温度的关系如下表:
700 800 830 1000 1200
0.6 0.9 1.0 1.7 2.5
①______0(填“>”“<”或“=”)
②时,某时刻反应体系中,此时平衡______(填“向正反应方向”“向逆反应方向”或“不”)移动。
(4)在一定温度下,向甲、乙两密闭反应器中分别充入和,分别在有水分子隔离膜、无水分子隔离膜作用下发生上述两个反应,测得平衡转化率与压强的关系如图所示。
①使用了水分子隔离膜的反应器是______(填“甲”或“乙”),理由是____________。
②已知点选择性为,该温度下,点反应Ⅱ的平衡常数为______。提示:选择性。
保山市文山州2023~2024学年上学期期末质量监测
高二化学参考答案
第Ⅰ卷(选择题,共56分)
一、选择题(本大题共14小题,每小题4分,共56分。在每小题给出的四个选项中,只有一项是符合题目要求的)
题号 1 2 3 4 5 6 7
答案 A A D C B B A
题号 8 9 10 11 12 13 14
答案 B C B C D B C
第Ⅱ卷(非选择题,共44分)
二、填空题(本大题共3小题,共44分)
15.(除特殊标注外,每空 2 分,共 15分)
(1)3d104s1(1 分)
(2)SiO2(写 H2SiO3也得分)、CaSO4
粉碎、加热、适当增加硫酸的浓度(合理即可)
(3)2Fe2+ + H2O2 +2H+ =2Fe3+ + 2H2O
(4)Fe(OH)3 10 36.8
(5)置换Cu2+变为Cu,从而除去
(6)蒸发浓缩(1 分) 冷却结晶(1 分)
【解析】菱锌矿焙烧碳酸锌分解,加硫酸浸取,滤渣①中有 SiO2和 CaSO4,滤液加 H2O2目的是把二价铁离子氧化为三价铁离子,加入Ca(OH)2调节 pH 值除去 Fe3+离子,再加入 Zn 粉置换出 Cu,加入 HF 除去 Ca2+和 Mg2+,最后得到七水硫酸锌。
(2)菱锌矿焙烧碳酸锌分解,加硫酸浸取,滤渣①中有 SiO2和 CaSO4,将菱锌矿粉碎、搅拌、适当加热、适当增加硫酸浓度都可以加快浸取的速率,提高浸取效率。
(3)氧化时离子方程式为 2Fe2+ + H2O2 +2H+ =2Fe3+ + 2H2O(合理即可)。
(4)pH 调节至 4.4,根据表格主要沉淀为Fe(OH)3;根据表格中 Fe3+沉淀完全时的 pH 值为 3.4,可以计算出氢氧化铁的溶度积常数。
(5)加入锌粉将Cu2+置换为 Cu 以除去。
(6)从滤液中获得带结晶水的晶体都是用蒸发浓缩、冷却结晶、过滤、洗涤、干燥等。
16.(除特殊标注外,每空 2 分,共 15分)
Ⅰ.(1)①稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸 ②分液漏斗(1 分)
(2)淀粉溶液 溶液蓝色褪去且半分钟内不恢复原来的颜色 0.08
Ⅱ.(1)碱性
(2)ClO +H2OHClO+OH ,残余 NaOH,增大c(OH ),抑制 ClO 水解,减小c(HClO),分解速率减慢(或消毒液更稳定)
(3)CO2+H2O+ClO HClO+
【解析】装置A中氯酸钠和过氧化氢发生氧化还原反应生成二氧化氯,装置B作为安全瓶防倒吸,气体进入C被吸收得到溶液,尾气使用碱液吸收防止污染。
(1)①根据题目信息“在混合气体中的体积分数大于10%就可能发生爆炸”,所以充入氮气的第二个目的就是为了稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;
②A中用分液漏斗装硫酸。
(2)KI被ClO2氧化之后生成单质碘,碘单质能使淀粉变蓝色,所以选用淀粉溶液为指示剂。加入淀粉溶液之后,溶液变为蓝色,用Na2S2O3 标准液滴定,最后一滴标准液加入后,溶液蓝色褪去且半分钟内不变色,单质碘被完全反应,滴定到达终点;标准液消耗的体积为20.00mL,则Na2S2O3 的物质的量为0.02L×0.2000mol/L=0.0040mol,其反应的化学方程式为I2+=2I +,可知I2的物质的量为0.0020mol,再由方程式2ClO2+10I +8H+=2Cl +5I2+4H2O,可知ClO2的物质的量为0.0008mol,其浓度为0.0008mol÷0.01L=0.08mol/L,故答案为:淀粉溶液;溶液蓝色褪去且半分钟内不恢复原色;0.08。
17.(每空 2 分,共 14分)
(1) 92
(2)C
(3)①>
②向逆反应方向
(4)①乙 两个反应的产物都有水分子,其他条件不变,分离水分子,二氧化碳的平衡转化率增大
②
【解析】本题主要考查化学反应原理,考查学生对化学反应原理的理解能力和综合运用知识的能力。
(1)反应热等于断裂化学键的总键能与形成化学键的总键能之差。ΔH1=(799×2+436×3 413×3 358 467×2 467) kJ·mol 1= 92kJ·mol 1。
(3)②1200℃时Q=4>2.5,平衡向逆反应方向移动。
(4)②根据原子守恒可知M点体系中各组分的物质的量:物质n(CO2)= 0.5 mol、n(CH3OH)=0.4mol、n(H2)= 1.7mol、n(CO)=0.1mol、n(H2O)=0.5mol所以带入数据,反应Ⅱ的平衡常数。
保山市文山州2023~2024学年上学期期末质量监测
高二化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1页至第5页,第Ⅱ卷第5页至第8页。考试结束后,请将答题卡交回。满分100分,考试用时60分钟。
以下数据可供解题时参考。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Cl-35.5
第Ⅰ卷(选择题,共56分)
注意事项:
1.答题前,考生务必用黑色碳素笔将自己的学校、班级、姓名、考场号、座位号、准考证号在答题卡上填写清楚。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。在试题卷上作答无效。
一、选择题(本大题共14小题,每小题4分,共56分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与我们的生活密切相关,下列说法错误的是( )
A.对超快速化学反应的研究被形象地称为飞秒化学,
B.在船体上镶嵌锌块可以避免船体遭受腐蚀
C.研究发现在饮用水、食物或牙膏中添加氟化物能起到预防龋齿的作用
D.把铬、镍等加入普通钢中制成不锈钢产品
2.下列化学用语或图示表达不正确的是( )
A.基态原子的价层电子排布图:
B.的名称:1,2-二溴乙烷
C.的电子式:
D.的电子云轮廓图:
3.为阿伏加德罗常数的值,下列说法正确的是( )
A.氢气与碘蒸气在密闭容器中充分反应,生成碘化氢分子数为
B.的氯气与足量氢氧化钠溶液充分反应,转移电子数为
C.钠与氧气完全反应,反应转移电子数介于和之间
D.乙烯和丙烯混合气体中,含碳氢键的数目为
4.下列离子方程式书写正确的是( )
A.溶液中通入足量氯气:
B.溶液与足量溶液反应:
C.漂白液吸收少量气体:
D.用惰性电极电解溶液:
5.某有机物的结构简式如图所示,下列关于该有机物的描述不正确的是( )
A.该有机物中有3种官能团
B.标准状况下,该物质与足量的钠反应生成的氢气
C.该物质可发生加聚反应
D.该有机物可以发生加成反应、取代反应、氧化反应
6.为原子序数依次增大的短周期主族元素,的简单氢化物能与它的最高价氧化物的水化物反应生成盐,原子核外能级上的电子总数与能级上的电子总数相等,原子核外没有未成对电子,与位于同一主族。下列说法正确的是( )
A.简单离子半径: B.的第一电离能比第一电离能小
C.用电解的氧化物制备单质 D.的简单氢化物比的简单氢化物稳定
7.下列说法错误的是( )
A.,恒温时,缩小容积,气体颜色变浅
B.若压强不再随时间变化能说明反应已达平衡,则一定为气体
C.,加入与充分反应后,放出热量小于
D.该反应
8.一定温度下,在的恒容密闭容器中发生反应: ,反应过程中的部分数据如下表所示:
0 2.0 1.0 0
10 0.6
20 1.4
30 0.6
下列说法正确的是( )
A.用B表示的平均反应速率为
B.其它条件不变,达平衡后移走C物质使正反应速率减小
C.后已达到平衡状态
D.平衡时A的转化率为30%
9.一种微生物脱盐电池的装置如图所示,下列关于该装置的描述错误的是( )
A.该电池不宜在高温条件下使用
B.负极反应为
C.转移电子,海水脱去氯化钠的质量是
D.膜为阴离子交换膜、膜为阳离子交换膜
10.如图是牺牲阳极法保护金属的实验装置图,烧杯内为经过酸化的溶液。
下列关于该装置的叙述错误的是( )
A.铁作正极被保护
B.将换成,也可以保护铁不被腐蚀
C.向试管中加入溶液,无明显现象
D.正极反应式为
11.下列实验操作、现象及结论均正确的是( )
选项 实验操作 现象 结论
A 将磁性氧化铁溶于浓盐酸,滴入溶液 溶液紫色褪去 磁性氧化铁中含有二价铁
B 常温下,分别测定同浓度的溶液和溶液的 溶液的pH前者大 于后者
C 向溶液中缓慢滴加氢氧化钠 溶液由橙红色变为黄色 平衡向生成的方向移动
D 某温度下,用计分别测定和的醋酸铵溶液的 pH都等于6 醋酸铵溶液中水的电离程度与其浓度无关
A.A B.B C.C D.D
12.铑的配合物离子可催化甲醇羰基化,反应过程如图4所示。下列叙述错误的是( )
A.是反应中间体
B.甲醇湠基化反应是化合反应
C.反应过程中的成键数目有4、5、6三种情况
D.反应中碳元素的化合价从未发生反应
13.时,下列说法正确的是( )
A.溶液呈酸性,可以推测为强酸
B.溶液中:
C.可溶性正盐溶液呈中性,可以推测为强酸强碱盐
D.的醋酸溶液的电离度分别为,则
14.某温度下,分别向浓度均为的溶液和溶液中滴加溶液,滴加过程中或与加入溶液体积的关系如图所示(已知)。下列说法不正确的是( )
A. B.曲线Ⅰ代表溶液
C.约为 D.
第Ⅱ卷(非选择题,共44分)
注意事项
第Ⅱ卷用黑色碳素笔在答题卡上各题的答题区域内作答,在试题卷上作答无效。
二、填空题(本大题共3小题,共44分)
15.(15分)皓矾主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为,还含有少量以及等的化合物)制备,制备流程图如图所示:
已知:常温下,金属离子开始沉淀和完全沉淀时的如下表所示:
金属离子
开始沉淀时 1.9 6.4 4.7 7.0 9.1
沉淀完全时 3.4 8.4 6.7 9.0 11.1
回答下列问题:
(1)写出基态铜原子的价层电子排布式____________。
(2)滤渣①的主要成分为______;“浸取”工序中,能加快浸取效率的措施有______(任写一种作答)。
(3)“氧化”时该步骤离子方程式为____________。
(4)若“调过滤”工序中,调节溶液,所得“滤渣②的主要成分为______,氢氧化铁的溶度积常数______。
(5)“转化过滤”中加入锌粉的目的是____________。
(6)从滤液④获得皓矾晶体的具体操作为______、______、过滤、洗涤、干燥。
16.(15分)化学消毒剂能够有效阻断病毒的传播与扩散。本题中,将探讨2种常见的消毒剂:
Ⅰ.二氧化氯是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组按照文献中制备的方法设计了如图所示的实验装置用于制备。
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是______。
②装置A中,装溶液的仪器名称为______。
(2)测定装置中溶液的浓度:取中溶液于锥形瓶中,加入足量的溶液和酸化(),然后加入______作指示剂,用的标准液滴定锥形瓶中的溶液(),当看到______现象时,测得标准液消耗的体积为,通过计算可知中溶液的浓度为______。
Ⅱ.84消毒液在生活中有广泛的应用,其主要成分是和。
资料:的电离常数;的电离常数,;的氧化性和杀菌消毒效果强于。
(1)84消毒液溶液呈______(填“酸性”或“碱性”)。
(2)84消毒液可由氯气与溶液反应制得。为了防止消毒液在存储过程中失效,通常要在84消毒液中残余一定量的,请运用平衡移动原理解释的作用______。
(3)待消杀物品喷洒上84消毒液后,露置于空气中10~30分钟可增强消毒效果,该过程中发生反应的离子方程式为____________。
17.(14分)科学家开发催化剂实现催化还原制备附加值高的产品。利用制备甲醇的有关反应如下:
Ⅰ.
Ⅱ.
(1)已知几种共价键的键能如下:
共价键
键能 799 436 413 358 467
利用键能数据计算:______。
(2)一定温度下,在恒容密闭容器中充入等体积的,仅发生反应Ⅰ。下列叙述正确的是______(填序号)。
A.平衡后充入氩气,正反应速率增大
B.反应过程中断裂键的同时生成
C.平衡后充入少量平衡转化率增大
(3)在一恒容反应器中充入一定量的,仅发生反应Ⅱ,平衡常数与温度的关系如下表:
700 800 830 1000 1200
0.6 0.9 1.0 1.7 2.5
①______0(填“>”“<”或“=”)
②时,某时刻反应体系中,此时平衡______(填“向正反应方向”“向逆反应方向”或“不”)移动。
(4)在一定温度下,向甲、乙两密闭反应器中分别充入和,分别在有水分子隔离膜、无水分子隔离膜作用下发生上述两个反应,测得平衡转化率与压强的关系如图所示。
①使用了水分子隔离膜的反应器是______(填“甲”或“乙”),理由是____________。
②已知点选择性为,该温度下,点反应Ⅱ的平衡常数为______。提示:选择性。
保山市文山州2023~2024学年上学期期末质量监测
高二化学参考答案
第Ⅰ卷(选择题,共56分)
一、选择题(本大题共14小题,每小题4分,共56分。在每小题给出的四个选项中,只有一项是符合题目要求的)
题号 1 2 3 4 5 6 7
答案 A A D C B B A
题号 8 9 10 11 12 13 14
答案 B C B C D B C
第Ⅱ卷(非选择题,共44分)
二、填空题(本大题共3小题,共44分)
15.(除特殊标注外,每空 2 分,共 15分)
(1)3d104s1(1 分)
(2)SiO2(写 H2SiO3也得分)、CaSO4
粉碎、加热、适当增加硫酸的浓度(合理即可)
(3)2Fe2+ + H2O2 +2H+ =2Fe3+ + 2H2O
(4)Fe(OH)3 10 36.8
(5)置换Cu2+变为Cu,从而除去
(6)蒸发浓缩(1 分) 冷却结晶(1 分)
【解析】菱锌矿焙烧碳酸锌分解,加硫酸浸取,滤渣①中有 SiO2和 CaSO4,滤液加 H2O2目的是把二价铁离子氧化为三价铁离子,加入Ca(OH)2调节 pH 值除去 Fe3+离子,再加入 Zn 粉置换出 Cu,加入 HF 除去 Ca2+和 Mg2+,最后得到七水硫酸锌。
(2)菱锌矿焙烧碳酸锌分解,加硫酸浸取,滤渣①中有 SiO2和 CaSO4,将菱锌矿粉碎、搅拌、适当加热、适当增加硫酸浓度都可以加快浸取的速率,提高浸取效率。
(3)氧化时离子方程式为 2Fe2+ + H2O2 +2H+ =2Fe3+ + 2H2O(合理即可)。
(4)pH 调节至 4.4,根据表格主要沉淀为Fe(OH)3;根据表格中 Fe3+沉淀完全时的 pH 值为 3.4,可以计算出氢氧化铁的溶度积常数。
(5)加入锌粉将Cu2+置换为 Cu 以除去。
(6)从滤液中获得带结晶水的晶体都是用蒸发浓缩、冷却结晶、过滤、洗涤、干燥等。
16.(除特殊标注外,每空 2 分,共 15分)
Ⅰ.(1)①稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸 ②分液漏斗(1 分)
(2)淀粉溶液 溶液蓝色褪去且半分钟内不恢复原来的颜色 0.08
Ⅱ.(1)碱性
(2)ClO +H2OHClO+OH ,残余 NaOH,增大c(OH ),抑制 ClO 水解,减小c(HClO),分解速率减慢(或消毒液更稳定)
(3)CO2+H2O+ClO HClO+
【解析】装置A中氯酸钠和过氧化氢发生氧化还原反应生成二氧化氯,装置B作为安全瓶防倒吸,气体进入C被吸收得到溶液,尾气使用碱液吸收防止污染。
(1)①根据题目信息“在混合气体中的体积分数大于10%就可能发生爆炸”,所以充入氮气的第二个目的就是为了稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;
②A中用分液漏斗装硫酸。
(2)KI被ClO2氧化之后生成单质碘,碘单质能使淀粉变蓝色,所以选用淀粉溶液为指示剂。加入淀粉溶液之后,溶液变为蓝色,用Na2S2O3 标准液滴定,最后一滴标准液加入后,溶液蓝色褪去且半分钟内不变色,单质碘被完全反应,滴定到达终点;标准液消耗的体积为20.00mL,则Na2S2O3 的物质的量为0.02L×0.2000mol/L=0.0040mol,其反应的化学方程式为I2+=2I +,可知I2的物质的量为0.0020mol,再由方程式2ClO2+10I +8H+=2Cl +5I2+4H2O,可知ClO2的物质的量为0.0008mol,其浓度为0.0008mol÷0.01L=0.08mol/L,故答案为:淀粉溶液;溶液蓝色褪去且半分钟内不恢复原色;0.08。
17.(每空 2 分,共 14分)
(1) 92
(2)C
(3)①>
②向逆反应方向
(4)①乙 两个反应的产物都有水分子,其他条件不变,分离水分子,二氧化碳的平衡转化率增大
②
【解析】本题主要考查化学反应原理,考查学生对化学反应原理的理解能力和综合运用知识的能力。
(1)反应热等于断裂化学键的总键能与形成化学键的总键能之差。ΔH1=(799×2+436×3 413×3 358 467×2 467) kJ·mol 1= 92kJ·mol 1。
(3)②1200℃时Q=4>2.5,平衡向逆反应方向移动。
(4)②根据原子守恒可知M点体系中各组分的物质的量:物质n(CO2)= 0.5 mol、n(CH3OH)=0.4mol、n(H2)= 1.7mol、n(CO)=0.1mol、n(H2O)=0.5mol所以带入数据,反应Ⅱ的平衡常数。
同课章节目录
