7.3溶液稀释的表示同步练习(含解析) 科粤版化学九年级下册
文档属性
| 名称 | 7.3溶液稀释的表示同步练习(含解析) 科粤版化学九年级下册 |  | |
| 格式 | docx | ||
| 文件大小 | 264.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-05 22:53:40 | ||
图片预览




文档简介
7.3溶液稀释的表示
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制成如图所示图像。下列说法不正确的是
A.时,100克水最多溶解该固体物质的质量为88g
B.C点所对应的溶液是不饱和溶液
C.图中A、B、C、D四点所对应的溶液溶质质量分数大小关系为
D.图中A、B、C、D四点所对应的溶液溶质质量分数大小关系为
2.下列推理正确的是
A.蜡烛在氧气中的燃烧比在空气中剧烈得多,说明反应物浓度越大,反应越剧烈
B.木材燃烧后留下的灰烬质量比原木材小,说明固体可燃物燃烧后质量一定减小
C.溶液中有晶体析出时,溶液中的溶质质量一定减小,溶质的质量分数一定减小
D.化学变化中有能量的释放或吸收,则有能量释放或吸收的变化一定是化学变化
3.白酒的 “度数”指的是白酒中酒精的含量。这里的含量不是指质量分数,而是体积分数。例如,52度(52°)的白酒表示100ml白酒中含有52ml酒精(常温时)。蒸馏水密度为1g/cm3,酒精密度为0.8g/cm3,若为40度(40°)的白酒溶液中溶质的质量分数约为
A.40% B.60% C.34.8% D.无法判断
4.向一定量的饱和NaOH溶液中加入少量Na2O固体(已知Na2O固体能溶于水生成NaOH),恢复到原来温度时,下列说法中正确的是
A.溶液中Na+总数不变 B.单位体积内的OH﹣数目变大
C.溶质的质量分数不变 D.溶液的质量不变
5.t℃时,M物质的溶解度为Sg,则bgM物质在t℃时,可配成的饱和溶液的质量是
A.b(100+S)/S g B.(100+S+b) g C.S(100+b)/b g D.100b/S g
6.如图1是甲、乙、丙三种固体物质的溶解度曲线,图2是对某物质的饱和溶液进行实验时的变化情况,下列描述不正确的是
A.t1℃时,乙、丙两种物质的饱和溶液的溶质质量分数一定相等
B.t3℃时,50g水中加入30g甲可得到70g 饱和溶液
C.将t3℃时甲、丙两种物质的饱和溶液降温至t2℃,两种溶液中溶质的质量分数:甲=丙
D.如图2滴入水后,饱和溶液变浑浊,则该饱和溶液的溶质是丙,不是甲和乙
7.下列各条件下的氢氧化钙溶液,溶质的质量分数最大的是
A.10℃的饱和溶液 B.20℃时饱和溶液
C.50℃的不饱和溶液 D.50℃的饱和溶液
8.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,甲和丙的溶液溶质质量分数相等
B.采用降温结晶的方法可以除去甲中混有的少量的丙
C.分别将甲和乙的饱和溶液t2℃降温到t1℃,析出固体的质量为甲>乙
D.t2℃时,将30克甲放入50克水中,充分溶解后,可以得到80克溶液
9.现用98%的浓硫酸配制490g20%的稀硫酸,需水的质量为
A.98g B.100g C.390g D.392g
10.某厂以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,其溶解度曲线如图所示。下列说法正确的是
A.硫酸钠的溶解度随温度的升高而增大
B.氯化铵和硫酸钠仅在30℃时的溶解度相等
C.将50℃时硫酸钠饱和溶液降温始终有晶体析出
D.40℃时硫酸钠饱和溶液的溶质质量分数约为33.3%
二、判断题
11.相同温度下,某物质的饱和溶液一定比不饱和溶液浓( )
12.溶质质量分数为10%的200mL某溶液,密度1.2克/厘米3,其中含溶质24克( )
13.用50g 10%的NaCl溶液配制5%的NaCl溶液需要加水50g( )
14.饱和溶液的溶质质量分数一定比不饱和溶液的大。( )
15.某温度下两种不同物质的溶液,溶质质量分数相同,则这两种物质的溶解度一定相同( )
三、综合应用题
16.掌握仪器的使用方法并严格按照操作要求进行实验,才能保障实验的成功和安全。根据所学化学知识,回答下列问题:
(1)固体药品通常保存在 里(填仪器名称)。
(2)实验室取用药品要注意节约,如果没有说明用量,一般应该取用最少量,液体药品取用 mL。
(3)利用量筒读数时,视线与量筒内液体的 保持水平。
(4)取液后的滴管,平放或倒置可能造成的后果是 (答一点即可)。
(5)用托盘天平称量12.6g药品时,向左盘中加入药品后,发现指针向左偏转,应进行的操作是 (填序号)
①右边的平衡螺母向右调至天平平衡
②移动游码至天平平衡
③左盘中减少药品至天平平衡
④左盘中添加药品至天平平衡
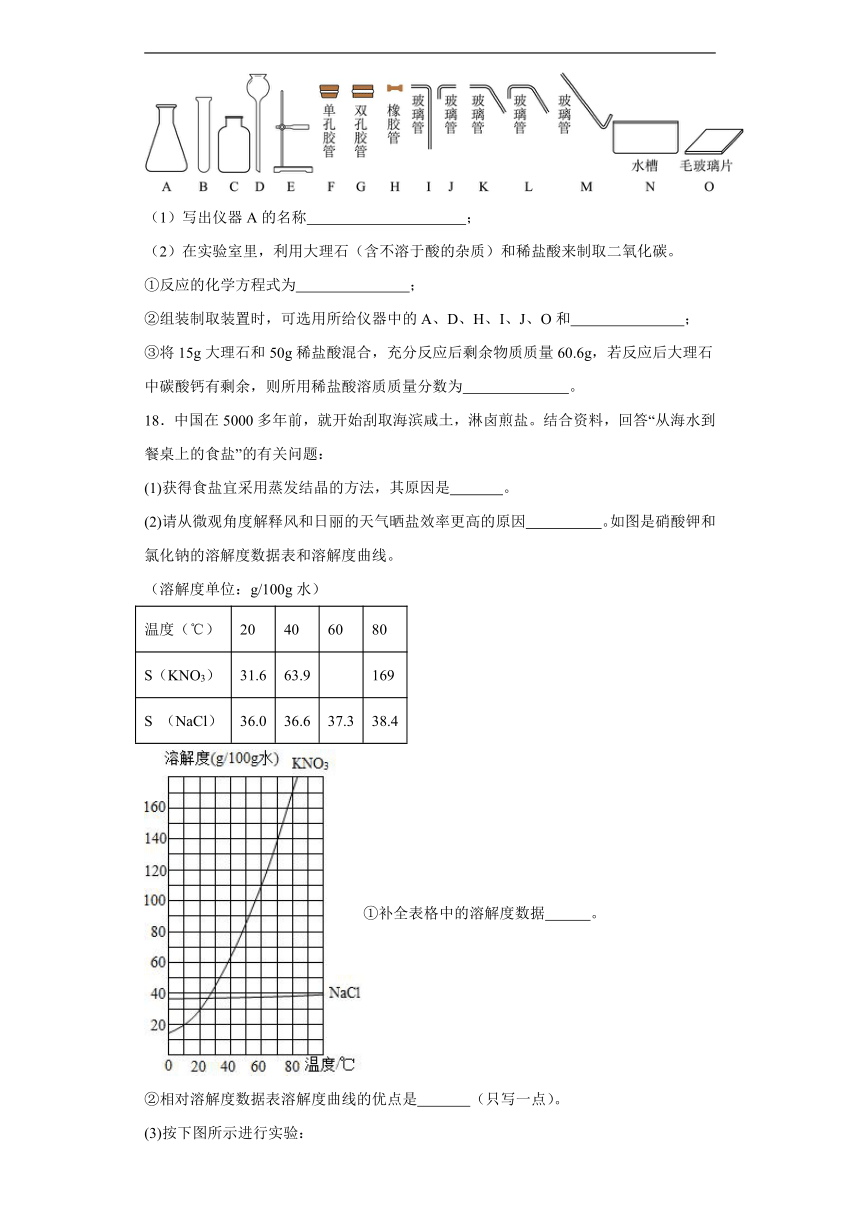
17.下图是实验室里制取气体可能用到的仪器,回答下列问题。
(1)写出仪器A的名称 ;
(2)在实验室里,利用大理石(含不溶于酸的杂质)和稀盐酸来制取二氧化碳。
①反应的化学方程式为 ;
②组装制取装置时,可选用所给仪器中的A、D、H、I、J、O和 ;
③将15g大理石和50g稀盐酸混合,充分反应后剩余物质质量60.6g,若反应后大理石中碳酸钙有剩余,则所用稀盐酸溶质质量分数为 。
18.中国在5000多年前,就开始刮取海滨咸土,淋卤煎盐。结合资料,回答“从海水到餐桌上的食盐”的有关问题:
(1)获得食盐宜采用蒸发结晶的方法,其原因是 。
(2)请从微观角度解释风和日丽的天气晒盐效率更高的原因 。如图是硝酸钾和氯化钠的溶解度数据表和溶解度曲线。
(溶解度单位:g/100g水)
温度(℃) 20 40 60 80
S(KNO3) 31.6 63.9 169
S (NaCl) 36.0 36.6 37.3 38.4
①补全表格中的溶解度数据 。
②相对溶解度数据表溶解度曲线的优点是 (只写一点)。
(3)按下图所示进行实验:
①R是 (选填“氯化钠”或“硝酸钾”),A、B、C三个烧杯中溶液的溶质质量分数的大小关系是 。
②如果将含27.0 gNaCl、63.2gKNO3的混合物溶于mg热水,然后冷却至20℃。若要使KNO3析出而NaCl不析出,则m的取值范围是 。
参考答案:
1.D
【详解】A、在曲线上的点和曲线上边的点都是饱和状态,20℃时,100克水最多溶解该固体物质的质量为88g,故选项说法正确;
B、在曲线上的点和曲线上边的点都是饱和状态,在曲线下边的点属于不饱和状态,C点在曲线下边,则C点对应的溶液是不饱和溶液,故选项说法正确;
C、A、B点对应的是20℃时的饱和溶液,溶液质量分数大小关系是A=B;C、D点对应的溶液,溶质质量相等,但溶剂质量D点的多,则溶液质量分数大小关系是C>D,图中四点所对应的溶液质量分数大小关系为A=B>C>D,故选项说法正确;
D、由C选项的解析,图中四点所对应的溶液质量分数大小关系为A=B>C>D,故选项说法错误;
故选:D。
2.A
【详解】A、蜡烛在氧气中的燃烧比在空气中剧烈得多,氧气中氧气的含量比空气中的大,说明反应物浓度越大,反应越剧烈,故选项正确;
B、木材燃烧后留下的灰烬质量比原木材小,是因为木材燃烧生成二氧化碳气体,不能说明固体可燃物燃烧后质量一定减小,故选项错误;
C、若原溶液可能是饱和溶液,采用的恒温蒸发溶剂的方法,溶液中有晶体析出时,所得溶液仍为该温度下的饱和溶液,溶质的质量分数不变,故选项错误;
D、化学变化中有能量的释放或吸收,但有能量释放或吸收的变化不一定是化学变化,如氢氧化钠溶于水放热,故选项错误。故选A。
【点睛】化学变化中有能量的释放或吸收,但有能量释放或吸收的变化不一定是化学变化,如氢氧化钠溶于水放热。
3.C
【详解】设40度白酒体积为100mL,则100mL白酒中水的质量为:1g/cm3×60mL=60g,酒精的质量为:0.8g/cm3×40mL=32g,40度(40°)的白酒溶液中溶质的质量分数约为:×100%=34.8%。故选C。
4.C
【详解】A、氧化钠消耗了水,导致溶剂减少,恢复到原来温度,氢氧化钠会析出,导致溶液中钠离子总数会减少,不正确;
B、因为温度不变所以溶解度不变,饱和溶液中溶质质量分数不变,所以氢氧根离子浓度不变,所以单位体积内氢氧根离子在数目不变,不正确;
C、因为溶解度不变,仍然是原温度下的饱和溶液,所以溶质质量分数不变,正确;
D、因为水变少了,氢氧化钠会析出,所以溶液质量变少,不正确。
故选C。
5.A
【分析】饱和溶液中溶质质量分数为
【详解】t℃时,M物质的溶解度为Sg,则此时溶液的溶质质量分数为 。现已知M物质饱和溶液中溶质的质量为b,其溶质质量分数为,则其溶液质量= ,故选A。
6.C
【详解】A、t1℃时,乙、丙的两种物质的溶解度相等,乙、丙两种物质的饱和溶液的溶质质量分数一定相等,故选项说法正确;
B、t3℃时,甲的溶解度是40g,50g水中加入30g甲形成溶液的质量为:20g+50g=70g,即可得到70g 饱和溶液,故选项说法正确;
C、将t3℃时,甲物质饱和溶液的质量分数大于丙物质饱和溶液的质量分数,甲、丙两种物质的饱和溶液降温至t2℃,降温后,丙的质量分数不变,还是最小,两种溶液中溶质的质量分数:甲>丙,故选项法错误;
D、如图2滴入水后,饱和溶液变浑浊,则该饱和溶液的溶质是丙,因为生石灰溶于水放热,丙的溶解度随温度的升高而减少,故选项说法正确。
故选:C。
7.A
【详解】氢氧化钙的溶解度随温度的升高而降低,所以温度越高质量分数越小,而且相同条件下不饱和的溶液的质量分数比饱和的要小。所以A 答案的氢氧化钙的质量分数是最大的。
综上所述:选择A。
8.B
【详解】A、t1℃时,甲和丙的溶解度相等,故该温度下,甲和丙的饱和溶液的溶质质量分数相等,溶液状态未知,无法比较,不符合题意;
B、由图可知,甲的溶解度随温度的升高而增加,且甲的溶解度受温度影响较大,丙的溶解度随温度的升高而减小,故可采用降温结晶的方法可以除去甲中混有的少量的丙,符合题意;
C、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,故分别将等质量的甲和乙的饱和溶液t2℃降温到t1℃,析出固体的质量为甲>乙,溶液质量未知,无法比较,不符合题意;
D、t2℃时,甲的溶解度是50g,将30克甲放入50克水中,只能溶解25g,故充分溶解后,可以得到75克溶液,不符合题意。
故选B。
9.C
【详解】溶液稀释前后溶质的质量不变。设需要98%的浓硫酸的质量为x,则有,解得x=100g,所以需要水的质量为。
故选C。
10.D
【详解】A、根据溶解度曲线,硫酸钠的溶解度在0到40℃时溶解度随温度的升高而增大,温度高于40℃时随温度的升高溶解度在降低,故选项说法错误;
B、从两种物质的溶解度曲线可以得知,两种物质在30℃和60℃时溶解度都相等,故选项说法错误;
C、将50℃时硫酸钠饱和溶液降温,温度在40℃到50℃之间时无晶体析出,在温度小于40℃时有晶体析出,故选项说法错误;
D、从溶解度曲线可以得知40℃时硫酸钠的溶解度为50g,故饱和的硫酸钠溶液中溶质的质量分数为:,故选项说法正确;
故选择D;
11.正确
【详解】同一温度下,某物质的饱和溶液的浓度最大,因此相同温度下,某物质的饱和溶液一定比不饱和溶液浓。
12.正确
【详解】溶质质量分数为10%的200mL某溶液,密度1.2克/厘米3,溶液质量为 ,其中含溶质
故填:正确
13.正确
【分析】溶液稀释前后溶质质量不变。
【详解】50g 10%的NaCl溶液中氯化钠的质量为,5%的NaCl溶液的质量为,则用50g 10%的NaCl溶液配制5%的NaCl溶液需要加水,故正确。
14.错误
【详解】饱和溶液的溶质质量分数不一定比不饱和溶液的大,如饱和的石灰水由于溶质氢氧化钙溶解度较小属于微溶物,因此其溶质质量分数很小,比一般的其他物质的不饱和溶液溶质质量分数小,故原说法错误。
15.错误
【详解】两种溶液的溶质质量分数相同,可能溶解度不同,因为并不确定是否为饱和溶液,如果确定为饱和溶液,该说法正确,但不知溶液是否为饱和溶液,故错误。
16. 广口瓶 1--2 凹液面的最低处 腐蚀胶帽(合理即可) ③
【详解】(1)固体药品通常保存在广口瓶中,液体药品保存在细口瓶中;
(2)未说明用量时,液体药品一般取1-2mL,固体药品只需盖满试管底部即可,避免浪费;
(3)利用量筒读数时,视线与量筒内液体的凹液面的最低处保持水平;
(4)取液后,将胶头滴管平放后倒置,会使残余液体流至胶帽中,腐蚀胶帽;
(5)用托盘天平称量12.6g药品时,向左盘中加入药品后,发现指针向左偏转,说明药品添加过多,应该减少药品至天平平衡。
17. 锥形瓶 CaCO3+2HCl=CaCl2+CO2↑+H2O C、G 解:由题意可知,反应前的总质量为15g+50g=65g,反应后剩余物质的质量60.6g,质量之所以减少是因为有二氧化碳气体排出,所以二氧化碳的质量为65g-60.6g=4.4g,
设参加反应的HCl为x,
x=7.3g
因反应后大理石中碳酸钙有剩余,稀盐酸完全反应,则参加反应的稀盐酸的溶质质量分数为=
答:参加反应的稀盐酸的溶质质量分数为14.6%。
【详解】⑴由图可知,A为锥形瓶
⑵①大理石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成二氧化碳、水和氯化钙,其化学方程式为;
②因为二氧化碳易溶于水,所以不用排水法收集气体,也就用不到水槽,又因为二氧化碳密度比空气大,所以用向上排空气法收集二氧化碳气体,需要用集气瓶;因为要通过分液漏斗向反应装置中加入稀盐酸,反应生成的二氧化碳要通过导气管,所以要选用双孔胶塞;故选C和G;
③详见答案。
18.(1)食盐的溶解度受温度影响不大
(2) 温度升高,分子的运动速率加快 110 可以查找任意温度下的溶解度
(3) 硝酸钾
B>C>A 75≤m<200
【详解】(1)食盐的溶解度受温度影响不大,故常用蒸发结晶的方法获取;
(2)风和日丽的天气能加快水分的蒸发,温度升高,分子的运动速率加快,晒盐效率更高
①根据溶解度曲线可知,60℃时,硝酸钾的溶解度是110g,表格中的溶解度数据为110;
②相对溶解度数据表,溶解度曲线的优点是可以查找任意温度下的溶解度;
(3)60°C时,氯化钠的溶解度小于50g,硝酸钾的溶解度大于50g,烧杯B中没有固体剩余,所以R是硝酸钾;
A:,B:,C:,所以A、B、C三个烧杯中溶液的溶质质量分数的大小关系是B>C>A;
②如果将含27. 0gNaCl、63. 2gKNO3的混合物溶于mg热水,然后冷却至20°C,氯化钠的溶解度36g,硝酸钾的溶解度是31. 6g,溶解27g的氯化钠需要水的质量为:,溶解63. 2g的硝酸钾需要水的质量为:,所以若要使KNO3析出而NaCl不析出,m的取值范围是75≤m<200。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制成如图所示图像。下列说法不正确的是
A.时,100克水最多溶解该固体物质的质量为88g
B.C点所对应的溶液是不饱和溶液
C.图中A、B、C、D四点所对应的溶液溶质质量分数大小关系为
D.图中A、B、C、D四点所对应的溶液溶质质量分数大小关系为
2.下列推理正确的是
A.蜡烛在氧气中的燃烧比在空气中剧烈得多,说明反应物浓度越大,反应越剧烈
B.木材燃烧后留下的灰烬质量比原木材小,说明固体可燃物燃烧后质量一定减小
C.溶液中有晶体析出时,溶液中的溶质质量一定减小,溶质的质量分数一定减小
D.化学变化中有能量的释放或吸收,则有能量释放或吸收的变化一定是化学变化
3.白酒的 “度数”指的是白酒中酒精的含量。这里的含量不是指质量分数,而是体积分数。例如,52度(52°)的白酒表示100ml白酒中含有52ml酒精(常温时)。蒸馏水密度为1g/cm3,酒精密度为0.8g/cm3,若为40度(40°)的白酒溶液中溶质的质量分数约为
A.40% B.60% C.34.8% D.无法判断
4.向一定量的饱和NaOH溶液中加入少量Na2O固体(已知Na2O固体能溶于水生成NaOH),恢复到原来温度时,下列说法中正确的是
A.溶液中Na+总数不变 B.单位体积内的OH﹣数目变大
C.溶质的质量分数不变 D.溶液的质量不变
5.t℃时,M物质的溶解度为Sg,则bgM物质在t℃时,可配成的饱和溶液的质量是
A.b(100+S)/S g B.(100+S+b) g C.S(100+b)/b g D.100b/S g
6.如图1是甲、乙、丙三种固体物质的溶解度曲线,图2是对某物质的饱和溶液进行实验时的变化情况,下列描述不正确的是
A.t1℃时,乙、丙两种物质的饱和溶液的溶质质量分数一定相等
B.t3℃时,50g水中加入30g甲可得到70g 饱和溶液
C.将t3℃时甲、丙两种物质的饱和溶液降温至t2℃,两种溶液中溶质的质量分数:甲=丙
D.如图2滴入水后,饱和溶液变浑浊,则该饱和溶液的溶质是丙,不是甲和乙
7.下列各条件下的氢氧化钙溶液,溶质的质量分数最大的是
A.10℃的饱和溶液 B.20℃时饱和溶液
C.50℃的不饱和溶液 D.50℃的饱和溶液
8.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,甲和丙的溶液溶质质量分数相等
B.采用降温结晶的方法可以除去甲中混有的少量的丙
C.分别将甲和乙的饱和溶液t2℃降温到t1℃,析出固体的质量为甲>乙
D.t2℃时,将30克甲放入50克水中,充分溶解后,可以得到80克溶液
9.现用98%的浓硫酸配制490g20%的稀硫酸,需水的质量为
A.98g B.100g C.390g D.392g
10.某厂以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,其溶解度曲线如图所示。下列说法正确的是
A.硫酸钠的溶解度随温度的升高而增大
B.氯化铵和硫酸钠仅在30℃时的溶解度相等
C.将50℃时硫酸钠饱和溶液降温始终有晶体析出
D.40℃时硫酸钠饱和溶液的溶质质量分数约为33.3%
二、判断题
11.相同温度下,某物质的饱和溶液一定比不饱和溶液浓( )
12.溶质质量分数为10%的200mL某溶液,密度1.2克/厘米3,其中含溶质24克( )
13.用50g 10%的NaCl溶液配制5%的NaCl溶液需要加水50g( )
14.饱和溶液的溶质质量分数一定比不饱和溶液的大。( )
15.某温度下两种不同物质的溶液,溶质质量分数相同,则这两种物质的溶解度一定相同( )
三、综合应用题
16.掌握仪器的使用方法并严格按照操作要求进行实验,才能保障实验的成功和安全。根据所学化学知识,回答下列问题:
(1)固体药品通常保存在 里(填仪器名称)。
(2)实验室取用药品要注意节约,如果没有说明用量,一般应该取用最少量,液体药品取用 mL。
(3)利用量筒读数时,视线与量筒内液体的 保持水平。
(4)取液后的滴管,平放或倒置可能造成的后果是 (答一点即可)。
(5)用托盘天平称量12.6g药品时,向左盘中加入药品后,发现指针向左偏转,应进行的操作是 (填序号)
①右边的平衡螺母向右调至天平平衡
②移动游码至天平平衡
③左盘中减少药品至天平平衡
④左盘中添加药品至天平平衡
17.下图是实验室里制取气体可能用到的仪器,回答下列问题。
(1)写出仪器A的名称 ;
(2)在实验室里,利用大理石(含不溶于酸的杂质)和稀盐酸来制取二氧化碳。
①反应的化学方程式为 ;
②组装制取装置时,可选用所给仪器中的A、D、H、I、J、O和 ;
③将15g大理石和50g稀盐酸混合,充分反应后剩余物质质量60.6g,若反应后大理石中碳酸钙有剩余,则所用稀盐酸溶质质量分数为 。
18.中国在5000多年前,就开始刮取海滨咸土,淋卤煎盐。结合资料,回答“从海水到餐桌上的食盐”的有关问题:
(1)获得食盐宜采用蒸发结晶的方法,其原因是 。
(2)请从微观角度解释风和日丽的天气晒盐效率更高的原因 。如图是硝酸钾和氯化钠的溶解度数据表和溶解度曲线。
(溶解度单位:g/100g水)
温度(℃) 20 40 60 80
S(KNO3) 31.6 63.9 169
S (NaCl) 36.0 36.6 37.3 38.4
①补全表格中的溶解度数据 。
②相对溶解度数据表溶解度曲线的优点是 (只写一点)。
(3)按下图所示进行实验:
①R是 (选填“氯化钠”或“硝酸钾”),A、B、C三个烧杯中溶液的溶质质量分数的大小关系是 。
②如果将含27.0 gNaCl、63.2gKNO3的混合物溶于mg热水,然后冷却至20℃。若要使KNO3析出而NaCl不析出,则m的取值范围是 。
参考答案:
1.D
【详解】A、在曲线上的点和曲线上边的点都是饱和状态,20℃时,100克水最多溶解该固体物质的质量为88g,故选项说法正确;
B、在曲线上的点和曲线上边的点都是饱和状态,在曲线下边的点属于不饱和状态,C点在曲线下边,则C点对应的溶液是不饱和溶液,故选项说法正确;
C、A、B点对应的是20℃时的饱和溶液,溶液质量分数大小关系是A=B;C、D点对应的溶液,溶质质量相等,但溶剂质量D点的多,则溶液质量分数大小关系是C>D,图中四点所对应的溶液质量分数大小关系为A=B>C>D,故选项说法正确;
D、由C选项的解析,图中四点所对应的溶液质量分数大小关系为A=B>C>D,故选项说法错误;
故选:D。
2.A
【详解】A、蜡烛在氧气中的燃烧比在空气中剧烈得多,氧气中氧气的含量比空气中的大,说明反应物浓度越大,反应越剧烈,故选项正确;
B、木材燃烧后留下的灰烬质量比原木材小,是因为木材燃烧生成二氧化碳气体,不能说明固体可燃物燃烧后质量一定减小,故选项错误;
C、若原溶液可能是饱和溶液,采用的恒温蒸发溶剂的方法,溶液中有晶体析出时,所得溶液仍为该温度下的饱和溶液,溶质的质量分数不变,故选项错误;
D、化学变化中有能量的释放或吸收,但有能量释放或吸收的变化不一定是化学变化,如氢氧化钠溶于水放热,故选项错误。故选A。
【点睛】化学变化中有能量的释放或吸收,但有能量释放或吸收的变化不一定是化学变化,如氢氧化钠溶于水放热。
3.C
【详解】设40度白酒体积为100mL,则100mL白酒中水的质量为:1g/cm3×60mL=60g,酒精的质量为:0.8g/cm3×40mL=32g,40度(40°)的白酒溶液中溶质的质量分数约为:×100%=34.8%。故选C。
4.C
【详解】A、氧化钠消耗了水,导致溶剂减少,恢复到原来温度,氢氧化钠会析出,导致溶液中钠离子总数会减少,不正确;
B、因为温度不变所以溶解度不变,饱和溶液中溶质质量分数不变,所以氢氧根离子浓度不变,所以单位体积内氢氧根离子在数目不变,不正确;
C、因为溶解度不变,仍然是原温度下的饱和溶液,所以溶质质量分数不变,正确;
D、因为水变少了,氢氧化钠会析出,所以溶液质量变少,不正确。
故选C。
5.A
【分析】饱和溶液中溶质质量分数为
【详解】t℃时,M物质的溶解度为Sg,则此时溶液的溶质质量分数为 。现已知M物质饱和溶液中溶质的质量为b,其溶质质量分数为,则其溶液质量= ,故选A。
6.C
【详解】A、t1℃时,乙、丙的两种物质的溶解度相等,乙、丙两种物质的饱和溶液的溶质质量分数一定相等,故选项说法正确;
B、t3℃时,甲的溶解度是40g,50g水中加入30g甲形成溶液的质量为:20g+50g=70g,即可得到70g 饱和溶液,故选项说法正确;
C、将t3℃时,甲物质饱和溶液的质量分数大于丙物质饱和溶液的质量分数,甲、丙两种物质的饱和溶液降温至t2℃,降温后,丙的质量分数不变,还是最小,两种溶液中溶质的质量分数:甲>丙,故选项法错误;
D、如图2滴入水后,饱和溶液变浑浊,则该饱和溶液的溶质是丙,因为生石灰溶于水放热,丙的溶解度随温度的升高而减少,故选项说法正确。
故选:C。
7.A
【详解】氢氧化钙的溶解度随温度的升高而降低,所以温度越高质量分数越小,而且相同条件下不饱和的溶液的质量分数比饱和的要小。所以A 答案的氢氧化钙的质量分数是最大的。
综上所述:选择A。
8.B
【详解】A、t1℃时,甲和丙的溶解度相等,故该温度下,甲和丙的饱和溶液的溶质质量分数相等,溶液状态未知,无法比较,不符合题意;
B、由图可知,甲的溶解度随温度的升高而增加,且甲的溶解度受温度影响较大,丙的溶解度随温度的升高而减小,故可采用降温结晶的方法可以除去甲中混有的少量的丙,符合题意;
C、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,故分别将等质量的甲和乙的饱和溶液t2℃降温到t1℃,析出固体的质量为甲>乙,溶液质量未知,无法比较,不符合题意;
D、t2℃时,甲的溶解度是50g,将30克甲放入50克水中,只能溶解25g,故充分溶解后,可以得到75克溶液,不符合题意。
故选B。
9.C
【详解】溶液稀释前后溶质的质量不变。设需要98%的浓硫酸的质量为x,则有,解得x=100g,所以需要水的质量为。
故选C。
10.D
【详解】A、根据溶解度曲线,硫酸钠的溶解度在0到40℃时溶解度随温度的升高而增大,温度高于40℃时随温度的升高溶解度在降低,故选项说法错误;
B、从两种物质的溶解度曲线可以得知,两种物质在30℃和60℃时溶解度都相等,故选项说法错误;
C、将50℃时硫酸钠饱和溶液降温,温度在40℃到50℃之间时无晶体析出,在温度小于40℃时有晶体析出,故选项说法错误;
D、从溶解度曲线可以得知40℃时硫酸钠的溶解度为50g,故饱和的硫酸钠溶液中溶质的质量分数为:,故选项说法正确;
故选择D;
11.正确
【详解】同一温度下,某物质的饱和溶液的浓度最大,因此相同温度下,某物质的饱和溶液一定比不饱和溶液浓。
12.正确
【详解】溶质质量分数为10%的200mL某溶液,密度1.2克/厘米3,溶液质量为 ,其中含溶质
故填:正确
13.正确
【分析】溶液稀释前后溶质质量不变。
【详解】50g 10%的NaCl溶液中氯化钠的质量为,5%的NaCl溶液的质量为,则用50g 10%的NaCl溶液配制5%的NaCl溶液需要加水,故正确。
14.错误
【详解】饱和溶液的溶质质量分数不一定比不饱和溶液的大,如饱和的石灰水由于溶质氢氧化钙溶解度较小属于微溶物,因此其溶质质量分数很小,比一般的其他物质的不饱和溶液溶质质量分数小,故原说法错误。
15.错误
【详解】两种溶液的溶质质量分数相同,可能溶解度不同,因为并不确定是否为饱和溶液,如果确定为饱和溶液,该说法正确,但不知溶液是否为饱和溶液,故错误。
16. 广口瓶 1--2 凹液面的最低处 腐蚀胶帽(合理即可) ③
【详解】(1)固体药品通常保存在广口瓶中,液体药品保存在细口瓶中;
(2)未说明用量时,液体药品一般取1-2mL,固体药品只需盖满试管底部即可,避免浪费;
(3)利用量筒读数时,视线与量筒内液体的凹液面的最低处保持水平;
(4)取液后,将胶头滴管平放后倒置,会使残余液体流至胶帽中,腐蚀胶帽;
(5)用托盘天平称量12.6g药品时,向左盘中加入药品后,发现指针向左偏转,说明药品添加过多,应该减少药品至天平平衡。
17. 锥形瓶 CaCO3+2HCl=CaCl2+CO2↑+H2O C、G 解:由题意可知,反应前的总质量为15g+50g=65g,反应后剩余物质的质量60.6g,质量之所以减少是因为有二氧化碳气体排出,所以二氧化碳的质量为65g-60.6g=4.4g,
设参加反应的HCl为x,
x=7.3g
因反应后大理石中碳酸钙有剩余,稀盐酸完全反应,则参加反应的稀盐酸的溶质质量分数为=
答:参加反应的稀盐酸的溶质质量分数为14.6%。
【详解】⑴由图可知,A为锥形瓶
⑵①大理石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成二氧化碳、水和氯化钙,其化学方程式为;
②因为二氧化碳易溶于水,所以不用排水法收集气体,也就用不到水槽,又因为二氧化碳密度比空气大,所以用向上排空气法收集二氧化碳气体,需要用集气瓶;因为要通过分液漏斗向反应装置中加入稀盐酸,反应生成的二氧化碳要通过导气管,所以要选用双孔胶塞;故选C和G;
③详见答案。
18.(1)食盐的溶解度受温度影响不大
(2) 温度升高,分子的运动速率加快 110 可以查找任意温度下的溶解度
(3) 硝酸钾
B>C>A 75≤m<200
【详解】(1)食盐的溶解度受温度影响不大,故常用蒸发结晶的方法获取;
(2)风和日丽的天气能加快水分的蒸发,温度升高,分子的运动速率加快,晒盐效率更高
①根据溶解度曲线可知,60℃时,硝酸钾的溶解度是110g,表格中的溶解度数据为110;
②相对溶解度数据表,溶解度曲线的优点是可以查找任意温度下的溶解度;
(3)60°C时,氯化钠的溶解度小于50g,硝酸钾的溶解度大于50g,烧杯B中没有固体剩余,所以R是硝酸钾;
A:,B:,C:,所以A、B、C三个烧杯中溶液的溶质质量分数的大小关系是B>C>A;
②如果将含27. 0gNaCl、63. 2gKNO3的混合物溶于mg热水,然后冷却至20°C,氯化钠的溶解度36g,硝酸钾的溶解度是31. 6g,溶解27g的氯化钠需要水的质量为:,溶解63. 2g的硝酸钾需要水的质量为:,所以若要使KNO3析出而NaCl不析出,m的取值范围是75≤m<200。
