8.4常见的盐同步练习(含解析) 科粤版化学九年级下册
文档属性
| 名称 | 8.4常见的盐同步练习(含解析) 科粤版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 307.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-05 00:00:00 | ||
图片预览


文档简介
8.4常见的盐
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下列情况中,能实现“1+1=2”这一结果的是( )
A.1毫升酒精加1毫升水得到2毫升酒精的水溶液
B.1克硫粉加1克氧气完全反应得到2克二氧化硫
C.1克氢氧化钙加1克水充分溶解后得到2克氢氧化钙溶液
D.1克氯化钡溶液加1克硫酸溶液充分反应后得到2克混合溶液
2.下列除去杂质的方法中,正确的是
选项 物质(括号内为杂质) 去除杂质的方法
A N2(O2) 将气体缓慢通过灼热的木炭粉
B CaO(CaCO3) 加水、过滤
C Fe(Zn) 加过量FeSO4溶液、过滤
D H2SO4(HNO3) 加过量Ba(NO3)2溶液、过滤
A.A B.B C.C D.D
3.下列物质间的转化,在一定条件下均能一步实现的是
①C→CO→CO2 ②Cu→CuO→CuSO4
③CaCO3→CaO→Ca(OH)2 ④Na2CO3→NaCl→NaNO3
A.①②④ B.①②③ C.①③④ D.①②③④
4.学习了碳及其化合物的相关知识之后,某同学绘制了如图所示的物质转化图。下列说法不正确的是
A.图中转化关系错误的是⑤ B.存在可逆转化的是③和④
C.转化①②只能和氧气反应实现 D.转化⑥是化合反应,且放出热量
5.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
6.下列除杂(或提纯)方法正确的是(括号中为杂质)
选项 物质 方法或试剂
A 稀硫酸(HCl) 足量锌粉,过滤
B MnO2(KCl) 溶解、过滤、洗涤、干燥
C Cu(C) 空气中灼烧
D CO2(O2) 通过高温炭层
A.A B.B C.C D.D
7.我国制碱工业的先驱—侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨工艺结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展作出了杰出贡献,纯碱的化学式为
A.NaOH B.H2SO4 C.Na2CO3 D.K2SO4
8.下列图示是化学概念之间关系的形象表示,不正确的是
A B
C D
A.A B.B C.C D.D
9.下列选项中,物质的名称、俗名、化学式不完全一致的是
A.碳酸钠﹣纯碱﹣Na2CO3 B.亚硝酸钠﹣食盐﹣NaNO2
C.氢氧化钙﹣消石灰﹣Ca(OH)2 D.氢氧化钠﹣烧碱﹣NaOH
10.下列溶液中无色,且在pH=1时能大量共存的是
A.CuSO4 NaCl KNO3 B.NaOH NaCl NaNO3
C.Na2SO4 KCl ZnCl2 D.K2SO4 AgNO3 NaCl
二、判断题
11.中和反应可能有沉淀生成( )
12.复分解反应中各物质的元素化合价不发生改变,则元素化合价没有发生改变的反应一定是复分解反应。
13.氧化反应、还原反应是从物质得失氧元素的角度定义的,氧化反应、还原反应不是基本反应类型。( )
14.复分解反应条件之一是有气体产生,因此有气体生成的反应均为复分解反应( )
15.食盐和盐,食盐和工业用盐一样。( )
三、综合应用题
16.2化学是一门以实验为基础的科学。
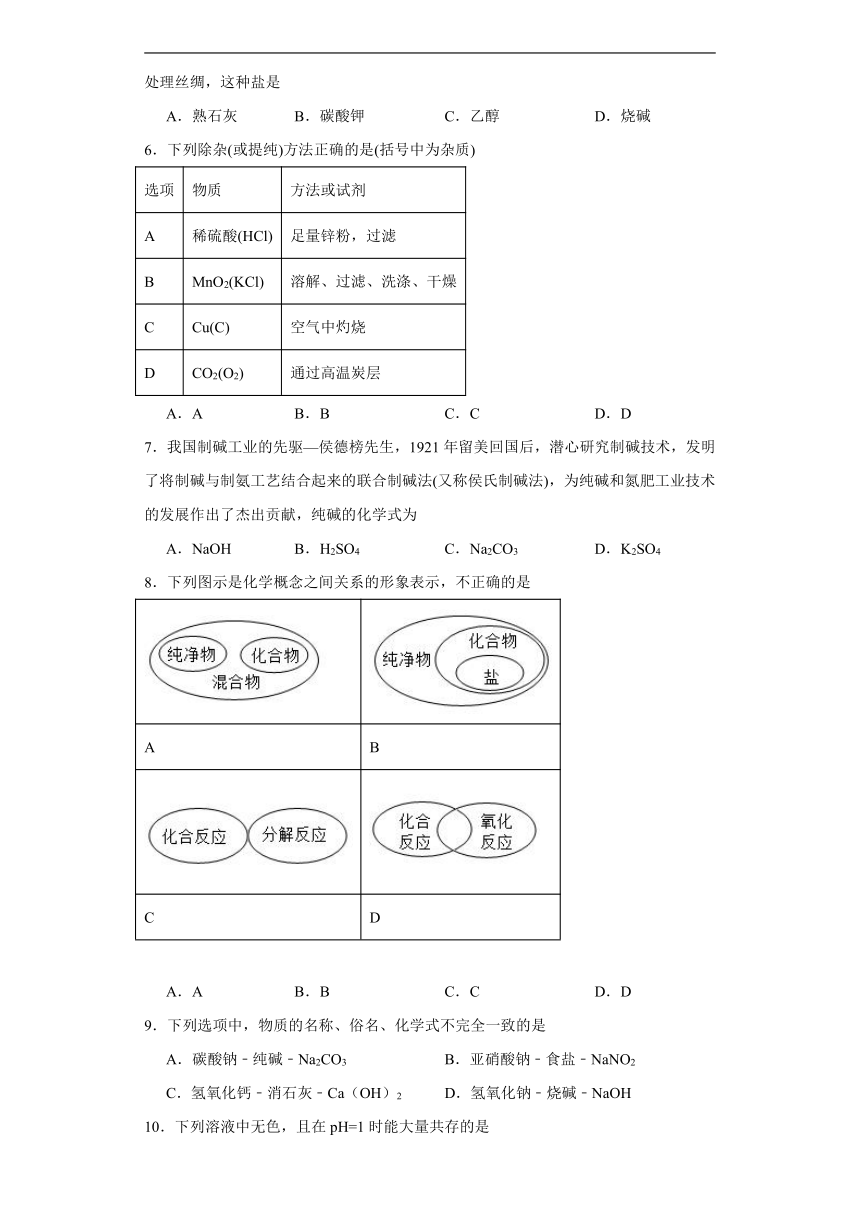
(1)下面是实验室制取气体的相关装置图,回答下列问题:
①写出实验室用高锰酸钾制取氧气的方程式 ,该实验正确的操作顺序是 (填字母) ;
a 加热 b 检查装置的气密性 c 加入药品,固定装置 d 用排水法收集氧气 e 从水槽中取出导管 f 熄灭酒精灯,
②甲烷是一种极难溶于水的气体,常温下与空气不反应。某同学想用无水醋酸钠固体和碱石灰固体加热制取一瓶干燥的甲烷气体,应该选择的装置组合是 (从A到E中选择) ;
③F装置可收集和储备氢气,若用水将该装置中的氢气排出,水应从 (填“m“或“n”)端通入。写出实验室制取氢气的方程式
(2)有一包白色粉末,可能含有碳酸钙、硫酸钠、硫酸铜、碳酸钠、氯化钙中的一种或几种。为了鉴别该白色粉末,做了如下实验:
滴加氯化钡溶液时发生反应的化学方程式是 ,根据实验现象判断此白色粉末的成分: 。
17.氢氧化钠(Sodiumhydroxide),化学式NaOH,也称苛性钠、烧碱、火碱。氢氧化钠具有强碱性,腐蚀性极强,可作酸中和剂、配合掩蔽剂、沉淀剂、沉淀掩蔽剂、显色剂、皂化剂、去皮剂、洗涤剂等,在生产和科学研究中有着广泛的应用。
(1)氢氧化钠溶液在空气中敞口放置过程中容易发生变质。
①变质的原因主要是NaOH溶液能与空气中的 (填化学式)发生化学反应。
②为除去该NaOH溶液中的杂质,小明同学向其中加入了适量的试剂X,出现白色沉淀,恰好完全反应后,再进行过滤,从而得到了较为纯净的NaOH溶液。
请判断他所选的试剂X是下列选项中的 (填选项序号之一)。
A.HCl溶液B.H2SO4溶液C.Ca(OH)2溶液D.BaCl2溶液
(2)欲测定100g某氯化镁溶液中MgCl2的质量,小明同学向其中逐滴加入溶质质量分数为8%的NaOH溶液,反应过程中产生沉淀的质量与所加入NaOH溶液的质量关系如下图所示。试回答:
①当加入NaOH溶液50g时(即图中A点),烧杯中溶液里大量存在的金属阳离子是 (填离子符号)。
②当加入NaOH溶液100g时(即图中B点),恰好完全反应。试通过计算求该氯化镁溶液中MgCl2的质量 。(计算结果精确至0.1g)
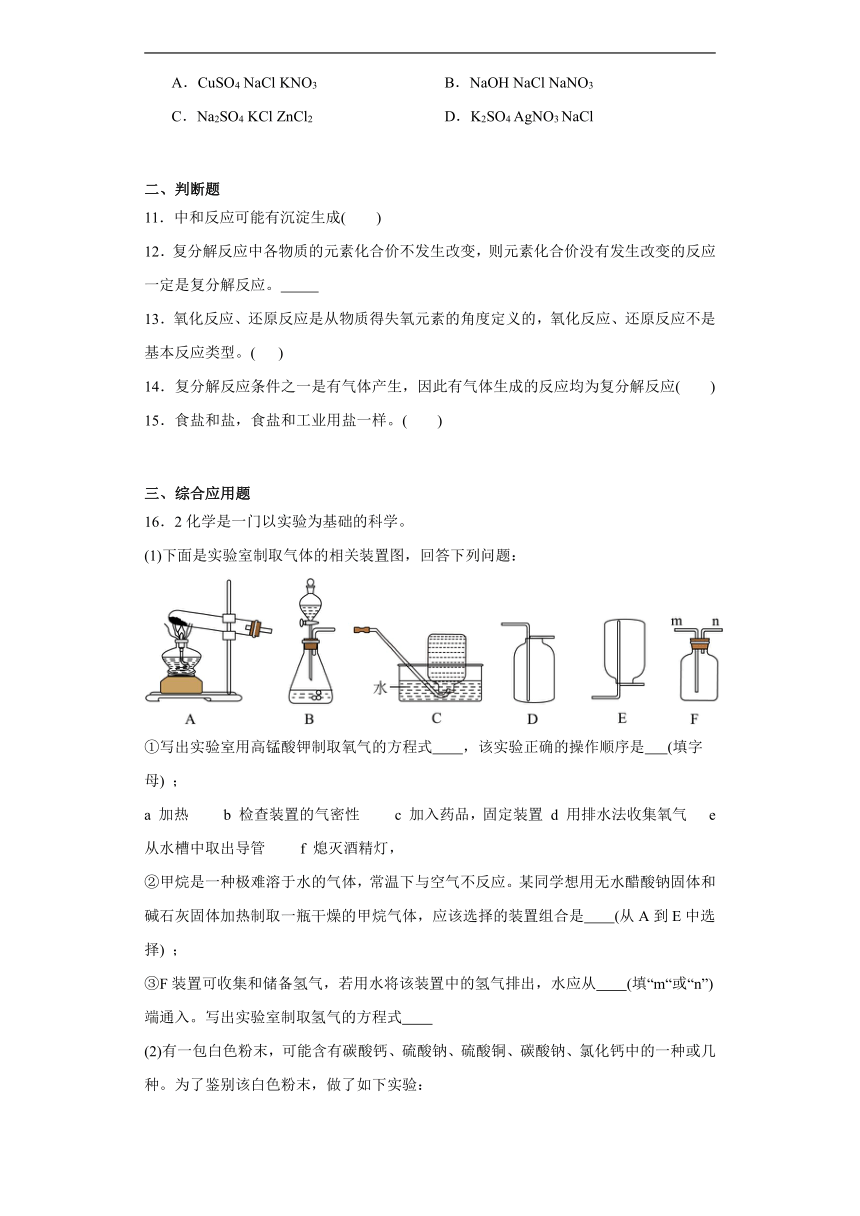
18.钠及其化合物是中学化学学习和研究的重要内容。
(1)如图是钠的原子结构示意图。下列说法不正确的是 。
a.钠属于金属元素
b.钠位于周期表中第三周期
c.钠离子的符号为Na
d.钠在化学反应中易失去电子
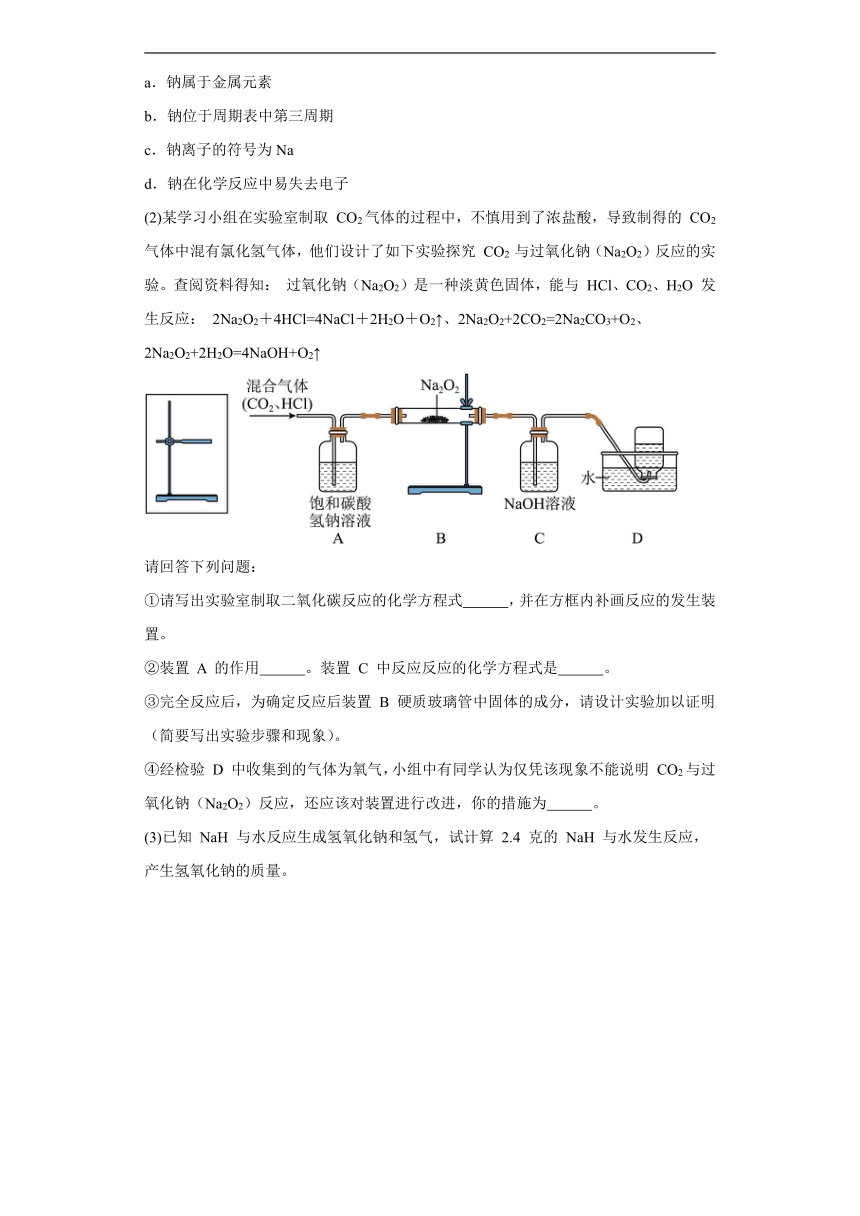
(2)某学习小组在实验室制取 CO2气体的过程中,不慎用到了浓盐酸,导致制得的 CO2气体中混有氯化氢气体,他们设计了如下实验探究 CO2 与过氧化钠(Na2O2)反应的实验。查阅资料得知: 过氧化钠(Na2O2)是一种淡黄色固体,能与 HCl、CO2、H2O 发生反应: 2Na2O2+4HCl=4NaCl+2H2O+O2↑、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑
请回答下列问题:
①请写出实验室制取二氧化碳反应的化学方程式 ,并在方框内补画反应的发生装置。
②装置 A 的作用 。装置 C 中反应反应的化学方程式是 。
③完全反应后,为确定反应后装置 B 硬质玻璃管中固体的成分,请设计实验加以证明 (简要写出实验步骤和现象)。
④经检验 D 中收集到的气体为氧气,小组中有同学认为仅凭该现象不能说明 CO2与过氧化钠(Na2O2)反应,还应该对装置进行改进,你的措施为 。
(3)已知 NaH 与水反应生成氢氧化钠和氢气,试计算 2.4 克的 NaH 与水发生反应,产生氢氧化钠的质量。
参考答案:
1.B
【详解】A、酒精分子与水分子的大小与分子间的间隙均不同,1毫升酒精和1毫升水混合后,两种分子相互穿插,最终得到的溶液的体积小于2毫升,选项错误;
B、硫与氧气燃烧后只生成二氧化硫一种物质,且1克硫粉与1克氧气能恰好完全反应,反应后得到2克二氧化硫,选项正确;
C、氢氧化钙微溶于水,将1克氢氧化钙加到1克水中,只能溶解少量的氢氧化钙,即氢氧化钙固体有剩余,则所得溶液的质量小于2克,选项错误;
D、氯化钡与硫酸反应生成盐酸和硫酸钡沉淀,所以1克氯化钡溶液和1克硫酸溶液充分反应后得到溶液的质量小于2克,选项错误,故选B。
2.C
【分析】除杂原则:不引入新杂质、不与主物质反应、步骤不繁琐,操作简便易行。
【详解】A、氧气通过灼热的木炭粉时可与木炭粉发生反应生成二氧化碳,而氮气不与木炭粉反应,能除去杂质且引入新的杂质二氧化碳,不符合除杂原则,故选项所采取的方法错误;
B、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误;
C、Zn能与过量FeSO4溶液反应生成硫酸锌溶液和铁,再过滤、洗涤、晾干,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
D、H2SO4能与适量Ba(NO3)2溶液反应生成硫酸钡沉淀和硝酸,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
故选C。
3.D
【详解】①中碳在氧气中不充分燃烧生成一氧化碳,一氧化碳燃烧生成二氧化碳;
②中铜和氧气在加热的条件下生成氧化铜,氧化铜和硫酸生成硫酸铜和水;
③碳酸钙在高温下分解为氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙;
④碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,氯化钠和硝酸银反应生成氯化银白色沉淀和硝酸钠;
①②③④均能一步实现,故选D。
4.C
【详解】A、碳酸钙高温反应生成氧化钙和氧气,氧化钙不能转化成碳酸钙,转化关系错误的是⑤,说法正确;
B、二氧化碳与碳在高温条件下反应生成一氧化碳,一氧化碳与氧气在点燃条件下反应生成二氧化碳,二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水,碳酸钙在高温条件下反应生成氧化钙和二氧化碳,存在可逆转化的是③和④,说法正确;
C、碳与氧气在点燃条件下不充分燃烧生成一氧化碳,碳与氧气在点燃条件下充分燃烧生成二氧化碳, 碳与氧化铜在高温条件下反应生成铜和二氧化碳,转化①不是只能和氧气反应实现,说法错误;
D、转化⑥是氧化钙与水反应生成氢氧化钙,两种物质反应生成一种物质的反应叫做化合反应,且放出热量,说法正确;
答案:C。
5.B
【详解】A.熟石灰属于碱,错误;B.碳酸钾属于盐,正确;C.乙醇属于有机物,错误;D.烧碱属于碱,错误。故选B。
6.B
【详解】A、加入足量锌粉,锌和稀硫酸反应生成硫酸锌和氢气,锌和稀盐酸反应生成氯化锌和氢气,不但除去了杂质,也除去了原物质,不符合题意;
B、二氧化锰难溶于水,氯化钾溶于水,可通过溶解、过滤、洗涤、干燥得到二氧化锰,符合题意;
C、在空气中灼烧,碳燃烧生成二氧化碳,铜与氧气在加热的条件下反应生成氧化铜,不但除去了杂质,也除去了原物质,不符合题意;
D、通过高温炭层,碳与氧气在高温下反应生成二氧化碳,二氧化碳和碳在高温下反应生成一氧化碳,不但除去了杂质,也除去了原物质,不符合题意。
故选B。
7.C
【详解】纯碱是碳酸钠的俗称,其化学式为Na2CO3;
答案:C。
8.A
【详解】A、纯净物是由同种物质组成,混合物是由不同种物质组成,故纯净物和混合物属于并列关系,化合物是由不同种元素组成的纯净物,故纯净物包含化合物,符合题意;
B、化合物是由不同种元素组成的纯净物,盐是由金属离子(或铵根离子)与 酸根离子构成的化合物,故纯净物包含化合物,化合物包含盐,不符合题意;
C、化合反应符合“多变一”的特点,分解反应符合“一变多”的特点,两者属于并列关系,不符合题意;
D、有的化合反应是氧化反应,如木炭燃烧生成二氧化碳,有的化合反应不是氧化反应,如氧化钙和水反应生成氢氧化钙,两者属于交叉关系,不符合题意。
故选A。
9.B
【详解】A、碳酸钠俗称纯碱、苏打,碳酸钠由钠离子和碳酸根离子构成,钠离子显+1价,碳酸根离子显-2价,化学式为:Na2CO3,不符合题意;
B、亚硝酸钠俗称工业盐,亚硝酸钠由钠离子和亚硝酸根离子构成,钠离子显+1价,亚硝酸根离子显-1价,化学式为:NaNO2,符合题意;
C、氢氧化钙俗称熟石灰、消石灰,氢氧化钙由钙离子和氢氧根离子构成,钙离子显+2价,氢氧根离子显-1价,化学式为:Ca(OH)2,不符合题意;
D、氢氧化钠俗称烧碱、火碱、苛性钠,氢氧化钠由钠离子和氢氧根离子构成,钠离子显+1价,氢氧根离子显-1价,化学式为:NaOH,不符合题意。
故选B。
10.C
【分析】pH=1的溶液中有大量的H+,大量共存要求物质之间相互交换成分不能结合生成水、气体或沉淀,形成无色溶液要求分析常见离子在水溶液中的颜色,若为无色,符合题意。
【详解】A、物质之间相互交换成分不能结合生成水、气体或沉淀,但Cu2+在水溶液中为蓝色,不正确;
B、NaOH可与酸发生中和反应,故不能共存,不正确;
C、物质之间相互交换成分不能结合生成水、气体或沉淀,且离子均为无色,正确;
D、K2SO4 、AgNO3生成硫酸银沉淀,不正确;
故选C。
11.正确
【详解】中和反应是酸和碱反应生成盐和水,当生成的盐不溶于水时即生成了沉淀,如氢氧化钡和硫酸反应生成硫酸钡沉淀。正确。
12.错误
【分析】根据复分解反应定义:两种化合物相互交换成分生成两种新的化合物的反应,及其他反应类型的特征分析。
【详解】复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,复分解反应中元素化合价一定不发生改变,但反应前后,各元素化合价没有发生变化的反应不一定是复分解反应,如碳酸的分解,反应前后,各元素化合价没有发生变化,但不属于复分解反应,故说法错误。
13.正确
【详解】基本反应类型包括:分解反应、化合反应、置换反应、复分解反应,氧化反应、还原反应不是基本反应类型,正确。
14.错误
【详解】有气体生成的反应不一定为复分解反应,例如水电解生成氢气和氧气,错误。
15.×
【详解】食盐是氯化钠,是盐类的一种,食盐和工业用盐不一样,说法错误。
故填:×。
16. 2KMnO4K2MnO4+MnO2+O2↑ bcadef AE/EA m Zn+H2SO4=ZnSO4+H2↑ Na2CO3+BaCl2=BaCO3↓+2NaCl 碳酸钠/Na2CO3
【详解】(1) ①实验室用高锰酸钾制取氧气的方程式为2KMnO4K2MnO4+MnO2+O2↑,该实验正确的操作顺序是bcadef;
②用无水醋酸钠固体和碱石灰固体加热制取一瓶干燥的甲烷气体,需中加热固体的反应装置,用向下排空气法收集,所以应该选择的装置组合是AE;
③F装置可收集和储备氢气,若用水将该装置中的氢气排出,水应从长导管m通入;
(2)由流程图可知,白色固体加入过量稀硝酸固体完全溶解产生气泡,说明沉淀为碳酸钡而没有硫酸钡,即白色粉末中一定含有碳酸钠,一定不含硫酸钠, 滴加氯化钡溶液时发生反应的化学方程式是 Na2CO3+BaCl2=BaCO3↓+2NaCl,白色粉末加水可形成无色溶液,说明一定不含碳酸钙和硫酸铜,因碳酸钠与氯化钙会产生碳酸钙沉淀,则氯化钙一定不含,由此可知,白色粉末中只有碳酸钠。
17.(1) CO2 C
(2) Mg2+、Na+ 100gNaOH溶液中NaOH的质量:100g×8%=8g
设氯化镁溶液中MgCl2的质量为x
答:氯化镁溶液中MgCl2的质量为9.5g。
【详解】(1)①NaOH能与空气中的CO2发生化学反应产生碳酸钠和水;
②氢氧化钠中的杂质是碳酸钠,要除去碳酸钠,不引入其他杂质,则要选用氢氧化钙,氢氧化钙和碳酸钠反应产生碳酸钙沉淀和氢氧化钠,故选C;
(2)①氯化镁和氢氧化钠反应产生氢氧化镁沉淀和氯化钠,图中A点没有将氯化镁反应完全,溶液中含有氯化镁、氯化钠,则烧杯中溶液里大量存在的金属阳离子是Mg2+、Na+;
②见答案。
18.(1)c
(2) ; 除去混合气体中的氯化氢 CO2+2NaOH=Na2CO3+H2O 取少量固体溶于水,滴加过量氯化钡溶液,如有白色沉淀则有碳酸钠,然后滴加几滴酚酞,如酚酞变红则有氢氧化钠 在AB装置中间加装装有浓硫酸的洗气瓶
(3)解:设生成氢氧化钠的质量为x
答:生成氢氧化钠的质量是4g。
【详解】(1)a.钠是“钅”字旁属于金属元素,正确。
b.钠有3个电子层,位于周期表中第三周期,正确。
c.钠离子的符号为Na+。错误。
d.钠的最外层电子数为1,小于4。在化学反应中易失去电子,正确。
故选c。
(2)①实验室使用大理石和稀盐酸制取二氧化碳,化学方程式是。该反应不需要加热,所以使用固液不加热型装置,所以补充如图:。
②装置A中的碳酸氢钠和氯化氢反应生成氯化钠、水和二氧化碳,作用是除去混合气体中的氯化氢。C装置中的是氢氧化钠,能与未与过氧化钠反应的二氧化碳反应,化学方程式为。
③硬质玻璃管发生过氧化钠与二氧化碳反应生成碳酸钠和氧气,因混合气体中会带有水蒸气,也会发生过氧化钠与水反应生成氢氧化钠和氧气。生成的氢氧化钠和二氧化碳会反应生成碳酸钠和水。因是完全反应,不考虑过氧化钠剩余,所以要验证的是混合固体中是否有碳酸钠和氢氧化钠。可以使用氯化钡检验并除去碳酸钠,然后用酚酞检验是否有氢氧化钠存在。具体步骤和现象为:取少量固体溶于水,滴加过量氯化钡溶液,如有白色沉淀则有碳酸钠,然后滴加几滴酚酞,如酚酞变红则有氢氧化钠。
④D中收集的氧气可能是水与过氧化钠反应生成的。所以可以除去水后再通入B装置,看是否有氧气生成。浓硫酸具有吸水性且不和二氧化碳反应,可用于干燥二氧化碳。所以改进措施可以是在AB装置中间加装装有浓硫酸的洗气瓶。
(3)见答案。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下列情况中,能实现“1+1=2”这一结果的是( )
A.1毫升酒精加1毫升水得到2毫升酒精的水溶液
B.1克硫粉加1克氧气完全反应得到2克二氧化硫
C.1克氢氧化钙加1克水充分溶解后得到2克氢氧化钙溶液
D.1克氯化钡溶液加1克硫酸溶液充分反应后得到2克混合溶液
2.下列除去杂质的方法中,正确的是
选项 物质(括号内为杂质) 去除杂质的方法
A N2(O2) 将气体缓慢通过灼热的木炭粉
B CaO(CaCO3) 加水、过滤
C Fe(Zn) 加过量FeSO4溶液、过滤
D H2SO4(HNO3) 加过量Ba(NO3)2溶液、过滤
A.A B.B C.C D.D
3.下列物质间的转化,在一定条件下均能一步实现的是
①C→CO→CO2 ②Cu→CuO→CuSO4
③CaCO3→CaO→Ca(OH)2 ④Na2CO3→NaCl→NaNO3
A.①②④ B.①②③ C.①③④ D.①②③④
4.学习了碳及其化合物的相关知识之后,某同学绘制了如图所示的物质转化图。下列说法不正确的是
A.图中转化关系错误的是⑤ B.存在可逆转化的是③和④
C.转化①②只能和氧气反应实现 D.转化⑥是化合反应,且放出热量
5.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
6.下列除杂(或提纯)方法正确的是(括号中为杂质)
选项 物质 方法或试剂
A 稀硫酸(HCl) 足量锌粉,过滤
B MnO2(KCl) 溶解、过滤、洗涤、干燥
C Cu(C) 空气中灼烧
D CO2(O2) 通过高温炭层
A.A B.B C.C D.D
7.我国制碱工业的先驱—侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨工艺结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展作出了杰出贡献,纯碱的化学式为
A.NaOH B.H2SO4 C.Na2CO3 D.K2SO4
8.下列图示是化学概念之间关系的形象表示,不正确的是
A B
C D
A.A B.B C.C D.D
9.下列选项中,物质的名称、俗名、化学式不完全一致的是
A.碳酸钠﹣纯碱﹣Na2CO3 B.亚硝酸钠﹣食盐﹣NaNO2
C.氢氧化钙﹣消石灰﹣Ca(OH)2 D.氢氧化钠﹣烧碱﹣NaOH
10.下列溶液中无色,且在pH=1时能大量共存的是
A.CuSO4 NaCl KNO3 B.NaOH NaCl NaNO3
C.Na2SO4 KCl ZnCl2 D.K2SO4 AgNO3 NaCl
二、判断题
11.中和反应可能有沉淀生成( )
12.复分解反应中各物质的元素化合价不发生改变,则元素化合价没有发生改变的反应一定是复分解反应。
13.氧化反应、还原反应是从物质得失氧元素的角度定义的,氧化反应、还原反应不是基本反应类型。( )
14.复分解反应条件之一是有气体产生,因此有气体生成的反应均为复分解反应( )
15.食盐和盐,食盐和工业用盐一样。( )
三、综合应用题
16.2化学是一门以实验为基础的科学。
(1)下面是实验室制取气体的相关装置图,回答下列问题:
①写出实验室用高锰酸钾制取氧气的方程式 ,该实验正确的操作顺序是 (填字母) ;
a 加热 b 检查装置的气密性 c 加入药品,固定装置 d 用排水法收集氧气 e 从水槽中取出导管 f 熄灭酒精灯,
②甲烷是一种极难溶于水的气体,常温下与空气不反应。某同学想用无水醋酸钠固体和碱石灰固体加热制取一瓶干燥的甲烷气体,应该选择的装置组合是 (从A到E中选择) ;
③F装置可收集和储备氢气,若用水将该装置中的氢气排出,水应从 (填“m“或“n”)端通入。写出实验室制取氢气的方程式
(2)有一包白色粉末,可能含有碳酸钙、硫酸钠、硫酸铜、碳酸钠、氯化钙中的一种或几种。为了鉴别该白色粉末,做了如下实验:
滴加氯化钡溶液时发生反应的化学方程式是 ,根据实验现象判断此白色粉末的成分: 。
17.氢氧化钠(Sodiumhydroxide),化学式NaOH,也称苛性钠、烧碱、火碱。氢氧化钠具有强碱性,腐蚀性极强,可作酸中和剂、配合掩蔽剂、沉淀剂、沉淀掩蔽剂、显色剂、皂化剂、去皮剂、洗涤剂等,在生产和科学研究中有着广泛的应用。
(1)氢氧化钠溶液在空气中敞口放置过程中容易发生变质。
①变质的原因主要是NaOH溶液能与空气中的 (填化学式)发生化学反应。
②为除去该NaOH溶液中的杂质,小明同学向其中加入了适量的试剂X,出现白色沉淀,恰好完全反应后,再进行过滤,从而得到了较为纯净的NaOH溶液。
请判断他所选的试剂X是下列选项中的 (填选项序号之一)。
A.HCl溶液B.H2SO4溶液C.Ca(OH)2溶液D.BaCl2溶液
(2)欲测定100g某氯化镁溶液中MgCl2的质量,小明同学向其中逐滴加入溶质质量分数为8%的NaOH溶液,反应过程中产生沉淀的质量与所加入NaOH溶液的质量关系如下图所示。试回答:
①当加入NaOH溶液50g时(即图中A点),烧杯中溶液里大量存在的金属阳离子是 (填离子符号)。
②当加入NaOH溶液100g时(即图中B点),恰好完全反应。试通过计算求该氯化镁溶液中MgCl2的质量 。(计算结果精确至0.1g)
18.钠及其化合物是中学化学学习和研究的重要内容。
(1)如图是钠的原子结构示意图。下列说法不正确的是 。
a.钠属于金属元素
b.钠位于周期表中第三周期
c.钠离子的符号为Na
d.钠在化学反应中易失去电子
(2)某学习小组在实验室制取 CO2气体的过程中,不慎用到了浓盐酸,导致制得的 CO2气体中混有氯化氢气体,他们设计了如下实验探究 CO2 与过氧化钠(Na2O2)反应的实验。查阅资料得知: 过氧化钠(Na2O2)是一种淡黄色固体,能与 HCl、CO2、H2O 发生反应: 2Na2O2+4HCl=4NaCl+2H2O+O2↑、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑
请回答下列问题:
①请写出实验室制取二氧化碳反应的化学方程式 ,并在方框内补画反应的发生装置。
②装置 A 的作用 。装置 C 中反应反应的化学方程式是 。
③完全反应后,为确定反应后装置 B 硬质玻璃管中固体的成分,请设计实验加以证明 (简要写出实验步骤和现象)。
④经检验 D 中收集到的气体为氧气,小组中有同学认为仅凭该现象不能说明 CO2与过氧化钠(Na2O2)反应,还应该对装置进行改进,你的措施为 。
(3)已知 NaH 与水反应生成氢氧化钠和氢气,试计算 2.4 克的 NaH 与水发生反应,产生氢氧化钠的质量。
参考答案:
1.B
【详解】A、酒精分子与水分子的大小与分子间的间隙均不同,1毫升酒精和1毫升水混合后,两种分子相互穿插,最终得到的溶液的体积小于2毫升,选项错误;
B、硫与氧气燃烧后只生成二氧化硫一种物质,且1克硫粉与1克氧气能恰好完全反应,反应后得到2克二氧化硫,选项正确;
C、氢氧化钙微溶于水,将1克氢氧化钙加到1克水中,只能溶解少量的氢氧化钙,即氢氧化钙固体有剩余,则所得溶液的质量小于2克,选项错误;
D、氯化钡与硫酸反应生成盐酸和硫酸钡沉淀,所以1克氯化钡溶液和1克硫酸溶液充分反应后得到溶液的质量小于2克,选项错误,故选B。
2.C
【分析】除杂原则:不引入新杂质、不与主物质反应、步骤不繁琐,操作简便易行。
【详解】A、氧气通过灼热的木炭粉时可与木炭粉发生反应生成二氧化碳,而氮气不与木炭粉反应,能除去杂质且引入新的杂质二氧化碳,不符合除杂原则,故选项所采取的方法错误;
B、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误;
C、Zn能与过量FeSO4溶液反应生成硫酸锌溶液和铁,再过滤、洗涤、晾干,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
D、H2SO4能与适量Ba(NO3)2溶液反应生成硫酸钡沉淀和硝酸,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
故选C。
3.D
【详解】①中碳在氧气中不充分燃烧生成一氧化碳,一氧化碳燃烧生成二氧化碳;
②中铜和氧气在加热的条件下生成氧化铜,氧化铜和硫酸生成硫酸铜和水;
③碳酸钙在高温下分解为氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙;
④碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,氯化钠和硝酸银反应生成氯化银白色沉淀和硝酸钠;
①②③④均能一步实现,故选D。
4.C
【详解】A、碳酸钙高温反应生成氧化钙和氧气,氧化钙不能转化成碳酸钙,转化关系错误的是⑤,说法正确;
B、二氧化碳与碳在高温条件下反应生成一氧化碳,一氧化碳与氧气在点燃条件下反应生成二氧化碳,二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水,碳酸钙在高温条件下反应生成氧化钙和二氧化碳,存在可逆转化的是③和④,说法正确;
C、碳与氧气在点燃条件下不充分燃烧生成一氧化碳,碳与氧气在点燃条件下充分燃烧生成二氧化碳, 碳与氧化铜在高温条件下反应生成铜和二氧化碳,转化①不是只能和氧气反应实现,说法错误;
D、转化⑥是氧化钙与水反应生成氢氧化钙,两种物质反应生成一种物质的反应叫做化合反应,且放出热量,说法正确;
答案:C。
5.B
【详解】A.熟石灰属于碱,错误;B.碳酸钾属于盐,正确;C.乙醇属于有机物,错误;D.烧碱属于碱,错误。故选B。
6.B
【详解】A、加入足量锌粉,锌和稀硫酸反应生成硫酸锌和氢气,锌和稀盐酸反应生成氯化锌和氢气,不但除去了杂质,也除去了原物质,不符合题意;
B、二氧化锰难溶于水,氯化钾溶于水,可通过溶解、过滤、洗涤、干燥得到二氧化锰,符合题意;
C、在空气中灼烧,碳燃烧生成二氧化碳,铜与氧气在加热的条件下反应生成氧化铜,不但除去了杂质,也除去了原物质,不符合题意;
D、通过高温炭层,碳与氧气在高温下反应生成二氧化碳,二氧化碳和碳在高温下反应生成一氧化碳,不但除去了杂质,也除去了原物质,不符合题意。
故选B。
7.C
【详解】纯碱是碳酸钠的俗称,其化学式为Na2CO3;
答案:C。
8.A
【详解】A、纯净物是由同种物质组成,混合物是由不同种物质组成,故纯净物和混合物属于并列关系,化合物是由不同种元素组成的纯净物,故纯净物包含化合物,符合题意;
B、化合物是由不同种元素组成的纯净物,盐是由金属离子(或铵根离子)与 酸根离子构成的化合物,故纯净物包含化合物,化合物包含盐,不符合题意;
C、化合反应符合“多变一”的特点,分解反应符合“一变多”的特点,两者属于并列关系,不符合题意;
D、有的化合反应是氧化反应,如木炭燃烧生成二氧化碳,有的化合反应不是氧化反应,如氧化钙和水反应生成氢氧化钙,两者属于交叉关系,不符合题意。
故选A。
9.B
【详解】A、碳酸钠俗称纯碱、苏打,碳酸钠由钠离子和碳酸根离子构成,钠离子显+1价,碳酸根离子显-2价,化学式为:Na2CO3,不符合题意;
B、亚硝酸钠俗称工业盐,亚硝酸钠由钠离子和亚硝酸根离子构成,钠离子显+1价,亚硝酸根离子显-1价,化学式为:NaNO2,符合题意;
C、氢氧化钙俗称熟石灰、消石灰,氢氧化钙由钙离子和氢氧根离子构成,钙离子显+2价,氢氧根离子显-1价,化学式为:Ca(OH)2,不符合题意;
D、氢氧化钠俗称烧碱、火碱、苛性钠,氢氧化钠由钠离子和氢氧根离子构成,钠离子显+1价,氢氧根离子显-1价,化学式为:NaOH,不符合题意。
故选B。
10.C
【分析】pH=1的溶液中有大量的H+,大量共存要求物质之间相互交换成分不能结合生成水、气体或沉淀,形成无色溶液要求分析常见离子在水溶液中的颜色,若为无色,符合题意。
【详解】A、物质之间相互交换成分不能结合生成水、气体或沉淀,但Cu2+在水溶液中为蓝色,不正确;
B、NaOH可与酸发生中和反应,故不能共存,不正确;
C、物质之间相互交换成分不能结合生成水、气体或沉淀,且离子均为无色,正确;
D、K2SO4 、AgNO3生成硫酸银沉淀,不正确;
故选C。
11.正确
【详解】中和反应是酸和碱反应生成盐和水,当生成的盐不溶于水时即生成了沉淀,如氢氧化钡和硫酸反应生成硫酸钡沉淀。正确。
12.错误
【分析】根据复分解反应定义:两种化合物相互交换成分生成两种新的化合物的反应,及其他反应类型的特征分析。
【详解】复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,复分解反应中元素化合价一定不发生改变,但反应前后,各元素化合价没有发生变化的反应不一定是复分解反应,如碳酸的分解,反应前后,各元素化合价没有发生变化,但不属于复分解反应,故说法错误。
13.正确
【详解】基本反应类型包括:分解反应、化合反应、置换反应、复分解反应,氧化反应、还原反应不是基本反应类型,正确。
14.错误
【详解】有气体生成的反应不一定为复分解反应,例如水电解生成氢气和氧气,错误。
15.×
【详解】食盐是氯化钠,是盐类的一种,食盐和工业用盐不一样,说法错误。
故填:×。
16. 2KMnO4K2MnO4+MnO2+O2↑ bcadef AE/EA m Zn+H2SO4=ZnSO4+H2↑ Na2CO3+BaCl2=BaCO3↓+2NaCl 碳酸钠/Na2CO3
【详解】(1) ①实验室用高锰酸钾制取氧气的方程式为2KMnO4K2MnO4+MnO2+O2↑,该实验正确的操作顺序是bcadef;
②用无水醋酸钠固体和碱石灰固体加热制取一瓶干燥的甲烷气体,需中加热固体的反应装置,用向下排空气法收集,所以应该选择的装置组合是AE;
③F装置可收集和储备氢气,若用水将该装置中的氢气排出,水应从长导管m通入;
(2)由流程图可知,白色固体加入过量稀硝酸固体完全溶解产生气泡,说明沉淀为碳酸钡而没有硫酸钡,即白色粉末中一定含有碳酸钠,一定不含硫酸钠, 滴加氯化钡溶液时发生反应的化学方程式是 Na2CO3+BaCl2=BaCO3↓+2NaCl,白色粉末加水可形成无色溶液,说明一定不含碳酸钙和硫酸铜,因碳酸钠与氯化钙会产生碳酸钙沉淀,则氯化钙一定不含,由此可知,白色粉末中只有碳酸钠。
17.(1) CO2 C
(2) Mg2+、Na+ 100gNaOH溶液中NaOH的质量:100g×8%=8g
设氯化镁溶液中MgCl2的质量为x
答:氯化镁溶液中MgCl2的质量为9.5g。
【详解】(1)①NaOH能与空气中的CO2发生化学反应产生碳酸钠和水;
②氢氧化钠中的杂质是碳酸钠,要除去碳酸钠,不引入其他杂质,则要选用氢氧化钙,氢氧化钙和碳酸钠反应产生碳酸钙沉淀和氢氧化钠,故选C;
(2)①氯化镁和氢氧化钠反应产生氢氧化镁沉淀和氯化钠,图中A点没有将氯化镁反应完全,溶液中含有氯化镁、氯化钠,则烧杯中溶液里大量存在的金属阳离子是Mg2+、Na+;
②见答案。
18.(1)c
(2) ; 除去混合气体中的氯化氢 CO2+2NaOH=Na2CO3+H2O 取少量固体溶于水,滴加过量氯化钡溶液,如有白色沉淀则有碳酸钠,然后滴加几滴酚酞,如酚酞变红则有氢氧化钠 在AB装置中间加装装有浓硫酸的洗气瓶
(3)解:设生成氢氧化钠的质量为x
答:生成氢氧化钠的质量是4g。
【详解】(1)a.钠是“钅”字旁属于金属元素,正确。
b.钠有3个电子层,位于周期表中第三周期,正确。
c.钠离子的符号为Na+。错误。
d.钠的最外层电子数为1,小于4。在化学反应中易失去电子,正确。
故选c。
(2)①实验室使用大理石和稀盐酸制取二氧化碳,化学方程式是。该反应不需要加热,所以使用固液不加热型装置,所以补充如图:。
②装置A中的碳酸氢钠和氯化氢反应生成氯化钠、水和二氧化碳,作用是除去混合气体中的氯化氢。C装置中的是氢氧化钠,能与未与过氧化钠反应的二氧化碳反应,化学方程式为。
③硬质玻璃管发生过氧化钠与二氧化碳反应生成碳酸钠和氧气,因混合气体中会带有水蒸气,也会发生过氧化钠与水反应生成氢氧化钠和氧气。生成的氢氧化钠和二氧化碳会反应生成碳酸钠和水。因是完全反应,不考虑过氧化钠剩余,所以要验证的是混合固体中是否有碳酸钠和氢氧化钠。可以使用氯化钡检验并除去碳酸钠,然后用酚酞检验是否有氢氧化钠存在。具体步骤和现象为:取少量固体溶于水,滴加过量氯化钡溶液,如有白色沉淀则有碳酸钠,然后滴加几滴酚酞,如酚酞变红则有氢氧化钠。
④D中收集的氧气可能是水与过氧化钠反应生成的。所以可以除去水后再通入B装置,看是否有氧气生成。浓硫酸具有吸水性且不和二氧化碳反应,可用于干燥二氧化碳。所以改进措施可以是在AB装置中间加装装有浓硫酸的洗气瓶。
(3)见答案。
