化学人教版九年级下册课件:9.2.1 饱和溶液与不饱和溶液(共22张PPT)
文档属性
| 名称 | 化学人教版九年级下册课件:9.2.1 饱和溶液与不饱和溶液(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 41.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-06 11:29:18 | ||
图片预览







文档简介
(共22张PPT)
第1课时 饱和溶液与不饱和溶液
第九单元 溶液
课题2 溶解度
人教版化学九年级下册
我们已经知道,蔗糖或食盐很容易地溶解在水里形成溶液。
若一种物质能溶于水,那么它能在定量的水中无限制地溶解下去吗?
饱和溶液与不饱和溶液
知识点 1
实验 9 – 5
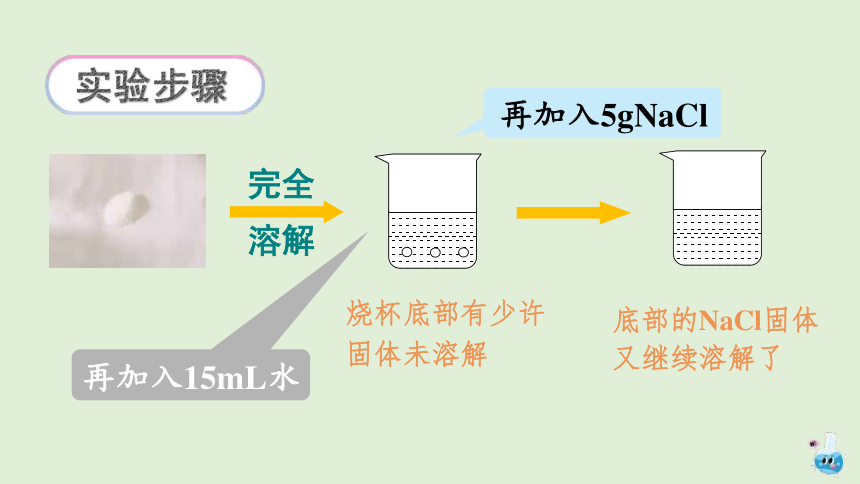
在室温下,向盛有20mL水的烧杯中加入5g氯化钠,搅拌;等溶解后,再加5g氯化钠,搅拌,观察现象。然后加入15mL水,搅拌,观察现象。
烧杯底部有少许固体未溶解
再加入5gNaCl
完全溶解
再加入15mL水
底部的NaCl固体又继续溶解了
实验步骤
物质的溶解是有限度的。增加溶剂的量,可将未溶物质溶解。
固体全部溶解
部分固体不溶解
固体全部溶解
氯化钠在一定量水中不能无限溶解。
氯化钠溶解的质量随着溶剂质量的增大而增大。
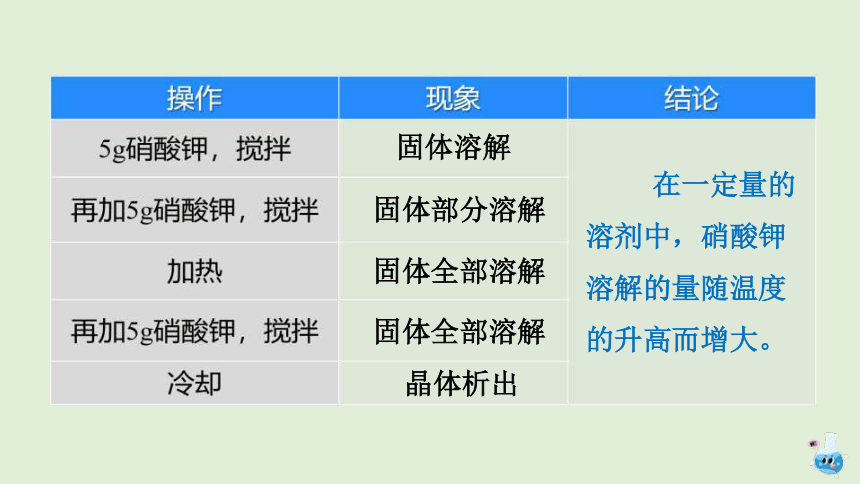
在室温下,向盛有20mL水的烧杯中加入5g硝酸钾,搅拌;等溶解后,再加5g硝酸钾,搅拌,观察现象。当烧杯中硝酸钾固体有剩余而不再继续溶解时,加热烧杯一段时间,观察剩余固体有什么变化。然后再加入5g硝酸钾,搅拌,观察现象。待溶液冷却后,又有什么现象发生?
实验 9 – 6
固体溶解
固体全部溶解
固体全部溶解
晶体析出
在一定量的溶剂中,硝酸钾溶解的量随温度的升高而增大。
固体部分溶解
饱和溶液与不饱和溶液
溶质的溶解是有限度的,溶质的溶解能力与温度有关。
在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
①要明确“一定温度” 和“一定量溶剂”。这样饱
和与不饱和才有意义。
对饱和溶液与不饱和溶液的理解
②要明确“某一溶质”的饱和溶液与不饱和溶液。
例如:在某一定温度下不能再溶解NaCl的饱和溶
液,可能还能溶解KNO3。
结晶
知识点 2
硝酸钾晶体
雪花晶体
冷却热饱和溶液
结晶后所得到的溶液是饱和溶液。
结晶
已溶解的溶质以晶体的形式从溶液中析出的过程叫结晶。
美丽的晶体
结晶的方法:
降温结晶法和蒸发结晶法。
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
从海水中提取食盐
蒸发溶剂结晶—海水晒盐
饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。相同溶质、相同温度:饱和溶液一定比不饱和溶液浓。
1. 使接近饱和的硝酸钾溶液变为饱和溶液的三种方
法分别是 、 、
。
添加硝酸钾固体
降低温度
蒸发溶剂
2. 下列关于饱和溶液的说法正确的是( )
A.相同温度下,饱和溶液一定比不饱和溶液浓
B.很浓的溶液一定是饱和溶液
C.不饱和溶液降温一定会变成饱和溶液
D.对于同一溶质的溶液,在同一温度时,饱和溶
液一定比不饱和溶液浓
D
3. 在一定温度下,有一杯完全溶解的、饱和的氯化铵
溶液,如果想把它变为不饱和溶液,下列可采取的
指施有(已知氯化铵固体的溶解能力随温度的升高
而增大)( )
①降低温度;②升高温度;③加氯化铵固体;④加
溶剂;⑤恒温蒸发溶剂。
A.①③④ B.①③⑤ C.②④ D.②⑤
C
4. 30℃时,往100g硝酸钾溶液中加入10g硝酸钾晶体,
充分搅拌后,尚有部分晶体未溶,稍加热后,晶体
全部溶解,试判断下列说法中正确的是( )
A. 搅拌后及加热前一定是饱和溶液
B. 搅拌后及加热前一定是不饱和溶液
C. 加热后一定是饱和溶液
D. 加热后一定不是饱和溶液
A
5. 为什么汗水带有咸味?被汗水浸湿的衣服晾干后,
常出现白色的斑迹。这是为什么?
汗水中含有一些盐分,因此有咸味。被汗水浸湿的衣服晾干后,水分蒸发了,但盐分仍留在衣服上,就形成白色斑迹。
6. 现有一瓶蒸馏水和一瓶氯化钾溶液,可用什么简单
的办法把它们鉴别开?(注意:在实验室里,任何
时候都不能尝溶液的味道。)
此题属于开放式的习题,办法有多种。最简单的办法是把一滴溶液滴在玻璃片上,晾干或烘干。有白色痕迹出现的原溶液是氯化钾溶液,没有痕迹的是蒸馏水。
加溶剂、升高温度
加入溶质、蒸发溶剂、
降低温度
饱和溶液和不饱和溶液之间的转化(一般情况)
饱和
溶液
不饱和
溶液
结晶的方法
蒸发溶剂:适用于固体溶解度随温度变化影响不大的物质。如氯化钠。
冷却热饱和溶液:适用于固体溶解度随温度的降低而减小且溶解度受温度影响变化较大的固体物质。如硝酸钾。
课后作业
1.从课后习题中选取;
2.完成练习册本课时的习题。
第1课时 饱和溶液与不饱和溶液
第九单元 溶液
课题2 溶解度
人教版化学九年级下册
我们已经知道,蔗糖或食盐很容易地溶解在水里形成溶液。
若一种物质能溶于水,那么它能在定量的水中无限制地溶解下去吗?
饱和溶液与不饱和溶液
知识点 1
实验 9 – 5
在室温下,向盛有20mL水的烧杯中加入5g氯化钠,搅拌;等溶解后,再加5g氯化钠,搅拌,观察现象。然后加入15mL水,搅拌,观察现象。
烧杯底部有少许固体未溶解
再加入5gNaCl
完全溶解
再加入15mL水
底部的NaCl固体又继续溶解了
实验步骤
物质的溶解是有限度的。增加溶剂的量,可将未溶物质溶解。
固体全部溶解
部分固体不溶解
固体全部溶解
氯化钠在一定量水中不能无限溶解。
氯化钠溶解的质量随着溶剂质量的增大而增大。
在室温下,向盛有20mL水的烧杯中加入5g硝酸钾,搅拌;等溶解后,再加5g硝酸钾,搅拌,观察现象。当烧杯中硝酸钾固体有剩余而不再继续溶解时,加热烧杯一段时间,观察剩余固体有什么变化。然后再加入5g硝酸钾,搅拌,观察现象。待溶液冷却后,又有什么现象发生?
实验 9 – 6
固体溶解
固体全部溶解
固体全部溶解
晶体析出
在一定量的溶剂中,硝酸钾溶解的量随温度的升高而增大。
固体部分溶解
饱和溶液与不饱和溶液
溶质的溶解是有限度的,溶质的溶解能力与温度有关。
在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
①要明确“一定温度” 和“一定量溶剂”。这样饱
和与不饱和才有意义。
对饱和溶液与不饱和溶液的理解
②要明确“某一溶质”的饱和溶液与不饱和溶液。
例如:在某一定温度下不能再溶解NaCl的饱和溶
液,可能还能溶解KNO3。
结晶
知识点 2
硝酸钾晶体
雪花晶体
冷却热饱和溶液
结晶后所得到的溶液是饱和溶液。
结晶
已溶解的溶质以晶体的形式从溶液中析出的过程叫结晶。
美丽的晶体
结晶的方法:
降温结晶法和蒸发结晶法。
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
从海水中提取食盐
蒸发溶剂结晶—海水晒盐
饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。相同溶质、相同温度:饱和溶液一定比不饱和溶液浓。
1. 使接近饱和的硝酸钾溶液变为饱和溶液的三种方
法分别是 、 、
。
添加硝酸钾固体
降低温度
蒸发溶剂
2. 下列关于饱和溶液的说法正确的是( )
A.相同温度下,饱和溶液一定比不饱和溶液浓
B.很浓的溶液一定是饱和溶液
C.不饱和溶液降温一定会变成饱和溶液
D.对于同一溶质的溶液,在同一温度时,饱和溶
液一定比不饱和溶液浓
D
3. 在一定温度下,有一杯完全溶解的、饱和的氯化铵
溶液,如果想把它变为不饱和溶液,下列可采取的
指施有(已知氯化铵固体的溶解能力随温度的升高
而增大)( )
①降低温度;②升高温度;③加氯化铵固体;④加
溶剂;⑤恒温蒸发溶剂。
A.①③④ B.①③⑤ C.②④ D.②⑤
C
4. 30℃时,往100g硝酸钾溶液中加入10g硝酸钾晶体,
充分搅拌后,尚有部分晶体未溶,稍加热后,晶体
全部溶解,试判断下列说法中正确的是( )
A. 搅拌后及加热前一定是饱和溶液
B. 搅拌后及加热前一定是不饱和溶液
C. 加热后一定是饱和溶液
D. 加热后一定不是饱和溶液
A
5. 为什么汗水带有咸味?被汗水浸湿的衣服晾干后,
常出现白色的斑迹。这是为什么?
汗水中含有一些盐分,因此有咸味。被汗水浸湿的衣服晾干后,水分蒸发了,但盐分仍留在衣服上,就形成白色斑迹。
6. 现有一瓶蒸馏水和一瓶氯化钾溶液,可用什么简单
的办法把它们鉴别开?(注意:在实验室里,任何
时候都不能尝溶液的味道。)
此题属于开放式的习题,办法有多种。最简单的办法是把一滴溶液滴在玻璃片上,晾干或烘干。有白色痕迹出现的原溶液是氯化钾溶液,没有痕迹的是蒸馏水。
加溶剂、升高温度
加入溶质、蒸发溶剂、
降低温度
饱和溶液和不饱和溶液之间的转化(一般情况)
饱和
溶液
不饱和
溶液
结晶的方法
蒸发溶剂:适用于固体溶解度随温度变化影响不大的物质。如氯化钠。
冷却热饱和溶液:适用于固体溶解度随温度的降低而减小且溶解度受温度影响变化较大的固体物质。如硝酸钾。
课后作业
1.从课后习题中选取;
2.完成练习册本课时的习题。
同课章节目录
