化学人教版九年级下册课件:10.1.2 酸的化学性质(共18张PPT)
文档属性
| 名称 | 化学人教版九年级下册课件:10.1.2 酸的化学性质(共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 38.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-06 11:39:52 | ||
图片预览



文档简介
(共18张PPT)
第2课时 酸的化学性质
第十单元 酸和碱
课题1 常见的酸和碱
人教版化学九年级下册
1. 常用的酸碱指示剂有哪些?是怎么变色的?
紫色的石蕊溶液:遇酸变红,遇碱变蓝;
无色酚酞溶液:遇酸不变色,遇碱变红。
2. 常见的酸有哪些?
常见的酸有:盐酸、硫酸、硝酸、醋酸、碳酸、磷酸等。
酸的化学性质
知识点 1
酸为什么能使酸碱指示剂变色呢?
酸还有哪些化学性质呢?
酸的化学性质
探究
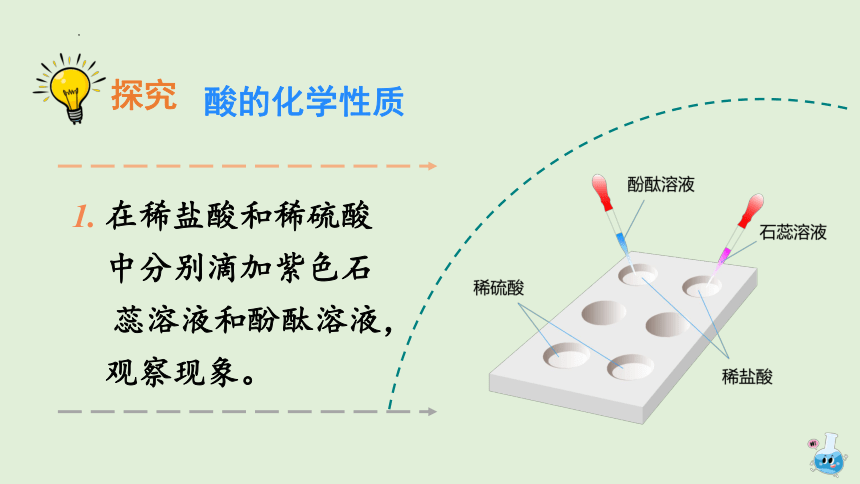
1. 在稀盐酸和稀硫酸
中分别滴加紫色石
蕊溶液和酚酞溶液,
观察现象。
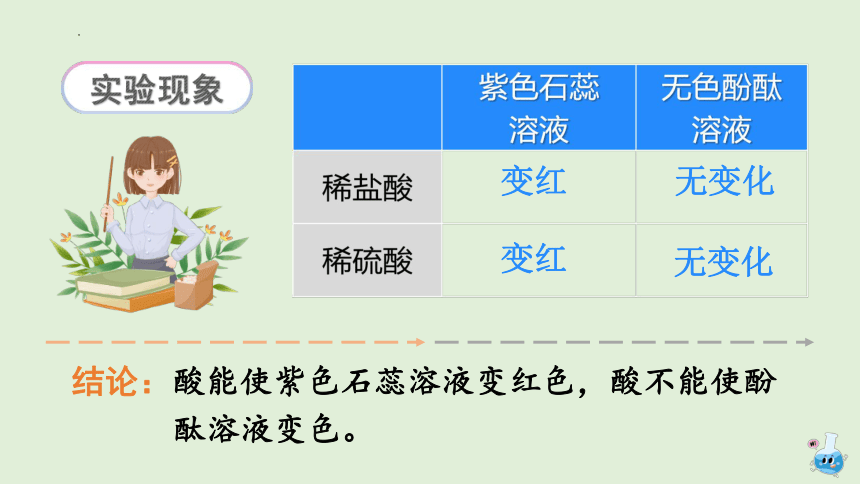
变红
变红
无变化
无变化
实验现象
结论:酸能使紫色石蕊溶液变红色,酸不能使酚
酞溶液变色。
适中
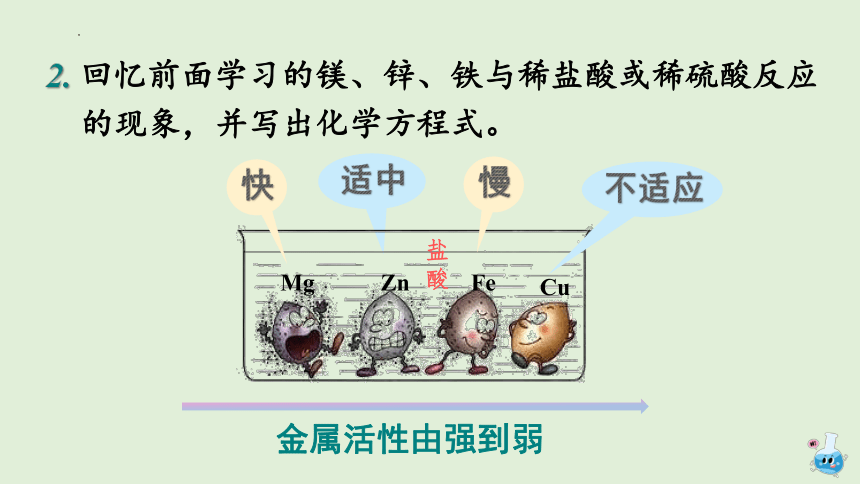
2. 回忆前面学习的镁、锌、铁与稀盐酸或稀硫酸反应
的现象,并写出化学方程式。
Mg
Zn
Fe
Cu
盐酸
快
慢
不适应
金属活性由强到弱
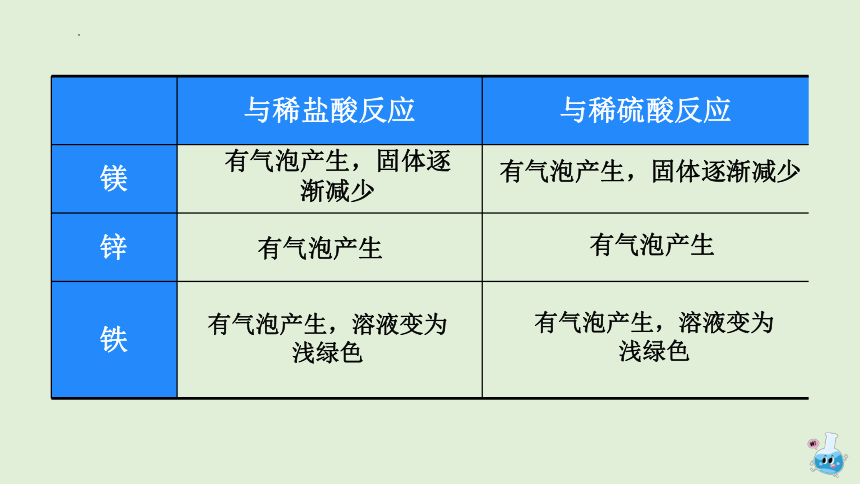
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
有气泡产生,固体逐渐减少
有气泡产生,固体逐渐减少
有气泡产生
有气泡产生
有气泡产生,溶液变为浅绿色
有气泡产生,溶液变为浅绿色
3. 在盛有稀盐酸和稀硫酸的试
管里分别放入一根生锈(铁
锈的主要成分是Fe2O3)的
铁钉,过一会儿取出,用水
洗净,铁钉表面和溶液颜色
有什么变化?
现象 化学方程式
铁锈+ 稀盐酸 Fe2O3+6HCl=2FeCl3+3H2O
铁锈+ 稀硫酸 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁钉表面的铁锈被除去,溶液变为黄色
铁钉表面的铁锈被除去,溶液变为黄色
结论: 酸能与金属氧化物反应
不能。
当铁钉表面的铁锈被清除完,酸将与铁发生反应。
如盐酸:Fe+2HCl=FeCl2+H2↑
都生成+3价的铁盐和水。
注:含有Fe3+的溶液显黄色。
①上面反应的生成物有什么共同之处?
②上述反应,除锈时能否将铁制品长期浸在酸中?为什么?
讨论
4. 根据上述实验和讨论,归纳出盐酸、硫酸等酸具有
哪些相似的化学性质。
酸能使酸碱指示剂显示不同的颜色,如酸溶液使紫色的石蕊溶液变红,使无色酚酞溶液不变色。
酸能与活泼金属反应,产生氢气。利用此性质在实验室可用酸来制备氢气。
酸能与某些金属氧化物反应,生成水。利用此性质可用稀盐酸或稀硫酸来除锈。
用 途
盐 酸 HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸 H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。(不能干燥氨气)
盐酸、硫酸的用途
1. 泉州是白蚂蚁的高发地区,白蚂蚁会蛀蚀木头,它
分泌的蚁酸是一种酸,还能腐蚀很多建筑材料。下
列建筑材料最不容易被白蚂蚁腐蚀的是( )
A.钢筋 B.铜制品
C.大理石 D.铝合金
B
2. 化学变化多姿多彩,美丽如花。图中甲、乙、丙、
X分别是我们已经学过的一种物质,甲、乙、丙均
能与X发生反应,若X是稀盐酸,则甲、乙、丙不
可能是下列物质中的( )
A.Cu B.Fe2O3
C.Fe D.CaCO3
A
3. 如下图所示,在白色点滴板1~6的孔穴中,分别滴加2滴
紫色石蕊溶液。
(1)孔穴4中溶液变为蓝色,说明
碳酸钾溶液显 (填“酸
性”或“碱性”)。
(2)溶液变为红色的孔穴有 (填孔穴序号,下同)。
(3) 作为空白对照实验的孔穴是 。
碱性
2 5
3
4. 某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现
有废硫酸9.8 t(H2SO4的质量分数为20%),与足量的
废铁屑反应,可生产FeSO4的质量是多少?
解:设可生产FeSO4的质量为x。
Fe + H2SO4 = FeSO4 + H2↑
98 152
9.8t×20%
解得x=3.04t
x
98
9.8t×20%
152
x
=
答:可生产FeSO4的质量是3.04t。
课后作业
1.从课后习题中选取;
2.完成练习册本课时的习题。
第2课时 酸的化学性质
第十单元 酸和碱
课题1 常见的酸和碱
人教版化学九年级下册
1. 常用的酸碱指示剂有哪些?是怎么变色的?
紫色的石蕊溶液:遇酸变红,遇碱变蓝;
无色酚酞溶液:遇酸不变色,遇碱变红。
2. 常见的酸有哪些?
常见的酸有:盐酸、硫酸、硝酸、醋酸、碳酸、磷酸等。
酸的化学性质
知识点 1
酸为什么能使酸碱指示剂变色呢?
酸还有哪些化学性质呢?
酸的化学性质
探究
1. 在稀盐酸和稀硫酸
中分别滴加紫色石
蕊溶液和酚酞溶液,
观察现象。
变红
变红
无变化
无变化
实验现象
结论:酸能使紫色石蕊溶液变红色,酸不能使酚
酞溶液变色。
适中
2. 回忆前面学习的镁、锌、铁与稀盐酸或稀硫酸反应
的现象,并写出化学方程式。
Mg
Zn
Fe
Cu
盐酸
快
慢
不适应
金属活性由强到弱
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
有气泡产生,固体逐渐减少
有气泡产生,固体逐渐减少
有气泡产生
有气泡产生
有气泡产生,溶液变为浅绿色
有气泡产生,溶液变为浅绿色
3. 在盛有稀盐酸和稀硫酸的试
管里分别放入一根生锈(铁
锈的主要成分是Fe2O3)的
铁钉,过一会儿取出,用水
洗净,铁钉表面和溶液颜色
有什么变化?
现象 化学方程式
铁锈+ 稀盐酸 Fe2O3+6HCl=2FeCl3+3H2O
铁锈+ 稀硫酸 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁钉表面的铁锈被除去,溶液变为黄色
铁钉表面的铁锈被除去,溶液变为黄色
结论: 酸能与金属氧化物反应
不能。
当铁钉表面的铁锈被清除完,酸将与铁发生反应。
如盐酸:Fe+2HCl=FeCl2+H2↑
都生成+3价的铁盐和水。
注:含有Fe3+的溶液显黄色。
①上面反应的生成物有什么共同之处?
②上述反应,除锈时能否将铁制品长期浸在酸中?为什么?
讨论
4. 根据上述实验和讨论,归纳出盐酸、硫酸等酸具有
哪些相似的化学性质。
酸能使酸碱指示剂显示不同的颜色,如酸溶液使紫色的石蕊溶液变红,使无色酚酞溶液不变色。
酸能与活泼金属反应,产生氢气。利用此性质在实验室可用酸来制备氢气。
酸能与某些金属氧化物反应,生成水。利用此性质可用稀盐酸或稀硫酸来除锈。
用 途
盐 酸 HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸 H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。(不能干燥氨气)
盐酸、硫酸的用途
1. 泉州是白蚂蚁的高发地区,白蚂蚁会蛀蚀木头,它
分泌的蚁酸是一种酸,还能腐蚀很多建筑材料。下
列建筑材料最不容易被白蚂蚁腐蚀的是( )
A.钢筋 B.铜制品
C.大理石 D.铝合金
B
2. 化学变化多姿多彩,美丽如花。图中甲、乙、丙、
X分别是我们已经学过的一种物质,甲、乙、丙均
能与X发生反应,若X是稀盐酸,则甲、乙、丙不
可能是下列物质中的( )
A.Cu B.Fe2O3
C.Fe D.CaCO3
A
3. 如下图所示,在白色点滴板1~6的孔穴中,分别滴加2滴
紫色石蕊溶液。
(1)孔穴4中溶液变为蓝色,说明
碳酸钾溶液显 (填“酸
性”或“碱性”)。
(2)溶液变为红色的孔穴有 (填孔穴序号,下同)。
(3) 作为空白对照实验的孔穴是 。
碱性
2 5
3
4. 某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现
有废硫酸9.8 t(H2SO4的质量分数为20%),与足量的
废铁屑反应,可生产FeSO4的质量是多少?
解:设可生产FeSO4的质量为x。
Fe + H2SO4 = FeSO4 + H2↑
98 152
9.8t×20%
解得x=3.04t
x
98
9.8t×20%
152
x
=
答:可生产FeSO4的质量是3.04t。
课后作业
1.从课后习题中选取;
2.完成练习册本课时的习题。
同课章节目录
