2015年广东省高考化学试卷(解析版 )
文档属性
| 名称 | 2015年广东省高考化学试卷(解析版 ) |  | |
| 格式 | zip | ||
| 文件大小 | 359.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-07-28 08:40:17 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
2015年广东省高考化学试卷
一、选择题(共6小题,每小题4分,满分24分)
7.(4分)(2015 广东)化学是你,化学是我,化学深入我们生活.下列说法正确的是( )
A. 木材纤维和土豆淀粉遇碘水均显蓝色
B. 食用花生油和鸡蛋清都能发生水解反应
C. 包装用材料聚乙烯和聚氯乙烯都属于烃
D. PX项目的主要产品对二甲苯属于饱和烃
8.(4分)(2015 广东)水溶液中能大量共存的一组离子是( )
A. NH4+、Ba2+、Br﹣、CO32﹣ B. Cl﹣、SO32﹣、Fe2+、H+
C. K+、Na+、SO42﹣、MnO4﹣ D. Na+、H+、NO3﹣、HCO3﹣
9.(4分)(2015 广东)下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A 1﹣己醇的沸点比己烷的沸点高 1﹣己醇和己烷可通过蒸馏初步分离
B 原电池可将化学能转化为电能 原电池需外接电源才能工作
C 乙二酸可与KMnO4溶液发生反应 乙二酸具有酸性
D Na在Cl2中燃烧的生成物含离子键 NaCl固体可导电
A. A B. B C. C D. D
10.(4分)(2015 广东)设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 23gNa与足量H2O反应完全后可生成NA个H2分子
B. 1molCu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4LN2和H2混合气中含NA个原子
D. 3mol单质Fe完全转化为Fe3O4,失去8NA个电子
11.(4分)(2015 广东)一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )21·世纪*教育网
( http: / / www.21cnjy.com )
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10﹣13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
12.(4分)(2015 广东)准确取2 ( http: / / www.21cnjy.com )0.00mL某待测HCl溶液于锥形瓶中,用0.1000mol L﹣1NaOH溶液滴定,下列说法正确的是( ) 21*cnjy*com
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
二、双项选择题(共2小题,每小题6分,满分 ( http: / / www.21cnjy.com )12分。在每小题给出的四个选项中,有两个选项符合题目要求,全部选对的得6分,只有1个且正确的得3分,有选错或不答的得0分。)【来源:21cnj*y.co*m】
22.(6分)(2015 广东)下列实验操作、现象和结论均正确的是( )
选项 实验操作 现象 结论
A 分别加热Na2CO3和NaHCO3固体 试管内壁均有水珠 两种物质均受热分解
B 向稀的苯酚水溶液滴加饱和溴水 生成白色沉淀 产物三溴苯酚不溶于水
C 向含I﹣的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 加入淀粉后溶液变成蓝色 氧化性:Cl2>I2
D 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 加入H2O2后溶液变成血红色 Fe2+既有氧化性又有还原性
A. A B. B C. C D. D
23.(6分)(2015 广东)甲~庚等元 ( http: / / www.21cnjy.com )素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )21教育名师原创作品
( http: / / www.21cnjy.com )
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
三、非选择题(共大题共4小 ( http: / / www.21cnjy.com )题,满分64分.按题目要求作答。解答题应写出必要的文字说明、方程式和重要演算步骤,只写出最后答案的不能得分。有数值计算的题,答案中必须明确写出数值和单位。)2·1·c·n·j·y
30.(15分)(2015 广东)有机锌试剂(R﹣ZnBr)与酰氯()偶联可用于制备药物Ⅱ:
( http: / / www.21cnjy.com )
(1)化合物Ⅰ的分子式为 .
(2)关于化合物Ⅱ,下列说法正确的有 (双选).
A.可以发生水解反应 B.可与新制Cu(OH)2共热生成红色沉淀
C.可与FeCl3溶液反应显紫色 D.可与热的浓硝酸和浓硫酸混合液反应
(3)化合物Ⅲ含有3个碳原子,且可发生 ( http: / / www.21cnjy.com )加聚反应,按照途径Ⅰ合成路线的表示方式.完成途径2中由Ⅲ到Ⅴ的合成路线: .(标明反应试剂,忽略反应条件).
(4)化合物V的核磁共振氢谱中峰的 ( http: / / www.21cnjy.com )组数为 .以H替代化合物Ⅵ中的ZnBr,所得化合物的羧酸类同分异构体共有 种(不考虑手性异构).
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为 .
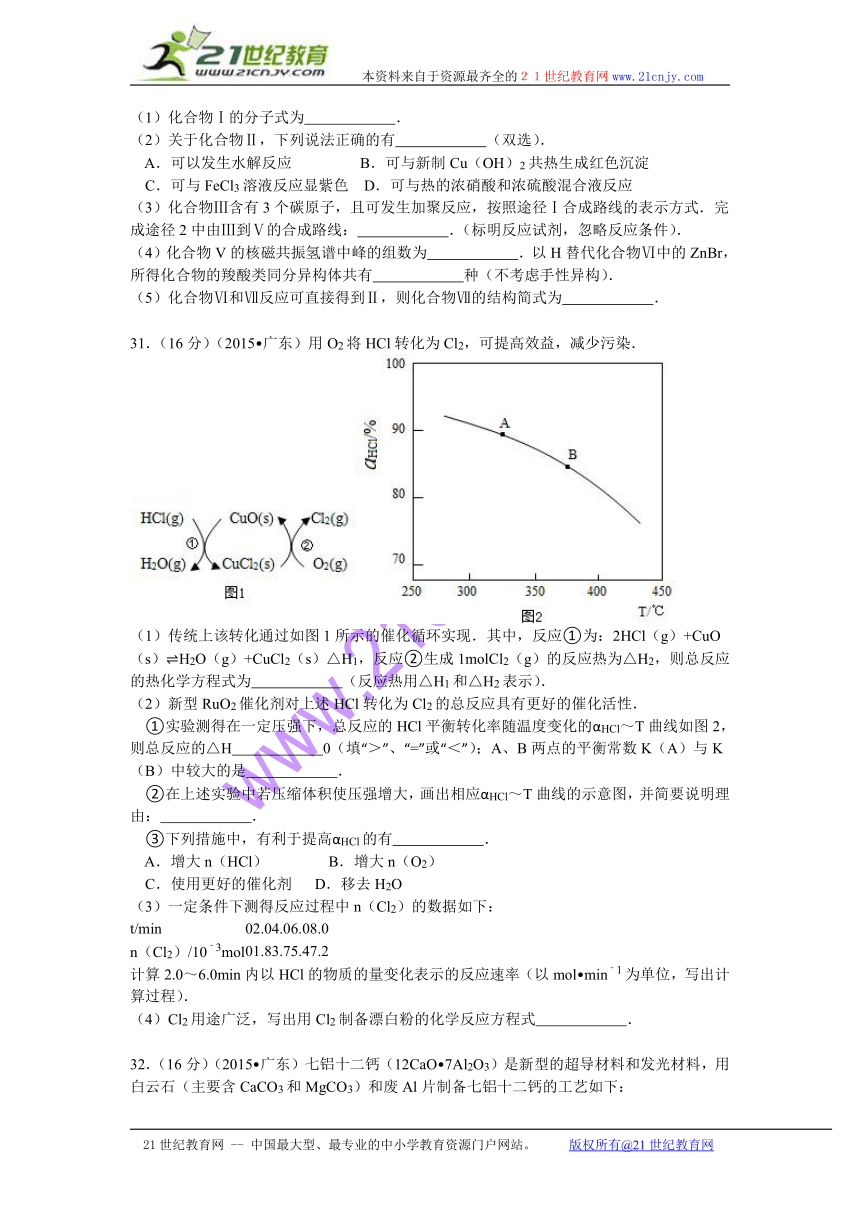
31.(16分)(2015 广东)用O2将HCl转化为Cl2,可提高效益,减少污染.
( http: / / www.21cnjy.com )
(1)传统上该转化通过如图1所示的 ( http: / / www.21cnjy.com )催化循环实现.其中,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 (反应热用△H1和△H2表示).21*cnjy*com
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平 ( http: / / www.21cnjy.com )衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H 0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 .
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由: .
③下列措施中,有利于提高αHCl的有 .
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t/min 0 2.0 4.0 6.0 8.0
n(Cl2)/10﹣3mol 0 1.8 3.7 5.4 7.2
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol min﹣1为单位,写出计算过程).
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式 .
32.(16分)(2015 ( http: / / www.21cnjy.com ) 广东)七铝十二钙(12CaO 7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
( http: / / www.21cnjy.com )
(1)锻粉主要含MgO和 ( http: / / www.21cnjy.com ) ,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,或滤液Ⅰ中c(Mg2+)小于5×10﹣6mol L﹣1,则溶液pH大于 (Mg(OH)2的Ksp=5×10﹣12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 .
(2)滤液Ⅰ中阴离子有 (忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成 ,从而导致CaCO3产率降低.
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 .
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 .
(5)一种可超快充电的新型铝电池,充放 ( http: / / www.21cnjy.com )电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 .
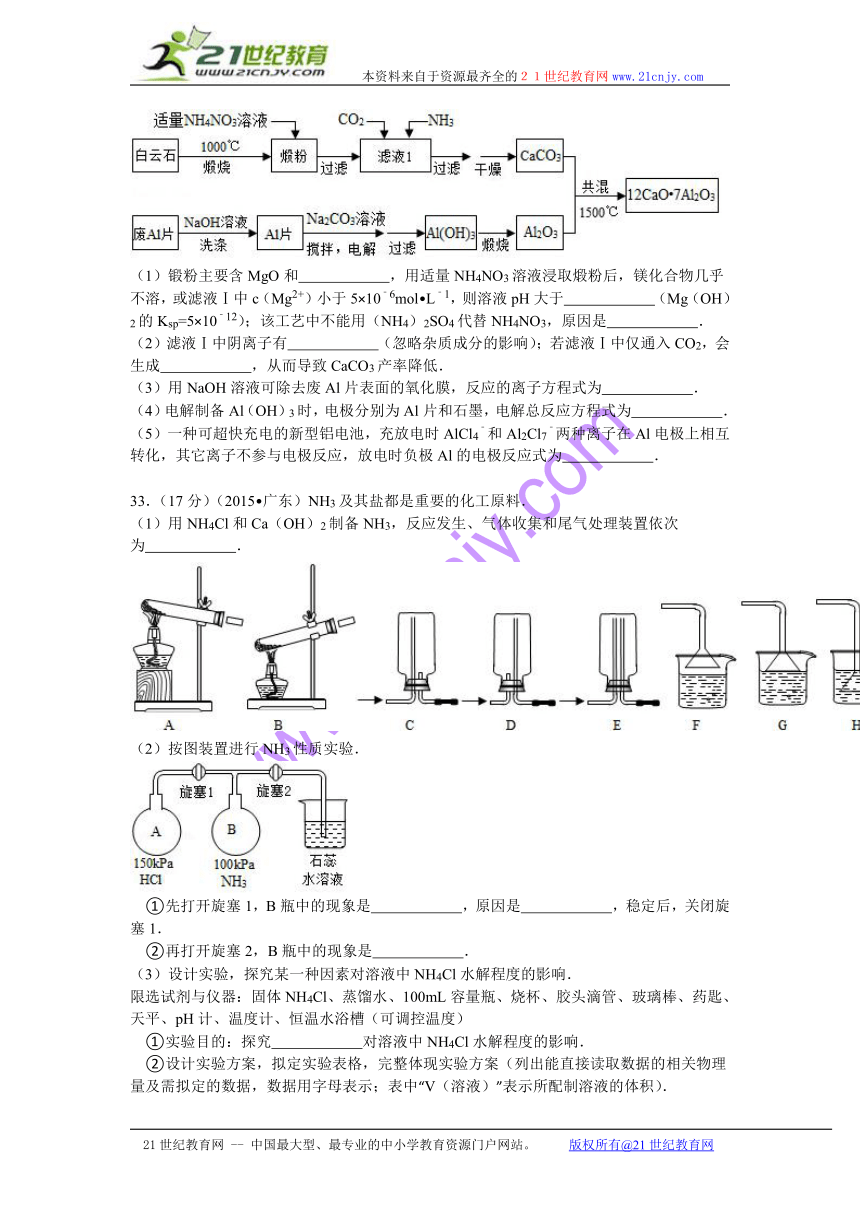
33.(17分)(2015 广东)NH3及其盐都是重要的化工原料.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 .
( http: / / www.21cnjy.com )
(2)按图装置进行NH3性质实验.
( http: / / www.21cnjy.com )
①先打开旋塞1,B瓶中的现象是 ,原因是 ,稳定后,关闭旋塞1.
②再打开旋塞2,B瓶中的现象是 .
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究 对溶液中NH4Cl水解程度的影响.
②设计实验方案,拟定实验表格,完整 ( http: / / www.21cnjy.com )体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量实验序号 V(溶液)/ml …
1 100 …
2 100 …
③按实验序号1所拟数据进行实验,若 ( http: / / www.21cnjy.com )读取的待测物理量的数值为Y,则NH4Cl水解反应的平衡转化率为 (只列出算式,忽略水自身电离的影响).
2015年广东省高考化学试卷
参考答案与试题解析
一、选择题(共6小题,每小题4分,满分24分)
7.(4分)(2015 广东)化学是你,化学是我,化学深入我们生活.下列说法正确的是( )
A. 木材纤维和土豆淀粉遇碘水均显蓝色
B. 食用花生油和鸡蛋清都能发生水解反应
C. 包装用材料聚乙烯和聚氯乙烯都属于烃
D. PX项目的主要产品对二甲苯属于饱和烃
考点: 生活中的有机化合物.
分析: A.淀粉遇碘水显蓝色;B.食用花生油成分是油脂,鸡蛋清成分是蛋白质;C.烃是指仅含碳氢两种元素的化合物;D.不饱和烃,是含有双键或三键或苯环的烃.
解答: 解:A.淀粉遇碘水显蓝色,纤维素遇碘水不显蓝色,木材纤维的主要成分是纤维素,故A错误; B.食用花生油成分是油脂,鸡蛋清成分是蛋白质,油脂水解生成高级脂肪酸和甘油,蛋白质水解生成氨基酸,故B正确;C.聚氯乙烯还含有氯元素,故C错误;D.对二甲苯含有苯环,属于不饱和烃,故D错误.故选B.
点评: 本题考查有机物的性质与简单分类,比较基础,明确不饱和烃,是含有双键或三键或苯环的烃是解题的关键.
8.(4分)(2015 广东)水溶液中能大量共存的一组离子是( )
A. NH4+、Ba2+、Br﹣、CO32﹣ B. Cl﹣、SO32﹣、Fe2+、H+
C. K+、Na+、SO42﹣、MnO4﹣ D. Na+、H+、NO3﹣、HCO3﹣
考点: 离子共存问题.
专题: 离子反应专题.
分析: 根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解等,则离子大量共存,以此来解答.
解答: 解:A.Ba2+、CO32﹣结合生成沉淀,不能大量共存,故A错误;B.SO32﹣、H+结合生成水和气体,不能大量共存,故B错误;C.该组离子之间不反应,可大量共存,故C正确;D.H+、HCO3﹣结合生成水和气体,不能大量共存,故D错误;故选C.
点评: 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、水解反应的离子共存考查,题目难度不大.
9.(4分)(2015 广东)下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A 1﹣己醇的沸点比己烷的沸点高 1﹣己醇和己烷可通过蒸馏初步分离
B 原电池可将化学能转化为电能 原电池需外接电源才能工作
C 乙二酸可与KMnO4溶液发生反应 乙二酸具有酸性
D Na在Cl2中燃烧的生成物含离子键 NaCl固体可导电
A. A B. B C. C D. D
考点: 真题集萃;离子化合物的结构特征与性质;原电池和电解池的工作原理;有机化学反应的综合应用;物质的分离、提纯和除杂.
分析: A.沸点相差较大的混合物可用蒸馏的方法分离;B.原电池提供电能,无需外接电源;C.乙二酸具有还原性,可与酸性高锰酸钾发生氧化还原反应;D.NaCl固体不导电,导电必须有自由移动的离子或电子.
解答: 解:A.1﹣己醇分子间可形成氢键,沸点较大,可用蒸馏的方法分离醇和己烷,故A正确;B.原电池提供电能,无需外接电源,外接电源时为电解池,电能转化为化学能,故B错误;C.乙二酸具有还原性,可与酸性高锰酸钾发生氧化还原反应,与酸性无关,故C错误;D.NaCl固体没有自由移动的离子,不能导电,熔融的NaCl可导电,故D错误.故选A.
点评: 本题为2015年考题,综合考查物质的分离 ( http: / / www.21cnjy.com )、原电池、氧化还原反应以及离子化合物等知识,为常见题型,有利于培养学生良好的科学素养,题目难度适中,贴近教材.
10.(4分)(2015 广东)设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 23gNa与足量H2O反应完全后可生成NA个H2分子
B. 1molCu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4LN2和H2混合气中含NA个原子
D. 3mol单质Fe完全转化为Fe3O4,失去8NA个电子
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A、求出钠的物质的量,然后根据反应后1mol钠反应生成0.5mol氢气来分析;B、铜和浓硫酸反应时,浓硫酸被还原为SO2;C、N2和H2均为双原子分子;D、根据Fe3O4中铁为+价来分析.
解答: 解:A、23g钠的物质的量为1mol,而钠与水反应时1mol钠生成0.5mol氢气,即生成0.5NA个分子,故A错误;,B、铜和浓硫酸反应时,浓硫酸被还原为SO2,不是三氧化硫,故B错误;C、标准状况下,22.4LN2和H2 ( http: / / www.21cnjy.com )混合气的物质的量为1mol,而N2和H2均为双原子分子,故1mol混合气体中无论两者的比例如何,均含2mol原子,即2NA个,故C错误;D、Fe3O4中铁为+价,故1mol铁反应失去mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,故D正确.故选D.
点评: 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.
11.(4分)(2015 广东)一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )www.21-cn-jy.com
( http: / / www.21cnjy.com )
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10﹣13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
考点: 水的电离;弱电解质在水溶液中的电离平衡.
分析: A、由图可知abc为等温线;B、由b点计算此温度下水的离子积常数为1.0×10﹣14;C、b点到a点,氢离子浓度变大,氢氧根离子浓度减小,据此解答即可;D、稀释不会引起水的离子积的改变,据此解答即可.
解答: 解:A、由图可知abc三点对应的平衡常数不变,故abc为等温线,故升高温度,不能由c到b,故A错误;B、b点c(H+)=c(OH﹣)=1.0×10﹣7,故KW=1.0×10﹣7×1.0×10﹣7=1.0×10﹣14,故B错误;C、加入FeCl3,氯化铁为强酸弱碱盐 ( http: / / www.21cnjy.com ),铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;D、由c点到d点,水的离子积常数减小,温度不变,K不变,故不能利用稀释使其形成此变化,故D错误,故选C.
点评: 本题主要考查的是水的离子积常数以及水电离的影响因素,掌握水的离子积为温度的函数是解决本题的关键,难度不大.
12.(4分)(2015 广东 ( http: / / www.21cnjy.com ))准确取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol L﹣1NaOH溶液滴定,下列说法正确的是( )【来源:21·世纪·教育·网】
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
考点: 真题集萃;中和滴定.
分析: A.滴定管使用必须用NaOH标准液润洗;B.碱滴定酸,氢离子浓度逐渐减小;C.用酚酞作指示剂,滴定前锥形瓶中为无色溶液;D.滴定终点时,发现滴定管尖嘴部分有悬滴,则消耗的标准液偏大.
解答: 解:A.滴定管使用必须用NaOH标准液润洗,否则消耗的标准液偏大,测定酸的浓度偏大,故A错误;B.碱滴定酸,氢离子浓度逐渐减小,则随着NaOH溶液滴入,锥形瓶中溶液pH由小变大,故B正确;C.用酚酞作指示剂,滴定前锥形瓶中为无色溶液,则当锥形瓶中溶液由无色变红色时停止滴定,故C错误;D.滴定终点时,发现滴定管尖嘴部分有悬滴,则消耗的标准液偏大,则测定酸的浓度偏大,故D错误;故选B.
点评: 本题为2015年广东高考题,侧重中和滴 ( http: / / www.21cnjy.com )定实验的考查,把握中和滴定原理、仪器的使用、误差分析为解答的关键,注重分析与实验能力的结合,题目难度不大.
二、双项选择题(共2小题,每小题6分,满分 ( http: / / www.21cnjy.com )12分。在每小题给出的四个选项中,有两个选项符合题目要求,全部选对的得6分,只有1个且正确的得3分,有选错或不答的得0分。)【版权所有:21教育】
22.(6分)(2015 广东)下列实验操作、现象和结论均正确的是( )
选项 实验操作 现象 结论
A 分别加热Na2CO3和NaHCO3固体 试管内壁均有水珠 两种物质均受热分解
B 向稀的苯酚水溶液滴加饱和溴水 生成白色沉淀 产物三溴苯酚不溶于水
C 向含I﹣的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 加入淀粉后溶液变成蓝色 氧化性:Cl2>I2
D 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 加入H2O2后溶液变成血红色 Fe2+既有氧化性又有还原性
A. A B. B C. C D. D
考点: 真题集萃;化学实验方案的评价.
专题: 实验评价题.
分析: A.根据元素守恒知,即使碳酸钠分解也不能生成水;B.苯酚和浓溴水反应生成三溴苯酚沉淀;C.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;D.亚铁离子具有还原性,能被双氧水氧化生成铁离子,铁离子和KSCN溶液混合生成络合物而导致溶液呈血红色.
解答: 解:A.根据元素守恒知,即使碳酸钠分解也不能生成水,可能是碳酸钠不干燥导致的,故A错误;B.苯酚和浓溴水反应生成三溴苯酚白色沉淀,向稀的苯酚水溶液滴加饱和溴水生成白色沉淀,说明产物三溴苯酚不溶于水,故B正确;C.同一氧化还原反应中,氧化 ( http: / / www.21cnjy.com )剂的氧化性大于氧化产物的氧化性,向含I﹣的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,氯气具有强氧化性,能将碘离子氧化生成碘,碘遇淀粉试液变蓝色,加入淀粉后溶液变蓝色,说明碘离子被氧化生成碘单质,氧化剂是氯气、氧化产物是碘,所以氧化性氧化性:Cl2>I2,故C正确;D.双氧水具有氧化性,亚铁离子具有还原 ( http: / / www.21cnjy.com )性,亚铁离子和双氧水反应生成铁离子,铁离子和KSCN溶液混合生成络合物而导致溶液呈血红色,加入双氧水后溶液变成血红色说明亚铁离子被氧化,则亚铁离子有还原性,不能说明具有氧化性,故D错误;故选BC.
点评: 本题考查化学实验方案评价,为2015年 ( http: / / www.21cnjy.com )广东省高考化学试题,涉及氧化还原反应、氧化性强弱比较、离子检验、物质性质等知识点,侧重考查学生分析判断能力,明确物质性质及基本原理是解本题关键,易错选项是D.
23.(6分)(2015 广东)甲~庚等 ( http: / / www.21cnjy.com )元素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )21·cn·jy·com
( http: / / www.21cnjy.com )
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
考点: 位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用.
分析: 己的最高价氧化物对应水化物有强脱水性,则为浓 ( http: / / www.21cnjy.com )硫酸,可知己为S元素,结合位置关系可知丁为Si,丙为B,庚为F,戊为As;甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,则甲为Mg,甲、乙同主族且相邻,可知乙为Ca元素,然后结合元素周期律及元素化合物知识来解答.
解答: 解:己的最高价氧化物对应水化物有强脱 ( http: / / www.21cnjy.com )水性,则为浓硫酸,可知己为S元素,结合位置关系可知丁为Si,丙为B,庚为F,戊为As;甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,则甲为Mg,可知乙为Ca元素,A.丙与戊的原子序数相差为33﹣5=28,故A正确;B.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:庚>己>戊,故B错误;C.金属性Ca>Mg,常温下,乙的单质能与水剧烈反应,而甲不能,故C错误;D.丁的最高价氧化物为SiO2,可用于制造光导纤维,故D正确;故选AD.
点评: 本题考查位置、结构、性质的关系及应用,为高频考点,把握信息及元素的位置推断元素为解答的关键,侧重分析、推断能力的考查,题目难度不大.
三、非选择题(共大题共4小题,满分64 ( http: / / www.21cnjy.com )分.按题目要求作答。解答题应写出必要的文字说明、方程式和重要演算步骤,只写出最后答案的不能得分。有数值计算的题,答案中必须明确写出数值和单位。)21cnjy.com
30.(15分)(2015 广东)有机锌试剂(R﹣ZnBr)与酰氯()偶联可用于制备药物Ⅱ:
( http: / / www.21cnjy.com )
(1)化合物Ⅰ的分子式为 C12H9Br .
(2)关于化合物Ⅱ,下列说法正确的有 AD (双选).
A.可以发生水解反应 B.可与新制Cu(OH)2共热生成红色沉淀
C.可与FeCl3溶液反应显紫色 D.可与热的浓硝酸和浓硫酸混合液反应
(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,按照途径Ⅰ合成路线的表示方式.完成途径2中由Ⅲ到Ⅴ的合成路线: .(标明反应试剂,忽略反应条件).2-1-c-n-j-y
(4)化合物V的核磁共振氢谱中峰的组数为 4 .以H替代化合物Ⅵ中的ZnBr,所得化合物的羧酸类同分异构体共有 4 种(不考虑手性异构).
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为 .
考点: 真题集萃;有机物的合成.
分析: (1)根据有机物I的结构确定其分子式;(2)有机物Ⅱ含有苯环,具有苯的性质,含 ( http: / / www.21cnjy.com )有酯基,具有酯基的性质,没有醛基、酚羟基,不能与新制Cu(OH)2共热生成红色沉淀,不能与FeCl3溶液反应显紫色;(3)化合物Ⅲ含有3个碳原子,且可 ( http: / / www.21cnjy.com )发生加聚反应,结合Ⅵ的结构及途径I中的转化可知,Ⅲ为CH2=CHCOOH,与HBr发生加成反应生成Ⅳ为BrCH2CH2COOH,再与乙醇发生酯化反应生成V为BrCH2CH2COOCH2CH3;(4)V为BrCH2CH2COOCH ( http: / / www.21cnjy.com )2CH3,分子中含有4种化学环境不同的H原子;以H替代化合物Ⅵ中的ZnBr得到CH3CH2COOCH2CH3,其同分异构体属于羧酸,可以看作﹣COOH取代丁烷形成的羧酸,结合丁烷同分异构体及等效氢判断;(5)对比Ⅵ、Ⅱ的结构,结合途径1中生成Ⅱ的反应为取代反应,可以判断化合物Ⅶ的结构简式为.
解答: 解:(1)根据有机物I的结构简式,可知其分子式为C12H9Br,故答案为:C12H9Br;(2)A.含有酯基,具有酯基的性质,可以发生水解反应,故A正确;B.不含醛基,不能与新制Cu(OH)2共热生成红色沉淀,故B错误;C.不含酚羟基,不能与FeCl3溶液反应显紫色,故C错误;D.含有苯环,可与热的浓硝酸和浓硫酸混合液发生苯环的硝化反应,故D正确,故选:AD;(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,结合Ⅵ的结构及途径I中的转化可知,Ⅲ为CH2=CHCOOH,与HBr发生加成反应生成Ⅳ为BrCH2CH2COOH,再与乙醇发生酯化反应生成V为BrCH2CH2COOCH2CH3,合成路线流程图为:,故答案为:;(4)V为BrCH2CH2COOCH2CH3,分子中含有4种化学环境不同的H原子,核磁共振氢谱中4组吸收峰;以H替代化合物Ⅵ中的ZnBr得到CH3 ( http: / / www.21cnjy.com )CH2COOCH2CH3,其同分异构体属于羧酸,可以看作﹣COOH取代丁烷形成的羧酸,丁烷有CH3CH2CH2CH3、CH3CH(CH3)2,CH3CH2CH2CH3中H原子被﹣COOH取代,形成2种羧酸,CH3CH(CH3)2中H原子被﹣COOH取代,也形成2种羧酸,故有4种,故答案为:4;4;(5)对比Ⅵ、Ⅱ的结构,结合途径1中生成Ⅱ的反应为取代反应,可以判断化合物Ⅶ的结构简式为,故答案为:.
点评: 本题考查有机物的合成,注意根 ( http: / / www.21cnjy.com )据有机物的结构进行分析解答,利用途径1的转化关系理解V→Ⅵ的转化,较好的考查学生分析推理能力、获取信息能力,(4)中注意利用取代法判断同分异构体数目,难度中等.
31.(16分)(2015 广东)用O2将HCl转化为Cl2,可提高效益,减少污染.
( http: / / www.21cnjy.com )
(1)传统上该转化通过如图 ( http: / / www.21cnjy.com )1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2) (反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl ( http: / / www.21cnjy.com )平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H < 0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 K(A) .
②在上述实验中若压缩体积使压强增大,画出 ( http: / / www.21cnjy.com )相应αHCl~T曲线的示意图,并简要说明理由: 增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大 .
③下列措施中,有利于提高αHCl的有 BD .
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t/min 0 2.0 4.0 6.0 8.0
n(Cl2)/10﹣3mol 0 1.8 3.7 5.4 7.2
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol min﹣1为单位,写出计算过程).www-2-1-cnjy-com
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O .【出处:21教育名师】
考点: 真题集萃;热化学方程式;化学平衡的影响因素.
专题: 基本概念与基本理论.
分析: (1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+O2(g)=CuO(s)+Cl2(g)△H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式;(2)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动;②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大;③改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度;(3)根据v=计算2.0~6.0min内v(Cl2),再利用速率之比等于其化学计量数之比计算v(HCl);(4)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水.
解答: 解:(1)由图示可知,整个过程为:4HCl+ ( http: / / www.21cnjy.com )O2=2Cl2+2H2O,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+O2(g)=CuO(s)+Cl2(g)△H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2),故答案为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2);(2)①由图可知,温度越高, ( http: / / www.21cnjy.com )平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0,化学平衡常数减小,即K(A)>K(B),故答案为:<;K(A);②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大,故压缩体积使压强增大,画相应αHCl~T曲线的示意图为 ( http: / / www.21cnjy.com ),故答案为: ( http: / / www.21cnjy.com ),增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大;③A.增大n(HCl),HCl浓度增大,平衡右移,但HCl的转化率降低,故A错误;B.增大n(O2),氧气浓度增大,平衡右移,HCl的转化率提高,故B正确;C.使用更好的催化剂,加快反应速率,缩短到达平衡的时间,不影响平衡移动,HCl的转化率不变,故C错误;D.移去生成物H2O,有利于平衡右移,HCl的转化率增大,故D正确,故选:BD;(3)由表中数据可知,2.0~6.0min内△n(Cl2)=(5.4﹣1.8)×10﹣3mol=3.6×10﹣3mol,则以Cl2的物质的量变化表示的反应速率v(Cl2)==9×10﹣4mol min﹣1,速率之比等于其化学计量数之比,故v(HCl)=2v(Cl2)=1.8×10﹣3mol.min﹣1,答:2.0~6.0min内以HCl的物质的量变化表示的反应速率1.8×10﹣3mol min﹣1;(4)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水,反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评: 本题比较综合,涉及热化学方程式书 ( http: / / www.21cnjy.com )写、化学平衡及平衡常数影响因素、化学反应速率的计算等,(3)中注意用单位时间内物质的量变化表示熟练,较好的考查的分析解决问题的能力,难度中等.
32.(16分)(2015 广东)七铝十二 ( http: / / www.21cnjy.com )钙(12CaO 7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
( http: / / www.21cnjy.com )
(1)锻粉主要含MgO和 CaO ,用 ( http: / / www.21cnjy.com )适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,或滤液Ⅰ中c(Mg2+)小于5×10﹣6mol L﹣1,则溶液pH大于 11 (Mg(OH)2的Ksp=5×10﹣12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失 .
(2)滤液Ⅰ中阴离子有 NO3﹣, ( http: / / www.21cnjy.com )OH﹣ (忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成 Ca(HCO3)2 ,从而导致CaCO3产率降低.
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 Al2O3+2OH﹣═2AlO2﹣+H2O .
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 2Al+6H2O2Al(OH)3↓+3H2↑ .
(5)一种可超快充电的新型铝电池 ( http: / / www.21cnjy.com ),充放电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 Al﹣3e﹣+7AlCl4﹣=4Al2Cl7﹣ .
考点: 金属的回收与环境、资源保护;
分析: (1)锻粉是由白云石高温煅烧而来;用适量NH4 ( http: / / www.21cnjy.com )NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp来计算;CaSO4微溶于水;(2)在锻粉中加入适量的NH4NO ( http: / / www.21cnjy.com )3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3 H2O,故过滤后溶液中含Ca(NO3)2和NH3 H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,据此分析产物;(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水;(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,据此分析;(5)放电时负极电极本身Al放电,失电子,根据AlCl4﹣和Al2Cl7﹣中铝元素和氯元素的比例来确定做AlCl4﹣做反应物而生成Al2Cl7﹣.
解答: 解:(1)锻粉是由白云石 ( http: / / www.21cnjy.com )高温煅烧而来,在煅烧白云石时,发生反应:CaCO3CaO+CO2↑,MgCO3MgO+CO2↑,故所得锻粉主要含MgO和CaO;用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp可知:Ksp=c(Mg2+) c2(OH﹣)=5×10﹣12,而c(Mg2+)小于5×10﹣6mol L﹣1,故c(OH﹣)大于10﹣3mol/L,则溶液中的c(H+)小于10﹣11mol/L,溶液的pH大于11;CaSO4微溶于水,如果用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失,故答案为:CaO;11;CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失;(2)在锻粉中加入适量的NH4NO3溶 ( http: / / www.21cnjy.com )液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3 H2O,故过滤后溶液中含Ca(NO3)2和NH3 H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,故滤液中的阴离子主要为NO3﹣,还含有OH﹣;若滤液Ⅰ中仅通入CO2,会造成CO2过量,则会生成Ca(HCO3)2,从而导致CaCO3产率降低,故答案为:NO3﹣,OH﹣;Ca(HCO3)2;(3)氧化铝和氢氧化钠反 ( http: / / www.21cnjy.com )应生成偏铝酸钠和水,离子反应为Al2O3+2OH﹣═2AlO2﹣+H2O,故答案为:Al2O3+2OH﹣═2AlO2﹣+H2O;(4)用Al片和石墨作电极来制备A ( http: / / www.21cnjy.com )l(OH)3,故Al做阳极,石墨做阴极,阳极反应为:Al﹣3e﹣=Al3+①,阴极上是来自于水的H+放电:2H2O+2e﹣=2OH﹣+H2↑ ②将①×2+②×3可得总反应:2Al+6H2O2Al(OH)3↓+3H2↑,故答案为:2Al+6H2O2Al(OH)3↓+3H2↑;(5)放电时负极电极本身Al放电,失电子,由于AlCl4﹣中氯元素的含量高于Al2Cl7﹣中氯元素的含量,故AlCl4﹣做反应物而Al2Cl7﹣为生成物,由于其它离子不参与电极反应,故电极反应为:Al﹣3e﹣+7AlCl4﹣=4Al2Cl7﹣,故答案为:Al﹣3e﹣+7AlCl4﹣=4Al2Cl7﹣.
点评: 本题是一道非常典型的工艺流程图题,综合性较强,综合了元素化合物、电解池和原电池的知识考查,难度较大.
33.(17分)(2015 广东)NH3及其盐都是重要的化工原料.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 ACG .
( http: / / www.21cnjy.com )
(2)按图装置进行NH3性质实验.
( http: / / www.21cnjy.com )
①先打开旋塞1,B瓶中的现象是 ( http: / / www.21cnjy.com ) 出现白烟 ,原因是 A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟 ,稳定后,关闭旋塞1.
②再打开旋塞2,B瓶中的现象是 烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红 .
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)21世纪教育网版权所有
①实验目的:探究 温度 对溶液中NH4Cl水解程度的影响.
②设计实验方案,拟定实验表格 ( http: / / www.21cnjy.com ),完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量实验序号 V(溶液)/ml …
1 100 …
2 100 …
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应的平衡转化率为 (只列出算式,忽略水自身电离的影响).21教育网
考点: 真题集萃;氨的制取和性质.
专题: 实验设计题.
分析: (1)实验室用加热固体氯化铵和熟石灰制取 ( http: / / www.21cnjy.com )氨气(2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,根据氨气为易溶于水密度比空气小的气体性质选择收集装置,氨气极易溶于水,尾气处理需考虑倒吸,据此分析解答;(2)①根据A、B容器压强 ( http: / / www.21cnjy.com )以及A、B混合后压强相等以及氨气和氯化氢反应生成氯化铵分析;②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,氯化铵为强酸弱碱盐,溶液呈酸性,据此分析;(3)①根据影响NH4Cl水解的因素以及题干提供的限选试剂与仪器分析;②氯化铵为强酸弱碱盐,水解溶液呈酸性,所配制溶液的体积,根据温度不同,盐类水解后PH不同,进行设计表格数据;③读取的待测物理量的数值为Y,Y为PH值,PH=﹣lgc(H+)可求算出氢离子浓度,根据NH4++H2O NH3 H2O+H+,求解NH4Cl水解反应的平衡转化率.
解答: 解:(1)实验室用加热固体氯化铵和熟石灰制取 ( http: / / www.21cnjy.com )氨气(2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,因防止药品中的湿存水以及反应产生的水使反应试管受热不均匀,所以选择试管口向下的A装置制备氨气,氨气为易溶于水,不能用排水法收集,密度比空气小,需用向上排空气法收集,所以选择C装置,氨气极易溶于水,尾气处理需考虑倒吸,倒扣的漏斗空间大,水柱不易极速上升,能防止倒吸,故选G装置,故答案为:ACG;(2)①A容器压强为150KPa,B ( http: / / www.21cnjy.com )容器压强100KPa,A容器压强大于B容器,先打开旋塞1,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,故答案为:出现白烟;A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟;②氨气、氯化氢为气体反应 ( http: / / www.21cnjy.com )生成的氯化铵为固体,压强减小,再打开旋塞2,紫色的石蕊试液倒吸入B瓶中,氯化铵为强酸弱碱盐,溶液中铵根离子水解生成一水合氨和氢离子,水解方程式为:NH4++H2O NH3 H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红;(3)①盐类水解,水解离 ( http: / / www.21cnjy.com )子浓度越大,水解程度越小,盐类水解为吸热反应,温度越高,水解程度越大,根据题干提供的限选试剂与仪器中的温度计、恒温水浴槽(可调控温度),可选择温度不同对盐类水解的影响,故答案为:温度;②根据①可知,该实验为探究温度对氯化 ( http: / / www.21cnjy.com )铵水解的影响,氯化铵为强酸弱碱盐,水解溶液呈酸性,所以可根据不同温度下,水解的溶液的pH进行判断,所配制溶液的体积都为100mL,m(NH4Cl)相同都为m g,温度不同,分别为T1℃、T2℃,分别测水解后pH,故答案为:物理量实验序号V(溶液)/mLNH4Cl质量(g)温度(℃)pH1100mT1Y2100mT2Z③读取的待测物理量的数值为Y,Y为pH值,pH=﹣lgc(H+),c(H+)=10﹣Ymol/L,NH4++H2O NH3 H2O+H+,水解的氯化铵的物质的量为n(NH4Cl)=c(H+)×V=10﹣Y×0.1mol,则NH4Cl水解反应的平衡转化率为×100%=,故答案为:.
点评: 本题主要考查了氨的制备以及铵盐的性质,掌握实验室制取氨气的原理以及铵盐的水解规律是解答的关键,题目难度中等.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
2015年广东省高考化学试卷
一、选择题(共6小题,每小题4分,满分24分)
7.(4分)(2015 广东)化学是你,化学是我,化学深入我们生活.下列说法正确的是( )
A. 木材纤维和土豆淀粉遇碘水均显蓝色
B. 食用花生油和鸡蛋清都能发生水解反应
C. 包装用材料聚乙烯和聚氯乙烯都属于烃
D. PX项目的主要产品对二甲苯属于饱和烃
8.(4分)(2015 广东)水溶液中能大量共存的一组离子是( )
A. NH4+、Ba2+、Br﹣、CO32﹣ B. Cl﹣、SO32﹣、Fe2+、H+
C. K+、Na+、SO42﹣、MnO4﹣ D. Na+、H+、NO3﹣、HCO3﹣
9.(4分)(2015 广东)下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A 1﹣己醇的沸点比己烷的沸点高 1﹣己醇和己烷可通过蒸馏初步分离
B 原电池可将化学能转化为电能 原电池需外接电源才能工作
C 乙二酸可与KMnO4溶液发生反应 乙二酸具有酸性
D Na在Cl2中燃烧的生成物含离子键 NaCl固体可导电
A. A B. B C. C D. D
10.(4分)(2015 广东)设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 23gNa与足量H2O反应完全后可生成NA个H2分子
B. 1molCu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4LN2和H2混合气中含NA个原子
D. 3mol单质Fe完全转化为Fe3O4,失去8NA个电子
11.(4分)(2015 广东)一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )21·世纪*教育网
( http: / / www.21cnjy.com )
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10﹣13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
12.(4分)(2015 广东)准确取2 ( http: / / www.21cnjy.com )0.00mL某待测HCl溶液于锥形瓶中,用0.1000mol L﹣1NaOH溶液滴定,下列说法正确的是( ) 21*cnjy*com
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
二、双项选择题(共2小题,每小题6分,满分 ( http: / / www.21cnjy.com )12分。在每小题给出的四个选项中,有两个选项符合题目要求,全部选对的得6分,只有1个且正确的得3分,有选错或不答的得0分。)【来源:21cnj*y.co*m】
22.(6分)(2015 广东)下列实验操作、现象和结论均正确的是( )
选项 实验操作 现象 结论
A 分别加热Na2CO3和NaHCO3固体 试管内壁均有水珠 两种物质均受热分解
B 向稀的苯酚水溶液滴加饱和溴水 生成白色沉淀 产物三溴苯酚不溶于水
C 向含I﹣的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 加入淀粉后溶液变成蓝色 氧化性:Cl2>I2
D 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 加入H2O2后溶液变成血红色 Fe2+既有氧化性又有还原性
A. A B. B C. C D. D
23.(6分)(2015 广东)甲~庚等元 ( http: / / www.21cnjy.com )素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )21教育名师原创作品
( http: / / www.21cnjy.com )
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
三、非选择题(共大题共4小 ( http: / / www.21cnjy.com )题,满分64分.按题目要求作答。解答题应写出必要的文字说明、方程式和重要演算步骤,只写出最后答案的不能得分。有数值计算的题,答案中必须明确写出数值和单位。)2·1·c·n·j·y
30.(15分)(2015 广东)有机锌试剂(R﹣ZnBr)与酰氯()偶联可用于制备药物Ⅱ:
( http: / / www.21cnjy.com )
(1)化合物Ⅰ的分子式为 .
(2)关于化合物Ⅱ,下列说法正确的有 (双选).
A.可以发生水解反应 B.可与新制Cu(OH)2共热生成红色沉淀
C.可与FeCl3溶液反应显紫色 D.可与热的浓硝酸和浓硫酸混合液反应
(3)化合物Ⅲ含有3个碳原子,且可发生 ( http: / / www.21cnjy.com )加聚反应,按照途径Ⅰ合成路线的表示方式.完成途径2中由Ⅲ到Ⅴ的合成路线: .(标明反应试剂,忽略反应条件).
(4)化合物V的核磁共振氢谱中峰的 ( http: / / www.21cnjy.com )组数为 .以H替代化合物Ⅵ中的ZnBr,所得化合物的羧酸类同分异构体共有 种(不考虑手性异构).
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为 .
31.(16分)(2015 广东)用O2将HCl转化为Cl2,可提高效益,减少污染.
( http: / / www.21cnjy.com )
(1)传统上该转化通过如图1所示的 ( http: / / www.21cnjy.com )催化循环实现.其中,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 (反应热用△H1和△H2表示).21*cnjy*com
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平 ( http: / / www.21cnjy.com )衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H 0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 .
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图,并简要说明理由: .
③下列措施中,有利于提高αHCl的有 .
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t/min 0 2.0 4.0 6.0 8.0
n(Cl2)/10﹣3mol 0 1.8 3.7 5.4 7.2
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol min﹣1为单位,写出计算过程).
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式 .
32.(16分)(2015 ( http: / / www.21cnjy.com ) 广东)七铝十二钙(12CaO 7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
( http: / / www.21cnjy.com )
(1)锻粉主要含MgO和 ( http: / / www.21cnjy.com ) ,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,或滤液Ⅰ中c(Mg2+)小于5×10﹣6mol L﹣1,则溶液pH大于 (Mg(OH)2的Ksp=5×10﹣12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 .
(2)滤液Ⅰ中阴离子有 (忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成 ,从而导致CaCO3产率降低.
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 .
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 .
(5)一种可超快充电的新型铝电池,充放 ( http: / / www.21cnjy.com )电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 .
33.(17分)(2015 广东)NH3及其盐都是重要的化工原料.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 .
( http: / / www.21cnjy.com )
(2)按图装置进行NH3性质实验.
( http: / / www.21cnjy.com )
①先打开旋塞1,B瓶中的现象是 ,原因是 ,稳定后,关闭旋塞1.
②再打开旋塞2,B瓶中的现象是 .
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究 对溶液中NH4Cl水解程度的影响.
②设计实验方案,拟定实验表格,完整 ( http: / / www.21cnjy.com )体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量实验序号 V(溶液)/ml …
1 100 …
2 100 …
③按实验序号1所拟数据进行实验,若 ( http: / / www.21cnjy.com )读取的待测物理量的数值为Y,则NH4Cl水解反应的平衡转化率为 (只列出算式,忽略水自身电离的影响).
2015年广东省高考化学试卷
参考答案与试题解析
一、选择题(共6小题,每小题4分,满分24分)
7.(4分)(2015 广东)化学是你,化学是我,化学深入我们生活.下列说法正确的是( )
A. 木材纤维和土豆淀粉遇碘水均显蓝色
B. 食用花生油和鸡蛋清都能发生水解反应
C. 包装用材料聚乙烯和聚氯乙烯都属于烃
D. PX项目的主要产品对二甲苯属于饱和烃
考点: 生活中的有机化合物.
分析: A.淀粉遇碘水显蓝色;B.食用花生油成分是油脂,鸡蛋清成分是蛋白质;C.烃是指仅含碳氢两种元素的化合物;D.不饱和烃,是含有双键或三键或苯环的烃.
解答: 解:A.淀粉遇碘水显蓝色,纤维素遇碘水不显蓝色,木材纤维的主要成分是纤维素,故A错误; B.食用花生油成分是油脂,鸡蛋清成分是蛋白质,油脂水解生成高级脂肪酸和甘油,蛋白质水解生成氨基酸,故B正确;C.聚氯乙烯还含有氯元素,故C错误;D.对二甲苯含有苯环,属于不饱和烃,故D错误.故选B.
点评: 本题考查有机物的性质与简单分类,比较基础,明确不饱和烃,是含有双键或三键或苯环的烃是解题的关键.
8.(4分)(2015 广东)水溶液中能大量共存的一组离子是( )
A. NH4+、Ba2+、Br﹣、CO32﹣ B. Cl﹣、SO32﹣、Fe2+、H+
C. K+、Na+、SO42﹣、MnO4﹣ D. Na+、H+、NO3﹣、HCO3﹣
考点: 离子共存问题.
专题: 离子反应专题.
分析: 根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解等,则离子大量共存,以此来解答.
解答: 解:A.Ba2+、CO32﹣结合生成沉淀,不能大量共存,故A错误;B.SO32﹣、H+结合生成水和气体,不能大量共存,故B错误;C.该组离子之间不反应,可大量共存,故C正确;D.H+、HCO3﹣结合生成水和气体,不能大量共存,故D错误;故选C.
点评: 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、水解反应的离子共存考查,题目难度不大.
9.(4分)(2015 广东)下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A 1﹣己醇的沸点比己烷的沸点高 1﹣己醇和己烷可通过蒸馏初步分离
B 原电池可将化学能转化为电能 原电池需外接电源才能工作
C 乙二酸可与KMnO4溶液发生反应 乙二酸具有酸性
D Na在Cl2中燃烧的生成物含离子键 NaCl固体可导电
A. A B. B C. C D. D
考点: 真题集萃;离子化合物的结构特征与性质;原电池和电解池的工作原理;有机化学反应的综合应用;物质的分离、提纯和除杂.
分析: A.沸点相差较大的混合物可用蒸馏的方法分离;B.原电池提供电能,无需外接电源;C.乙二酸具有还原性,可与酸性高锰酸钾发生氧化还原反应;D.NaCl固体不导电,导电必须有自由移动的离子或电子.
解答: 解:A.1﹣己醇分子间可形成氢键,沸点较大,可用蒸馏的方法分离醇和己烷,故A正确;B.原电池提供电能,无需外接电源,外接电源时为电解池,电能转化为化学能,故B错误;C.乙二酸具有还原性,可与酸性高锰酸钾发生氧化还原反应,与酸性无关,故C错误;D.NaCl固体没有自由移动的离子,不能导电,熔融的NaCl可导电,故D错误.故选A.
点评: 本题为2015年考题,综合考查物质的分离 ( http: / / www.21cnjy.com )、原电池、氧化还原反应以及离子化合物等知识,为常见题型,有利于培养学生良好的科学素养,题目难度适中,贴近教材.
10.(4分)(2015 广东)设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 23gNa与足量H2O反应完全后可生成NA个H2分子
B. 1molCu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4LN2和H2混合气中含NA个原子
D. 3mol单质Fe完全转化为Fe3O4,失去8NA个电子
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A、求出钠的物质的量,然后根据反应后1mol钠反应生成0.5mol氢气来分析;B、铜和浓硫酸反应时,浓硫酸被还原为SO2;C、N2和H2均为双原子分子;D、根据Fe3O4中铁为+价来分析.
解答: 解:A、23g钠的物质的量为1mol,而钠与水反应时1mol钠生成0.5mol氢气,即生成0.5NA个分子,故A错误;,B、铜和浓硫酸反应时,浓硫酸被还原为SO2,不是三氧化硫,故B错误;C、标准状况下,22.4LN2和H2 ( http: / / www.21cnjy.com )混合气的物质的量为1mol,而N2和H2均为双原子分子,故1mol混合气体中无论两者的比例如何,均含2mol原子,即2NA个,故C错误;D、Fe3O4中铁为+价,故1mol铁反应失去mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,故D正确.故选D.
点评: 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.
11.(4分)(2015 广东)一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )www.21-cn-jy.com
( http: / / www.21cnjy.com )
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10﹣13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
考点: 水的电离;弱电解质在水溶液中的电离平衡.
分析: A、由图可知abc为等温线;B、由b点计算此温度下水的离子积常数为1.0×10﹣14;C、b点到a点,氢离子浓度变大,氢氧根离子浓度减小,据此解答即可;D、稀释不会引起水的离子积的改变,据此解答即可.
解答: 解:A、由图可知abc三点对应的平衡常数不变,故abc为等温线,故升高温度,不能由c到b,故A错误;B、b点c(H+)=c(OH﹣)=1.0×10﹣7,故KW=1.0×10﹣7×1.0×10﹣7=1.0×10﹣14,故B错误;C、加入FeCl3,氯化铁为强酸弱碱盐 ( http: / / www.21cnjy.com ),铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;D、由c点到d点,水的离子积常数减小,温度不变,K不变,故不能利用稀释使其形成此变化,故D错误,故选C.
点评: 本题主要考查的是水的离子积常数以及水电离的影响因素,掌握水的离子积为温度的函数是解决本题的关键,难度不大.
12.(4分)(2015 广东 ( http: / / www.21cnjy.com ))准确取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol L﹣1NaOH溶液滴定,下列说法正确的是( )【来源:21·世纪·教育·网】
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
考点: 真题集萃;中和滴定.
分析: A.滴定管使用必须用NaOH标准液润洗;B.碱滴定酸,氢离子浓度逐渐减小;C.用酚酞作指示剂,滴定前锥形瓶中为无色溶液;D.滴定终点时,发现滴定管尖嘴部分有悬滴,则消耗的标准液偏大.
解答: 解:A.滴定管使用必须用NaOH标准液润洗,否则消耗的标准液偏大,测定酸的浓度偏大,故A错误;B.碱滴定酸,氢离子浓度逐渐减小,则随着NaOH溶液滴入,锥形瓶中溶液pH由小变大,故B正确;C.用酚酞作指示剂,滴定前锥形瓶中为无色溶液,则当锥形瓶中溶液由无色变红色时停止滴定,故C错误;D.滴定终点时,发现滴定管尖嘴部分有悬滴,则消耗的标准液偏大,则测定酸的浓度偏大,故D错误;故选B.
点评: 本题为2015年广东高考题,侧重中和滴 ( http: / / www.21cnjy.com )定实验的考查,把握中和滴定原理、仪器的使用、误差分析为解答的关键,注重分析与实验能力的结合,题目难度不大.
二、双项选择题(共2小题,每小题6分,满分 ( http: / / www.21cnjy.com )12分。在每小题给出的四个选项中,有两个选项符合题目要求,全部选对的得6分,只有1个且正确的得3分,有选错或不答的得0分。)【版权所有:21教育】
22.(6分)(2015 广东)下列实验操作、现象和结论均正确的是( )
选项 实验操作 现象 结论
A 分别加热Na2CO3和NaHCO3固体 试管内壁均有水珠 两种物质均受热分解
B 向稀的苯酚水溶液滴加饱和溴水 生成白色沉淀 产物三溴苯酚不溶于水
C 向含I﹣的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 加入淀粉后溶液变成蓝色 氧化性:Cl2>I2
D 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 加入H2O2后溶液变成血红色 Fe2+既有氧化性又有还原性
A. A B. B C. C D. D
考点: 真题集萃;化学实验方案的评价.
专题: 实验评价题.
分析: A.根据元素守恒知,即使碳酸钠分解也不能生成水;B.苯酚和浓溴水反应生成三溴苯酚沉淀;C.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;D.亚铁离子具有还原性,能被双氧水氧化生成铁离子,铁离子和KSCN溶液混合生成络合物而导致溶液呈血红色.
解答: 解:A.根据元素守恒知,即使碳酸钠分解也不能生成水,可能是碳酸钠不干燥导致的,故A错误;B.苯酚和浓溴水反应生成三溴苯酚白色沉淀,向稀的苯酚水溶液滴加饱和溴水生成白色沉淀,说明产物三溴苯酚不溶于水,故B正确;C.同一氧化还原反应中,氧化 ( http: / / www.21cnjy.com )剂的氧化性大于氧化产物的氧化性,向含I﹣的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,氯气具有强氧化性,能将碘离子氧化生成碘,碘遇淀粉试液变蓝色,加入淀粉后溶液变蓝色,说明碘离子被氧化生成碘单质,氧化剂是氯气、氧化产物是碘,所以氧化性氧化性:Cl2>I2,故C正确;D.双氧水具有氧化性,亚铁离子具有还原 ( http: / / www.21cnjy.com )性,亚铁离子和双氧水反应生成铁离子,铁离子和KSCN溶液混合生成络合物而导致溶液呈血红色,加入双氧水后溶液变成血红色说明亚铁离子被氧化,则亚铁离子有还原性,不能说明具有氧化性,故D错误;故选BC.
点评: 本题考查化学实验方案评价,为2015年 ( http: / / www.21cnjy.com )广东省高考化学试题,涉及氧化还原反应、氧化性强弱比较、离子检验、物质性质等知识点,侧重考查学生分析判断能力,明确物质性质及基本原理是解本题关键,易错选项是D.
23.(6分)(2015 广东)甲~庚等 ( http: / / www.21cnjy.com )元素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )21·cn·jy·com
( http: / / www.21cnjy.com )
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
考点: 位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用.
分析: 己的最高价氧化物对应水化物有强脱水性,则为浓 ( http: / / www.21cnjy.com )硫酸,可知己为S元素,结合位置关系可知丁为Si,丙为B,庚为F,戊为As;甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,则甲为Mg,甲、乙同主族且相邻,可知乙为Ca元素,然后结合元素周期律及元素化合物知识来解答.
解答: 解:己的最高价氧化物对应水化物有强脱 ( http: / / www.21cnjy.com )水性,则为浓硫酸,可知己为S元素,结合位置关系可知丁为Si,丙为B,庚为F,戊为As;甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,则甲为Mg,可知乙为Ca元素,A.丙与戊的原子序数相差为33﹣5=28,故A正确;B.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:庚>己>戊,故B错误;C.金属性Ca>Mg,常温下,乙的单质能与水剧烈反应,而甲不能,故C错误;D.丁的最高价氧化物为SiO2,可用于制造光导纤维,故D正确;故选AD.
点评: 本题考查位置、结构、性质的关系及应用,为高频考点,把握信息及元素的位置推断元素为解答的关键,侧重分析、推断能力的考查,题目难度不大.
三、非选择题(共大题共4小题,满分64 ( http: / / www.21cnjy.com )分.按题目要求作答。解答题应写出必要的文字说明、方程式和重要演算步骤,只写出最后答案的不能得分。有数值计算的题,答案中必须明确写出数值和单位。)21cnjy.com
30.(15分)(2015 广东)有机锌试剂(R﹣ZnBr)与酰氯()偶联可用于制备药物Ⅱ:
( http: / / www.21cnjy.com )
(1)化合物Ⅰ的分子式为 C12H9Br .
(2)关于化合物Ⅱ,下列说法正确的有 AD (双选).
A.可以发生水解反应 B.可与新制Cu(OH)2共热生成红色沉淀
C.可与FeCl3溶液反应显紫色 D.可与热的浓硝酸和浓硫酸混合液反应
(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,按照途径Ⅰ合成路线的表示方式.完成途径2中由Ⅲ到Ⅴ的合成路线: .(标明反应试剂,忽略反应条件).2-1-c-n-j-y
(4)化合物V的核磁共振氢谱中峰的组数为 4 .以H替代化合物Ⅵ中的ZnBr,所得化合物的羧酸类同分异构体共有 4 种(不考虑手性异构).
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为 .
考点: 真题集萃;有机物的合成.
分析: (1)根据有机物I的结构确定其分子式;(2)有机物Ⅱ含有苯环,具有苯的性质,含 ( http: / / www.21cnjy.com )有酯基,具有酯基的性质,没有醛基、酚羟基,不能与新制Cu(OH)2共热生成红色沉淀,不能与FeCl3溶液反应显紫色;(3)化合物Ⅲ含有3个碳原子,且可 ( http: / / www.21cnjy.com )发生加聚反应,结合Ⅵ的结构及途径I中的转化可知,Ⅲ为CH2=CHCOOH,与HBr发生加成反应生成Ⅳ为BrCH2CH2COOH,再与乙醇发生酯化反应生成V为BrCH2CH2COOCH2CH3;(4)V为BrCH2CH2COOCH ( http: / / www.21cnjy.com )2CH3,分子中含有4种化学环境不同的H原子;以H替代化合物Ⅵ中的ZnBr得到CH3CH2COOCH2CH3,其同分异构体属于羧酸,可以看作﹣COOH取代丁烷形成的羧酸,结合丁烷同分异构体及等效氢判断;(5)对比Ⅵ、Ⅱ的结构,结合途径1中生成Ⅱ的反应为取代反应,可以判断化合物Ⅶ的结构简式为.
解答: 解:(1)根据有机物I的结构简式,可知其分子式为C12H9Br,故答案为:C12H9Br;(2)A.含有酯基,具有酯基的性质,可以发生水解反应,故A正确;B.不含醛基,不能与新制Cu(OH)2共热生成红色沉淀,故B错误;C.不含酚羟基,不能与FeCl3溶液反应显紫色,故C错误;D.含有苯环,可与热的浓硝酸和浓硫酸混合液发生苯环的硝化反应,故D正确,故选:AD;(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,结合Ⅵ的结构及途径I中的转化可知,Ⅲ为CH2=CHCOOH,与HBr发生加成反应生成Ⅳ为BrCH2CH2COOH,再与乙醇发生酯化反应生成V为BrCH2CH2COOCH2CH3,合成路线流程图为:,故答案为:;(4)V为BrCH2CH2COOCH2CH3,分子中含有4种化学环境不同的H原子,核磁共振氢谱中4组吸收峰;以H替代化合物Ⅵ中的ZnBr得到CH3 ( http: / / www.21cnjy.com )CH2COOCH2CH3,其同分异构体属于羧酸,可以看作﹣COOH取代丁烷形成的羧酸,丁烷有CH3CH2CH2CH3、CH3CH(CH3)2,CH3CH2CH2CH3中H原子被﹣COOH取代,形成2种羧酸,CH3CH(CH3)2中H原子被﹣COOH取代,也形成2种羧酸,故有4种,故答案为:4;4;(5)对比Ⅵ、Ⅱ的结构,结合途径1中生成Ⅱ的反应为取代反应,可以判断化合物Ⅶ的结构简式为,故答案为:.
点评: 本题考查有机物的合成,注意根 ( http: / / www.21cnjy.com )据有机物的结构进行分析解答,利用途径1的转化关系理解V→Ⅵ的转化,较好的考查学生分析推理能力、获取信息能力,(4)中注意利用取代法判断同分异构体数目,难度中等.
31.(16分)(2015 广东)用O2将HCl转化为Cl2,可提高效益,减少污染.
( http: / / www.21cnjy.com )
(1)传统上该转化通过如图 ( http: / / www.21cnjy.com )1所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为 4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2) (反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl ( http: / / www.21cnjy.com )平衡转化率随温度变化的αHCl~T曲线如图2,则总反应的△H < 0(填“>”、“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 K(A) .
②在上述实验中若压缩体积使压强增大,画出 ( http: / / www.21cnjy.com )相应αHCl~T曲线的示意图,并简要说明理由: 增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大 .
③下列措施中,有利于提高αHCl的有 BD .
A.增大n(HCl) B.增大n(O2)
C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t/min 0 2.0 4.0 6.0 8.0
n(Cl2)/10﹣3mol 0 1.8 3.7 5.4 7.2
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol min﹣1为单位,写出计算过程).www-2-1-cnjy-com
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O .【出处:21教育名师】
考点: 真题集萃;热化学方程式;化学平衡的影响因素.
专题: 基本概念与基本理论.
分析: (1)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+O2(g)=CuO(s)+Cl2(g)△H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式;(2)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动;②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大;③改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度;(3)根据v=计算2.0~6.0min内v(Cl2),再利用速率之比等于其化学计量数之比计算v(HCl);(4)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水.
解答: 解:(1)由图示可知,整个过程为:4HCl+ ( http: / / www.21cnjy.com )O2=2Cl2+2H2O,反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(s)△H1,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+O2(g)=CuO(s)+Cl2(g)△H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2),故答案为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2);(2)①由图可知,温度越高, ( http: / / www.21cnjy.com )平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0,化学平衡常数减小,即K(A)>K(B),故答案为:<;K(A);②正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大,故压缩体积使压强增大,画相应αHCl~T曲线的示意图为 ( http: / / www.21cnjy.com ),故答案为: ( http: / / www.21cnjy.com ),增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大;③A.增大n(HCl),HCl浓度增大,平衡右移,但HCl的转化率降低,故A错误;B.增大n(O2),氧气浓度增大,平衡右移,HCl的转化率提高,故B正确;C.使用更好的催化剂,加快反应速率,缩短到达平衡的时间,不影响平衡移动,HCl的转化率不变,故C错误;D.移去生成物H2O,有利于平衡右移,HCl的转化率增大,故D正确,故选:BD;(3)由表中数据可知,2.0~6.0min内△n(Cl2)=(5.4﹣1.8)×10﹣3mol=3.6×10﹣3mol,则以Cl2的物质的量变化表示的反应速率v(Cl2)==9×10﹣4mol min﹣1,速率之比等于其化学计量数之比,故v(HCl)=2v(Cl2)=1.8×10﹣3mol.min﹣1,答:2.0~6.0min内以HCl的物质的量变化表示的反应速率1.8×10﹣3mol min﹣1;(4)氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水,反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评: 本题比较综合,涉及热化学方程式书 ( http: / / www.21cnjy.com )写、化学平衡及平衡常数影响因素、化学反应速率的计算等,(3)中注意用单位时间内物质的量变化表示熟练,较好的考查的分析解决问题的能力,难度中等.
32.(16分)(2015 广东)七铝十二 ( http: / / www.21cnjy.com )钙(12CaO 7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
( http: / / www.21cnjy.com )
(1)锻粉主要含MgO和 CaO ,用 ( http: / / www.21cnjy.com )适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,或滤液Ⅰ中c(Mg2+)小于5×10﹣6mol L﹣1,则溶液pH大于 11 (Mg(OH)2的Ksp=5×10﹣12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失 .
(2)滤液Ⅰ中阴离子有 NO3﹣, ( http: / / www.21cnjy.com )OH﹣ (忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成 Ca(HCO3)2 ,从而导致CaCO3产率降低.
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 Al2O3+2OH﹣═2AlO2﹣+H2O .
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 2Al+6H2O2Al(OH)3↓+3H2↑ .
(5)一种可超快充电的新型铝电池 ( http: / / www.21cnjy.com ),充放电时AlCl4﹣和Al2Cl7﹣两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 Al﹣3e﹣+7AlCl4﹣=4Al2Cl7﹣ .
考点: 金属的回收与环境、资源保护;
分析: (1)锻粉是由白云石高温煅烧而来;用适量NH4 ( http: / / www.21cnjy.com )NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp来计算;CaSO4微溶于水;(2)在锻粉中加入适量的NH4NO ( http: / / www.21cnjy.com )3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3 H2O,故过滤后溶液中含Ca(NO3)2和NH3 H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,据此分析滤液中的阴离子;若滤液Ⅰ中仅通入CO2,会造成CO2过量,据此分析产物;(3)氧化铝和氢氧化钠反应生成偏铝酸钠和水;(4)用Al片和石墨作电极来制备Al(OH)3,故Al做阳极,据此分析;(5)放电时负极电极本身Al放电,失电子,根据AlCl4﹣和Al2Cl7﹣中铝元素和氯元素的比例来确定做AlCl4﹣做反应物而生成Al2Cl7﹣.
解答: 解:(1)锻粉是由白云石 ( http: / / www.21cnjy.com )高温煅烧而来,在煅烧白云石时,发生反应:CaCO3CaO+CO2↑,MgCO3MgO+CO2↑,故所得锻粉主要含MgO和CaO;用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,即得Mg(OH)2的饱和溶液,根据Mg(OH)2的Ksp可知:Ksp=c(Mg2+) c2(OH﹣)=5×10﹣12,而c(Mg2+)小于5×10﹣6mol L﹣1,故c(OH﹣)大于10﹣3mol/L,则溶液中的c(H+)小于10﹣11mol/L,溶液的pH大于11;CaSO4微溶于水,如果用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失,故答案为:CaO;11;CaSO4微溶于水,用(NH4)2SO4代替NH4NO3,会生成CaSO4沉淀引起Ca2+的损失;(2)在锻粉中加入适量的NH4NO3溶 ( http: / / www.21cnjy.com )液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3 H2O,故过滤后溶液中含Ca(NO3)2和NH3 H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,故滤液中的阴离子主要为NO3﹣,还含有OH﹣;若滤液Ⅰ中仅通入CO2,会造成CO2过量,则会生成Ca(HCO3)2,从而导致CaCO3产率降低,故答案为:NO3﹣,OH﹣;Ca(HCO3)2;(3)氧化铝和氢氧化钠反 ( http: / / www.21cnjy.com )应生成偏铝酸钠和水,离子反应为Al2O3+2OH﹣═2AlO2﹣+H2O,故答案为:Al2O3+2OH﹣═2AlO2﹣+H2O;(4)用Al片和石墨作电极来制备A ( http: / / www.21cnjy.com )l(OH)3,故Al做阳极,石墨做阴极,阳极反应为:Al﹣3e﹣=Al3+①,阴极上是来自于水的H+放电:2H2O+2e﹣=2OH﹣+H2↑ ②将①×2+②×3可得总反应:2Al+6H2O2Al(OH)3↓+3H2↑,故答案为:2Al+6H2O2Al(OH)3↓+3H2↑;(5)放电时负极电极本身Al放电,失电子,由于AlCl4﹣中氯元素的含量高于Al2Cl7﹣中氯元素的含量,故AlCl4﹣做反应物而Al2Cl7﹣为生成物,由于其它离子不参与电极反应,故电极反应为:Al﹣3e﹣+7AlCl4﹣=4Al2Cl7﹣,故答案为:Al﹣3e﹣+7AlCl4﹣=4Al2Cl7﹣.
点评: 本题是一道非常典型的工艺流程图题,综合性较强,综合了元素化合物、电解池和原电池的知识考查,难度较大.
33.(17分)(2015 广东)NH3及其盐都是重要的化工原料.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 ACG .
( http: / / www.21cnjy.com )
(2)按图装置进行NH3性质实验.
( http: / / www.21cnjy.com )
①先打开旋塞1,B瓶中的现象是 ( http: / / www.21cnjy.com ) 出现白烟 ,原因是 A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟 ,稳定后,关闭旋塞1.
②再打开旋塞2,B瓶中的现象是 烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红 .
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)21世纪教育网版权所有
①实验目的:探究 温度 对溶液中NH4Cl水解程度的影响.
②设计实验方案,拟定实验表格 ( http: / / www.21cnjy.com ),完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量实验序号 V(溶液)/ml …
1 100 …
2 100 …
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应的平衡转化率为 (只列出算式,忽略水自身电离的影响).21教育网
考点: 真题集萃;氨的制取和性质.
专题: 实验设计题.
分析: (1)实验室用加热固体氯化铵和熟石灰制取 ( http: / / www.21cnjy.com )氨气(2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,根据氨气为易溶于水密度比空气小的气体性质选择收集装置,氨气极易溶于水,尾气处理需考虑倒吸,据此分析解答;(2)①根据A、B容器压强 ( http: / / www.21cnjy.com )以及A、B混合后压强相等以及氨气和氯化氢反应生成氯化铵分析;②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,氯化铵为强酸弱碱盐,溶液呈酸性,据此分析;(3)①根据影响NH4Cl水解的因素以及题干提供的限选试剂与仪器分析;②氯化铵为强酸弱碱盐,水解溶液呈酸性,所配制溶液的体积,根据温度不同,盐类水解后PH不同,进行设计表格数据;③读取的待测物理量的数值为Y,Y为PH值,PH=﹣lgc(H+)可求算出氢离子浓度,根据NH4++H2O NH3 H2O+H+,求解NH4Cl水解反应的平衡转化率.
解答: 解:(1)实验室用加热固体氯化铵和熟石灰制取 ( http: / / www.21cnjy.com )氨气(2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,因防止药品中的湿存水以及反应产生的水使反应试管受热不均匀,所以选择试管口向下的A装置制备氨气,氨气为易溶于水,不能用排水法收集,密度比空气小,需用向上排空气法收集,所以选择C装置,氨气极易溶于水,尾气处理需考虑倒吸,倒扣的漏斗空间大,水柱不易极速上升,能防止倒吸,故选G装置,故答案为:ACG;(2)①A容器压强为150KPa,B ( http: / / www.21cnjy.com )容器压强100KPa,A容器压强大于B容器,先打开旋塞1,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,故答案为:出现白烟;A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟;②氨气、氯化氢为气体反应 ( http: / / www.21cnjy.com )生成的氯化铵为固体,压强减小,再打开旋塞2,紫色的石蕊试液倒吸入B瓶中,氯化铵为强酸弱碱盐,溶液中铵根离子水解生成一水合氨和氢离子,水解方程式为:NH4++H2O NH3 H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红;(3)①盐类水解,水解离 ( http: / / www.21cnjy.com )子浓度越大,水解程度越小,盐类水解为吸热反应,温度越高,水解程度越大,根据题干提供的限选试剂与仪器中的温度计、恒温水浴槽(可调控温度),可选择温度不同对盐类水解的影响,故答案为:温度;②根据①可知,该实验为探究温度对氯化 ( http: / / www.21cnjy.com )铵水解的影响,氯化铵为强酸弱碱盐,水解溶液呈酸性,所以可根据不同温度下,水解的溶液的pH进行判断,所配制溶液的体积都为100mL,m(NH4Cl)相同都为m g,温度不同,分别为T1℃、T2℃,分别测水解后pH,故答案为:物理量实验序号V(溶液)/mLNH4Cl质量(g)温度(℃)pH1100mT1Y2100mT2Z③读取的待测物理量的数值为Y,Y为pH值,pH=﹣lgc(H+),c(H+)=10﹣Ymol/L,NH4++H2O NH3 H2O+H+,水解的氯化铵的物质的量为n(NH4Cl)=c(H+)×V=10﹣Y×0.1mol,则NH4Cl水解反应的平衡转化率为×100%=,故答案为:.
点评: 本题主要考查了氨的制备以及铵盐的性质,掌握实验室制取氨气的原理以及铵盐的水解规律是解答的关键,题目难度中等.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
