湖南省株洲市第十三中学2023-2024学年高二上学期1月期末考试化学试题(含答案)
文档属性
| 名称 | 湖南省株洲市第十三中学2023-2024学年高二上学期1月期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 562.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-06 19:45:49 | ||
图片预览

文档简介
株洲市第十三中学2023-2024学年高二上学期1月期末考试 化学
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(本大题共 18小题,每小题3分,共 54分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.(本题3分)铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法不正确的是
A.该过程的总反应为HCOOHCO2↑+H2↑
B.H+浓度过大或者过小,均导致反应速率降低
C.该历程中反应速率最慢的一步:
D.该催化循环中Fe元素的化合价发生了变化
2.(本题3分)氨氮废水的处置一直是工业难题,最近我国科学家开发了如下电解装置可将其氧化去除。处理前先调节废水pH=12,通电后可将其转化为无害气体,已知装置中A、B电极均为惰性电极,下列分析错误的是
A.电极A应与外电源正极相连
B.处理废水过程中A电极附近pH降低
C.OH-从电极B向电极A定向移动
D.N2与H2的体积比为3:1
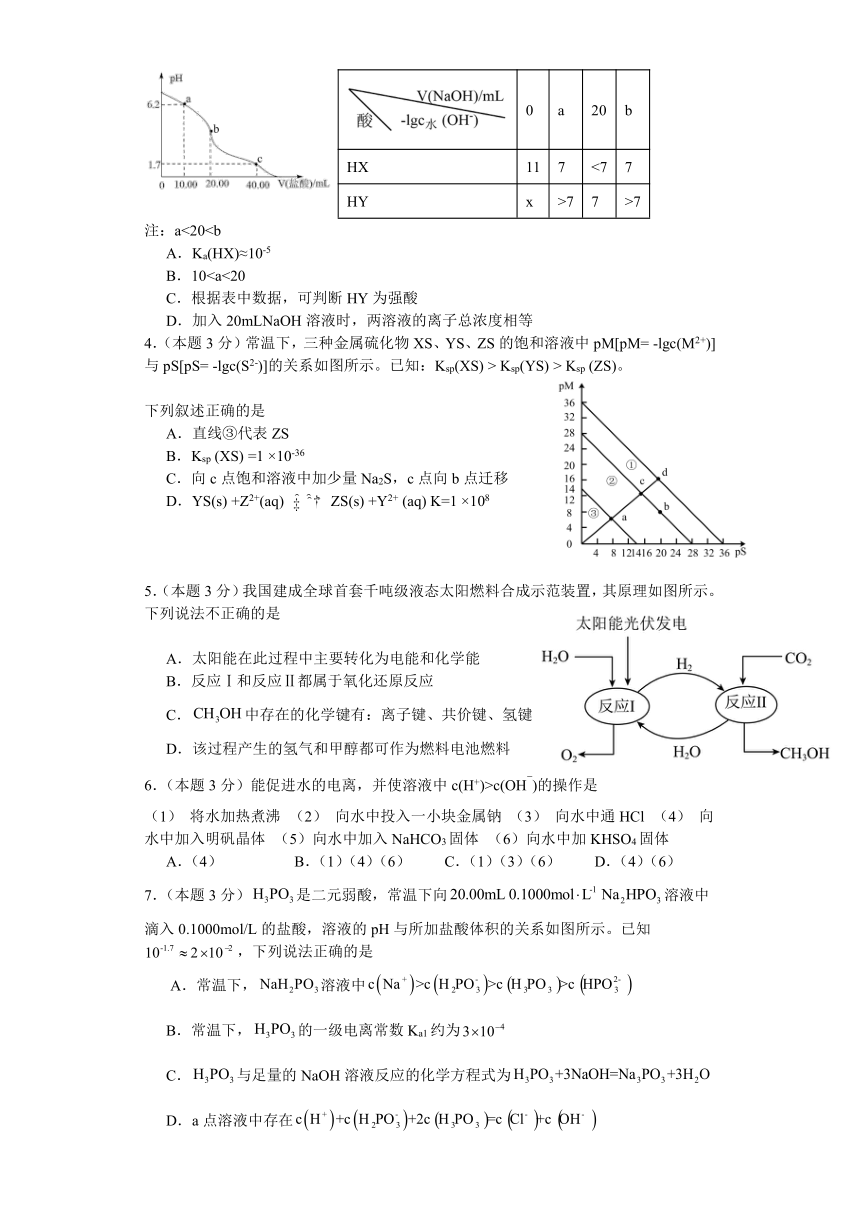
3.(本题3分)室温下,向体积均为20mL,浓度均为0.1mol/L的HX溶液和HY溶液中分别滴加0.1mol/L的NaOH溶液,反应后溶液中水电离的c水(OH-)的负对数[-lgc水(OH-)]与滴加氢氧化钠溶液体积的关系如下表。下列说法不正确的是
0 a 20 b
HX 11 7 <7 7
HY x >7 7 >7
注:a<20A.Ka(HX)≈10-5
B.10C.根据表中数据,可判断HY为强酸
D.加入20mLNaOH溶液时,两溶液的离子总浓度相等
4.(本题3分)常温下,三种金属硫化物XS、YS、ZS的饱和溶液中pM[pM= -lgc(M2+)]与pS[pS= -lgc(S2-)]的关系如图所示。已知:Ksp(XS) > Ksp(YS) > Ksp (ZS)。
下列叙述正确的是
A.直线③代表ZS
B.Ksp (XS) =1 ×10-36
C.向c点饱和溶液中加少量Na2S,c点向b点迁移
D.YS(s) +Z2+(aq) ZS(s) +Y2+ (aq) K=1 ×108
5.(本题3分)我国建成全球首套千吨级液态太阳燃料合成示范装置,其原理如图所示。下列说法不正确的是
A.太阳能在此过程中主要转化为电能和化学能
B.反应Ⅰ和反应Ⅱ都属于氧化还原反应
C.中存在的化学键有:离子键、共价键、氢键
D.该过程产生的氢气和甲醇都可作为燃料电池燃料
6.(本题3分)能促进水的电离,并使溶液中c(H+)>c(OH)的操作是
(1) 将水加热煮沸 (2) 向水中投入一小块金属钠 (3) 向水中通HCl (4) 向水中加入明矾晶体 (5)向水中加入NaHCO3固体 (6)向水中加KHSO4固体
A.(4) B.(1)(4)(6) C.(1)(3)(6) D.(4)(6)
7.(本题3分)是二元弱酸,常温下向溶液中滴入0.1000mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。已知,下列说法正确的是
A.常温下,溶液中
B.常温下,的一级电离常数Ka1约为
C.与足量的NaOH溶液反应的化学方程式为
D.a点溶液中存在
8.(本题3分)下列关于物质的性质和应用的说法错误的是
A.绿矾的化学式为FeSO4·7H2O,可用作补血剂
B.赤铁矿可用于冶炼生铁,发生的主要反应是Fe2O3+3CO2Fe+3CO2
C.泡沫灭火器中发生的反应是6NaHCO3+Al2(SO4)3=2Al(OH)3↓+6CO2↑+3Na2SO4
D.用Na2S作还原剂,除去水中的Cu2+和Hg2+
9.(本题3分)在配制0.1000 NaOH标准溶液并用其滴定未知浓度盐酸的实验过程中,不需要用到的仪器是
A. B. C. D.
10.(本题3分)工业上,利用氨气还原二氧化氮的技术已经成熟。250℃时,在1L恒容密闭容器中通入氨气和二氧化氮,发生反应: ,测得容器中压强随时间变化情况如下:
反应时间 0 10 20 30 50 60 70
总压 10 10.50 10.60 10.70 10.80 11.00 11.00
下列说法不正确的是
A.单位时间内断裂键,同时断裂键即达到平衡状态
B.在内,二氧化氮的化学反应速率是
C.达到化学平衡时,氮气的体积分数是30%
D.的活化能小于的活化能
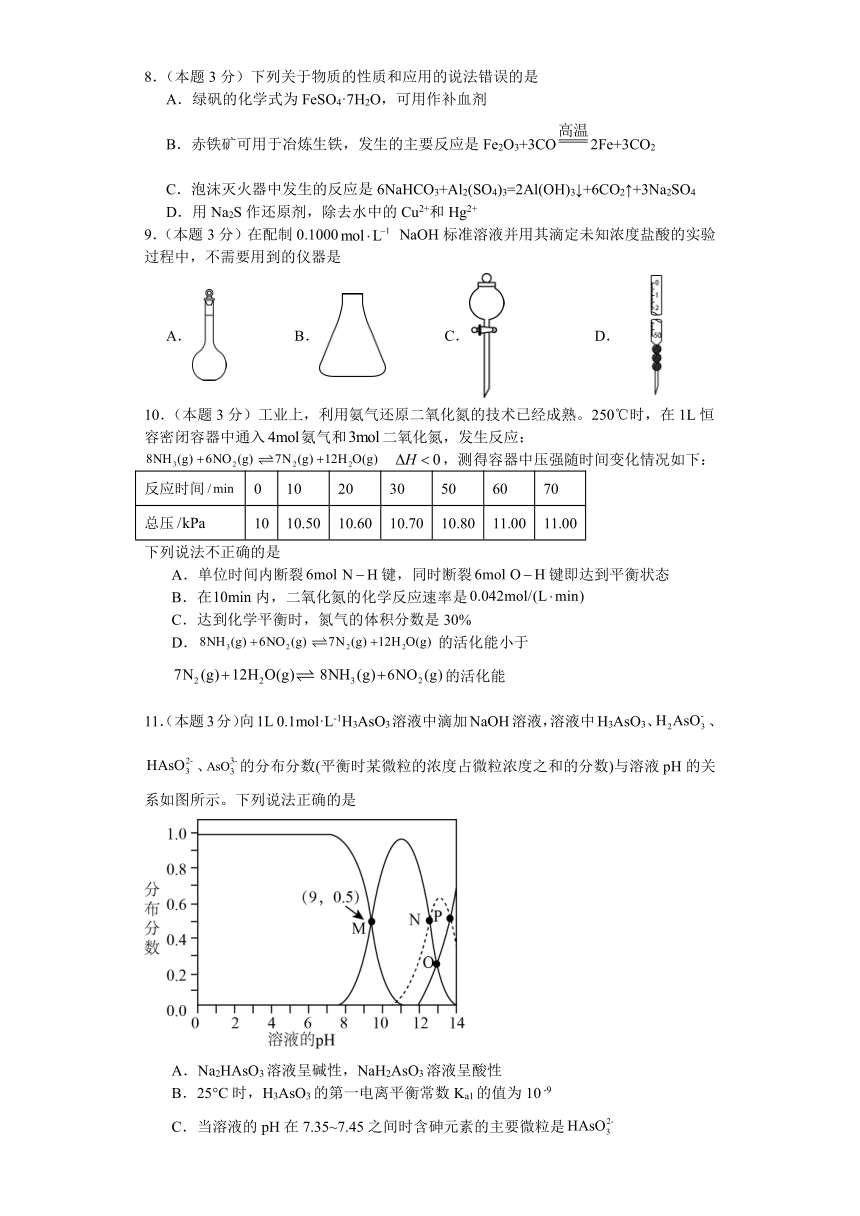
11.(本题3分)向1L 0.1mol·L-1H3AsO3溶液中滴加NaOH溶液,溶液中H3AsO3、、、的分布分数(平衡时某微粒的浓度占微粒浓度之和的分数)与溶液pH的关系如图所示。下列说法正确的是
A.Na2HAsO3溶液呈碱性,NaH2AsO3溶液呈酸性
B.25°C时,H3AsO3的第一电离平衡常数Ka1的值为10 -9
C.当溶液的pH在7.35~7.45之间时含砷元素的主要微粒是
D.N点,c(OH- )+2c( )+3c( )=c(Na+ )+c(H+)
12.(本题3分)下列物质属于弱电解质的是
A.NH3 B.H3PO4 C.NaHCO3 D.CH3CH2OH
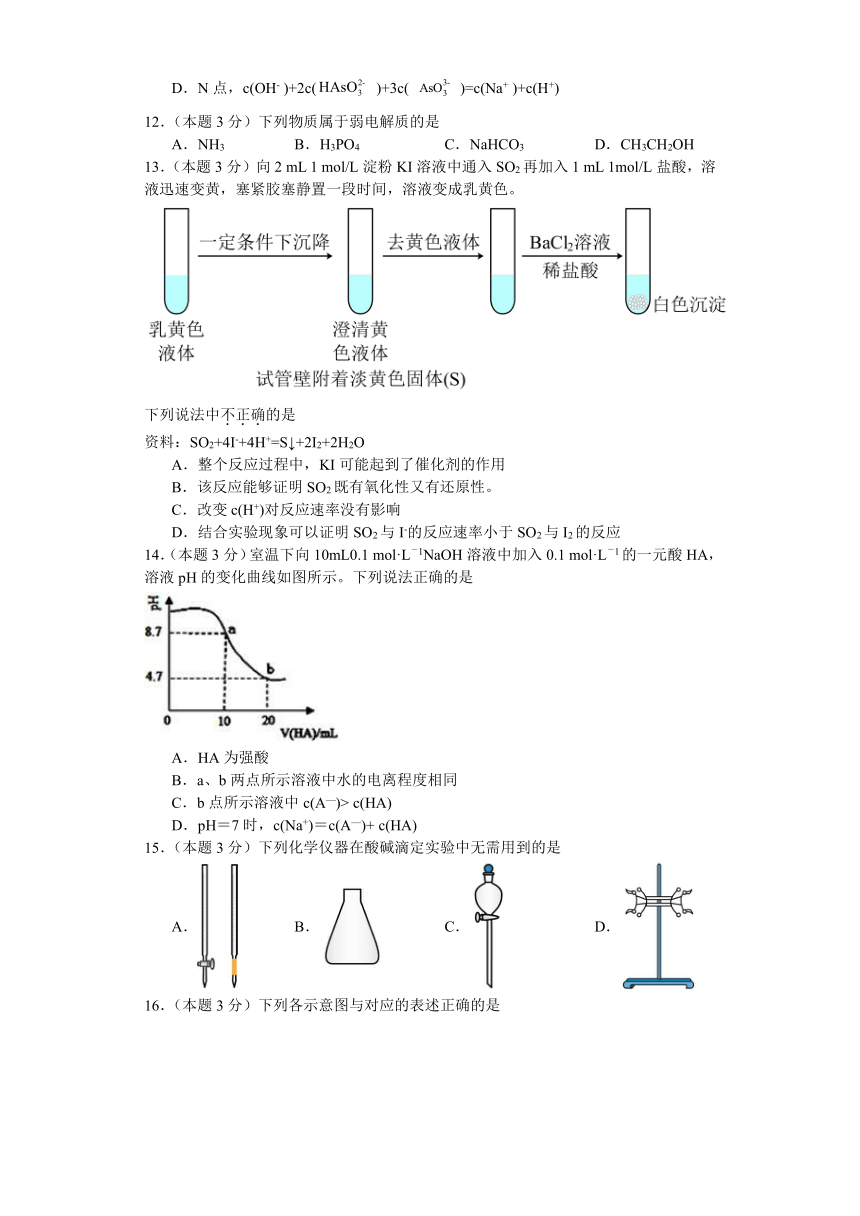
13.(本题3分)向2 mL 1 mol/L淀粉KI溶液中通入SO2再加入1 mL 1mol/L盐酸,溶液迅速变黄,塞紧胶塞静置一段时间,溶液变成乳黄色。
下列说法中不正确的是
资料:SO2+4I-+4H+=S↓+2I2+2H2O
A.整个反应过程中,KI可能起到了催化剂的作用
B.该反应能够证明SO2既有氧化性又有还原性。
C.改变c(H+)对反应速率没有影响
D.结合实验现象可以证明SO2与I-的反应速率小于SO2与I2的反应
14.(本题3分)室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
A.HA为强酸
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A—)> c(HA)
D.pH=7时,c(Na+)=c(A—)+ c(HA)
15.(本题3分)下列化学仪器在酸碱滴定实验中无需用到的是
A. B. C. D.
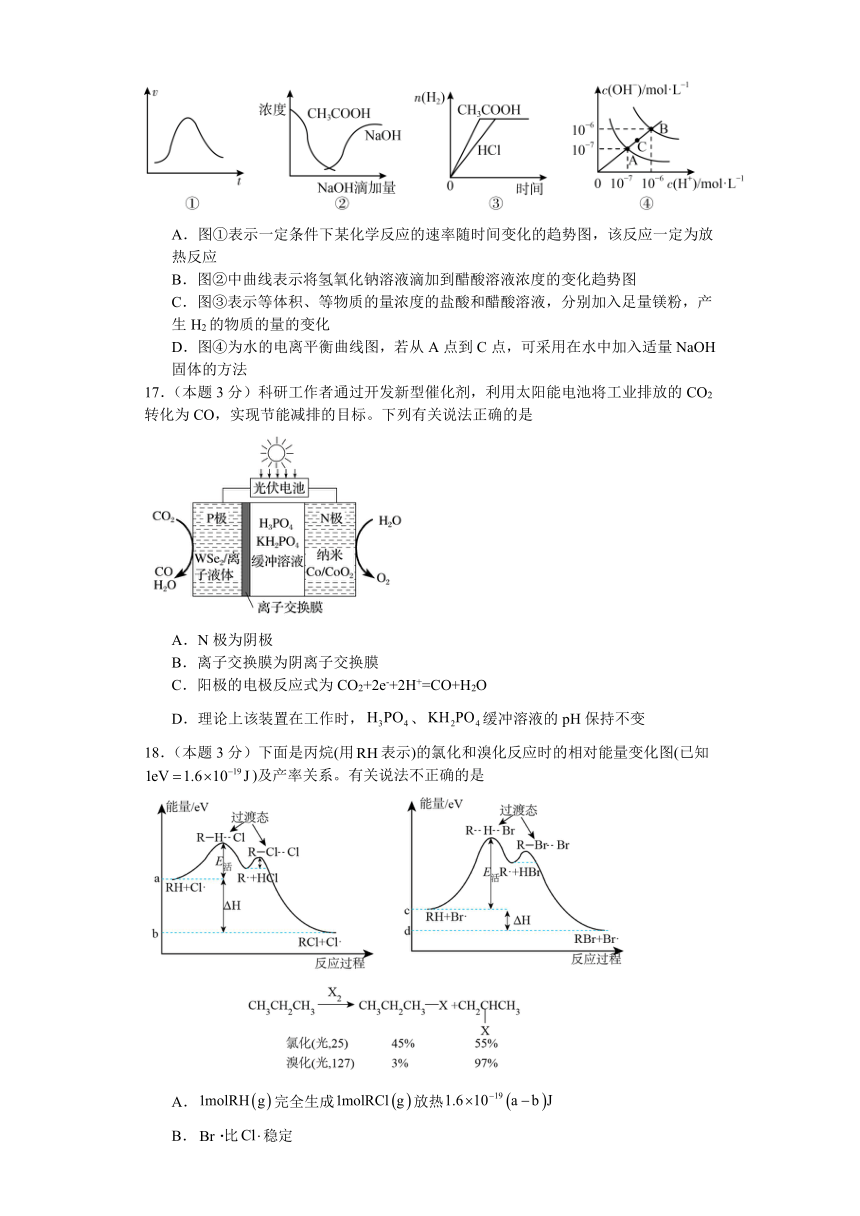
16.(本题3分)下列各示意图与对应的表述正确的是
A.图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应
B.图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图
C.图③表示等体积、等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁粉,产生H2的物质的量的变化
D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
17.(本题3分)科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为CO,实现节能减排的目标。下列有关说法正确的是
A.N极为阴极
B.离子交换膜为阴离子交换膜
C.阳极的电极反应式为CO2+2e-+2H+=CO+H2O
D.理论上该装置在工作时,、缓冲溶液的pH保持不变
18.(本题3分)下面是丙烷(用表示)的氯化和溴化反应时的相对能量变化图(已知)及产率关系。有关说法不正确的是
A.完全生成放热
B.比稳定
C.以丙烷、卤素、氢氧化钠溶液为原料制备2-丙醇,优于
D.溴代和氯代第一步都是决速反应
二、非选择题(本大题共5小题,共46分)
19.电镀污泥是指电镀废水处理后产生的污泥和镀槽淤泥,被列入国家危险废物名录,属于第十七类危险废物。电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收得到Na2Cr2O7等物质。
已知:①水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
②不同钠盐在不同温度下的溶解度(g)如下表
20℃ 60℃ 100℃
Na2SO4 19.5 45.3 42.5
Na2Cr2O7 183 269 415
Na2CrO4 84 115 126
(1)水浸后的溶液呈 性(“酸”、“碱”、“中”)。(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
Cr(OH)3+____Na2CO3+_____ = ____Na2CrO4+___CO2+_____
(3)滤渣II的主要成分有Zn(OH)2、 。
(4)“系列操作”中为:继续加入H2SO4, (填操作方法),过滤。继续加入H2SO4目的是 (结合平衡移动的原理予以说明)。
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式 。
20.金属镁及其化合物在科学研究及生产中具有广泛的用途。
(1)镁能在氧气、空气、氮气或二氧化碳中燃烧。
①点燃条件下,单质镁能与CO2发生置换反应并产生大量的热,反应的化学方程式为 。
②在空气中燃烧会发出眼的自光,将燃烧产物X置于60℃的热水中并充分搅拌,最终得到白色固体,同时有能使湿润的红色石蕊试纸变蓝色的气体生成。则产物X中除MgO外,还肯定含有的物质是 (填化学式)。
(2)镁一过氧化氢电池具有能量高、安全方便等优点,可用于驱动无人驾驶的潜航器。某种镁一过氧化氢电池以海水为电解质溶液,其工作原理如右图所示(已知:氢氧化镁难溶于水)。
正极的电极反应式为 ,隔膜应选择 (填“阳”或“阴”)离子膜。
(3)轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]在化工生产上有广泛的用途。以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备它的工艺流程如下:
常温下,Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH:
Fe3+ Fe2+ Mg2+
开始沉淀时的pH 2.7 7.6 9.9
完全沉淀时的pH 3.7 9.6 11
[注:Fe(OH)2沉淀呈絮状,不易从溶液中除去]。
①写出一条能提高酸浸速率的措施: 。
②“氧化”过程中,参加反应的氧化剂与还原剂的物质的量之比为 。
③加入NaOH溶液调节pH,通常控制pH在9.0左右,其目的是 。
④热解时,反应的离子方程式为 。
⑤操作I、Ⅱ均是将固体与液体分离,但在对分离后所得固体的操作上有明显差异,差异是 。
21.合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 。其中氮元素原子最外层电子排布的轨道表达式是 。通过比较 可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是 。CS2熔点高于CO2,其原因是 。
22.水中的溶解氧是水生生物生存不可缺少的条件,某课外小组采用碘量法测定学校周边河水中的溶解氧,实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I 还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2+I2=2I +)。
回答下列问题:
(1)氧的固定”中发生反应的化学方程式为 。
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、胶头滴管、试剂瓶和 ,配制溶液定容时俯视会导致Na2S2O3溶液的浓度 ,(填“偏高”或“偏低”)蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除 及二氧化碳。
(3)取100.00 mL水样经固氧、酸化后,用0.5 mol·L 1Na2S2O3溶液滴定,以 作指示剂,如何判断该反应到达终点 ;若反应中消耗Na2S2O3溶液的体积为10 mL,则水样中溶解氧的含量为 mg·L 1。
(4)上述滴定完成时,若滴定前平视,滴定后仰视会导致测量结果 。(填“偏高”或“偏低”)
23.根据下图所示的关系填空,已知A为FeS2固体,C的焰色反应火焰呈黄色,其中①、③是硫酸工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,F是红棕色固体。
(1)物质X的化学式是 。
(2)化合物B中所包含的化学键有 和 。
(3)反应④的离子方程式为 。
反应②的化学方程式为 ,其中还原剂是 。
(4)已知每生成16克E,放出106.5KJ的热量,则反应①的热化学反应方程式为 。(相对原子质量:Fe-56 S-3 O-16)
株洲十三中高二化学参考答案
1.D
2.D
3.D
4.D
5.C
6.A
7.D
8.D
9.C
10.C
11.B
12.B
13.C
14.C
15.C
16.B
17.D
18.A
19. 碱性 4Cr(OH)3+4Na2CO3+3O2=4Na2CrO4+4CO2+6H2O Al(OH)3 蒸发浓缩、趁热过滤、冷却结晶 促进平衡2CrO42ˉ+2H+Cr2O72ˉ+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7 CrO42ˉ+8H++6eˉ=Cr+4H2O或Cr2O72ˉ+14H++12 eˉ=2Cr+7H2O
20. 2Mg+CO22MgO+C Mg3N2 H2O2+2e-=2OH- 阳 将卤块粉碎(或加热、搅拌、适当增大盐酸浓度等) 1∶2 将溶液中的Fe3+尽可能多地除去,同时避免Mg2+形成沉淀 2Mg2++4HCO3-+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑ 操作Ⅱ过滤后所得固体为产品,还必须对产品进行洗涤、干燥
21. bc 2NH3+CO2+H2O=(NH4)2CO3 (NH4)2CO3+CO2+H2O=2NH4HCO3 ①低温加压下吸收CO②然后将铜液洗涤转移至另一容器中③高温低压下释放CO,然后将铜洗液循环利用 C>N>O>H NH3和PH3的稳定性 CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大
22.(1)
(2) 容量瓶和玻璃棒 偏高 氧气
(3) 淀粉溶液 当滴加最后一滴Na2S2O3溶液时蓝色刚好褪去,且半分钟内不变色 400
(4)偏高
23.(1)H2O
(2) 非极性键 离子键
(3) Fe2O3+6H+=2Fe3++3H2O 2Na2O2+2H2O=4NaOH+O2↑ Na2O2
(4)4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) ΔH= -3408kJ/mol
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(本大题共 18小题,每小题3分,共 54分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.(本题3分)铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法不正确的是
A.该过程的总反应为HCOOHCO2↑+H2↑
B.H+浓度过大或者过小,均导致反应速率降低
C.该历程中反应速率最慢的一步:
D.该催化循环中Fe元素的化合价发生了变化
2.(本题3分)氨氮废水的处置一直是工业难题,最近我国科学家开发了如下电解装置可将其氧化去除。处理前先调节废水pH=12,通电后可将其转化为无害气体,已知装置中A、B电极均为惰性电极,下列分析错误的是
A.电极A应与外电源正极相连
B.处理废水过程中A电极附近pH降低
C.OH-从电极B向电极A定向移动
D.N2与H2的体积比为3:1
3.(本题3分)室温下,向体积均为20mL,浓度均为0.1mol/L的HX溶液和HY溶液中分别滴加0.1mol/L的NaOH溶液,反应后溶液中水电离的c水(OH-)的负对数[-lgc水(OH-)]与滴加氢氧化钠溶液体积的关系如下表。下列说法不正确的是
0 a 20 b
HX 11 7 <7 7
HY x >7 7 >7
注:a<20
B.10
D.加入20mLNaOH溶液时,两溶液的离子总浓度相等
4.(本题3分)常温下,三种金属硫化物XS、YS、ZS的饱和溶液中pM[pM= -lgc(M2+)]与pS[pS= -lgc(S2-)]的关系如图所示。已知:Ksp(XS) > Ksp(YS) > Ksp (ZS)。
下列叙述正确的是
A.直线③代表ZS
B.Ksp (XS) =1 ×10-36
C.向c点饱和溶液中加少量Na2S,c点向b点迁移
D.YS(s) +Z2+(aq) ZS(s) +Y2+ (aq) K=1 ×108
5.(本题3分)我国建成全球首套千吨级液态太阳燃料合成示范装置,其原理如图所示。下列说法不正确的是
A.太阳能在此过程中主要转化为电能和化学能
B.反应Ⅰ和反应Ⅱ都属于氧化还原反应
C.中存在的化学键有:离子键、共价键、氢键
D.该过程产生的氢气和甲醇都可作为燃料电池燃料
6.(本题3分)能促进水的电离,并使溶液中c(H+)>c(OH)的操作是
(1) 将水加热煮沸 (2) 向水中投入一小块金属钠 (3) 向水中通HCl (4) 向水中加入明矾晶体 (5)向水中加入NaHCO3固体 (6)向水中加KHSO4固体
A.(4) B.(1)(4)(6) C.(1)(3)(6) D.(4)(6)
7.(本题3分)是二元弱酸,常温下向溶液中滴入0.1000mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。已知,下列说法正确的是
A.常温下,溶液中
B.常温下,的一级电离常数Ka1约为
C.与足量的NaOH溶液反应的化学方程式为
D.a点溶液中存在
8.(本题3分)下列关于物质的性质和应用的说法错误的是
A.绿矾的化学式为FeSO4·7H2O,可用作补血剂
B.赤铁矿可用于冶炼生铁,发生的主要反应是Fe2O3+3CO2Fe+3CO2
C.泡沫灭火器中发生的反应是6NaHCO3+Al2(SO4)3=2Al(OH)3↓+6CO2↑+3Na2SO4
D.用Na2S作还原剂,除去水中的Cu2+和Hg2+
9.(本题3分)在配制0.1000 NaOH标准溶液并用其滴定未知浓度盐酸的实验过程中,不需要用到的仪器是
A. B. C. D.
10.(本题3分)工业上,利用氨气还原二氧化氮的技术已经成熟。250℃时,在1L恒容密闭容器中通入氨气和二氧化氮,发生反应: ,测得容器中压强随时间变化情况如下:
反应时间 0 10 20 30 50 60 70
总压 10 10.50 10.60 10.70 10.80 11.00 11.00
下列说法不正确的是
A.单位时间内断裂键,同时断裂键即达到平衡状态
B.在内,二氧化氮的化学反应速率是
C.达到化学平衡时,氮气的体积分数是30%
D.的活化能小于的活化能
11.(本题3分)向1L 0.1mol·L-1H3AsO3溶液中滴加NaOH溶液,溶液中H3AsO3、、、的分布分数(平衡时某微粒的浓度占微粒浓度之和的分数)与溶液pH的关系如图所示。下列说法正确的是
A.Na2HAsO3溶液呈碱性,NaH2AsO3溶液呈酸性
B.25°C时,H3AsO3的第一电离平衡常数Ka1的值为10 -9
C.当溶液的pH在7.35~7.45之间时含砷元素的主要微粒是
D.N点,c(OH- )+2c( )+3c( )=c(Na+ )+c(H+)
12.(本题3分)下列物质属于弱电解质的是
A.NH3 B.H3PO4 C.NaHCO3 D.CH3CH2OH
13.(本题3分)向2 mL 1 mol/L淀粉KI溶液中通入SO2再加入1 mL 1mol/L盐酸,溶液迅速变黄,塞紧胶塞静置一段时间,溶液变成乳黄色。
下列说法中不正确的是
资料:SO2+4I-+4H+=S↓+2I2+2H2O
A.整个反应过程中,KI可能起到了催化剂的作用
B.该反应能够证明SO2既有氧化性又有还原性。
C.改变c(H+)对反应速率没有影响
D.结合实验现象可以证明SO2与I-的反应速率小于SO2与I2的反应
14.(本题3分)室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
A.HA为强酸
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A—)> c(HA)
D.pH=7时,c(Na+)=c(A—)+ c(HA)
15.(本题3分)下列化学仪器在酸碱滴定实验中无需用到的是
A. B. C. D.
16.(本题3分)下列各示意图与对应的表述正确的是
A.图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应
B.图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图
C.图③表示等体积、等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁粉,产生H2的物质的量的变化
D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
17.(本题3分)科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为CO,实现节能减排的目标。下列有关说法正确的是
A.N极为阴极
B.离子交换膜为阴离子交换膜
C.阳极的电极反应式为CO2+2e-+2H+=CO+H2O
D.理论上该装置在工作时,、缓冲溶液的pH保持不变
18.(本题3分)下面是丙烷(用表示)的氯化和溴化反应时的相对能量变化图(已知)及产率关系。有关说法不正确的是
A.完全生成放热
B.比稳定
C.以丙烷、卤素、氢氧化钠溶液为原料制备2-丙醇,优于
D.溴代和氯代第一步都是决速反应
二、非选择题(本大题共5小题,共46分)
19.电镀污泥是指电镀废水处理后产生的污泥和镀槽淤泥,被列入国家危险废物名录,属于第十七类危险废物。电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收得到Na2Cr2O7等物质。
已知:①水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
②不同钠盐在不同温度下的溶解度(g)如下表
20℃ 60℃ 100℃
Na2SO4 19.5 45.3 42.5
Na2Cr2O7 183 269 415
Na2CrO4 84 115 126
(1)水浸后的溶液呈 性(“酸”、“碱”、“中”)。(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
Cr(OH)3+____Na2CO3+_____ = ____Na2CrO4+___CO2+_____
(3)滤渣II的主要成分有Zn(OH)2、 。
(4)“系列操作”中为:继续加入H2SO4, (填操作方法),过滤。继续加入H2SO4目的是 (结合平衡移动的原理予以说明)。
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式 。
20.金属镁及其化合物在科学研究及生产中具有广泛的用途。
(1)镁能在氧气、空气、氮气或二氧化碳中燃烧。
①点燃条件下,单质镁能与CO2发生置换反应并产生大量的热,反应的化学方程式为 。
②在空气中燃烧会发出眼的自光,将燃烧产物X置于60℃的热水中并充分搅拌,最终得到白色固体,同时有能使湿润的红色石蕊试纸变蓝色的气体生成。则产物X中除MgO外,还肯定含有的物质是 (填化学式)。
(2)镁一过氧化氢电池具有能量高、安全方便等优点,可用于驱动无人驾驶的潜航器。某种镁一过氧化氢电池以海水为电解质溶液,其工作原理如右图所示(已知:氢氧化镁难溶于水)。
正极的电极反应式为 ,隔膜应选择 (填“阳”或“阴”)离子膜。
(3)轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]在化工生产上有广泛的用途。以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备它的工艺流程如下:
常温下,Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH:
Fe3+ Fe2+ Mg2+
开始沉淀时的pH 2.7 7.6 9.9
完全沉淀时的pH 3.7 9.6 11
[注:Fe(OH)2沉淀呈絮状,不易从溶液中除去]。
①写出一条能提高酸浸速率的措施: 。
②“氧化”过程中,参加反应的氧化剂与还原剂的物质的量之比为 。
③加入NaOH溶液调节pH,通常控制pH在9.0左右,其目的是 。
④热解时,反应的离子方程式为 。
⑤操作I、Ⅱ均是将固体与液体分离,但在对分离后所得固体的操作上有明显差异,差异是 。
21.合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 。其中氮元素原子最外层电子排布的轨道表达式是 。通过比较 可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是 。CS2熔点高于CO2,其原因是 。
22.水中的溶解氧是水生生物生存不可缺少的条件,某课外小组采用碘量法测定学校周边河水中的溶解氧,实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I 还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2+I2=2I +)。
回答下列问题:
(1)氧的固定”中发生反应的化学方程式为 。
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、胶头滴管、试剂瓶和 ,配制溶液定容时俯视会导致Na2S2O3溶液的浓度 ,(填“偏高”或“偏低”)蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除 及二氧化碳。
(3)取100.00 mL水样经固氧、酸化后,用0.5 mol·L 1Na2S2O3溶液滴定,以 作指示剂,如何判断该反应到达终点 ;若反应中消耗Na2S2O3溶液的体积为10 mL,则水样中溶解氧的含量为 mg·L 1。
(4)上述滴定完成时,若滴定前平视,滴定后仰视会导致测量结果 。(填“偏高”或“偏低”)
23.根据下图所示的关系填空,已知A为FeS2固体,C的焰色反应火焰呈黄色,其中①、③是硫酸工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,F是红棕色固体。
(1)物质X的化学式是 。
(2)化合物B中所包含的化学键有 和 。
(3)反应④的离子方程式为 。
反应②的化学方程式为 ,其中还原剂是 。
(4)已知每生成16克E,放出106.5KJ的热量,则反应①的热化学反应方程式为 。(相对原子质量:Fe-56 S-3 O-16)
株洲十三中高二化学参考答案
1.D
2.D
3.D
4.D
5.C
6.A
7.D
8.D
9.C
10.C
11.B
12.B
13.C
14.C
15.C
16.B
17.D
18.A
19. 碱性 4Cr(OH)3+4Na2CO3+3O2=4Na2CrO4+4CO2+6H2O Al(OH)3 蒸发浓缩、趁热过滤、冷却结晶 促进平衡2CrO42ˉ+2H+Cr2O72ˉ+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7 CrO42ˉ+8H++6eˉ=Cr+4H2O或Cr2O72ˉ+14H++12 eˉ=2Cr+7H2O
20. 2Mg+CO22MgO+C Mg3N2 H2O2+2e-=2OH- 阳 将卤块粉碎(或加热、搅拌、适当增大盐酸浓度等) 1∶2 将溶液中的Fe3+尽可能多地除去,同时避免Mg2+形成沉淀 2Mg2++4HCO3-+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑ 操作Ⅱ过滤后所得固体为产品,还必须对产品进行洗涤、干燥
21. bc 2NH3+CO2+H2O=(NH4)2CO3 (NH4)2CO3+CO2+H2O=2NH4HCO3 ①低温加压下吸收CO②然后将铜液洗涤转移至另一容器中③高温低压下释放CO,然后将铜洗液循环利用 C>N>O>H NH3和PH3的稳定性 CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大
22.(1)
(2) 容量瓶和玻璃棒 偏高 氧气
(3) 淀粉溶液 当滴加最后一滴Na2S2O3溶液时蓝色刚好褪去,且半分钟内不变色 400
(4)偏高
23.(1)H2O
(2) 非极性键 离子键
(3) Fe2O3+6H+=2Fe3++3H2O 2Na2O2+2H2O=4NaOH+O2↑ Na2O2
(4)4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) ΔH= -3408kJ/mol
同课章节目录
