氧化还原反应课件(共20张PPT)
文档属性
| 名称 | 氧化还原反应课件(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-07 10:28:28 | ||
图片预览






文档简介
(共20张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第1课时
观察·思考 生活处处有化学------
观察·思考 生活处处有化学------
观察·思考 生活处处有化学------
苹果“锈”了?
氧化
观察·思考 生活处处有化学------
铁锁锈了?
氧化
Fe Fe2O3
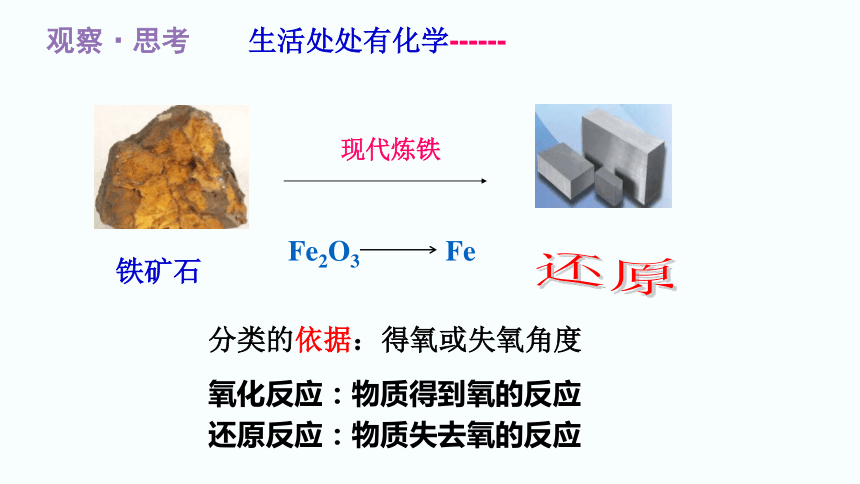
观察·思考 生活处处有化学------
现代炼铁
铁矿石
Fe2O3 Fe
还原
分类的依据:得氧或失氧角度
氧化反应:物质得到氧的反应
还原反应:物质失去氧的反应
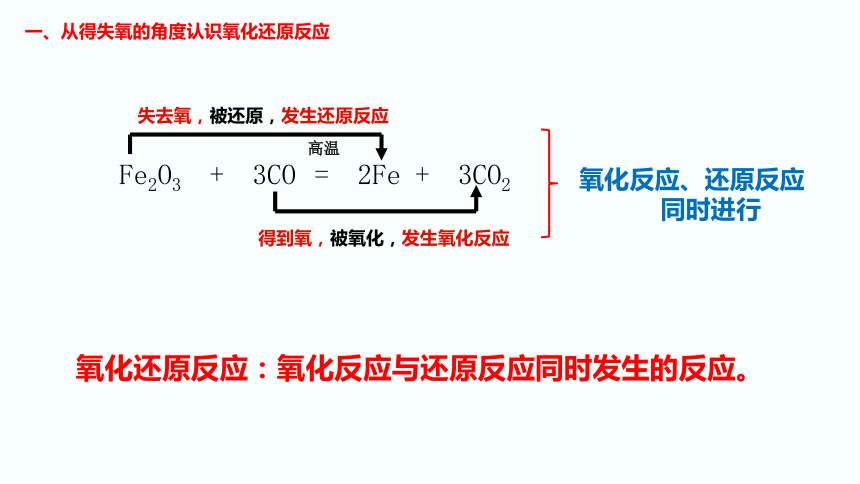
一、从得失氧的角度认识氧化还原反应
Fe2O3 + 3CO = 2Fe + 3CO2
高温
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
氧化反应、还原反应
同时进行
氧化还原反应:氧化反应与还原反应同时发生的反应。
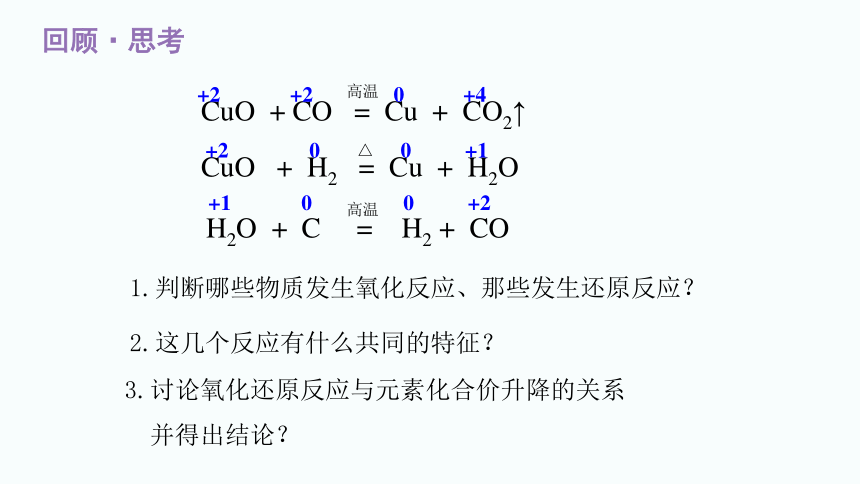
回顾·思考
完成下列反应的方程式,并思考问题?
(1)一氧化碳还原氧化铜
(2)氢气还原氧化铜
(3)碳与水高温下的反应
高温
△
高温
回顾·思考
CuO + CO = Cu + CO2↑
CuO + H2 = Cu + H2O
H2O + C = H2 + CO
1.判断哪些物质发生氧化反应、那些发生还原反应?
2.这几个反应有什么共同的特征?
3.讨论氧化还原反应与元素化合价升降的关系
并得出结论?
+2 +2 0 +4
+2 0 0 +1
+1 0 0 +2
二、从化合价角度认识氧化还原反应
+2
+2
0
+4
化合价升高,氧化反应
化合价降低,还原反应
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:凡是有元素化合价升降的化学反应
【氧化还原反应判断依据】
是否有元素化合价的升降(特征)
MnO2
△
高温
随堂练习
判断以下反应属于四大基本反应的哪个反应类型,并判断是否为氧化还原反应?
① Fe+CuSO4=FeSO4+Cu
② 2H2 + O2
③ CaO+H2O = Ca(OH)2
④ 2KClO3 = 2KCl+3O2↑
⑤ CaCO3 = CaO + CO2↑
⑥ Na2CO3+2HCl = 2NaCl+ H2O + CO2↑
四大基本反应类型
是否属于
氧化还原反应
置换
化合
化合
分解
分解
复分解
√
√
×
√
×
×
判断方法:
是否有元素
化合价的升降(特征)
尝试画出四大基本反应类型与氧化还原反应的交叉分类示意图:
随堂练习
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
分解反应
三、认识氧化还原反应的实质
为什么会有元素化合价的升降?
三、认识氧化还原反应的本质
①对于金属与非金属的反应:
2Na + Cl2 = 2NaCl
点燃
0
0
+1
-1
失2xe-,化合价升高,发生氧化反应
得2xe-,化合价降低,发生还原反应
电子的得失
三、认识氧化还原反应的实质
②对于非金属与非金属的反应:
H2 + Cl2 = 2HCl
点燃
H
Cl
+1
+17
+17
+1
HCl
H Cl
H Cl
+1 -1
电子对偏离,化合价升高,发生氧化反应
电子对偏向,化合价降低,发生还原反应
共用电子对的偏移
三、认识氧化还原反应的实质
从电子转移的角度(实质)
氧化反应:
失去电子或电子对偏离的反应
还原反应:
得到电子或电子对偏向的反应
氧化还原反应:
有电子转移(得失或偏移)的反应
归纳总结
化合价升高--失去电子--氧化反应
化合价降低--得到电子--还原反应
特 征
本质
随堂练习
1.下列类型的反应中,元素化合价一定发生变化的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
随堂练习
2、反应2NO+2CO==N2+2CO2可应用于汽车尾气的净化。下列判断中正确的是( )
A.该反应是置换反应
B.该反应是复分解反应
C.CO是氧化剂
D.NO发生还原反应
D
3、当化合物中的元素被转化成单质中的元素时,该元素 ( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.化合价降低为零
随堂练习
C
第一章 物质及其变化
第三节 氧化还原反应
第1课时
观察·思考 生活处处有化学------
观察·思考 生活处处有化学------
观察·思考 生活处处有化学------
苹果“锈”了?
氧化
观察·思考 生活处处有化学------
铁锁锈了?
氧化
Fe Fe2O3
观察·思考 生活处处有化学------
现代炼铁
铁矿石
Fe2O3 Fe
还原
分类的依据:得氧或失氧角度
氧化反应:物质得到氧的反应
还原反应:物质失去氧的反应
一、从得失氧的角度认识氧化还原反应
Fe2O3 + 3CO = 2Fe + 3CO2
高温
失去氧,被还原,发生还原反应
得到氧,被氧化,发生氧化反应
氧化反应、还原反应
同时进行
氧化还原反应:氧化反应与还原反应同时发生的反应。
回顾·思考
完成下列反应的方程式,并思考问题?
(1)一氧化碳还原氧化铜
(2)氢气还原氧化铜
(3)碳与水高温下的反应
高温
△
高温
回顾·思考
CuO + CO = Cu + CO2↑
CuO + H2 = Cu + H2O
H2O + C = H2 + CO
1.判断哪些物质发生氧化反应、那些发生还原反应?
2.这几个反应有什么共同的特征?
3.讨论氧化还原反应与元素化合价升降的关系
并得出结论?
+2 +2 0 +4
+2 0 0 +1
+1 0 0 +2
二、从化合价角度认识氧化还原反应
+2
+2
0
+4
化合价升高,氧化反应
化合价降低,还原反应
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:凡是有元素化合价升降的化学反应
【氧化还原反应判断依据】
是否有元素化合价的升降(特征)
MnO2
△
高温
随堂练习
判断以下反应属于四大基本反应的哪个反应类型,并判断是否为氧化还原反应?
① Fe+CuSO4=FeSO4+Cu
② 2H2 + O2
③ CaO+H2O = Ca(OH)2
④ 2KClO3 = 2KCl+3O2↑
⑤ CaCO3 = CaO + CO2↑
⑥ Na2CO3+2HCl = 2NaCl+ H2O + CO2↑
四大基本反应类型
是否属于
氧化还原反应
置换
化合
化合
分解
分解
复分解
√
√
×
√
×
×
判断方法:
是否有元素
化合价的升降(特征)
尝试画出四大基本反应类型与氧化还原反应的交叉分类示意图:
随堂练习
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
分解反应
三、认识氧化还原反应的实质
为什么会有元素化合价的升降?
三、认识氧化还原反应的本质
①对于金属与非金属的反应:
2Na + Cl2 = 2NaCl
点燃
0
0
+1
-1
失2xe-,化合价升高,发生氧化反应
得2xe-,化合价降低,发生还原反应
电子的得失
三、认识氧化还原反应的实质
②对于非金属与非金属的反应:
H2 + Cl2 = 2HCl
点燃
H
Cl
+1
+17
+17
+1
HCl
H Cl
H Cl
+1 -1
电子对偏离,化合价升高,发生氧化反应
电子对偏向,化合价降低,发生还原反应
共用电子对的偏移
三、认识氧化还原反应的实质
从电子转移的角度(实质)
氧化反应:
失去电子或电子对偏离的反应
还原反应:
得到电子或电子对偏向的反应
氧化还原反应:
有电子转移(得失或偏移)的反应
归纳总结
化合价升高--失去电子--氧化反应
化合价降低--得到电子--还原反应
特 征
本质
随堂练习
1.下列类型的反应中,元素化合价一定发生变化的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
随堂练习
2、反应2NO+2CO==N2+2CO2可应用于汽车尾气的净化。下列判断中正确的是( )
A.该反应是置换反应
B.该反应是复分解反应
C.CO是氧化剂
D.NO发生还原反应
D
3、当化合物中的元素被转化成单质中的元素时,该元素 ( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.化合价降低为零
随堂练习
C
