山东省青岛市第二中学2023-2024学年高二上学期1月期末化学试题(含答案)
文档属性
| 名称 | 山东省青岛市第二中学2023-2024学年高二上学期1月期末化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-09 08:56:43 | ||
图片预览




文档简介
青岛二中2023-2024学年第一学期期末考试
高二试题(化学)
(时间:90分钟 分值:100分)
可能用到的相对原子质量:
1.答卷前,考生将自己的姓名、班级、座号、考号等填写在答题卡的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动用橡皮擦干净后再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。
3.考试结束后,只将答题卡交回。
第I卷(共40分)
一、选择题(每题只有一个正确选项。每题2分,共20分)
1.下列说法正确的有几个( )
①最外层电子数为的元素都在元素周期表的第2列
②分子中一定存在键,不一定存在键
③、、中碳碳键键长相同
④基态原子的价电子排布为的元素,其族序数一定为
⑤核外电子跃迁过程中形城了发射光谱
⑥与空间结构为V形且中心原子均为杂化
A.0个 B.1个 C.2个 D.3个
2.已知W、X、Y、Z均为短周期元素,常温下它们的最高价氧化物对应的水化物溶液(浓度均为)的和原子半径、原子序数的关系如图所示。下列说法正确的是( )
A.电负性: B.简单气态氢化物的热稳定性:
C.离子半径: D.化合物中含有极性共价键和非极性共价键
3.下列两组命题中,M组命题能用N组命题加以解释的是( )
选项 M组 N组
A 的稳定性大于 的分子间作用力更大
B 的沸点高于 因为分子间范德华力更大
C 金属具有导热性 当金属中存在温度差时,“自由电子”碰撞金属阳离子将能量进行传递
D 过氧化氢分子是极性分子 过氧化氢分子中只含有极性键
A.A B.B C.C D.D
4.下列各组离子在指定溶液中一定能大量共存的是( )
①无色溶液中:
②的溶液中:
③加入能放出的溶液中:
④由水电离出的的溶液中:
⑤有较多的溶液中:
⑥酸性溶液中:
A.①② B.③⑥ C.②④ D.③⑤
5.许多过渡金属离子能形成种类繁多的配合物。下列说法正确的是( )
A.二乙二胺合铜配离子的结构如图所示,可知的价电子排布式为,配位数为4,配体数也为4
B.配合物中含有配位键
C.配合物中的的配位原子是C
D.配合物中心离子为,该配合物与溶液作用,生成
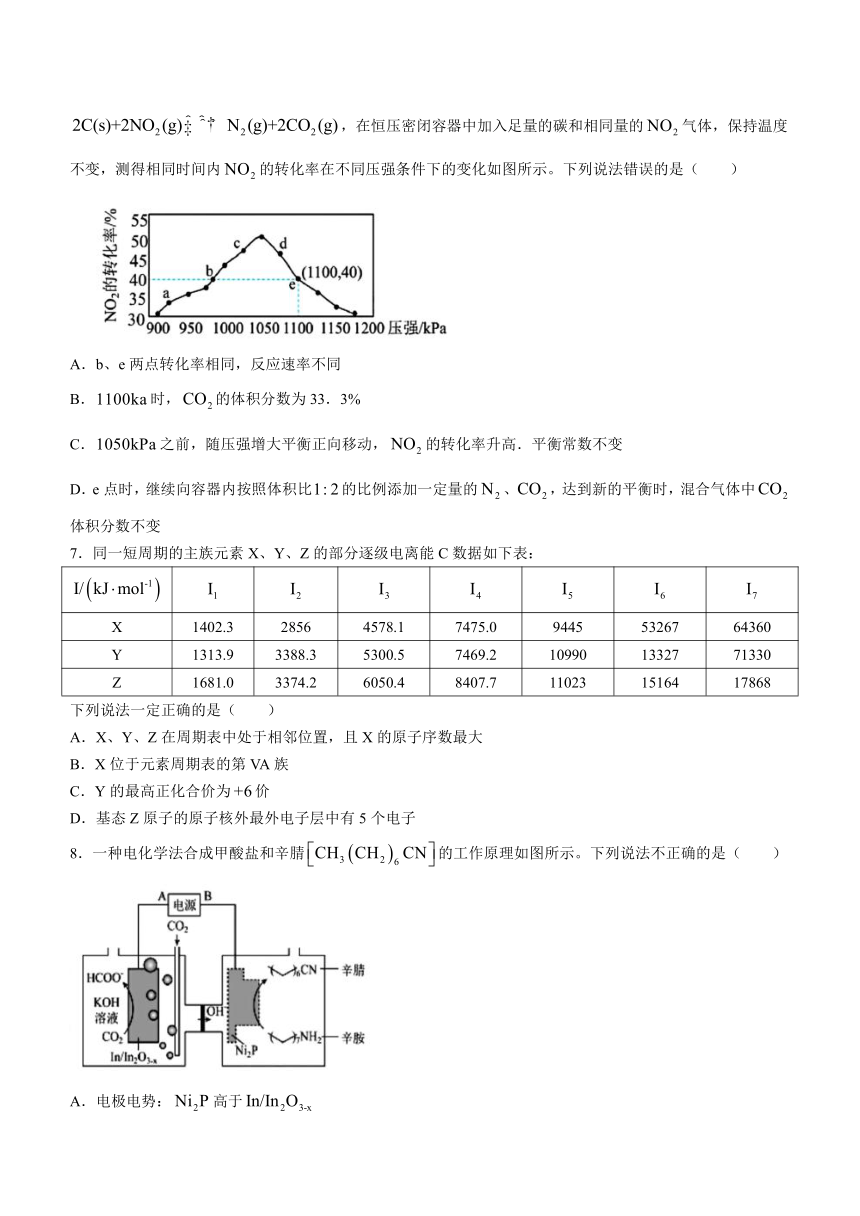
6.已知汽油车尾气的治理中可以用碳在催化剂的条件下还原,实验室模拟该反应,在恒压密闭容器中加入足量的碳和相同量的气体,保持温度不变,测得相同时间内的转化率在不同压强条件下的变化如图所示。下列说法错误的是( )
A.b、e两点转化率相同,反应速率不同
B.时,的体积分数为33.3%
C.之前,随压强增大平衡正向移动,的转化率升高.平衡常数不变
D.e点时,继续向容器内按照体积比的比例添加一定量的、,达到新的平衡时,混合气体中体积分数不变
7.同一短周期的主族元素X、Y、Z的部分逐级电离能C数据如下表:
X 1402.3 2856 4578.1 7475.0 9445 53267 64360
Y 1313.9 3388.3 5300.5 7469.2 10990 13327 71330
Z 1681.0 3374.2 6050.4 8407.7 11023 15164 17868
下列说法一定正确的是( )
A.X、Y、Z在周期表中处于相邻位置,且X的原子序数最大
B.X位于元素周期表的第VA族
C.Y的最高正化合价为价
D.基态Z原子的原子核外最外电子层中有5个电子
8.一种电化学法合成甲酸盐和辛腈的工作原理如图所示。下列说法不正确的是( )
A.电极电势:高于
B.电解一段时间后,阴极区溶液增大
C.电极的电极方程式:
D.标准状况下,参与反应时,电极有辛腈生成
9.常温下,用溶液分别滴定浓度均为溶液和溶液,所得滴定曲线如图所示(其中的滴定曲线部分未画出)。下列说法错误的是( )
已知:M点溶液中,
A.
B.P点溶液中溶质为和,由水电离出的
C.M点溶液中,
D.等体积等浓度的溶液和溶液混合后的溶液中:
10.和(砖红色都是难溶电解质,常温下以对和作图的沉淀平衡曲线如图所示。下列说法正确的是( )
A.阴影区域和都沉淀
B.
C.向含有的溶液中加入,白色固体逐渐变为砖红色
D.用硝酸银标准液滴定溶液中的,作指行剂的浓度在左右时滴定误差很大
二、不定项选择题(每题有1-2个正确选项。每题4分,共20分)
11.M、N、Z、Y、X、T是原子半径依次增大的前10号元素,基态N原子核外电子有5种空间运动状态,并有1个单电子,这六种元素形成的一种化合物结构如图所示。
A.与Z同周期且第一电离能大于Z的元素有2种
B.该化合物中只含有离子键、共价键,不存在配位键
C.六种元素中,X的最高价含氧酸的酸性最强
D.最简单氢,化物的沸点为
12.下列装置可分离废水中的和。已知和性质相似,和乙酰丙酮不反应。下列说法正确的是( )
A.M电极接太阳能电池的P电极
B.通电一段时间后,I、IV室内溶液均减小
C.膜、膜b分别为阳离子交换膜和阴离子交换膜
D.每生成,理论上双极膜至少解离
13.与催化重整生成和,可减少温室气体排放,同时得到高热值的燃料。
重整时涉及的主要反应如下:①;
②。在恒压密闭容器中,起始时通入,实验测得和的平衡转化率随温度变化的曲线如图所示。
A.曲线A表示的平衡转化率随温度的变化
B.若压强恒为,则时反应②的压强平衡常数
C.当反应至转化率为X点的值时,改变除温度外的某一条件继续反应,平衡时的转化率不可能达到Y点的值
D.若在恒压、绝热容器中进行反应,反应达平衡时充入,达新平衡后保持不变
14.的配位化合物较稳定且用运广泛。可与等配体形成溶液呈浅紫色的、红色的、无色的配离子。某同学按如下步骤完成实验:
已知:向的溶液中加入溶液生成蓝色的的配离子,不能与形成配位离子。下列说法正确的是( )
A.第四电离能以小于第三电离能
B.基态和基态的核外电子排布中,未成对电子数之比
C.配离子中的键角与分子中的键角相等
D.可用和溶液检验溶液中是否含有
15.乙二胺(,简写为)是常用的分析试剂,该物质为二元弱碱,在水中的电离方式与氨类似。时,向其盐酸盐溶液中加入固体(溶液体积变化,忽略不计),体系中三种粒子的浓度的对数值()、所加固体质量与的关系如图所示。下列说法错误的是( )
A.乙二胶第一步电离常数的数量级为
B.时,
C.时,
D.时,加入的质量
第Ⅱ卷(非选择题 共60分)
16.(12分)配合物在生产生活中有着广泛的应用,结合相关知识回答下列问题:
(1)是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为,但只有甲的水解产物能与草酸反应生成。
①草酸分子中碳的杂化方式为__________________。
②发生水解反应的化学方程式是___________________________。
③查阅资料可知,甲、乙均为平面结构,画出乙的水解产物的空间结构_________。
(2)一种含B化合物可用作吸附材料,其化学式为,部分晶体结构如图所示,其中为平面结构。
下列说法不正确的是_________。
A.基态原子未成对电子数:
B.基态原子的第一电离能:
C.该晶体中存在的化学键有离子键、共价键、配位键、氢键
D.晶体中B、C、N和O原子轨道的杂化类型分别为
(3)比较键角大小:_________(填“>”“=”或“<”),并说明理由___________________________.
(4)一种锂离子电池负极材料为两层石墨层中嵌入,形成如图所示的晶胞结构。该物质中与C原子的个数比为_________。
17.(12分)工业污酸因酸性强,且含有大量等毒性物质不可直接排放,用锌冶炼窑渣处理含砷废酸可实现砷、酸的高效脱除,同时获得有价金属铜、铁。
已知:①锌窑渣主要成分:等
②氧化浸出后上清液主要成分()
(主要以形式存在)
18.9 17.8 6.6 1.65 8.85
(1)为提高污酸中的消除率,可采取的措施有_________。
a.将锌窑渣粉碎 b.提高液固比 c.延长浸取时间 d.适当升温
(2)氧化浸出步骤,氧气分压对溶出率的影响如图所示,试分析氧气分压过大时,铁元素溶出率变化的可能原因:__________________;若该步骤不通入氧气,将影响锌窑渣中_________(填化学式)成分的溶浸。
(3)滤渣2的主要成分为__________________(填化学式)
(4)基态砷原子价电子轨道表示式为__________________。
(5)⑤已知:的VSEPR模型为__________________,分子空间结构为_________,为正四面体结构,则中含_________键。
(6)《本草纲目》中记载砒霜可入药,已知:的熔点为,沸点为。古代采用“升华法”提纯砒霜,砒霜升华时破坏的作用力为_________;
18.(12分)滴定法是实验室和工业生产中常用的一种简便、快速和应用广泛的定量分析方法,常见的有:酸碱中和滴定法、氧化还原滴定法、沉淀滴定法等。
(1)酸碱中和滴定:在实验室用盐酸分别滴定体积均为、浓度均为的溶液和氨水,得到溶液随加入盐酸体积而变化的两条滴定曲线。
①用盐酸滴定氨水选择的指示剂为_________,滴定终点的现象是_________;符合其滴定曲线的是_________(填“I”或“II”)。
②图中a、b两点对应加入盐酸的体积和大小的比较:_________(填“>”、“<”或“=”)。
(2)氧化还原滴定法:对环境具有极强的污染性,含有的工业废水常采用沉淀法除去。
已知:常温下,当溶液的为5时,恰好完全沉淀;过量时溶解生成还原产物为。
①常温下,的溶度积常数_________。
为测定工业废水中的物质的量浓度,操作步骤如下:
I.取滤液
II.用标准酸性溶液滴定某浓度溶液,消耗溶液;
III.取滤液,用上述溶液滴定,达到滴定终点时,消耗溶液
②步骤Ⅱ中的滴定过程应选用_________(填“酸式”或“碱式”)滴定管。
③步骤Ⅲ的滤液中物质的量浓度为_________。
(3)沉淀滴定——利用沉淀反应进行滴定、测量溶液物质的量浓度的方法,所用指示剂本身就是沉淀剂,滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用溶液滴定溶液,可选用的指示剂是_________(填选项字母)。
难溶物
颜色 白 砖红 白 白 浅黄
a. b. c. d.
19.(12分)元素A、D、E、W、X、Y、Z基态原子,原子序数依次增大且分占前四周期, D的各能级电子数相等;E的核外电子有3种空间运动状态。W的价电子排布式为,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
(1)Z元素在周期表中的位置为:__________________;位于周期表_________区。
(2)D、E、W元素第一电离能由大到小顺序为:__________________;电负性由大到小顺序为:__________________。
(3)比较键角:_________(填“>”、“<”或“=”)
(4)实验测得:ZY属于共价化合物,气态ZY分子的相对分子质量为199,该分子中含有配位键,则气态ZY分子的结构式可能为_________。
(5)某物质晶胞结构如图所示。
①该物质的化学式可以表示为_________。
②该晶胞中距离最近的与Z原子的核间距为,则该晶胞的密度为_________(用含a、的代数式表示,表示阿伏加德罗常数的值,).
20.(12分)碳、氮及其化合物在工农业生产中有着广泛应用,处理、回收利用是环境科学研究的热点课题。回答下列问题:
(1)汽车防撞气囊中加入的叠氮化钠在受到剧烈撞击时会迅速分解,能量变化如图。该反应的热化学方程式为:
_________。
(2)工业上用氨气和二氧化碳合成尿素的反应历程与能量变化如图:
①下列说法正确的是_________(填标号)。
a.合成尿素的反应在低温下可自发进行
b.相同条件下,氨基甲酸铵比尿素稳定
c.若氨气和二氧化碳的转化率相等,则反应达到平衡状态
d.加压、降温有利于尿素的生成(不考虑副反应发生)
②在温度、压强恒定条件下,欲提高氨气的平转化率,可采取的措施是_________。
(3)工业上利用还原消除氮的氧化物对环境的污染,反应原理为
①
②
时,向固定体积的密闭容器中充入和,测得起始压强为,反应后达到平衡,测得转化率为占总气体物质的量分数为,用表示到达平衡时的反应速率_________;该温度下反应②的正反应平衡常数_________。(用分数表示)
(4)间接电解法除。其工作原理如图所示,已知:是一种弱酸。从A口中出来的气体是__________________填化学式,电解池的阴极电极反应式为_________,用化学方程式表示吸收池中除去的原理:__________________。
青岛二中2023-2024学年第一学期期末考试
高二试题(化学)参考答案
一、单选(每小题2分,共20分)
1-5 ABCCC 6-10 CBBDB
二、不定项选择(每小题4分,选对但不全的得2分,有选错的得0分)
11-15D AD B D BD
三、填空(共60分)
16.(12分)
(1)
(2)BCD
(3)< 中B为杂化,中B为杂化
(4)
17.(12分)
(1)acd
(2)氧气分压过大时,被氧化为进一步发生水解沉淀损失或直接与发生沉砷反应;
(3)
(4)
(5)正四面体 三角锥形 6
(6)范德华力(或分子间作用力)
18.(12分)
(1)甲基橙溶液 当滴入最后半滴盐酸,锥形瓶中溶液由黄色变为橙色时,且半分钟内不变色 1 <
(2) 酸式
(3)b
19.(12分)
(1)第四周期族
(2);
(3)>
(4)
(5)
20.(12分)
(1) (2)①
②及时分离出,减小氨碳比等
(3)0.12
(4)
高二试题(化学)
(时间:90分钟 分值:100分)
可能用到的相对原子质量:
1.答卷前,考生将自己的姓名、班级、座号、考号等填写在答题卡的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动用橡皮擦干净后再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。
3.考试结束后,只将答题卡交回。
第I卷(共40分)
一、选择题(每题只有一个正确选项。每题2分,共20分)
1.下列说法正确的有几个( )
①最外层电子数为的元素都在元素周期表的第2列
②分子中一定存在键,不一定存在键
③、、中碳碳键键长相同
④基态原子的价电子排布为的元素,其族序数一定为
⑤核外电子跃迁过程中形城了发射光谱
⑥与空间结构为V形且中心原子均为杂化
A.0个 B.1个 C.2个 D.3个
2.已知W、X、Y、Z均为短周期元素,常温下它们的最高价氧化物对应的水化物溶液(浓度均为)的和原子半径、原子序数的关系如图所示。下列说法正确的是( )
A.电负性: B.简单气态氢化物的热稳定性:
C.离子半径: D.化合物中含有极性共价键和非极性共价键
3.下列两组命题中,M组命题能用N组命题加以解释的是( )
选项 M组 N组
A 的稳定性大于 的分子间作用力更大
B 的沸点高于 因为分子间范德华力更大
C 金属具有导热性 当金属中存在温度差时,“自由电子”碰撞金属阳离子将能量进行传递
D 过氧化氢分子是极性分子 过氧化氢分子中只含有极性键
A.A B.B C.C D.D
4.下列各组离子在指定溶液中一定能大量共存的是( )
①无色溶液中:
②的溶液中:
③加入能放出的溶液中:
④由水电离出的的溶液中:
⑤有较多的溶液中:
⑥酸性溶液中:
A.①② B.③⑥ C.②④ D.③⑤
5.许多过渡金属离子能形成种类繁多的配合物。下列说法正确的是( )
A.二乙二胺合铜配离子的结构如图所示,可知的价电子排布式为,配位数为4,配体数也为4
B.配合物中含有配位键
C.配合物中的的配位原子是C
D.配合物中心离子为,该配合物与溶液作用,生成
6.已知汽油车尾气的治理中可以用碳在催化剂的条件下还原,实验室模拟该反应,在恒压密闭容器中加入足量的碳和相同量的气体,保持温度不变,测得相同时间内的转化率在不同压强条件下的变化如图所示。下列说法错误的是( )
A.b、e两点转化率相同,反应速率不同
B.时,的体积分数为33.3%
C.之前,随压强增大平衡正向移动,的转化率升高.平衡常数不变
D.e点时,继续向容器内按照体积比的比例添加一定量的、,达到新的平衡时,混合气体中体积分数不变
7.同一短周期的主族元素X、Y、Z的部分逐级电离能C数据如下表:
X 1402.3 2856 4578.1 7475.0 9445 53267 64360
Y 1313.9 3388.3 5300.5 7469.2 10990 13327 71330
Z 1681.0 3374.2 6050.4 8407.7 11023 15164 17868
下列说法一定正确的是( )
A.X、Y、Z在周期表中处于相邻位置,且X的原子序数最大
B.X位于元素周期表的第VA族
C.Y的最高正化合价为价
D.基态Z原子的原子核外最外电子层中有5个电子
8.一种电化学法合成甲酸盐和辛腈的工作原理如图所示。下列说法不正确的是( )
A.电极电势:高于
B.电解一段时间后,阴极区溶液增大
C.电极的电极方程式:
D.标准状况下,参与反应时,电极有辛腈生成
9.常温下,用溶液分别滴定浓度均为溶液和溶液,所得滴定曲线如图所示(其中的滴定曲线部分未画出)。下列说法错误的是( )
已知:M点溶液中,
A.
B.P点溶液中溶质为和,由水电离出的
C.M点溶液中,
D.等体积等浓度的溶液和溶液混合后的溶液中:
10.和(砖红色都是难溶电解质,常温下以对和作图的沉淀平衡曲线如图所示。下列说法正确的是( )
A.阴影区域和都沉淀
B.
C.向含有的溶液中加入,白色固体逐渐变为砖红色
D.用硝酸银标准液滴定溶液中的,作指行剂的浓度在左右时滴定误差很大
二、不定项选择题(每题有1-2个正确选项。每题4分,共20分)
11.M、N、Z、Y、X、T是原子半径依次增大的前10号元素,基态N原子核外电子有5种空间运动状态,并有1个单电子,这六种元素形成的一种化合物结构如图所示。
A.与Z同周期且第一电离能大于Z的元素有2种
B.该化合物中只含有离子键、共价键,不存在配位键
C.六种元素中,X的最高价含氧酸的酸性最强
D.最简单氢,化物的沸点为
12.下列装置可分离废水中的和。已知和性质相似,和乙酰丙酮不反应。下列说法正确的是( )
A.M电极接太阳能电池的P电极
B.通电一段时间后,I、IV室内溶液均减小
C.膜、膜b分别为阳离子交换膜和阴离子交换膜
D.每生成,理论上双极膜至少解离
13.与催化重整生成和,可减少温室气体排放,同时得到高热值的燃料。
重整时涉及的主要反应如下:①;
②。在恒压密闭容器中,起始时通入,实验测得和的平衡转化率随温度变化的曲线如图所示。
A.曲线A表示的平衡转化率随温度的变化
B.若压强恒为,则时反应②的压强平衡常数
C.当反应至转化率为X点的值时,改变除温度外的某一条件继续反应,平衡时的转化率不可能达到Y点的值
D.若在恒压、绝热容器中进行反应,反应达平衡时充入,达新平衡后保持不变
14.的配位化合物较稳定且用运广泛。可与等配体形成溶液呈浅紫色的、红色的、无色的配离子。某同学按如下步骤完成实验:
已知:向的溶液中加入溶液生成蓝色的的配离子,不能与形成配位离子。下列说法正确的是( )
A.第四电离能以小于第三电离能
B.基态和基态的核外电子排布中,未成对电子数之比
C.配离子中的键角与分子中的键角相等
D.可用和溶液检验溶液中是否含有
15.乙二胺(,简写为)是常用的分析试剂,该物质为二元弱碱,在水中的电离方式与氨类似。时,向其盐酸盐溶液中加入固体(溶液体积变化,忽略不计),体系中三种粒子的浓度的对数值()、所加固体质量与的关系如图所示。下列说法错误的是( )
A.乙二胶第一步电离常数的数量级为
B.时,
C.时,
D.时,加入的质量
第Ⅱ卷(非选择题 共60分)
16.(12分)配合物在生产生活中有着广泛的应用,结合相关知识回答下列问题:
(1)是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为,但只有甲的水解产物能与草酸反应生成。
①草酸分子中碳的杂化方式为__________________。
②发生水解反应的化学方程式是___________________________。
③查阅资料可知,甲、乙均为平面结构,画出乙的水解产物的空间结构_________。
(2)一种含B化合物可用作吸附材料,其化学式为,部分晶体结构如图所示,其中为平面结构。
下列说法不正确的是_________。
A.基态原子未成对电子数:
B.基态原子的第一电离能:
C.该晶体中存在的化学键有离子键、共价键、配位键、氢键
D.晶体中B、C、N和O原子轨道的杂化类型分别为
(3)比较键角大小:_________(填“>”“=”或“<”),并说明理由___________________________.
(4)一种锂离子电池负极材料为两层石墨层中嵌入,形成如图所示的晶胞结构。该物质中与C原子的个数比为_________。
17.(12分)工业污酸因酸性强,且含有大量等毒性物质不可直接排放,用锌冶炼窑渣处理含砷废酸可实现砷、酸的高效脱除,同时获得有价金属铜、铁。
已知:①锌窑渣主要成分:等
②氧化浸出后上清液主要成分()
(主要以形式存在)
18.9 17.8 6.6 1.65 8.85
(1)为提高污酸中的消除率,可采取的措施有_________。
a.将锌窑渣粉碎 b.提高液固比 c.延长浸取时间 d.适当升温
(2)氧化浸出步骤,氧气分压对溶出率的影响如图所示,试分析氧气分压过大时,铁元素溶出率变化的可能原因:__________________;若该步骤不通入氧气,将影响锌窑渣中_________(填化学式)成分的溶浸。
(3)滤渣2的主要成分为__________________(填化学式)
(4)基态砷原子价电子轨道表示式为__________________。
(5)⑤已知:的VSEPR模型为__________________,分子空间结构为_________,为正四面体结构,则中含_________键。
(6)《本草纲目》中记载砒霜可入药,已知:的熔点为,沸点为。古代采用“升华法”提纯砒霜,砒霜升华时破坏的作用力为_________;
18.(12分)滴定法是实验室和工业生产中常用的一种简便、快速和应用广泛的定量分析方法,常见的有:酸碱中和滴定法、氧化还原滴定法、沉淀滴定法等。
(1)酸碱中和滴定:在实验室用盐酸分别滴定体积均为、浓度均为的溶液和氨水,得到溶液随加入盐酸体积而变化的两条滴定曲线。
①用盐酸滴定氨水选择的指示剂为_________,滴定终点的现象是_________;符合其滴定曲线的是_________(填“I”或“II”)。
②图中a、b两点对应加入盐酸的体积和大小的比较:_________(填“>”、“<”或“=”)。
(2)氧化还原滴定法:对环境具有极强的污染性,含有的工业废水常采用沉淀法除去。
已知:常温下,当溶液的为5时,恰好完全沉淀;过量时溶解生成还原产物为。
①常温下,的溶度积常数_________。
为测定工业废水中的物质的量浓度,操作步骤如下:
I.取滤液
II.用标准酸性溶液滴定某浓度溶液,消耗溶液;
III.取滤液,用上述溶液滴定,达到滴定终点时,消耗溶液
②步骤Ⅱ中的滴定过程应选用_________(填“酸式”或“碱式”)滴定管。
③步骤Ⅲ的滤液中物质的量浓度为_________。
(3)沉淀滴定——利用沉淀反应进行滴定、测量溶液物质的量浓度的方法,所用指示剂本身就是沉淀剂,滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用溶液滴定溶液,可选用的指示剂是_________(填选项字母)。
难溶物
颜色 白 砖红 白 白 浅黄
a. b. c. d.
19.(12分)元素A、D、E、W、X、Y、Z基态原子,原子序数依次增大且分占前四周期, D的各能级电子数相等;E的核外电子有3种空间运动状态。W的价电子排布式为,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
(1)Z元素在周期表中的位置为:__________________;位于周期表_________区。
(2)D、E、W元素第一电离能由大到小顺序为:__________________;电负性由大到小顺序为:__________________。
(3)比较键角:_________(填“>”、“<”或“=”)
(4)实验测得:ZY属于共价化合物,气态ZY分子的相对分子质量为199,该分子中含有配位键,则气态ZY分子的结构式可能为_________。
(5)某物质晶胞结构如图所示。
①该物质的化学式可以表示为_________。
②该晶胞中距离最近的与Z原子的核间距为,则该晶胞的密度为_________(用含a、的代数式表示,表示阿伏加德罗常数的值,).
20.(12分)碳、氮及其化合物在工农业生产中有着广泛应用,处理、回收利用是环境科学研究的热点课题。回答下列问题:
(1)汽车防撞气囊中加入的叠氮化钠在受到剧烈撞击时会迅速分解,能量变化如图。该反应的热化学方程式为:
_________。
(2)工业上用氨气和二氧化碳合成尿素的反应历程与能量变化如图:
①下列说法正确的是_________(填标号)。
a.合成尿素的反应在低温下可自发进行
b.相同条件下,氨基甲酸铵比尿素稳定
c.若氨气和二氧化碳的转化率相等,则反应达到平衡状态
d.加压、降温有利于尿素的生成(不考虑副反应发生)
②在温度、压强恒定条件下,欲提高氨气的平转化率,可采取的措施是_________。
(3)工业上利用还原消除氮的氧化物对环境的污染,反应原理为
①
②
时,向固定体积的密闭容器中充入和,测得起始压强为,反应后达到平衡,测得转化率为占总气体物质的量分数为,用表示到达平衡时的反应速率_________;该温度下反应②的正反应平衡常数_________。(用分数表示)
(4)间接电解法除。其工作原理如图所示,已知:是一种弱酸。从A口中出来的气体是__________________填化学式,电解池的阴极电极反应式为_________,用化学方程式表示吸收池中除去的原理:__________________。
青岛二中2023-2024学年第一学期期末考试
高二试题(化学)参考答案
一、单选(每小题2分,共20分)
1-5 ABCCC 6-10 CBBDB
二、不定项选择(每小题4分,选对但不全的得2分,有选错的得0分)
11-15D AD B D BD
三、填空(共60分)
16.(12分)
(1)
(2)BCD
(3)< 中B为杂化,中B为杂化
(4)
17.(12分)
(1)acd
(2)氧气分压过大时,被氧化为进一步发生水解沉淀损失或直接与发生沉砷反应;
(3)
(4)
(5)正四面体 三角锥形 6
(6)范德华力(或分子间作用力)
18.(12分)
(1)甲基橙溶液 当滴入最后半滴盐酸,锥形瓶中溶液由黄色变为橙色时,且半分钟内不变色 1 <
(2) 酸式
(3)b
19.(12分)
(1)第四周期族
(2);
(3)>
(4)
(5)
20.(12分)
(1) (2)①
②及时分离出,减小氨碳比等
(3)0.12
(4)
同课章节目录
