第八章 第一节 第1课时 金属矿物、海水资源的开发利用 学案(含答案)—2024春高中化学人教版必修二
文档属性
| 名称 | 第八章 第一节 第1课时 金属矿物、海水资源的开发利用 学案(含答案)—2024春高中化学人教版必修二 |

|
|
| 格式 | docx | ||
| 文件大小 | 1003.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-09 17:57:07 | ||
图片预览




文档简介
第八章 化学与可持续发展
第一节 自然资源的开发利用
第1课时 金属矿物、海水资源的开发利用
[核心素养发展目标]
1.了解金属在自然界中的存在形式,理解金属冶炼的一般原理,掌握活泼性不同的金属冶炼的一般方法,形成金属冶炼方法知识模型,培养证据推理与模型认知能力。
2.了解海水的主要组成元素、海水资源及开发利用的主要方式,掌握从海水中提取溴的化学反应原理及实验方法,培养宏观辨识与变化观念的学科素养。
3.通过对金属冶炼原理及海水资源综合利用的认识,体会化学对促进人与自然和谐相处的意义,培养科学探究精神,增强社会责任感。
一、金属矿物的开发利用
1.金属元素在自然界中的存在形态
2.金属的冶炼
(1)概念:将金属矿物中的金属从其化合物中还原出来,用于生产各种金属材料,这一过程在工业上称为________________。
(2)原理:利用氧化还原反应原理,在一定条件下,使金属离子________电子被________成金属原子,从而获得金属单质。即Mn++ne-===M。
3.金属的冶炼方法
思考1 根据下图人类冶炼金属的历史时间分析推测人类发现和使用金属材料受哪些因素的影响?为什么?
________________________________________________________________________
________________________________________________________________________
(1)金属活泼性与冶炼方法的关系如下:
(2)金属的冶炼方法
热分解法 分解HgO
分解Ag2O
电解法 冶炼钠
冶炼镁
冶炼铝
热还原法 高炉炼铁 Fe2O3+3CO2Fe+3CO2
铝热法炼铁
其他方法 湿法炼铜 Fe+CuSO4===FeSO4+Cu
火法炼铜 Cu2S+O22Cu+SO2
其中热还原法常用的还原剂有________、________、________、________________等。
思考2 结合下列表格物质的熔、沸点数据分析,为什么冶炼镁时,选择MgCl2而不是MgO?为什么冶炼铝时,选择Al2O3而不是AlCl3
物质 MgO Al2O3 MgCl2 AlCl3
熔点/℃ 2 852 2 054 714 190(以分子形式存在)
沸点/℃ 3 600 2 980 1 412 180
________________________________________________________________________
________________________________________________________________________
思考3 计算表明,生产1 mol铝消耗的电能至少为1.8×106 J,回收铝制饮料罐得到铝与从铝土矿得到铝相比,前者的能耗仅为后者的3%~5%。通过对上述数据的分析和比较,你想到了什么?
________________________________________________________________________
4.金属矿物资源的开发和利用措施
(1)提高金属矿物的利用率。
(2)开发环保高效的金属冶炼方法。
(3)防止金属的腐蚀。
(4)加强废旧金属的回收和再利用。
(5)使用其他材料代替金属材料,减少金属的使用量。
1.判断正误
(1)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(2)越活泼的金属元素,人类利用的越晚( )
(3)用热还原法冶炼金属时,可以用H2将Mg从其化合物中还原出来( )
(4)可以通过电解饱和食盐水的方法获取金属钠( )
(5)可以通过电解熔融的MgO和AlCl3来制备金属Mg、Al( )
2.冶炼金属常用以下几种方法:①以C、CO或H2作还原剂;②电解法;③热分解法。
下列金属各采用哪种方法?
(1)Fe、Zn、Cu等相对较活泼金属:________(填序号,下同)。
(2)Na、Mg、Al等活泼金属:__________________________________________。
(3)Hg、Ag等不活泼金属:________________________________________。
3.工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
(1)步骤Ⅰ和Ⅱ中分离溶液和沉淀的操作为__________,所用到的玻璃仪器是______________。
(2)沉淀M中除含有泥沙外,一定还含有________,固体N是________。
(3)滤液X中,含铝元素的溶质的化学式为__________,它属于________(填“酸”“碱”或“盐”)类物质。
(4)实验室里通常向AlCl3溶液中加入________(填“氨水”或“NaOH溶液”)来制取Al(OH)3。
二、海水资源的开发利用
1.海水资源的特点
→
→
→
2.海水水资源的开发利用
(1)利用途径及海水淡化方法
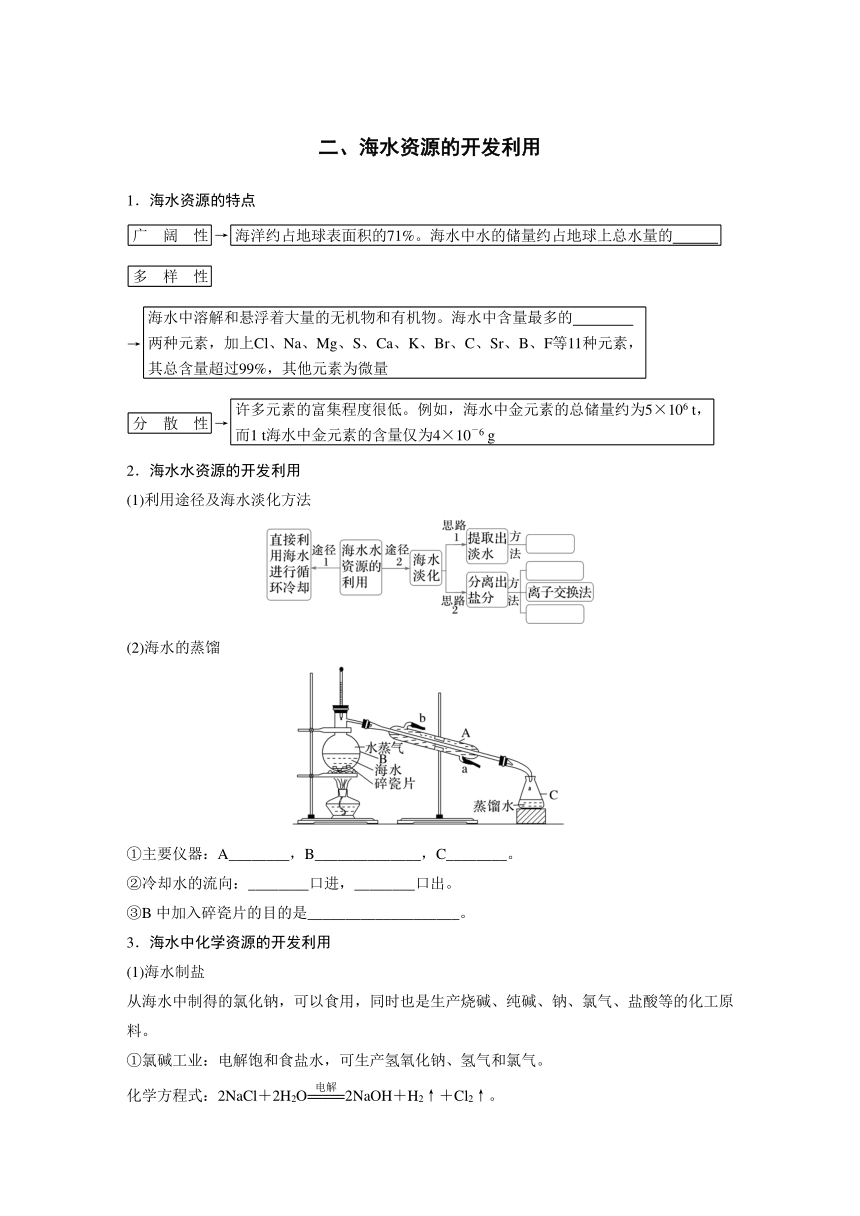
(2)海水的蒸馏
①主要仪器:A________,B______________,C________。
②冷却水的流向:________口进,________口出。
③B中加入碎瓷片的目的是____________________。
3.海水中化学资源的开发利用
(1)海水制盐
从海水中制得的氯化钠,可以食用,同时也是生产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
①氯碱工业:电解饱和食盐水,可生产氢氧化钠、氢气和氯气。
化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑。
②制钠和氯气:____________________。
③制盐酸:H2+Cl22HCl。
④制漂白剂(84消毒液):_________________________________________。
⑤制纯碱:NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓;__________________。
(2)海水提溴
①海水提溴的方法(吹出法)
工艺流程
基本操作 浓缩 海水晒盐和海水淡化的过程中副产物Br-得到浓缩
氧化 向浓缩的海水中通入Cl2,将Br-氧化成Br2
吹出 利用溴的挥发性,通入热空气和水蒸气,吹出溴蒸气
吸收 吹出的溴蒸气用SO2吸收
蒸馏 再用Cl2将HBr氧化得到溴后蒸馏分离
②氧化、吸收环节主要的离子方程式:
________________________________________________________________________、
________________________________________________________________________。
4.海水中其他资源的开发利用
(1)制备化工产品:制备Mg、K、I2及其他化工产品。
(2)获取能量物质:提取铀和重水用来开发核能。
(3)开发利用新型能源:潮汐能、波浪能等。
思考1 下图为海水提镁的工艺流程,写出下列步骤中的化学(或离子)方程式。
①分解贝壳(主要成分是CaCO3)、制备Ca(OH)2:_____________________________、
_______________________________________。
②沉淀Mg2+:________________________(离子方程式)。
③制备MgCl2:_____________________________________。
④制取Mg:_____________________________________。
思考2 从海带中提取碘单质,相关实验步骤如下:
①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及适当的氧化剂,然后加入几滴某溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯中,加蒸馏水,搅拌、煮沸、过滤。
(1)合理的步骤顺序是______________(填序号)。
(2)适当的氧化剂是______________,反应的离子方程式是_____________________________。
(3)证明含碘的操作及现象是__________________________________。
1.判断正误
(1)海洋约占地球表面积的71%,因此地球不缺水,人类可以任意使用,不用节约( )
(2)海水淡化的方法中,蒸馏法成本最低( )
(3)海水中含量最多的两种元素为Na元素和Cl元素( )
(4)海水中各种化学资源的开发过程中,必须都要发生化学反应( )
(5)蒸馏操作时,温度计水银球的位置应在蒸馏烧瓶支管口处,测量蒸气的温度( )
2.下列叙述不正确的是( )
A.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
B.蒸馏时的接收装置如图
C.冷却水应该从冷凝管的下口进水上口出水
D.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
3.(2023·陕西长安一中高一期中)海水开发利用的部分过程如图所示。下列说法错误的是( )
A.上述过程涉及氧化还原反应
B.可以采用蒸馏法从海水中获得淡水
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
4.从海带中提取碘单质,工艺流程如下。下列关于海带制碘的说法错误的是( )
干海带海带灰悬浊液滤液碘水I2的CCl4溶液
A.实验室灼烧干海带在坩埚中进行
B.沸水浸泡的目的是使I-充分浸出
C.由滤液获得碘水,发生的离子反应为2I-+H2O2===I2+2OH-
D.可以用淀粉溶液检验碘水中的I2
1.从本质上讲,工业上冶炼金属的反应一定都属于( )
A.氧化还原反应 B.置换反应
C.分解反应 D.复分解反应
2.(2023·济南高一检测)下列反应原理中,不符合工业冶炼金属实际情况的是( )
A.2Ag2O4Ag+O2↑
B.2Al2O3(熔融)4Al+3O2↑
C.2MgO2Mg+O2↑
D.4CO+Fe3O43Fe+4CO2
3.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就能得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Na
D.利用潮汐发电是将化学能转化为电能
4.下列有关工业生产的说法错误的是( )
A.海水提镁时,通过电解熔融MgCl2得到镁单质
B.海水提溴的过程中涉及了氧化还原反应
C.通常用海水提取食盐后的母液为原料制取溴单质
D.目前工业上可直接从海水中提取碘单质
5.如图为铝热反应的实验装置,请回答下列问题:
(1)写出该反应的化学方程式:__________________________________________。
(2)若将氧化铁换成氧化镁,该反应______(填“能”或“不能”)发生,理由是_____________。
(3)若将所得产品置于足量的NaOH溶液中,可能看到的现象是__________________,写出铝热反应的一种主要用途:____________________。
(4)假设铝足量且反应充分,设计一种实验方案,证明本实验中有单质铁生成:
________________________________________________________________________。
第一节 自然资源的开发利用
第1课时 金属矿物、海水资源的开发利用
一、
1.游离态 金、铂 化合态
2.(1)金属的冶炼 (2)得到 还原
3.思考1 影响因素主要是金属在自然界中的存在状态和金属的活泼性。因为金属越活泼其还原性就越强,离子的氧化性越弱,得电子能力越弱,就越难被还原,故使用的时间越晚。
(2)2HgO2Hg+O2↑ 2Ag2O4Ag+O2↑ 2NaCl(熔融)2Na+Cl2↑ MgCl2(熔融)Mg+Cl2↑ 2Al2O3(熔融)4Al+3O2↑ 2Al+Fe2O3Al2O3+2Fe 焦炭 CO H2 一些活泼金属
思考2 从表中可以发现,MgO熔点高,耗能多;AlCl3的沸点比熔点低,易升华,是共价化合物,熔融状态下不导电。
思考3 (1)从铝土矿制铝消耗的能量要远远高于回收铝制饮料罐得到铝消耗的能量,加强废旧金属的回收和再利用是合理利用金属资源的重要途径。
(2)实际生产中,从金属矿物到纯净金属的冶炼过程是一个复杂的过程,在得到所需产品的同时也会产生废弃物,因此必须考虑废弃物的处理对环境的影响,走可持续发展道路。
应用体验
1.(1)√ (2)√ (3)× (4)× (5)×
2.(1)① (2)② (3)③
3.(1)过滤 烧杯、漏斗、玻璃棒 (2)Fe2O3 Al2O3
(3)Na[Al(OH)4] 盐 (4)氨水
二、
1.97% O、H
2.(1)蒸馏法 电渗析法 反渗透法 (2)①冷凝管 蒸馏烧瓶 锥形瓶 ②a b ③防止液体暴沸
3.(1)②2NaCl(熔融)2Na+Cl2↑ ④2NaOH+Cl2===NaClO+NaCl+H2O ⑤2NaHCO3Na2CO3+CO2↑+H2O
(2)②2Br-+Cl2===Br2+2Cl- SO2+Br2+2H2O===4H++SO+2Br-
4.思考1 ①CaCO3CaO+CO2↑ CaO+H2O===Ca(OH)2 ②Mg2++2OH-===Mg(OH)2↓
③Mg(OH)2+2HCl===MgCl2+2H2O ④MgCl2(熔融)Mg+Cl2↑
思考2 (1)③①④② (2)H2O2 2I-+2H++H2O2 === I2+2H2O (3)取步骤②后的溶液于试管中,滴入淀粉溶液,溶液变蓝
应用体验
1.(1)× (2)× (3)× (4)× (5)√
2.B
3.C [由于Ca(OH)2比NaOH便宜,工业生产中常选用Ca(OH)2作为沉淀剂,故C错误。]
4.C [干海带灼烧得到海带灰,海带灰溶于沸水,过滤得到含有碘离子的滤液,加入酸化的过氧化氢溶液氧化碘离子生成碘单质,加入四氯化碳萃取分液得到碘的四氯化碳溶液。固体灼烧应在坩埚中进行,A正确;沸水浸泡海带灰的目的是加快I-的溶解,并使之溶解更充分,B正确;由滤液获得碘水,正确的离子方程式为2I-+2H++H2O2===I2+2H2O,C错误;淀粉遇I2变蓝,D正确。]
随堂演练 知识落实
1.A [金属冶炼的本质是金属阳离子得电子被还原生成金属单质,因此一定属于氧化还原反应。]
2.C [银的活泼性差,用加热分解氧化银的方法冶炼银,A项不符合题意;工业上电解熔融氧化铝冶炼金属铝,B项不符合题意;工业上冶炼镁可采用电解法,其原料应选用MgCl2而不是MgO,因为MgO的熔点比MgCl2的高,会消耗大量电能,成本较高,C项符合题意;铁性质较活泼,工业上常采用热还原法制取,D项不符合题意。]
3.C [钾为活泼金属,在海水中没有单质钾,无法用物理方法制得钾单质,A错误;海水蒸发制海盐只发生了物理变化,未发生化学变化,B错误;Na为活泼金属,电解熔融的NaCl可制备Na,C正确;潮汐发电是将海水的动能转化为电能,D错误。]
4.D [海水提镁时,是通过电解熔融MgCl2得到镁单质,故A正确;海水提溴的过程中涉及了氧化还原反应,即氯气和溴离子反应生成溴单质和氯离子,溴单质和二氧化硫反应生成硫酸和氢溴酸,故B正确;通常用海水提取食盐后的母液为原料,用氯气氧化溴离子制取溴单质,故C正确;海水中没有单质碘,目前工业上氧化海水中的碘离子提取碘单质,故D错误。]
5.(1)Fe2O3+2AlAl2O3+2Fe
(2)不能 镁比铝活泼,铝不能置换出镁
(3)部分固体溶解,有气泡产生 焊接钢轨(或冶炼某些熔点高的金属,合理即可)
(4)取适量反应后的固体混合物,先用NaOH溶液除去铝,再加入稀硫酸,有气泡冒出,说明有铁生成(或用磁铁靠近固体,有固体可被磁铁吸引,说明有铁生成)
解析 (2)Mg比Al活泼,Al不能从MgO中置换出Mg。(3)若铝过量,剩余的铝及反应生成的氧化铝与NaOH溶液反应,可看到部分固体溶解,且溶液中有气泡产生。(4)可取适量反应后的固体混合物,先用NaOH溶液除去铝,再加入盐酸或稀硫酸,根据有气泡冒出确定有铁生成;也可用磁铁靠近固体,根据固体可被磁铁吸引判断有铁生成。
第一节 自然资源的开发利用
第1课时 金属矿物、海水资源的开发利用
[核心素养发展目标]
1.了解金属在自然界中的存在形式,理解金属冶炼的一般原理,掌握活泼性不同的金属冶炼的一般方法,形成金属冶炼方法知识模型,培养证据推理与模型认知能力。
2.了解海水的主要组成元素、海水资源及开发利用的主要方式,掌握从海水中提取溴的化学反应原理及实验方法,培养宏观辨识与变化观念的学科素养。
3.通过对金属冶炼原理及海水资源综合利用的认识,体会化学对促进人与自然和谐相处的意义,培养科学探究精神,增强社会责任感。
一、金属矿物的开发利用
1.金属元素在自然界中的存在形态
2.金属的冶炼
(1)概念:将金属矿物中的金属从其化合物中还原出来,用于生产各种金属材料,这一过程在工业上称为________________。
(2)原理:利用氧化还原反应原理,在一定条件下,使金属离子________电子被________成金属原子,从而获得金属单质。即Mn++ne-===M。
3.金属的冶炼方法
思考1 根据下图人类冶炼金属的历史时间分析推测人类发现和使用金属材料受哪些因素的影响?为什么?
________________________________________________________________________
________________________________________________________________________
(1)金属活泼性与冶炼方法的关系如下:
(2)金属的冶炼方法
热分解法 分解HgO
分解Ag2O
电解法 冶炼钠
冶炼镁
冶炼铝
热还原法 高炉炼铁 Fe2O3+3CO2Fe+3CO2
铝热法炼铁
其他方法 湿法炼铜 Fe+CuSO4===FeSO4+Cu
火法炼铜 Cu2S+O22Cu+SO2
其中热还原法常用的还原剂有________、________、________、________________等。
思考2 结合下列表格物质的熔、沸点数据分析,为什么冶炼镁时,选择MgCl2而不是MgO?为什么冶炼铝时,选择Al2O3而不是AlCl3
物质 MgO Al2O3 MgCl2 AlCl3
熔点/℃ 2 852 2 054 714 190(以分子形式存在)
沸点/℃ 3 600 2 980 1 412 180
________________________________________________________________________
________________________________________________________________________
思考3 计算表明,生产1 mol铝消耗的电能至少为1.8×106 J,回收铝制饮料罐得到铝与从铝土矿得到铝相比,前者的能耗仅为后者的3%~5%。通过对上述数据的分析和比较,你想到了什么?
________________________________________________________________________
4.金属矿物资源的开发和利用措施
(1)提高金属矿物的利用率。
(2)开发环保高效的金属冶炼方法。
(3)防止金属的腐蚀。
(4)加强废旧金属的回收和再利用。
(5)使用其他材料代替金属材料,减少金属的使用量。
1.判断正误
(1)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(2)越活泼的金属元素,人类利用的越晚( )
(3)用热还原法冶炼金属时,可以用H2将Mg从其化合物中还原出来( )
(4)可以通过电解饱和食盐水的方法获取金属钠( )
(5)可以通过电解熔融的MgO和AlCl3来制备金属Mg、Al( )
2.冶炼金属常用以下几种方法:①以C、CO或H2作还原剂;②电解法;③热分解法。
下列金属各采用哪种方法?
(1)Fe、Zn、Cu等相对较活泼金属:________(填序号,下同)。
(2)Na、Mg、Al等活泼金属:__________________________________________。
(3)Hg、Ag等不活泼金属:________________________________________。
3.工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
(1)步骤Ⅰ和Ⅱ中分离溶液和沉淀的操作为__________,所用到的玻璃仪器是______________。
(2)沉淀M中除含有泥沙外,一定还含有________,固体N是________。
(3)滤液X中,含铝元素的溶质的化学式为__________,它属于________(填“酸”“碱”或“盐”)类物质。
(4)实验室里通常向AlCl3溶液中加入________(填“氨水”或“NaOH溶液”)来制取Al(OH)3。
二、海水资源的开发利用
1.海水资源的特点
→
→
→
2.海水水资源的开发利用
(1)利用途径及海水淡化方法
(2)海水的蒸馏
①主要仪器:A________,B______________,C________。
②冷却水的流向:________口进,________口出。
③B中加入碎瓷片的目的是____________________。
3.海水中化学资源的开发利用
(1)海水制盐
从海水中制得的氯化钠,可以食用,同时也是生产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
①氯碱工业:电解饱和食盐水,可生产氢氧化钠、氢气和氯气。
化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑。
②制钠和氯气:____________________。
③制盐酸:H2+Cl22HCl。
④制漂白剂(84消毒液):_________________________________________。
⑤制纯碱:NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓;__________________。
(2)海水提溴
①海水提溴的方法(吹出法)
工艺流程
基本操作 浓缩 海水晒盐和海水淡化的过程中副产物Br-得到浓缩
氧化 向浓缩的海水中通入Cl2,将Br-氧化成Br2
吹出 利用溴的挥发性,通入热空气和水蒸气,吹出溴蒸气
吸收 吹出的溴蒸气用SO2吸收
蒸馏 再用Cl2将HBr氧化得到溴后蒸馏分离
②氧化、吸收环节主要的离子方程式:
________________________________________________________________________、
________________________________________________________________________。
4.海水中其他资源的开发利用
(1)制备化工产品:制备Mg、K、I2及其他化工产品。
(2)获取能量物质:提取铀和重水用来开发核能。
(3)开发利用新型能源:潮汐能、波浪能等。
思考1 下图为海水提镁的工艺流程,写出下列步骤中的化学(或离子)方程式。
①分解贝壳(主要成分是CaCO3)、制备Ca(OH)2:_____________________________、
_______________________________________。
②沉淀Mg2+:________________________(离子方程式)。
③制备MgCl2:_____________________________________。
④制取Mg:_____________________________________。
思考2 从海带中提取碘单质,相关实验步骤如下:
①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及适当的氧化剂,然后加入几滴某溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯中,加蒸馏水,搅拌、煮沸、过滤。
(1)合理的步骤顺序是______________(填序号)。
(2)适当的氧化剂是______________,反应的离子方程式是_____________________________。
(3)证明含碘的操作及现象是__________________________________。
1.判断正误
(1)海洋约占地球表面积的71%,因此地球不缺水,人类可以任意使用,不用节约( )
(2)海水淡化的方法中,蒸馏法成本最低( )
(3)海水中含量最多的两种元素为Na元素和Cl元素( )
(4)海水中各种化学资源的开发过程中,必须都要发生化学反应( )
(5)蒸馏操作时,温度计水银球的位置应在蒸馏烧瓶支管口处,测量蒸气的温度( )
2.下列叙述不正确的是( )
A.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
B.蒸馏时的接收装置如图
C.冷却水应该从冷凝管的下口进水上口出水
D.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
3.(2023·陕西长安一中高一期中)海水开发利用的部分过程如图所示。下列说法错误的是( )
A.上述过程涉及氧化还原反应
B.可以采用蒸馏法从海水中获得淡水
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
4.从海带中提取碘单质,工艺流程如下。下列关于海带制碘的说法错误的是( )
干海带海带灰悬浊液滤液碘水I2的CCl4溶液
A.实验室灼烧干海带在坩埚中进行
B.沸水浸泡的目的是使I-充分浸出
C.由滤液获得碘水,发生的离子反应为2I-+H2O2===I2+2OH-
D.可以用淀粉溶液检验碘水中的I2
1.从本质上讲,工业上冶炼金属的反应一定都属于( )
A.氧化还原反应 B.置换反应
C.分解反应 D.复分解反应
2.(2023·济南高一检测)下列反应原理中,不符合工业冶炼金属实际情况的是( )
A.2Ag2O4Ag+O2↑
B.2Al2O3(熔融)4Al+3O2↑
C.2MgO2Mg+O2↑
D.4CO+Fe3O43Fe+4CO2
3.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就能得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Na
D.利用潮汐发电是将化学能转化为电能
4.下列有关工业生产的说法错误的是( )
A.海水提镁时,通过电解熔融MgCl2得到镁单质
B.海水提溴的过程中涉及了氧化还原反应
C.通常用海水提取食盐后的母液为原料制取溴单质
D.目前工业上可直接从海水中提取碘单质
5.如图为铝热反应的实验装置,请回答下列问题:
(1)写出该反应的化学方程式:__________________________________________。
(2)若将氧化铁换成氧化镁,该反应______(填“能”或“不能”)发生,理由是_____________。
(3)若将所得产品置于足量的NaOH溶液中,可能看到的现象是__________________,写出铝热反应的一种主要用途:____________________。
(4)假设铝足量且反应充分,设计一种实验方案,证明本实验中有单质铁生成:
________________________________________________________________________。
第一节 自然资源的开发利用
第1课时 金属矿物、海水资源的开发利用
一、
1.游离态 金、铂 化合态
2.(1)金属的冶炼 (2)得到 还原
3.思考1 影响因素主要是金属在自然界中的存在状态和金属的活泼性。因为金属越活泼其还原性就越强,离子的氧化性越弱,得电子能力越弱,就越难被还原,故使用的时间越晚。
(2)2HgO2Hg+O2↑ 2Ag2O4Ag+O2↑ 2NaCl(熔融)2Na+Cl2↑ MgCl2(熔融)Mg+Cl2↑ 2Al2O3(熔融)4Al+3O2↑ 2Al+Fe2O3Al2O3+2Fe 焦炭 CO H2 一些活泼金属
思考2 从表中可以发现,MgO熔点高,耗能多;AlCl3的沸点比熔点低,易升华,是共价化合物,熔融状态下不导电。
思考3 (1)从铝土矿制铝消耗的能量要远远高于回收铝制饮料罐得到铝消耗的能量,加强废旧金属的回收和再利用是合理利用金属资源的重要途径。
(2)实际生产中,从金属矿物到纯净金属的冶炼过程是一个复杂的过程,在得到所需产品的同时也会产生废弃物,因此必须考虑废弃物的处理对环境的影响,走可持续发展道路。
应用体验
1.(1)√ (2)√ (3)× (4)× (5)×
2.(1)① (2)② (3)③
3.(1)过滤 烧杯、漏斗、玻璃棒 (2)Fe2O3 Al2O3
(3)Na[Al(OH)4] 盐 (4)氨水
二、
1.97% O、H
2.(1)蒸馏法 电渗析法 反渗透法 (2)①冷凝管 蒸馏烧瓶 锥形瓶 ②a b ③防止液体暴沸
3.(1)②2NaCl(熔融)2Na+Cl2↑ ④2NaOH+Cl2===NaClO+NaCl+H2O ⑤2NaHCO3Na2CO3+CO2↑+H2O
(2)②2Br-+Cl2===Br2+2Cl- SO2+Br2+2H2O===4H++SO+2Br-
4.思考1 ①CaCO3CaO+CO2↑ CaO+H2O===Ca(OH)2 ②Mg2++2OH-===Mg(OH)2↓
③Mg(OH)2+2HCl===MgCl2+2H2O ④MgCl2(熔融)Mg+Cl2↑
思考2 (1)③①④② (2)H2O2 2I-+2H++H2O2 === I2+2H2O (3)取步骤②后的溶液于试管中,滴入淀粉溶液,溶液变蓝
应用体验
1.(1)× (2)× (3)× (4)× (5)√
2.B
3.C [由于Ca(OH)2比NaOH便宜,工业生产中常选用Ca(OH)2作为沉淀剂,故C错误。]
4.C [干海带灼烧得到海带灰,海带灰溶于沸水,过滤得到含有碘离子的滤液,加入酸化的过氧化氢溶液氧化碘离子生成碘单质,加入四氯化碳萃取分液得到碘的四氯化碳溶液。固体灼烧应在坩埚中进行,A正确;沸水浸泡海带灰的目的是加快I-的溶解,并使之溶解更充分,B正确;由滤液获得碘水,正确的离子方程式为2I-+2H++H2O2===I2+2H2O,C错误;淀粉遇I2变蓝,D正确。]
随堂演练 知识落实
1.A [金属冶炼的本质是金属阳离子得电子被还原生成金属单质,因此一定属于氧化还原反应。]
2.C [银的活泼性差,用加热分解氧化银的方法冶炼银,A项不符合题意;工业上电解熔融氧化铝冶炼金属铝,B项不符合题意;工业上冶炼镁可采用电解法,其原料应选用MgCl2而不是MgO,因为MgO的熔点比MgCl2的高,会消耗大量电能,成本较高,C项符合题意;铁性质较活泼,工业上常采用热还原法制取,D项不符合题意。]
3.C [钾为活泼金属,在海水中没有单质钾,无法用物理方法制得钾单质,A错误;海水蒸发制海盐只发生了物理变化,未发生化学变化,B错误;Na为活泼金属,电解熔融的NaCl可制备Na,C正确;潮汐发电是将海水的动能转化为电能,D错误。]
4.D [海水提镁时,是通过电解熔融MgCl2得到镁单质,故A正确;海水提溴的过程中涉及了氧化还原反应,即氯气和溴离子反应生成溴单质和氯离子,溴单质和二氧化硫反应生成硫酸和氢溴酸,故B正确;通常用海水提取食盐后的母液为原料,用氯气氧化溴离子制取溴单质,故C正确;海水中没有单质碘,目前工业上氧化海水中的碘离子提取碘单质,故D错误。]
5.(1)Fe2O3+2AlAl2O3+2Fe
(2)不能 镁比铝活泼,铝不能置换出镁
(3)部分固体溶解,有气泡产生 焊接钢轨(或冶炼某些熔点高的金属,合理即可)
(4)取适量反应后的固体混合物,先用NaOH溶液除去铝,再加入稀硫酸,有气泡冒出,说明有铁生成(或用磁铁靠近固体,有固体可被磁铁吸引,说明有铁生成)
解析 (2)Mg比Al活泼,Al不能从MgO中置换出Mg。(3)若铝过量,剩余的铝及反应生成的氧化铝与NaOH溶液反应,可看到部分固体溶解,且溶液中有气泡产生。(4)可取适量反应后的固体混合物,先用NaOH溶液除去铝,再加入盐酸或稀硫酸,根据有气泡冒出确定有铁生成;也可用磁铁靠近固体,根据固体可被磁铁吸引判断有铁生成。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
