2.3 分子结构与物质的性质 同步练习 (含解析) 2023-2024学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3 分子结构与物质的性质 同步练习 (含解析) 2023-2024学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 553.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-10 11:03:09 | ||
图片预览



文档简介
2.3 分子结构与物质的性质 同步练习
一、单选题
1.在下列物质中,含有非极性共价键的是( )
A.CO2 B.CH4 C.Na2O2 D.MgCl2
2.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中错误的是( )
A.该配合物的配体为Cl-、NH3
B.该配合物的配位数为6
C.该配合物的空间构型可能为平面正方形结构
D.1 mol该分子中含有12 mol σ键
3.下列各组分子中都属于含极性键的非极性分子的是 ( )
A.SO2、H2O、NH3 B.CH4 、C2H4、C6H6
C.N2、Cl2、O3 D.H2O2、C2H6、PCl3
4.下列有关说法正确的是( )
A.s电子与s电子间形成的是键,p电子与p电子间形成的是键
B.与中心原子杂化轨道类型相同
C.氢键是一种特殊的化学键,它广泛存在于物质中
D.和化学键的类型和分子的极性(极性或非极性)都相同
5.下列分子属于非极性分子的是( )
A.H2O B.HCl C.NH3 D.CH4
6.下列说法正确的是 ( )
A.一个水分子与其他水分子间只能形成 2 个氢键
B.含氢键的物质的熔、沸点一定升高
C.分子间作用力包括氢键和范德华力
D.当 H2O 由液态变为气体时只破坏了氢键
7.下列说法正确的是( )
A.非极性分子中的原子上一定不含孤电子对
B.平面三角形分子一定是非极性分子
C.二氯甲烷(CH2Cl2)分子的中心原子采取sp3杂化,键角均为109°28'
D.ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子
8.强酸可由如下反应制备,。下列说法正确的是( )
A.的电子式为 B.相同条件下,酸性弱于HF
C.BF3的空间结构是三角锥形 D.中含有配位键
9.下列现象与氢键有关的是( )
①HF的熔、沸点比ⅦA族其他元素氢化物的高 ②乙醇可以与水以任意比互溶 ③冰的密度比液态水的密度小 ④水分子高温下也很稳定 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.②③④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
10.下列物质中,只含有非极性共价键的是( )
A.NaOH B.NaCl C.Cl2 D.H2S
11.(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。其释氢方式主要有两种,水解释氢和热分解释氢。氨硼烷水解释氢时转化为;受热释氢时固体残留率随温度的变化如图所示。下列说法错误的是( )
A.分子中存在配位键
B.水解释氢的化学方程式
C.110℃时残留固体的化学式可能为
D.若B点一种产物的最简式就是分子式,则该产物分子中σ键∶π键=2∶3
12.氯仿常因保存不慎而被氧化、产生剧毒物光气(COCl2),反应为2CHCl3+O2 2HCl+2COCl2,光气的结构式为 ,下列说法正确的是( )
A.COCl2分子中所有原子的最外层都满足8电子稳定结构
B.CHCl3分子中含有4个σ键,中心C原子采用sp2杂化
C.COCl2分子为含极性键的非极性分子
D.CHCl3为正四面体结构
13.X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z位于同一周期,X原子的最外层电子排布式是2s22p4,Z原子的核外电子数比Y原子少1。下列说法错误的是( )
A.CX2(C是原子核内含有6个质子的原子)分子是非极性分子
B.ZH3分子的立体构型为平面三角形
C.Z4分子是非极性分子
D.H2YO4的酸性比H3ZO4强
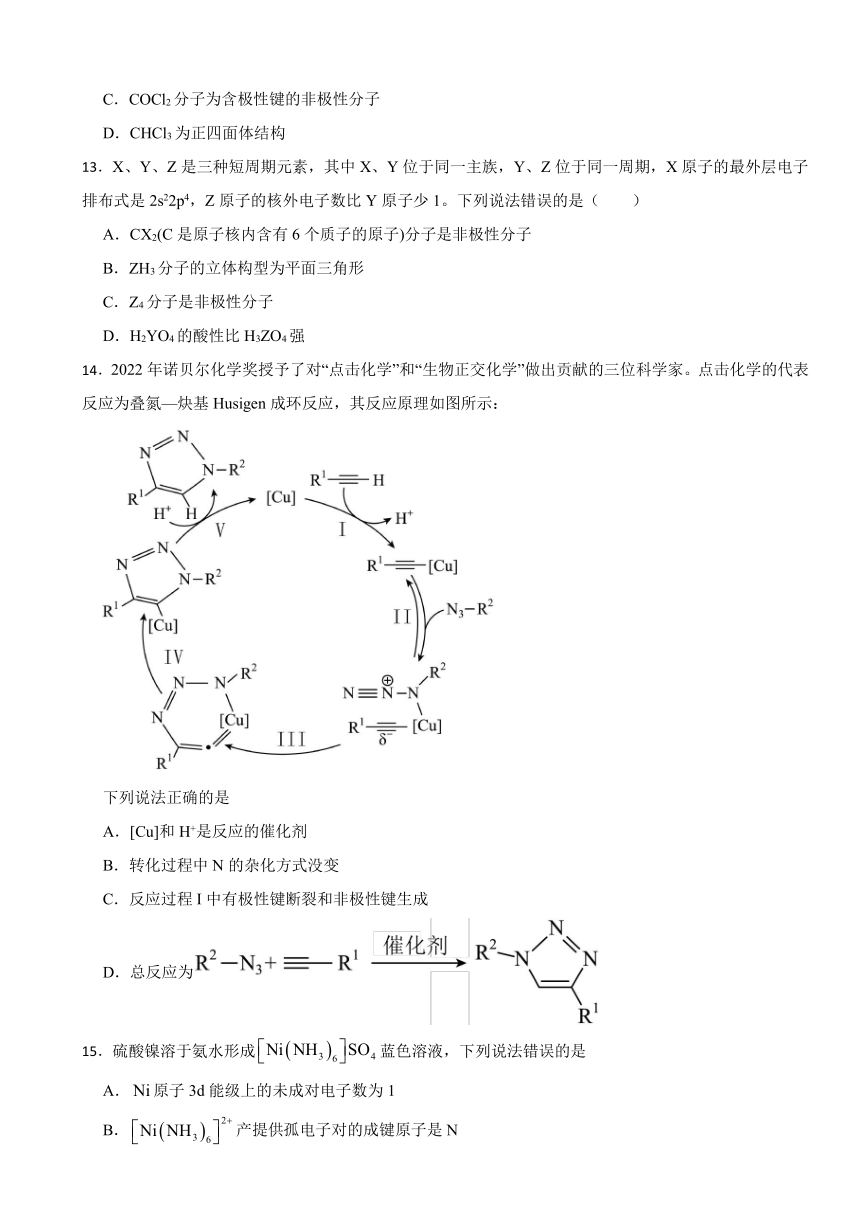
14.2022年诺贝尔化学奖授予了对“点击化学”和“生物正交化学”做出贡献的三位科学家。点击化学的代表反应为叠氮—炔基Husigen成环反应,其反应原理如图所示:
下列说法正确的是
A.[Cu]和H+是反应的催化剂
B.转化过程中N的杂化方式没变
C.反应过程I中有极性键断裂和非极性键生成
D.总反应为
15.硫酸镍溶于氨水形成蓝色溶液,下列说法错误的是
A.原子3d能级上的未成对电子数为1
B.产提供孤电子对的成键原子是N
C.中与之间形成配位键
D.中阴离子的立体构型是正四面体形
16.下列说法正确的是( )
A.乙烯与苯都能发生加成反应,所以都能使溴水褪色
B.①乙二醇②乙醇③丙烷④甘油沸点由低到高的顺序为:④①②③
C.可以用重结晶的方法提纯苯甲酸
D.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
17.下列说法正确的是( )
A.光束通过蔗糖溶液、CuSO4溶液、云、雾时,均无丁达尔效应
B.Al2O3熔点高、耐高温,实验室可以用Al2O3制成的坩埚加热NaOH固体至熔融态
C.Na2CO3固体中含有NaHCO3杂质,可用加热法除去
D.不同元素组成的多原子分子里,不可能存在非极性键
18.部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系如图。下列说法正确的是
A.X的气态氢化物中所有原子最外层都达到8电子结构
B.最高价氧化物的水化物的酸性W>R
C.H2Y比H2R稳定,是因为H2Y分子间存在氢键
D.X的气态氢化物和W的气态氢化物反应生成的产物只含有共价键
19.对H3O+的说法正确的是( )
A.O原子采取sp2杂化
B.O原子采取sp3杂化
C.离子中无配位键
D.离子中配体为O原子
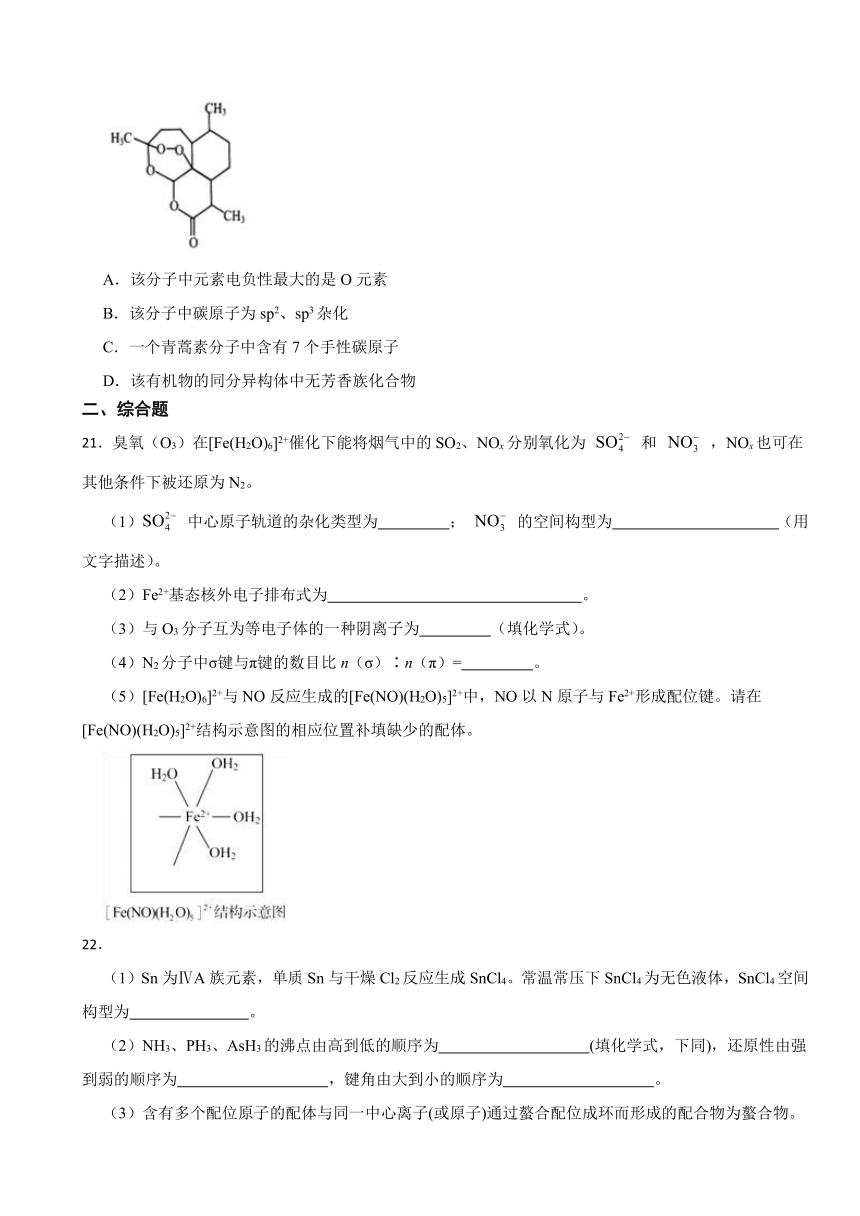
20.青蒿素是一种无色针状晶体,具有较好的抗疟疾效果,其分子结构如图所示。有关青蒿素的说法中错误的是( )
A.该分子中元素电负性最大的是O元素
B.该分子中碳原子为sp2、sp3杂化
C.一个青蒿素分子中含有7个手性碳原子
D.该有机物的同分异构体中无芳香族化合物
二、综合题
21.臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为 和 ,NOx也可在其他条件下被还原为N2。
(1) 中心原子轨道的杂化类型为 ; 的空间构型为 (用文字描述)。
(2)Fe2+基态核外电子排布式为 。
(3)与O3分子互为等电子体的一种阴离子为 (填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)= 。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
22.
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 (填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol 该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
23.CH4、NH3、H2O、HF是第二周期的氢化物,也是生产生活中的重要物质。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4的燃烧热为 。
(2)
NH3和H2O中稳定性较高的是: ,NH3和PH3中沸点较高的是: 。
(3)如图所示组成闭合回路,其中,甲装置是由CH4、O2和CO2为反应物,稀土金属材料为电极,以熔融碳酸盐为电解质形成的原电池;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
①装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为 。
②乙装置中a极上的电极反应式为 。
若在a极产生112 mL(标准状况)气体,则甲装置中消耗CH4 mL(标准状况),乙装置中所得溶液的pH= (忽略电解前后溶液体积变化)。
24.呋喃()、噻吩( )、吡咯()和苯结构相似,所有的原子共平面,具有芳香性,是有机工业的重要基础原料。利用高粱秆生产呋喃过程中会用到锌、铬和锰的化合物作催化剂。请回答下列问题:
(1)基态Zn原子的价电子轨道表示式为 ;Cr在元素周期表中的位置是 ;Mn属于 区。
(2)已知吡咯中含有大键(5个原子共用6个电子),则吡咯中N原子的价层孤电子对占据_______(填字母)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
(3) 、的碱性随N原子电子云密度的增大而增强,其中碱性较强的是 。
(4)呋喃的氢化饱和产物()极易溶于水,可能的原因是 。
25.工业合成氨是人类科学技术的一项重大突破。
I.合成氨反应为:。一定条件下,在2L密闭容器中充入一定量的、。测得各物质的浓度随时间变化如下表所示。
物质的量/(mol) 时间
0 2.0 6.0 0
2min 1.6
5min 3.0
(1)2min时,= mol。0~5min内,以的浓度变化表示反应的平均速率: 。
(2)下列能说明该反应达到平衡状态的是____(填标号)。
A.的质量保持不变
B.
C.的含量保持不变
D.容器中的压强不随时间变化
E.、和的物质的量之比为1:3:2
(3)如图所示是反应过程中的能量变化图。由图可知,该反应是 反应。(填“吸热”或“放热”)
II.合成氨反应可能的微观历程如图所示:
(4)过程③形成是 能量(填“吸收”或“放出”)。的化学键类型是 共价键(填“极性”或“非极性”)。
(5)吸附在催化剂表面的物质用*标注。已知过程③可以表示为,则过程②可以表示为 。
答案解析部分
1.【答案】C
【解析】【解答】A.CO2中C原子和O原子之间存在极性共价键,A不符合题意;
B.CH4中C原子和H原子之间存在极性共价键,B不符合题意;
C.Na2O2中钠离子和过氧根离子之间存在离子键,O与O之间存在非极性共价键,C符合题意;
D.MgCl2中镁离子和氯离子之间存在离子键,D不符合题意;
故答案为:C。
【分析】一般的活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键。
2.【答案】C
【解析】【解答】A.该物质的化学式为[PtCl4(NH3)2],化合物为配位化合物,则配体为Cl-、NH3,A不符合题意;
B.根据配位化学式为[PtCl4(NH3)2]可知:配合物中心原子的配位数为4+2=6,B不符合题意;
C.中心Pt与6个配位体形成6个配位键,即6个σ键,该配合物应是八面体结构,C符合题意;
D.该配合物中心Pt原子与6个配位体形成6个配位键,在配位体NH3分子中含有3个N-H共价键,共价键和配位键都是σ键,则1个配合物中含有σ键数目是6+2×3=12个,则1 mol该分子中含有12 mol σ键,D不符合题意;
故答案为:C。
【分析】实验式为 PtCl4·2NH3的物质,其水溶液不导电说明它不是离子化合物,在溶液中不能电离出阴、阳离子;加入 AgNO3 不产生沉淀,以强碱处理并没有NH3放出,说明不存在游离的氯离子和氨分子,所以该物质的配位化学式为[PtCl4(NH3)2],据此解答。
3.【答案】B
【解析】【解答】A. SO2、H2O、NH3三种分子都是含有极性键的极性分子,A不符合题意;
B. CH4中碳氢键为极性键,分子为正四面体结构,是非极性分子,C2H4是平面结构,是非极性分子,C6H6是平面正六边形结构,是非极性结构,B符合题意;
C. N2、Cl2、O3都含非极性键,C不符合题意;
D. H2O2、C2H6、PCl3都是极性分子,D不符合题意。
故答案为:B
【分析】(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
4.【答案】B
【解析】【解答】A.当pp电子云头碰头重叠时,形成键;肩并肩重叠时,形成键,故A不符合题意;
B.与中心原子杂化轨道类型相同,都为sp3杂化,故B符合题意;
C.氢键是一种较强的分子间作用力,不是化学键,故C不符合题意;
D.是非极性分子,是极性分子,故D不符合题意;
故答案为:B。
【分析】A. p电子与p电子可以形成键 ,也可以形成 键;
B.与中心原子均为sp3杂化;
C.氢键是一种分子间作用力;
D.是非极性分子,是极性分子。
5.【答案】D
【解析】【解答】A.H2O空间构型是V形,则H2O为极性键构成的极性分子,故A错;
B.HCl为极性键构成的极性分子,故B错;
C.氨气的空间构型为三角锥形结构,为极性分子,故C错;
D.甲烷分子的结构为正四面体结构,四个键的键长相同、键角相等,正负电荷重心重合,所以甲烷为非极性分子,故D符合题意;
故答案为:D。
【分析】非极性分子的正负电荷重心重合。
6.【答案】C
【解析】【解答】A.氢键的形成是提供空轨道和孤对电子,1个氧原子可以提供2个孤对电子,1个氢原子可以提供1个空轨道,因此可以形成4个氢键,故A不符合题意
B.含有氢键的物质的沸点可能增高,也有可能降低,如分子内和分子间的氢键沸点不同,故B不符合题意
C.分子间作用力包括范德华力和氢键,故C符合题意
D.水的状态的改变克服可范德华力和氢键,故D不符合题意
故答案为:C
【分析】A.考查的是氢键的形成原因
B.氢键对物质的熔沸点的影响可以增大可以降低
C.考查的是分子间作用力包括的内容
D.考查的是水的状态的改变克服的分子间作用力,主要是范德华力和氢键
7.【答案】D
【解析】【解答】CH4、CCl4均为非极性分子,CH4分子中的原子无孤电子对,CCl4分子中的氯原子含有孤电子对,A不符合题意;
甲醛分子中心C原子上无孤电子对,价电子对数为3,空间结构为平面三角形,碳原子位于三角形内部,正电荷重心和负电荷重心不重合,所以为极性分子,B不符合题意;
甲烷分子的空间结构是正四面体形,键角均为109°28',二氯甲烷分子的空间结构是四面体形,键角发生了变化,不等于109°28' ,C不符合题意;
NH3分子中中心N原子最外层满足8电子结构,为极性分子,而中心原子最外层满足8电子结构的AB.型分子,若中心原子的化合价的绝对值等于价电子数,则一定是非极性分子,如CH, D符合题意。
【分析】A.配原子上可能有孤电子对;
B.根据价层电子对互斥理论分析;
C.C-Cl键与C-H键不同;
D.若中心原子的化合价的绝对值等于价电子数,则一定是非极性分子。
8.【答案】D
【解析】【解答】A、属于酸,为共价化合物,故A错误;
B、为强酸,HF为弱酸, 酸性强于HF,故B错误;
C、BF3中心B原子的价层电子对数为3,不含孤电子对,空间结构是平面三角形,故C错误;
D、中B含有空轨道,F含有孤电子对,B提供空轨道,F提供孤电子可形成配位键,故D正确;
故答案为:D。
【分析】A、 为共价化合物;
B、为强酸,HF为弱酸;
C、BF3中心B原子的价层电子对数为3,不含孤电子对;
D、中B含有空轨道,F含有孤电子对。
9.【答案】B
【解析】【解答】①因第ⅦA族中,F的非金属性最强,HF中分子之间存在氢键,则HF的熔、沸点比ⅦA族其他元素氢化物的高,①符合题意;
②因乙醇、水分子之间能形成氢键,则乙醇可以和水以任意比互溶,②符合题意;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,③符合题意;
④水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,④不符合题意;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,⑤符合题意;
综上,上述现象与氢键有关的是①②③⑤,B符合题意;
故答案为:B
【分析】N、O、F的非金属性强,且其原子半径小,易形成氢键,氢键的存在,会影响物质的熔沸点、水溶性等物理性质,但不影响物质的化学性质。
10.【答案】C
【解析】【解答】A.NaOH含有离子键和极性共价键,A不合题意;
B.NaCl只含离子键,B不合题意;
C.Cl2只含非极性共价键,C符合题意;
D.H2S只含极性共价键,D不合题意;
故答案为:C。
【分析】非单原子分子形成的单质或由原子直接构成的单质,只含非极性共价键。
11.【答案】D
【解析】【解答】A.N存在孤电子对,B原子为缺电子原子,其提供空轨道故存在配位键,故A不符合题意;
B.根据题意氨硼烷水解释氢时转化为,水解释氢的化学方程式,故B不符合题意;
C.110℃时, 根据图可知M(A) = M(NH3BH3) 93.55% =3193.55% =29,故A为BNH4,故C不符合题意;
D.B点时,根据图可知M(B) = M(NH3BH3) 87.10% =3187.10%=27,B点一种产物的最简式就是分子式,故B为NH2=B,键: 键为3:2,故D符合题意;
故答案为:D。
【分析】A.含有孤电子对和含有空轨道的原子之间易形成配位键;
B.氨硼烷水解释氢时转化为和氢气;
C.110℃时,M(A) = M(NH3BH3) 93.55% =3193.55% =29。
12.【答案】A
【解析】【解答】A.Cl最外层有7个电子,O最外层有6个电子、C最外层有4个电子,由结构可知,含2个C-Cl、1个C=O,所有原子都满足最外层8电子稳定结构,故A符合题意;
B.CHCl3中心原子C的价电子对数为4+ =4,不含有孤电子对,分子中含有4个σ键,C原子采用sp3杂化,故B不符合题意;
C.由 结构可知,该分子中含有C=O、C-Cl键,正负电荷的中心不重合,为极性分子,故C不符合题意;
D.由 结构可知,该分子中C-H键与C-Cl键键长不等,为含极性键的四面体形分子,而不是正四面体,故D不符合题意;
答案为A。
【分析】根据结构简式, 所有碳原子均达到8个电子稳定结构,形成碳氧双键,正负电荷中心不重合,为极性分子,因此为sp2杂化,氯仿中形成4个单键,因此碳原子为sp3杂化,键长不同,故为简单的四面体。
13.【答案】B
【解析】【解答】X、Y、Z是3种短周期元素,X原子的最外层电子排布式是2s22p4,则X为氧元素;X、Y位于同一族,故Y为硫元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为磷元素;
A.原子核内含6个质子的元素是碳元素,CO2分子结构是直线型,为非极性分子,故A不符合题意;
B.PH3分子与NH3是等电子体,其结构应为三角锥形,故B符合题意;
C.P4分子只含有非极性共价键,是非极性分子,故C不符合题意;
D.硫的非金属性比P强,则酸H2SO4比酸H3PO4的酸性强,故D不符合题意;
故答案为B。
【分析】先根据条件进行判断XYZ的元素符号,再结合选项进行判断即可
14.【答案】D
【解析】【解答】A.根据流程可知,该反应中[Cu]为催化剂,H+是中间产物,故A不符合题意;
B.根据流程可知,N3-R2中N原子有形成三键的氮原子,为sp杂化,后续产物中变为双键,为sp2杂化,故B不符合题意;
C.反应过程I中有极性键断裂,但没有非极性键形成,故C不符合题意;
D.据图可知,该流程中初始反应物为N3-R2和HCCR1,最终产物为,化学方程式为N3-R2+HCCR1,故D符合题意;
故答案为:D。
【分析】A.催化剂在反应前后质量和化学性质均不变;
B.N3-R2中N原子有形成三键的氮原子,后续产物中变为双键;
C.相同的非金属原子之间形成非极性键,不同的非金属原子之间形成极性键。
15.【答案】A
【解析】【解答】A. Ni是28号元素,原子的价电子排布式为3d84s2,能级上的未成对电子数2,故A符合题意;
B. 中配体是NH3,配位原子是N,提供孤电子对的成键原子是N,故B不符合题意;
C. 中Ni2+与NH3之间形成配位键,故C不符合题意;
D. 中阴离子是SO,S原子价层电子对数为4,其立体构型是正四面体形,故D不符合题意;
故答案为:A。
【分析】依据配合物的结构及构造原理分析。
16.【答案】C
【解析】【解答】A.乙烯能与溴水发生加成反应生成1,2-二溴乙烷,能使溴水褪色,而苯不能使溴水因反应而褪色,而苯却能使溴水由于萃取作用而褪色,故A不符合题意;
B.①②④中都含有氢键,分子中羟基数目越多,相对分子质量越大,沸点越高,分子中所含有的羟基数④>①>②,且相对分子质量④>①>②,故沸点④>①>②;丙烷分子间不存在氢键,常温下为气体,几种物质中沸点最低,故沸点由高到低的顺序是:④>①>②>③,故B不符合题意;
C.苯甲酸为无色、无味片状晶体,含杂质的粗苯甲酸因制备苯甲酸的方法不同所含的杂质不同,均可采用溶解→加入氢氧化钠→过滤→加适量稀盐酸→冰水混合溶液冷却→过滤→重结晶→提纯苯甲酸,故C符合题意;
D.为防止酸液的飞溅,应先加入浓硝酸,最后加入浓硫酸,故D不符合题意。
故答案为:C。
【分析】A、根据官能团的结构与特点分析解答;
B、含有氢键的分子中羟基数目越多,相对分子质量越大,沸点越高;
C、可利用重结晶的方法除去苯甲酸中的杂质;
D、根据实验室中制取苯甲酸的步骤分析解答。
17.【答案】C
【解析】【解答】A.云、雾属于胶体,可以产生丁达尔效应,A不符合题意;
B.氧化铝可以和氢氧化钠反应,不能用Al2O3制成的坩埚加热NaOH固体至熔融态,B不符合题意;
C.碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,可以通过加热的方法除去,C符合题意;
D.不同元素组成的多原子分子里可存在极性键、非极性键,如过氧化氢中含非极性键,D不符合题意;
故答案为:C。
【分析】A.胶体能产生丁达尔效应;
B.氧化铝能够与氢氧化钠反应;
D.不同元素组成的多原子分子里可存在极性键、非极性键。
18.【答案】B
【解析】【解答】依据题意可知X、Y、Z、R、W分别为N、O、Na、S、Cl
A. 氢原子核外最多2个电子,故气态氢化物中不可能所有原子最外层都达到8电子结构,A错误;
B.依据非金属性越强,最高价氧化物的水化物的酸性越强,同周期,从左向右,非金属性逐渐增强,故非金属性Cl>S,故最高价氧化物的水化物的酸性HClO4>H2SO4,B正确;
C. 氢化物的稳定性与非金属性有关,是化学性质,氢键只影响物质的物理性质,C错误;
D. NH3和HCl会发生反应生成NH4Cl,NH4Cl是离子化合物,含有共价键和离子键,D错误;
故答案为:B。
【分析】A. 氢原子核外最多2个电子;
B.依据非金属性越强,最高价氧化物的水化物的酸性越强;
C. 氢化物的稳定性与非金属性有关,是化学性质;
D. NH4Cl是离子化合物。
19.【答案】B
【解析】【解答】H3O+的中心原子的价层电子对数是4,采取的是sp3杂化,H2O和H+之间形成配位键。故B符合题意
故正确答案是:B
【分析】根据计算出 H3O+的孤对电子和价层电子对即可判断杂化方式和形成的配位键
20.【答案】D
【解析】【解答】A.该分子中含有碳、氢、氧元素,元素电负性大小关系为HB.该分子中碳原子主要形成碳碳单键和碳氧双键,碳氧双键为sp2,碳碳单键为sp3杂化,故B不符合题意;
C.手性碳原子是指与四个各不相同原子或基团相连的碳原子,则有如图所示 ,共7个,故C不符合题意;
D.该有机物分子式为C15H22O5,不饱和度为 ,而苯环的不饱和度为4,则同分异构体中可能有芳香族化合物,故D符合题意;
故答案为D。
【分析】根据结构简式即可判断出碳原子的杂化方式为sp2和sp3杂化,根据含有的元素,非金属性越强,电负性越强,氧元素的非金属性越强,电负性越强,根据结构简式即可找出含有的手性碳原子个数,根据结构简式找出不饱和度即可判断是否含有芳香族化合物
21.【答案】(1)sp3 ;平面(正)三角形
(2)[Ar]3d6或1s22s22p63s23p63d6
(3)NO2
(4)1∶2
(5)
【解析】【解答】解:(1)SO42-中中心原子S的价层电子对数为 (6+2-4 2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为 (5+1-3 2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
(2)Fe原子核外有26个电子,根据构造原理,基态Fe的核外电子排布式为1s22s22p63s23p63d64s2,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6。
(3)用替代法,与O3互为等电子体的一种阴离子为NO2-。
(4)N2的结构式为N N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子,答案为: 。
【分析】注意等电子体是指原子数相同,价电子数相同的分子互为等电子体,互为等电子体的分子具有相同的结构,而等电子体根据价电子数相同可以用同主族进行替换。(2)中注意失去电子时先失去最外层电子。
22.【答案】(1)正四面体形
(2)NH3、AsH3、PH3;AsH3、PH3、NH3;NH3、PH3、AsH3
(3)6;1
【解析】【解答】(1)SnCl4分子中中心Sn原子价电子对数为4+=4,不含孤电子对,采取sp3杂化,分子的空间构型为正四面体形。
(2)NH3、PH3、AsH3的组成和结构相似,相对分子质量越大,分子间作用力越大,沸点越高,但由于NH,分子间存在氢键,分子间作用力最大,沸点反常的高,故沸点由高到低的顺序为NH3、AsH3、PH3;同主族元素非金属性越强,简单氢化物的还原性越弱,因非金属性:N>P>As,故还原性由强到弱的顺序为AsH3、PH3、NH3;同主族元素的简单氢化物,中心原子的电负性越大,键角越大,故键角由大到小的顺序为NH3、PH3、AsH3。
(3)根据题目信息,结合题图甲中的结构,含多个配位原子的配体与Cd2+通过螯合作用配位成环,其形成的配位键均是通过螯合作用形成的配位键,可得1 mol该配合物中通过螯合作用形成的配位键有6 mol;配合物中含有2个N原子的配体中,N的杂化方式为sp2,再结合其余N原子的价电子对数,可知该螯合物中N原子的杂化方式都是sp2杂化,故该螯合物中N的杂化方式有1种。
【分析】
(1)SnCl4空间结构类似甲烷,属于正四面体结构;
(2)结构相似,相对分子质量越大,沸点越大,但氨气含氢键,沸点较大;非金属性越强,简单氢化物的还原性越弱;同主族的氢化物,电负性越大,键角越大;
(3)根据题意和图像分析,找其配位键即可,故配位键有6个,杂化类型根据成键情况是sp2杂化,且只有一种。
23.【答案】(1)ΔH=-890.31 kJ·mol-1
(2)H2O;NH3
(3)CH4;O2+4e-+2CO2=2CO32-;4OH--4e-=O2↑+2H2O;56;1
【解析】【解答】(1)16g甲烷的物质的量是1mol,16g CH4完全燃烧生成液态水时放出的热量是890.31kJ,即1molCH4完全燃烧生成液态水时放出的热量是890.31kJ,所以甲烷的燃烧热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.31 kJ·mol-1,故答案为:ΔH=-890.31 kJ·mol-1 。
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性O>N,则氢化物的稳定性,NH3<H2O;结构相似时,相对分子质量越大,分子间作用力越大,但氨气分子间还存在氢键,则NH3的沸点高于PH3;故答案为:H2O ,NH3。
(3)①b电极上有红色物质生成,则b是阴极,所以a是阳极,c是负极、d是正极,通入甲烷的电极是负极,所以A是CH4、B是二氧化碳和氧气,d电极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为:O2+4e-+2CO2=2CO32-,故答案为:CH4 ,O2+4e-+2CO2=2CO32-。
②a是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=O2↑+2H2O, a极上生成n(O2)=0.112L÷22.4L/mol=0.005mol,生成0.005mol氧气转移电子物质的量=0.005mol×4=0.02mol,根据转移电子相等计算消耗甲烷体=0.02mol/8×22.4L/mol=56mL;电池反应式为2Cu2++2H2O=4H++O2↑+2Cu,根据方程式知,n(H+)=4n(O2)=4×0.005mol=0.02mol,c(H+)=0.02mol/0.2L=0.1mol/L,则溶液的pH=1,
故答案为:4OH--4e-=O2↑+2H2O,56 ,1。
【分析】 (1)根据燃烧热的定义进行判断;
(2)氢化物的稳定性与元素的非金属性强弱有关,氨气分子间能够形成氢键,沸点较高;
(3)①根据b电极上有红色物质析出,判断b电极为阴极,则c电极为负极,据此判断气体A和电极方程式;
②乙装置是电解硫酸铜溶液,结合电解原理进行分析即可。
24.【答案】(1);第四周期VIB族;d
(2)D
(3)
(4) 与水分子之间能形成氢键
【解析】【解答】(1) 基态Zn原子的价电子轨道表示式是 ;Cr在周期表中的位置是第四周期VIB族;Mn位于元素周期表的d区;
故答案为:
第1空、
第2空、第四周期VIB族
第3空、d
(2) 吡咯含有大键 ,N原子采用sp2杂化;
故答案为:D
(3) -Cl是吸电子基团,会使N原子电子云密度减小,碱性减弱 ;
故答案为: 第1空、
(4) 呋喃的氢化饱和产物 () 可以和水形成分子间氢键;
故答案为: 第1空、 与水分子之间能形成氢键
【分析】(1) 锌原子序数30,基态Zn原子的价电子轨道表示式是 ;Cr是24号元素,在周期表中的位置是第四周期VIB族;Mn元素的最后一个电子填入了 d能级;
(2) 吡啶中N原子是采用sp2杂化;
(3) 吸电子基团,电子云密度减小,碱性减弱 ;
(4) 和水形成分子间氢键得化合物, 易溶于水 。
25.【答案】(1)4.8;0.2mol/(min·L)
(2)A;C;D
(3)放热
(4)放出;极性
(5)
【解析】【解答】(1) 0~2min,氮气消耗了0.4mol,氢气消耗了1.2mol,2min时, =6.0mol-1.2mol=4.8mol。0~5min内,以 的浓度变化表示反应的平均速率:v(H2)=6-3/2x5=0.3mol/L/min,v(NH3)=0.2mol/L/min ;
(2) A. 的质量保持不变,反应达到了平衡状态;
B. ,不能说明达到了平衡;
C. 的含量保持不变,反应达到了平衡状态;
D. 容器中的压强随着反应的进行而变化,不随时间变化时达到了平衡状态;
E.、 、和 和的物质的量之比为1:3:2时,不能说明平衡,选ACD;
(3) 反应物的总能量高于生成物的总能量,为放热反应;
(4) 过程③形成化学键,放出能量。不同非金属原子之间形成的共价键是极性共价键, 的化学键类型是极性共价键。
(5) 过程②可以表示为 。
【分析】(1)平均反应速率的计算公式使用;
(2)A. 质量保持不变,反应达到了平衡状态;
B. 反应速率和化学计量数的比值 ,不能说明达到了平衡;
C. 含量保持不变,反应达到了平衡状态;
D. 容器中的压强随着反应的进行而变化,不随时间变化时达到了平衡状态;
E.、根据物质的量之比,不能说明平衡;
(3)反应物的总能量高于生成物的总能量,为放热反应;不同非金属原子之间形成的共价键是极性共价键。
一、单选题
1.在下列物质中,含有非极性共价键的是( )
A.CO2 B.CH4 C.Na2O2 D.MgCl2
2.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中错误的是( )
A.该配合物的配体为Cl-、NH3
B.该配合物的配位数为6
C.该配合物的空间构型可能为平面正方形结构
D.1 mol该分子中含有12 mol σ键
3.下列各组分子中都属于含极性键的非极性分子的是 ( )
A.SO2、H2O、NH3 B.CH4 、C2H4、C6H6
C.N2、Cl2、O3 D.H2O2、C2H6、PCl3
4.下列有关说法正确的是( )
A.s电子与s电子间形成的是键,p电子与p电子间形成的是键
B.与中心原子杂化轨道类型相同
C.氢键是一种特殊的化学键,它广泛存在于物质中
D.和化学键的类型和分子的极性(极性或非极性)都相同
5.下列分子属于非极性分子的是( )
A.H2O B.HCl C.NH3 D.CH4
6.下列说法正确的是 ( )
A.一个水分子与其他水分子间只能形成 2 个氢键
B.含氢键的物质的熔、沸点一定升高
C.分子间作用力包括氢键和范德华力
D.当 H2O 由液态变为气体时只破坏了氢键
7.下列说法正确的是( )
A.非极性分子中的原子上一定不含孤电子对
B.平面三角形分子一定是非极性分子
C.二氯甲烷(CH2Cl2)分子的中心原子采取sp3杂化,键角均为109°28'
D.ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子
8.强酸可由如下反应制备,。下列说法正确的是( )
A.的电子式为 B.相同条件下,酸性弱于HF
C.BF3的空间结构是三角锥形 D.中含有配位键
9.下列现象与氢键有关的是( )
①HF的熔、沸点比ⅦA族其他元素氢化物的高 ②乙醇可以与水以任意比互溶 ③冰的密度比液态水的密度小 ④水分子高温下也很稳定 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.②③④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
10.下列物质中,只含有非极性共价键的是( )
A.NaOH B.NaCl C.Cl2 D.H2S
11.(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。其释氢方式主要有两种,水解释氢和热分解释氢。氨硼烷水解释氢时转化为;受热释氢时固体残留率随温度的变化如图所示。下列说法错误的是( )
A.分子中存在配位键
B.水解释氢的化学方程式
C.110℃时残留固体的化学式可能为
D.若B点一种产物的最简式就是分子式,则该产物分子中σ键∶π键=2∶3
12.氯仿常因保存不慎而被氧化、产生剧毒物光气(COCl2),反应为2CHCl3+O2 2HCl+2COCl2,光气的结构式为 ,下列说法正确的是( )
A.COCl2分子中所有原子的最外层都满足8电子稳定结构
B.CHCl3分子中含有4个σ键,中心C原子采用sp2杂化
C.COCl2分子为含极性键的非极性分子
D.CHCl3为正四面体结构
13.X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z位于同一周期,X原子的最外层电子排布式是2s22p4,Z原子的核外电子数比Y原子少1。下列说法错误的是( )
A.CX2(C是原子核内含有6个质子的原子)分子是非极性分子
B.ZH3分子的立体构型为平面三角形
C.Z4分子是非极性分子
D.H2YO4的酸性比H3ZO4强
14.2022年诺贝尔化学奖授予了对“点击化学”和“生物正交化学”做出贡献的三位科学家。点击化学的代表反应为叠氮—炔基Husigen成环反应,其反应原理如图所示:
下列说法正确的是
A.[Cu]和H+是反应的催化剂
B.转化过程中N的杂化方式没变
C.反应过程I中有极性键断裂和非极性键生成
D.总反应为
15.硫酸镍溶于氨水形成蓝色溶液,下列说法错误的是
A.原子3d能级上的未成对电子数为1
B.产提供孤电子对的成键原子是N
C.中与之间形成配位键
D.中阴离子的立体构型是正四面体形
16.下列说法正确的是( )
A.乙烯与苯都能发生加成反应,所以都能使溴水褪色
B.①乙二醇②乙醇③丙烷④甘油沸点由低到高的顺序为:④①②③
C.可以用重结晶的方法提纯苯甲酸
D.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
17.下列说法正确的是( )
A.光束通过蔗糖溶液、CuSO4溶液、云、雾时,均无丁达尔效应
B.Al2O3熔点高、耐高温,实验室可以用Al2O3制成的坩埚加热NaOH固体至熔融态
C.Na2CO3固体中含有NaHCO3杂质,可用加热法除去
D.不同元素组成的多原子分子里,不可能存在非极性键
18.部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系如图。下列说法正确的是
A.X的气态氢化物中所有原子最外层都达到8电子结构
B.最高价氧化物的水化物的酸性W>R
C.H2Y比H2R稳定,是因为H2Y分子间存在氢键
D.X的气态氢化物和W的气态氢化物反应生成的产物只含有共价键
19.对H3O+的说法正确的是( )
A.O原子采取sp2杂化
B.O原子采取sp3杂化
C.离子中无配位键
D.离子中配体为O原子
20.青蒿素是一种无色针状晶体,具有较好的抗疟疾效果,其分子结构如图所示。有关青蒿素的说法中错误的是( )
A.该分子中元素电负性最大的是O元素
B.该分子中碳原子为sp2、sp3杂化
C.一个青蒿素分子中含有7个手性碳原子
D.该有机物的同分异构体中无芳香族化合物
二、综合题
21.臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为 和 ,NOx也可在其他条件下被还原为N2。
(1) 中心原子轨道的杂化类型为 ; 的空间构型为 (用文字描述)。
(2)Fe2+基态核外电子排布式为 。
(3)与O3分子互为等电子体的一种阴离子为 (填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)= 。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
22.
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 (填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol 该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
23.CH4、NH3、H2O、HF是第二周期的氢化物,也是生产生活中的重要物质。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4的燃烧热为 。
(2)
NH3和H2O中稳定性较高的是: ,NH3和PH3中沸点较高的是: 。
(3)如图所示组成闭合回路,其中,甲装置是由CH4、O2和CO2为反应物,稀土金属材料为电极,以熔融碳酸盐为电解质形成的原电池;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
①装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为 。
②乙装置中a极上的电极反应式为 。
若在a极产生112 mL(标准状况)气体,则甲装置中消耗CH4 mL(标准状况),乙装置中所得溶液的pH= (忽略电解前后溶液体积变化)。
24.呋喃()、噻吩( )、吡咯()和苯结构相似,所有的原子共平面,具有芳香性,是有机工业的重要基础原料。利用高粱秆生产呋喃过程中会用到锌、铬和锰的化合物作催化剂。请回答下列问题:
(1)基态Zn原子的价电子轨道表示式为 ;Cr在元素周期表中的位置是 ;Mn属于 区。
(2)已知吡咯中含有大键(5个原子共用6个电子),则吡咯中N原子的价层孤电子对占据_______(填字母)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
(3) 、的碱性随N原子电子云密度的增大而增强,其中碱性较强的是 。
(4)呋喃的氢化饱和产物()极易溶于水,可能的原因是 。
25.工业合成氨是人类科学技术的一项重大突破。
I.合成氨反应为:。一定条件下,在2L密闭容器中充入一定量的、。测得各物质的浓度随时间变化如下表所示。
物质的量/(mol) 时间
0 2.0 6.0 0
2min 1.6
5min 3.0
(1)2min时,= mol。0~5min内,以的浓度变化表示反应的平均速率: 。
(2)下列能说明该反应达到平衡状态的是____(填标号)。
A.的质量保持不变
B.
C.的含量保持不变
D.容器中的压强不随时间变化
E.、和的物质的量之比为1:3:2
(3)如图所示是反应过程中的能量变化图。由图可知,该反应是 反应。(填“吸热”或“放热”)
II.合成氨反应可能的微观历程如图所示:
(4)过程③形成是 能量(填“吸收”或“放出”)。的化学键类型是 共价键(填“极性”或“非极性”)。
(5)吸附在催化剂表面的物质用*标注。已知过程③可以表示为,则过程②可以表示为 。
答案解析部分
1.【答案】C
【解析】【解答】A.CO2中C原子和O原子之间存在极性共价键,A不符合题意;
B.CH4中C原子和H原子之间存在极性共价键,B不符合题意;
C.Na2O2中钠离子和过氧根离子之间存在离子键,O与O之间存在非极性共价键,C符合题意;
D.MgCl2中镁离子和氯离子之间存在离子键,D不符合题意;
故答案为:C。
【分析】一般的活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键。
2.【答案】C
【解析】【解答】A.该物质的化学式为[PtCl4(NH3)2],化合物为配位化合物,则配体为Cl-、NH3,A不符合题意;
B.根据配位化学式为[PtCl4(NH3)2]可知:配合物中心原子的配位数为4+2=6,B不符合题意;
C.中心Pt与6个配位体形成6个配位键,即6个σ键,该配合物应是八面体结构,C符合题意;
D.该配合物中心Pt原子与6个配位体形成6个配位键,在配位体NH3分子中含有3个N-H共价键,共价键和配位键都是σ键,则1个配合物中含有σ键数目是6+2×3=12个,则1 mol该分子中含有12 mol σ键,D不符合题意;
故答案为:C。
【分析】实验式为 PtCl4·2NH3的物质,其水溶液不导电说明它不是离子化合物,在溶液中不能电离出阴、阳离子;加入 AgNO3 不产生沉淀,以强碱处理并没有NH3放出,说明不存在游离的氯离子和氨分子,所以该物质的配位化学式为[PtCl4(NH3)2],据此解答。
3.【答案】B
【解析】【解答】A. SO2、H2O、NH3三种分子都是含有极性键的极性分子,A不符合题意;
B. CH4中碳氢键为极性键,分子为正四面体结构,是非极性分子,C2H4是平面结构,是非极性分子,C6H6是平面正六边形结构,是非极性结构,B符合题意;
C. N2、Cl2、O3都含非极性键,C不符合题意;
D. H2O2、C2H6、PCl3都是极性分子,D不符合题意。
故答案为:B
【分析】(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
4.【答案】B
【解析】【解答】A.当pp电子云头碰头重叠时,形成键;肩并肩重叠时,形成键,故A不符合题意;
B.与中心原子杂化轨道类型相同,都为sp3杂化,故B符合题意;
C.氢键是一种较强的分子间作用力,不是化学键,故C不符合题意;
D.是非极性分子,是极性分子,故D不符合题意;
故答案为:B。
【分析】A. p电子与p电子可以形成键 ,也可以形成 键;
B.与中心原子均为sp3杂化;
C.氢键是一种分子间作用力;
D.是非极性分子,是极性分子。
5.【答案】D
【解析】【解答】A.H2O空间构型是V形,则H2O为极性键构成的极性分子,故A错;
B.HCl为极性键构成的极性分子,故B错;
C.氨气的空间构型为三角锥形结构,为极性分子,故C错;
D.甲烷分子的结构为正四面体结构,四个键的键长相同、键角相等,正负电荷重心重合,所以甲烷为非极性分子,故D符合题意;
故答案为:D。
【分析】非极性分子的正负电荷重心重合。
6.【答案】C
【解析】【解答】A.氢键的形成是提供空轨道和孤对电子,1个氧原子可以提供2个孤对电子,1个氢原子可以提供1个空轨道,因此可以形成4个氢键,故A不符合题意
B.含有氢键的物质的沸点可能增高,也有可能降低,如分子内和分子间的氢键沸点不同,故B不符合题意
C.分子间作用力包括范德华力和氢键,故C符合题意
D.水的状态的改变克服可范德华力和氢键,故D不符合题意
故答案为:C
【分析】A.考查的是氢键的形成原因
B.氢键对物质的熔沸点的影响可以增大可以降低
C.考查的是分子间作用力包括的内容
D.考查的是水的状态的改变克服的分子间作用力,主要是范德华力和氢键
7.【答案】D
【解析】【解答】CH4、CCl4均为非极性分子,CH4分子中的原子无孤电子对,CCl4分子中的氯原子含有孤电子对,A不符合题意;
甲醛分子中心C原子上无孤电子对,价电子对数为3,空间结构为平面三角形,碳原子位于三角形内部,正电荷重心和负电荷重心不重合,所以为极性分子,B不符合题意;
甲烷分子的空间结构是正四面体形,键角均为109°28',二氯甲烷分子的空间结构是四面体形,键角发生了变化,不等于109°28' ,C不符合题意;
NH3分子中中心N原子最外层满足8电子结构,为极性分子,而中心原子最外层满足8电子结构的AB.型分子,若中心原子的化合价的绝对值等于价电子数,则一定是非极性分子,如CH, D符合题意。
【分析】A.配原子上可能有孤电子对;
B.根据价层电子对互斥理论分析;
C.C-Cl键与C-H键不同;
D.若中心原子的化合价的绝对值等于价电子数,则一定是非极性分子。
8.【答案】D
【解析】【解答】A、属于酸,为共价化合物,故A错误;
B、为强酸,HF为弱酸, 酸性强于HF,故B错误;
C、BF3中心B原子的价层电子对数为3,不含孤电子对,空间结构是平面三角形,故C错误;
D、中B含有空轨道,F含有孤电子对,B提供空轨道,F提供孤电子可形成配位键,故D正确;
故答案为:D。
【分析】A、 为共价化合物;
B、为强酸,HF为弱酸;
C、BF3中心B原子的价层电子对数为3,不含孤电子对;
D、中B含有空轨道,F含有孤电子对。
9.【答案】B
【解析】【解答】①因第ⅦA族中,F的非金属性最强,HF中分子之间存在氢键,则HF的熔、沸点比ⅦA族其他元素氢化物的高,①符合题意;
②因乙醇、水分子之间能形成氢键,则乙醇可以和水以任意比互溶,②符合题意;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,③符合题意;
④水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,④不符合题意;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,⑤符合题意;
综上,上述现象与氢键有关的是①②③⑤,B符合题意;
故答案为:B
【分析】N、O、F的非金属性强,且其原子半径小,易形成氢键,氢键的存在,会影响物质的熔沸点、水溶性等物理性质,但不影响物质的化学性质。
10.【答案】C
【解析】【解答】A.NaOH含有离子键和极性共价键,A不合题意;
B.NaCl只含离子键,B不合题意;
C.Cl2只含非极性共价键,C符合题意;
D.H2S只含极性共价键,D不合题意;
故答案为:C。
【分析】非单原子分子形成的单质或由原子直接构成的单质,只含非极性共价键。
11.【答案】D
【解析】【解答】A.N存在孤电子对,B原子为缺电子原子,其提供空轨道故存在配位键,故A不符合题意;
B.根据题意氨硼烷水解释氢时转化为,水解释氢的化学方程式,故B不符合题意;
C.110℃时, 根据图可知M(A) = M(NH3BH3) 93.55% =3193.55% =29,故A为BNH4,故C不符合题意;
D.B点时,根据图可知M(B) = M(NH3BH3) 87.10% =3187.10%=27,B点一种产物的最简式就是分子式,故B为NH2=B,键: 键为3:2,故D符合题意;
故答案为:D。
【分析】A.含有孤电子对和含有空轨道的原子之间易形成配位键;
B.氨硼烷水解释氢时转化为和氢气;
C.110℃时,M(A) = M(NH3BH3) 93.55% =3193.55% =29。
12.【答案】A
【解析】【解答】A.Cl最外层有7个电子,O最外层有6个电子、C最外层有4个电子,由结构可知,含2个C-Cl、1个C=O,所有原子都满足最外层8电子稳定结构,故A符合题意;
B.CHCl3中心原子C的价电子对数为4+ =4,不含有孤电子对,分子中含有4个σ键,C原子采用sp3杂化,故B不符合题意;
C.由 结构可知,该分子中含有C=O、C-Cl键,正负电荷的中心不重合,为极性分子,故C不符合题意;
D.由 结构可知,该分子中C-H键与C-Cl键键长不等,为含极性键的四面体形分子,而不是正四面体,故D不符合题意;
答案为A。
【分析】根据结构简式, 所有碳原子均达到8个电子稳定结构,形成碳氧双键,正负电荷中心不重合,为极性分子,因此为sp2杂化,氯仿中形成4个单键,因此碳原子为sp3杂化,键长不同,故为简单的四面体。
13.【答案】B
【解析】【解答】X、Y、Z是3种短周期元素,X原子的最外层电子排布式是2s22p4,则X为氧元素;X、Y位于同一族,故Y为硫元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为磷元素;
A.原子核内含6个质子的元素是碳元素,CO2分子结构是直线型,为非极性分子,故A不符合题意;
B.PH3分子与NH3是等电子体,其结构应为三角锥形,故B符合题意;
C.P4分子只含有非极性共价键,是非极性分子,故C不符合题意;
D.硫的非金属性比P强,则酸H2SO4比酸H3PO4的酸性强,故D不符合题意;
故答案为B。
【分析】先根据条件进行判断XYZ的元素符号,再结合选项进行判断即可
14.【答案】D
【解析】【解答】A.根据流程可知,该反应中[Cu]为催化剂,H+是中间产物,故A不符合题意;
B.根据流程可知,N3-R2中N原子有形成三键的氮原子,为sp杂化,后续产物中变为双键,为sp2杂化,故B不符合题意;
C.反应过程I中有极性键断裂,但没有非极性键形成,故C不符合题意;
D.据图可知,该流程中初始反应物为N3-R2和HCCR1,最终产物为,化学方程式为N3-R2+HCCR1,故D符合题意;
故答案为:D。
【分析】A.催化剂在反应前后质量和化学性质均不变;
B.N3-R2中N原子有形成三键的氮原子,后续产物中变为双键;
C.相同的非金属原子之间形成非极性键,不同的非金属原子之间形成极性键。
15.【答案】A
【解析】【解答】A. Ni是28号元素,原子的价电子排布式为3d84s2,能级上的未成对电子数2,故A符合题意;
B. 中配体是NH3,配位原子是N,提供孤电子对的成键原子是N,故B不符合题意;
C. 中Ni2+与NH3之间形成配位键,故C不符合题意;
D. 中阴离子是SO,S原子价层电子对数为4,其立体构型是正四面体形,故D不符合题意;
故答案为:A。
【分析】依据配合物的结构及构造原理分析。
16.【答案】C
【解析】【解答】A.乙烯能与溴水发生加成反应生成1,2-二溴乙烷,能使溴水褪色,而苯不能使溴水因反应而褪色,而苯却能使溴水由于萃取作用而褪色,故A不符合题意;
B.①②④中都含有氢键,分子中羟基数目越多,相对分子质量越大,沸点越高,分子中所含有的羟基数④>①>②,且相对分子质量④>①>②,故沸点④>①>②;丙烷分子间不存在氢键,常温下为气体,几种物质中沸点最低,故沸点由高到低的顺序是:④>①>②>③,故B不符合题意;
C.苯甲酸为无色、无味片状晶体,含杂质的粗苯甲酸因制备苯甲酸的方法不同所含的杂质不同,均可采用溶解→加入氢氧化钠→过滤→加适量稀盐酸→冰水混合溶液冷却→过滤→重结晶→提纯苯甲酸,故C符合题意;
D.为防止酸液的飞溅,应先加入浓硝酸,最后加入浓硫酸,故D不符合题意。
故答案为:C。
【分析】A、根据官能团的结构与特点分析解答;
B、含有氢键的分子中羟基数目越多,相对分子质量越大,沸点越高;
C、可利用重结晶的方法除去苯甲酸中的杂质;
D、根据实验室中制取苯甲酸的步骤分析解答。
17.【答案】C
【解析】【解答】A.云、雾属于胶体,可以产生丁达尔效应,A不符合题意;
B.氧化铝可以和氢氧化钠反应,不能用Al2O3制成的坩埚加热NaOH固体至熔融态,B不符合题意;
C.碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,可以通过加热的方法除去,C符合题意;
D.不同元素组成的多原子分子里可存在极性键、非极性键,如过氧化氢中含非极性键,D不符合题意;
故答案为:C。
【分析】A.胶体能产生丁达尔效应;
B.氧化铝能够与氢氧化钠反应;
D.不同元素组成的多原子分子里可存在极性键、非极性键。
18.【答案】B
【解析】【解答】依据题意可知X、Y、Z、R、W分别为N、O、Na、S、Cl
A. 氢原子核外最多2个电子,故气态氢化物中不可能所有原子最外层都达到8电子结构,A错误;
B.依据非金属性越强,最高价氧化物的水化物的酸性越强,同周期,从左向右,非金属性逐渐增强,故非金属性Cl>S,故最高价氧化物的水化物的酸性HClO4>H2SO4,B正确;
C. 氢化物的稳定性与非金属性有关,是化学性质,氢键只影响物质的物理性质,C错误;
D. NH3和HCl会发生反应生成NH4Cl,NH4Cl是离子化合物,含有共价键和离子键,D错误;
故答案为:B。
【分析】A. 氢原子核外最多2个电子;
B.依据非金属性越强,最高价氧化物的水化物的酸性越强;
C. 氢化物的稳定性与非金属性有关,是化学性质;
D. NH4Cl是离子化合物。
19.【答案】B
【解析】【解答】H3O+的中心原子的价层电子对数是4,采取的是sp3杂化,H2O和H+之间形成配位键。故B符合题意
故正确答案是:B
【分析】根据计算出 H3O+的孤对电子和价层电子对即可判断杂化方式和形成的配位键
20.【答案】D
【解析】【解答】A.该分子中含有碳、氢、氧元素,元素电负性大小关系为H
C.手性碳原子是指与四个各不相同原子或基团相连的碳原子,则有如图所示 ,共7个,故C不符合题意;
D.该有机物分子式为C15H22O5,不饱和度为 ,而苯环的不饱和度为4,则同分异构体中可能有芳香族化合物,故D符合题意;
故答案为D。
【分析】根据结构简式即可判断出碳原子的杂化方式为sp2和sp3杂化,根据含有的元素,非金属性越强,电负性越强,氧元素的非金属性越强,电负性越强,根据结构简式即可找出含有的手性碳原子个数,根据结构简式找出不饱和度即可判断是否含有芳香族化合物
21.【答案】(1)sp3 ;平面(正)三角形
(2)[Ar]3d6或1s22s22p63s23p63d6
(3)NO2
(4)1∶2
(5)
【解析】【解答】解:(1)SO42-中中心原子S的价层电子对数为 (6+2-4 2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为 (5+1-3 2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
(2)Fe原子核外有26个电子,根据构造原理,基态Fe的核外电子排布式为1s22s22p63s23p63d64s2,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6。
(3)用替代法,与O3互为等电子体的一种阴离子为NO2-。
(4)N2的结构式为N N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子,答案为: 。
【分析】注意等电子体是指原子数相同,价电子数相同的分子互为等电子体,互为等电子体的分子具有相同的结构,而等电子体根据价电子数相同可以用同主族进行替换。(2)中注意失去电子时先失去最外层电子。
22.【答案】(1)正四面体形
(2)NH3、AsH3、PH3;AsH3、PH3、NH3;NH3、PH3、AsH3
(3)6;1
【解析】【解答】(1)SnCl4分子中中心Sn原子价电子对数为4+=4,不含孤电子对,采取sp3杂化,分子的空间构型为正四面体形。
(2)NH3、PH3、AsH3的组成和结构相似,相对分子质量越大,分子间作用力越大,沸点越高,但由于NH,分子间存在氢键,分子间作用力最大,沸点反常的高,故沸点由高到低的顺序为NH3、AsH3、PH3;同主族元素非金属性越强,简单氢化物的还原性越弱,因非金属性:N>P>As,故还原性由强到弱的顺序为AsH3、PH3、NH3;同主族元素的简单氢化物,中心原子的电负性越大,键角越大,故键角由大到小的顺序为NH3、PH3、AsH3。
(3)根据题目信息,结合题图甲中的结构,含多个配位原子的配体与Cd2+通过螯合作用配位成环,其形成的配位键均是通过螯合作用形成的配位键,可得1 mol该配合物中通过螯合作用形成的配位键有6 mol;配合物中含有2个N原子的配体中,N的杂化方式为sp2,再结合其余N原子的价电子对数,可知该螯合物中N原子的杂化方式都是sp2杂化,故该螯合物中N的杂化方式有1种。
【分析】
(1)SnCl4空间结构类似甲烷,属于正四面体结构;
(2)结构相似,相对分子质量越大,沸点越大,但氨气含氢键,沸点较大;非金属性越强,简单氢化物的还原性越弱;同主族的氢化物,电负性越大,键角越大;
(3)根据题意和图像分析,找其配位键即可,故配位键有6个,杂化类型根据成键情况是sp2杂化,且只有一种。
23.【答案】(1)ΔH=-890.31 kJ·mol-1
(2)H2O;NH3
(3)CH4;O2+4e-+2CO2=2CO32-;4OH--4e-=O2↑+2H2O;56;1
【解析】【解答】(1)16g甲烷的物质的量是1mol,16g CH4完全燃烧生成液态水时放出的热量是890.31kJ,即1molCH4完全燃烧生成液态水时放出的热量是890.31kJ,所以甲烷的燃烧热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.31 kJ·mol-1,故答案为:ΔH=-890.31 kJ·mol-1 。
(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性O>N,则氢化物的稳定性,NH3<H2O;结构相似时,相对分子质量越大,分子间作用力越大,但氨气分子间还存在氢键,则NH3的沸点高于PH3;故答案为:H2O ,NH3。
(3)①b电极上有红色物质生成,则b是阴极,所以a是阳极,c是负极、d是正极,通入甲烷的电极是负极,所以A是CH4、B是二氧化碳和氧气,d电极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为:O2+4e-+2CO2=2CO32-,故答案为:CH4 ,O2+4e-+2CO2=2CO32-。
②a是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=O2↑+2H2O, a极上生成n(O2)=0.112L÷22.4L/mol=0.005mol,生成0.005mol氧气转移电子物质的量=0.005mol×4=0.02mol,根据转移电子相等计算消耗甲烷体=0.02mol/8×22.4L/mol=56mL;电池反应式为2Cu2++2H2O=4H++O2↑+2Cu,根据方程式知,n(H+)=4n(O2)=4×0.005mol=0.02mol,c(H+)=0.02mol/0.2L=0.1mol/L,则溶液的pH=1,
故答案为:4OH--4e-=O2↑+2H2O,56 ,1。
【分析】 (1)根据燃烧热的定义进行判断;
(2)氢化物的稳定性与元素的非金属性强弱有关,氨气分子间能够形成氢键,沸点较高;
(3)①根据b电极上有红色物质析出,判断b电极为阴极,则c电极为负极,据此判断气体A和电极方程式;
②乙装置是电解硫酸铜溶液,结合电解原理进行分析即可。
24.【答案】(1);第四周期VIB族;d
(2)D
(3)
(4) 与水分子之间能形成氢键
【解析】【解答】(1) 基态Zn原子的价电子轨道表示式是 ;Cr在周期表中的位置是第四周期VIB族;Mn位于元素周期表的d区;
故答案为:
第1空、
第2空、第四周期VIB族
第3空、d
(2) 吡咯含有大键 ,N原子采用sp2杂化;
故答案为:D
(3) -Cl是吸电子基团,会使N原子电子云密度减小,碱性减弱 ;
故答案为: 第1空、
(4) 呋喃的氢化饱和产物 () 可以和水形成分子间氢键;
故答案为: 第1空、 与水分子之间能形成氢键
【分析】(1) 锌原子序数30,基态Zn原子的价电子轨道表示式是 ;Cr是24号元素,在周期表中的位置是第四周期VIB族;Mn元素的最后一个电子填入了 d能级;
(2) 吡啶中N原子是采用sp2杂化;
(3) 吸电子基团,电子云密度减小,碱性减弱 ;
(4) 和水形成分子间氢键得化合物, 易溶于水 。
25.【答案】(1)4.8;0.2mol/(min·L)
(2)A;C;D
(3)放热
(4)放出;极性
(5)
【解析】【解答】(1) 0~2min,氮气消耗了0.4mol,氢气消耗了1.2mol,2min时, =6.0mol-1.2mol=4.8mol。0~5min内,以 的浓度变化表示反应的平均速率:v(H2)=6-3/2x5=0.3mol/L/min,v(NH3)=0.2mol/L/min ;
(2) A. 的质量保持不变,反应达到了平衡状态;
B. ,不能说明达到了平衡;
C. 的含量保持不变,反应达到了平衡状态;
D. 容器中的压强随着反应的进行而变化,不随时间变化时达到了平衡状态;
E.、 、和 和的物质的量之比为1:3:2时,不能说明平衡,选ACD;
(3) 反应物的总能量高于生成物的总能量,为放热反应;
(4) 过程③形成化学键,放出能量。不同非金属原子之间形成的共价键是极性共价键, 的化学键类型是极性共价键。
(5) 过程②可以表示为 。
【分析】(1)平均反应速率的计算公式使用;
(2)A. 质量保持不变,反应达到了平衡状态;
B. 反应速率和化学计量数的比值 ,不能说明达到了平衡;
C. 含量保持不变,反应达到了平衡状态;
D. 容器中的压强随着反应的进行而变化,不随时间变化时达到了平衡状态;
E.、根据物质的量之比,不能说明平衡;
(3)反应物的总能量高于生成物的总能量,为放热反应;不同非金属原子之间形成的共价键是极性共价键。
