第五章 第二节 第3课时 NH3及常见气体的制备方法(共78张PPT)
文档属性
| 名称 | 第五章 第二节 第3课时 NH3及常见气体的制备方法(共78张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-10 16:35:20 | ||
图片预览









文档简介
(共78张PPT)
第3课时 NH3及常见气体的
制备方法
第五章 第二节
1.掌握实验室制取NH3的方法。
2.掌握实验室制取常见气体的原理、装置、收集、净化方法及制备方法的比较。
核心素养
发展目标
一、氨的实验室制法
二、常见气体的制备方法比较
课时对点练
内容索引
随堂演练 知识落实
氨的实验室制法
一
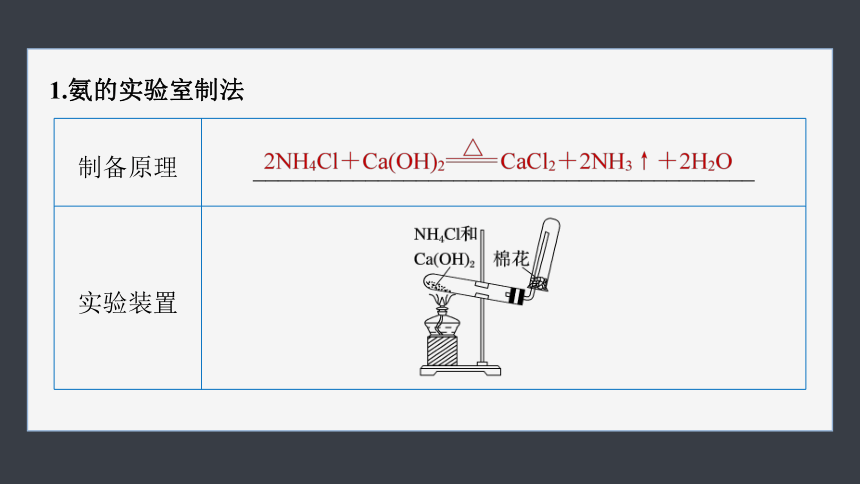
1.氨的实验室制法
制备原理 ________________________________________
实验装置
收集 NH3极易溶于水,可以用_____________收集
验满 把湿润的红色石蕊试纸置于试管口,试纸变_____;或将蘸有浓盐酸的玻璃棒置于试管口,有_____产生
向下排空气法
蓝色
白烟
【思考】 (1)此装置存在的弊端是什么?如何进行改进?
提示 此装置缺少NH3的干燥装置,可在NH3的收集装置之前加一个干燥装置。
(2)收集NH3时,试管口处为什么加一团棉花?
提示 减缓NH3与空气的对流,使收集到的NH3更纯净。
2.氨的简易制法
方法及装置 原理及化学方程式
氨水具有_________和_______,受热易分解。
化学方程式为_______________________
不稳定性
挥发性
NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为______________________
___________
NH3·H2O+CaO===NH3↑
+Ca(OH)2
应用体验
1.判断正误
(1)实验室中可以利用加热NH4Cl分解的方法制取NH3
(2)由于氨极易溶于水,所以不能用排水法收集氨,只能用向下排空气法收集
(3)氨不能用浓硫酸进行干燥,但可以用无水CaCl2干燥
(4)为加快产生NH3的速率,实验室中可以用NaOH和NH4Cl反应制NH3
(5)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收
×
×
×
√
×
应用体验
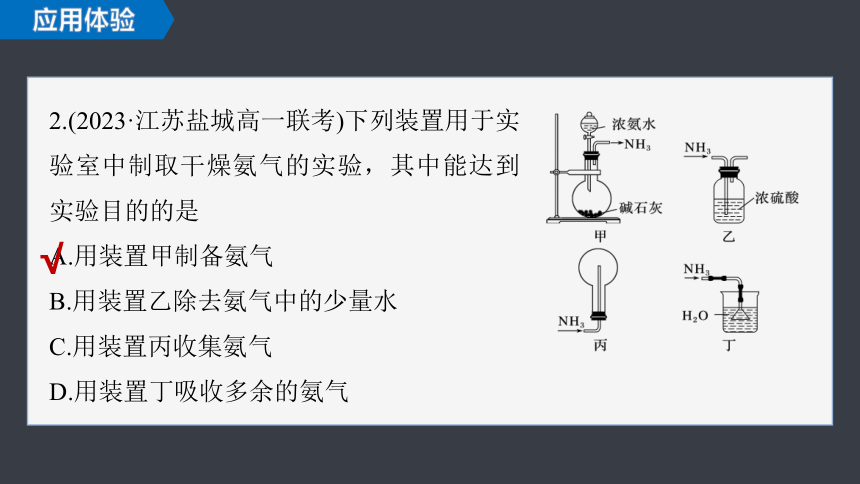
2.(2023·江苏盐城高一联考)下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是
A.用装置甲制备氨气
B.用装置乙除去氨气中的少量水
C.用装置丙收集氨气
D.用装置丁吸收多余的氨气
√
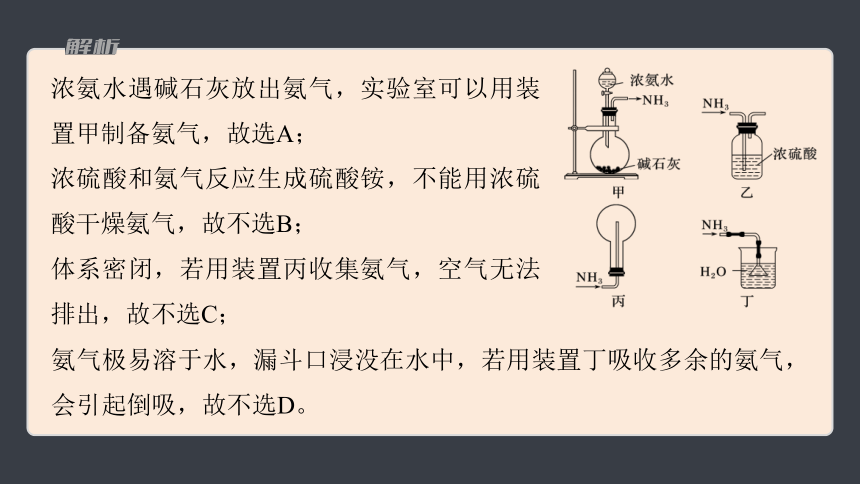
浓氨水遇碱石灰放出氨气,实验室可以用装置甲制备氨气,故选A;
浓硫酸和氨气反应生成硫酸铵,不能用浓硫酸干燥氨气,故不选B;
体系密闭,若用装置丙收集氨气,空气无法排出,故不选C;
氨气极易溶于水,漏斗口浸没在水中,若用装置丁吸收多余的氨气,会引起倒吸,故不选D。
(1)制氨气所用的铵盐不能用NH4NO3、NH4HCO3、(NH4)2CO3等代替,NH4NO3加热时爆炸,而NH4HCO3、(NH4)2CO3极易分解产生CO2气体使制得的NH3不纯。
(2)消石灰不能用NaOH、KOH等强碱代替,因为NaOH、KOH具有吸湿性,易潮解结块,不利于生成的氨气逸出,而且NaOH、KOH对玻璃有强烈的腐蚀作用。
(3)NH3极易溶于水,制取和收集的容器必须干燥。
归纳总结
返回
常见气体的制备方法比较
二
1.常见气体的制备装置
装置
应用 固体(或液体)+液体 气体 固体(+固体) 气体 固体(或液体)+液体
―→ 气体
【思考】 用上表中装置对应的字母填写下列空白:
气体 反应试剂 反应装置
O2 KMnO4或KClO3分解 ___
Na2O2与H2O;H2O2与MnO2 ___
SO2 Na2SO3与浓H2SO4 ___
Cu与浓H2SO4,加热 ___
Cl2 浓盐酸与MnO2,加热 ___
浓盐酸与KMnO4 ___
B
C
C
A
A
C
C
H2 稀盐酸与Zn ___
CO2 CaCO3与稀盐酸 ___
NH3 NH4Cl与Ca(OH)2,加热 ___
浓氨水,加热 ___
浓氨水与CaO ___
C
C
A
B
C
2.气体的收集方法
(1)一般方法
收集方法 收集气体的类型 收集装置 可收集的气体(举例)
排水法 难溶于水或微溶于水且不与水反应 ________________等
O2、H2、NO、CO
排空气法 向上排空气法 密度_____空气且不与空气中的成分反应 _________________
_____等
向下排空气法 密度_____空气且不与空气中的成分反应 _________等
大于
小于
Cl2、SO2、NO2、
CO2
H2、NH3
(2)创新方法
①从a管进气b管出水可收集________________,如____
___等。
②若将广口瓶中的液体更换,还可以收集以下气体:
换成饱和食盐水收集_____,换成饱和碳酸氢钠溶液收集_________,换成四氯化碳(密度比水大,且与水不互溶)收集__________。
难溶于水的气体
H2、
O2
氯气
二氧化碳
HCl或NH3
3.常用的防倒吸装置
尾气处理时,有些气体要防倒吸,常见的防倒吸装置有:
实验室制备气体装置选择的基本思路
归纳总结
应用体验
1.判断下列装置是否正确。
×
×
×
应用体验
×
√
√
应用体验
2.如图为常用玻璃仪器组成的六种实验装置,均可根据不同的实验需要在其中加入不同的液体或固体试剂,请用适宜装置的字母完成下列填空:
(1)既能用于收集Cl2,又能用于收集NO的装置是____。
(2)能用于干燥CO2气体的装置是
____。
AB
AEF
应用体验
(3)在实验室制取Cl2并检验Cl2部分性质的实验中,用于除去Cl2中HCl杂质的最佳装置是___。
(4)用于尾气吸收并能防止液体倒吸入反应装置中的是_____。
(5)接在气体制备的连续实验装置中间,用于控制气流平稳的装置是__。
A
ACE
D
解答实验装置题做到“四看”
一看发生装置是否有错:①实验是否需加热。②仪器放置是否有错。③夹持仪器的位置是否有错。
二看试剂(反应物、干燥剂、尾气吸收剂等)是否符合实验原理。
三看收集方法是否有错(导管伸入的位置等)。
四看是否缺少尾气吸收装置,对于有毒气体,一定要设计尾气吸收装置,并选择适宜的吸收剂。
练后反思
返回
随堂演练 知识落实
1
2
3
1.(2023·南昌高一检测)下列是中学化学中常见气体,只能用排水法收集的是
A.Cl2 B.HCl C.SO2 D.NO
随堂演练
4
√
1
2
3
随堂演练
4
Cl2密度大于空气且Cl2与空气不反应,可溶于水,故可以用向上排空气法或者排饱和食盐水法收集氯气,不能用排水法收集,A不符合题意;
HCl密度大于空气且HCl与空气不反应,极易溶于水,故只能用向上排空气法收集HCl,不能用排水法收集,B不符合题意;
SO2密度大于空气且SO2与空气不反应,易溶于水,故只能用向上排空气法收集SO2,不能用排水法收集,C不符合题意;
NO能与空气中的O2反应转化为NO2,且不溶于水,故只能用排水法收集NO,不能用排空气法收集,D符合题意。
选项 A B C D
X中试剂 浓盐酸 双氧水 浓硫酸 浓氨水
Y中试剂 MnO2 MnO2 Cu NaOH
气体 Cl2 O2 SO2 NH3
2.(2023·云南玉溪一中高一月考)用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
随堂演练
1
2
3
4
√
1
2
3
随堂演练
浓盐酸与二氧化锰反应制氯气必须在加热条件下,且氯气可溶于水,收集氯气不能用排水法,选项A错误;
4
双氧水分解制氧气的制取装置用固液不加热装置,收集氧气可用排水法,选项B正确;
浓硫酸与铜在加热条件下反应生成二氧化硫,且SO2易溶于水,选项C错误;
氨气极易溶于水,不能用排水法收集,选项D错误。
选项 试剂 试纸或试液 现象 结论
A 浓盐酸、浓硫酸 湿润的pH试纸 变红 HCl为酸性气体
B 浓盐酸、二氧化锰 淀粉碘化钾溶液 变蓝 Cl2具有氧化性
C 浓氨水、生石灰 湿润的红色石蕊试纸 变蓝 NH3溶于水显碱性
D 亚硫酸钠、硫酸 品红溶液 褪色 SO2具有还原性
3.下列气体的制备和性质实验中,由现象得出的结论错误的是
随堂演练
1
2
3
4
√
随堂演练
1
2
3
4
浓盐酸易挥发,浓硫酸不挥发,且浓硫酸稀释放热,可制备HCl气体,盐酸可以使pH试纸变红,故A正确;
浓盐酸与二氧化锰加热可制备氯气,氯气可氧化KI生成碘,遇淀粉变蓝,故B正确;
浓氨水与CaO混合可制备氨气,氨水显碱性,因此氨气使湿润的红色石蕊试纸变蓝,故C正确;
亚硫酸钠与硫酸反应生成二氧化硫,二氧化硫可使品红溶液褪色,体现其漂白性,故D错误。
4.为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如图所示三套实验装置:
(1)写出实验室制氨气的化学方程式:________________________________
________。
随堂演练
1
2
3
4
+2H2O
随堂演练
1
2
3
4
氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,反应的化学方程式为Ca(OH)2+2NH4Cl 2NH3↑+CaCl2+2H2O。
(2)实验装置和所用样品都正确且能得到干燥氨气的是___(填“甲”“乙”或“丙”)。
随堂演练
1
2
3
4
丙
甲中没有干燥装置,得到的氨气中含有水蒸气;乙中浓硫酸能够与氨气发生反应;丙中碱石灰与氨气不反应,能够干燥氨气。
(3)检验试管里是否收集满氨气的方法是____________________________
_________________________________________________________________________________________________________________。
随堂演练
1
2
3
4
在试管口放一片湿润的红色石蕊
试纸,若试纸变蓝色,则证明氨气已经集满(或用玻璃棒蘸取浓盐酸或浓
硝酸放在试管口,若产生大量白烟,则证明氨气已经集满)
随堂演练
1
2
3
4
氨气与水反应生成一水合氨,一水合氨遇红色的石蕊试纸显蓝色,可将湿润的红色石蕊试纸放在试管口检验氨气是否已收集满;氨气和氯化氢或硝酸反应可产生大量白烟,所以可用玻璃棒蘸取浓盐酸或浓硝酸放在试管口,若产生大量白烟,可证明氨气已经收集满。
(4)上述装置中肯定收集不到氨气的是___(填“甲”“乙”或“丙”),其原因是____________________________________________________(用化学方程式表示)。
随堂演练
1
2
3
4
乙
2NH3+H2SO4===(NH4)2SO4(或NH3+H2SO4===NH4HSO4)
随堂演练
1
2
3
4
氨气为碱性气体,可与浓硫酸反应生成硫酸铵或硫酸氢铵,故乙肯定收集不到氨气。
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
题组一 氨气的制备
1.在实验室里,某学习小组设计了下列制取纯净干燥氨气的方案,下列方案简易、可行的是
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱
石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
2.某化学研究小组的同学在实验室中利用如图装置制取并收集少量干燥的NH3。下列叙述正确的是
A.试管a中的固体是NH4Cl和NaOH的混合物
B.装置b中的试剂是碱石灰
C.用塞子代替棉花,收集到的NH3纯度更高
D.用蘸有浓硫酸的玻璃棒靠近c试管口能检验NH3是否收集满
√
3.(2023·深圳高一检测)以下关于氨气的实验装置正确的是
A.图甲用于实验室制取氨气
B.图乙用于制备NaHCO3
C.图丙用于干燥氨气
D.图丁用于氨气的尾气处理
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
加热氯化铵,生成的氨气与氯化氢在试管口又化合生成氯化铵,得不到氨气,故A错误;
制备NaHCO3需要将CO2通入溶有NH3的饱和食盐水中,故B错误;
氨气会和浓硫酸反应,不能用浓硫酸干燥氨气,故C错误;
氨气极易溶于水而不溶于四氯化碳,图丁可用于氨气的尾气处理,故D正确。
4.(2023·福州八中高一质检)下列实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是
A.可利用装置甲制取大量氨
B.用装置乙收集氨气时气体应该从a口进b口出
C.装置丙中黑色固体变成红色时还原产物为铜
D.可以用装置丁吸收氨气,进行尾气处理
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
氨气比空气轻,应用向下排空气法收集,导气管短进长出,用装置乙收集氨气时,气体应该从a口进b口出,故B正确;
装置丙中氧化铜可以被还原为铜或氧化亚铜,铜、氧化亚铜都是红色固体,则还原产物不一定为铜,故C错误;
氨气极易溶于水,导管直接插入饱和食盐水中易发生倒吸,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
题组二 常见气体的制备方法比较
5.下列各装置不能达到实验目的的是
A.装置①可用于吸收多余的HCl
B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥H2
D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
HCl极易溶于水,可用水吸收,倒扣漏斗可防倒吸,故A不符合题意;
Cl2和HCl都可以与氢氧化钠溶液反应,应该使用饱和食盐水除杂,故B符合题意;
H2为中性气体,可用碱石灰干燥,故C不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
H2的密度小于空气,以短进长出的方式连接,即为向下排空气法收集,CO2、Cl2、HCl的密度比空气大,以长进短出的方式连接,即为向上排空气法收集,故D不符合题意。
6.用常见反应原理制取下列气体,实验室使用的发生装置相同的一组是
A.HCl和H2 B.CO2和HCl
C.HCl和O2 D.H2和CO2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
7.如图是实验室常见的气体制取、干燥和收集装置。若用氯酸钾和催化剂二氧化锰制取干燥的氧气,则合理的装置组合为
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
A.①⑤⑧ B.③④⑦ C.①⑤⑥ D.③⑤⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
氯酸钾在二氧化锰作催化剂、加热的条件下生成氯化钾和氧气,氯酸钾和二氧化锰为粉末状,可选①作为制取装置,可选用装置④用浓硫酸进行干燥,或选用装置⑤用碱石灰进行干燥,氧气密度比空气大,采用装置⑥向上排空气法收集,不可采用装置⑧排水法收集,得不到干燥的氧气,故合理的装置组合为①⑤⑥。
8.(2023·四川南充高一期中)关于实验装置与试剂选择,下列说法正确的是
A.装置①可用作MnO2与浓盐酸反应制Cl2的发生装置
B.用装置②吸收尾气NH3可防倒吸
C.装置③可用于验证氨气在水中的溶解性
D.装置④可用于收集NO2气体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
MnO2与浓盐酸反应制Cl2的反应需要加热,A不正确;
NH3极易溶于水,装置②中的煤油不能起到防止倒吸的作用,B不正确;
装置③中,向烧瓶内滴入水,看到气球膨胀,则表明烧瓶内气体压强减小,从而表明NH3易溶于水,所以装置③可用于验证氨气在水中的溶解性,C正确;
NO2易与水反应生成HNO3和NO,所以装置④不可用于收集NO2气体,D不正确。
9.(2023·山东新泰一中高一检测)下列装置进行的实验,能达到目的的是
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可演示NO的喷泉实验
C.用图3装置除去CO2气体中混有的少量SO2
D.用图4装置检验铁粉与水蒸气反应产生的H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
图中为向上排空气法,氨气的密度比空气密度小,应采取向下排空气法,则图中氨气的收集方法不合理,故A错误;
NO不溶于水,则不能演示NO的喷泉实验,故B错误;
CO2气体能与碳酸钠溶液反应生成碳酸氢钠,所以无法达到实验目的,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
氢气是可燃性气体,氢气在空气中燃烧会发出淡蓝色火焰,所以图4装置可以检验铁粉与水蒸气反应产生的H2,故D正确。
10.NaClO2具有强氧化性,是较好的消毒剂,实验室可以用NaClO2与浓盐酸反应制取Cl2,制取装置如图所示,下列叙述一定正确的是
A.长颈漏斗可以替换仪器a
B.可用排饱和食盐水法收集Cl2
C.可通过装置乙除去HCl和H2O
D.反应中NaClO2被氧化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
浓盐酸会挥发且生成的氯气会从长颈漏斗中逸出,滴加浓盐酸不能用长颈漏斗,A错误;
氯气难溶于饱和食盐水,可用排饱和食盐水法收集Cl2,B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
装置乙净化气体时应长管进气短管出气,C错误;
NaClO2与浓盐酸反应制取Cl2,NaClO2中氯元素化合价从+3价降低到0价,被还原,D错误。
A.①②③中依次盛装酸性KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
11.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
12.(2023·开封高一期中)某课外活动小组在实验室用如图所示装置快速制取氨并验证氨的某些性质,同时收集少量纯净的氮气,请回答。
(1)写出用生石灰和浓氨水反应制取氨
的化学方程式:__________________
_______________。
NH3·H2O+CaO===
Ca(OH)2+NH3↑
生石灰和浓氨水反应生成Ca(OH)2和NH3,化学方程式:NH3·H2O+CaO
===Ca(OH)2+NH3↑。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(2)实验进行一段时间,观察到硬质玻璃管内黑色氧化铜粉末变为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管口处收集到纯净、干燥的氮气。根据这些现象,在硬质玻璃管内发生的反应说明氨具有___(填字母)。
A.碱性 B.还原性
C.氧化性 D.不稳定性
B
由题知生成物有N2,NH3失去电子,表现了NH3的还原性,故选B。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(3)洗气瓶中浓硫酸的主要作用是_______________________________
_________________,但也可能存在的安全隐患是_______________。
氨,防止污染空气
浓硫酸发生倒吸
浓硫酸具有吸水性且能和氨气反应,则洗气瓶中浓硫酸的主要作用:吸收多余的氨气,防止污染空气;防止空气中的水蒸气进入装置F。氨气被吸收可引起装置内压强减小,故可能存在的安全隐患是浓硫酸发生倒吸。
吸收空气中的水分,排除干扰;吸收
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(4)装置E的作用是____________________,
装置F的作用是__________________,
装置E中的碱石灰_____(填“能”或
“不能”)换成CaCl2。
吸收水蒸气,干燥NH3
检验是否有水生成
不能
装置E中盛放的是碱石灰,其作用是吸收NH3中的水蒸气;
装置F中盛放的是无水硫酸铜,无水硫酸铜遇水变为蓝色的五水硫酸铜,因此作用是检验反应生成了水;CaCl2能与氨气反应,则装置E中的碱石灰不能换成CaCl2。
13.Ⅰ.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中制备NH3,回答下列问题:
(1)氨气的发生装置可以选择右图
中的_____(填字母),反应的化学
方程式为____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→____→____→____→____→____(按气流方向,用小写字母表示)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
d
c
f
e
i
Ⅱ.亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5 ℃,其液体呈红褐色,遇水发生反应:2NOCl+H2O===2HCl+NO+NO2。某化学兴趣小组设计如图装置用Cl2和NO制备NOCl。回答下列相关问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(3)甲装置发生反应的离子方程式为________________________________
_______________,装置丙中的液体为_______。
+Mn2++2H2O
浓硫酸
(4)实验时,先通入Cl2,待丁中烧瓶内充满黄绿色气体时,再通入NO,这样做的目的是_________________________________。
(5)装置丁中冰盐水的作用是____________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
排尽装置中的空气,避免NO被氧化
液化亚硝酰氯,便于收集产品
(6)经分析该套装置设计上有一处明显缺陷,改进方法是______________
_________________________(用文字描述)。
(7)吸收尾气时,NOCl发生反应的化学方程式为_____________________
_______________(已知:NO+NO2+2NaOH===2NaNO2+H2O)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
在装置丁和戊
之间增加一个气体干燥装置
NOCl+2NaOH=== NaCl
+NaNO2+H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
14.叠氮化钠(NaN3)是一种重要的化工产品,可用于合成抗生素头孢菌素药物和用作汽车安全气囊的气源。实验室可通过以下流程制备叠氮化钠并测定其纯度。请回答以下问题:
Ⅰ.制备氨基钠(反应原理为2Na+2NH3 2NaNH2+H2)实验装置如图甲。
已知:氨基钠极易水解且易被空气中的氧气氧化。
(1)仪器a的名称为_________。
实验开始时,应先打开分液漏斗
使浓氨水滴入,目的是_______
_________________________________。
圆底烧瓶
将装置
内的空气排尽,防止Na、氨基钠变质
(2)B装置中的药品可选用_____
(填字母)。
A.P2O5
B.碱石灰
C.无水硫酸铜
D.无水氯化钙
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
B
氨气是碱性气体,不能使用酸性干燥剂,且氨气可以与无水氯化钙反应,故B装置中的药品可选用碱石灰。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
Ⅱ.制备NaN3。
(3)将Ⅰ中制备的NaNH2与N2O在210~220 ℃的条件下反应生成NaN3、NaOH和氨气,化学方程式为_____________________________________
_______。
+NH3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
Ⅲ.测定NaN3的纯度。
精确称量0.150 0 g NaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。
已知:2NaN3~3N2(其他产物略),反应中放出大量的热。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(4)对量气管读数时,反应前后都需要进行的操作是___________________________。
调节量气管使两侧的液面相平
对量气管读数时,需要调节量气管使两侧的液面相平,确保气体压强与外界大气压相等。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(5)常温下测得产生气体的体积为54.00 mL(N2的密度为1.400 g·L-1),计算NaN3样品的纯度为_______
(结果保留三位有效数字)。
78.0%
返回
本课结束
第3课时 NH3及常见气体的
制备方法
第五章 第二节
1.掌握实验室制取NH3的方法。
2.掌握实验室制取常见气体的原理、装置、收集、净化方法及制备方法的比较。
核心素养
发展目标
一、氨的实验室制法
二、常见气体的制备方法比较
课时对点练
内容索引
随堂演练 知识落实
氨的实验室制法
一
1.氨的实验室制法
制备原理 ________________________________________
实验装置
收集 NH3极易溶于水,可以用_____________收集
验满 把湿润的红色石蕊试纸置于试管口,试纸变_____;或将蘸有浓盐酸的玻璃棒置于试管口,有_____产生
向下排空气法
蓝色
白烟
【思考】 (1)此装置存在的弊端是什么?如何进行改进?
提示 此装置缺少NH3的干燥装置,可在NH3的收集装置之前加一个干燥装置。
(2)收集NH3时,试管口处为什么加一团棉花?
提示 减缓NH3与空气的对流,使收集到的NH3更纯净。
2.氨的简易制法
方法及装置 原理及化学方程式
氨水具有_________和_______,受热易分解。
化学方程式为_______________________
不稳定性
挥发性
NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为______________________
___________
NH3·H2O+CaO===NH3↑
+Ca(OH)2
应用体验
1.判断正误
(1)实验室中可以利用加热NH4Cl分解的方法制取NH3
(2)由于氨极易溶于水,所以不能用排水法收集氨,只能用向下排空气法收集
(3)氨不能用浓硫酸进行干燥,但可以用无水CaCl2干燥
(4)为加快产生NH3的速率,实验室中可以用NaOH和NH4Cl反应制NH3
(5)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收
×
×
×
√
×
应用体验
2.(2023·江苏盐城高一联考)下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是
A.用装置甲制备氨气
B.用装置乙除去氨气中的少量水
C.用装置丙收集氨气
D.用装置丁吸收多余的氨气
√
浓氨水遇碱石灰放出氨气,实验室可以用装置甲制备氨气,故选A;
浓硫酸和氨气反应生成硫酸铵,不能用浓硫酸干燥氨气,故不选B;
体系密闭,若用装置丙收集氨气,空气无法排出,故不选C;
氨气极易溶于水,漏斗口浸没在水中,若用装置丁吸收多余的氨气,会引起倒吸,故不选D。
(1)制氨气所用的铵盐不能用NH4NO3、NH4HCO3、(NH4)2CO3等代替,NH4NO3加热时爆炸,而NH4HCO3、(NH4)2CO3极易分解产生CO2气体使制得的NH3不纯。
(2)消石灰不能用NaOH、KOH等强碱代替,因为NaOH、KOH具有吸湿性,易潮解结块,不利于生成的氨气逸出,而且NaOH、KOH对玻璃有强烈的腐蚀作用。
(3)NH3极易溶于水,制取和收集的容器必须干燥。
归纳总结
返回
常见气体的制备方法比较
二
1.常见气体的制备装置
装置
应用 固体(或液体)+液体 气体 固体(+固体) 气体 固体(或液体)+液体
―→ 气体
【思考】 用上表中装置对应的字母填写下列空白:
气体 反应试剂 反应装置
O2 KMnO4或KClO3分解 ___
Na2O2与H2O;H2O2与MnO2 ___
SO2 Na2SO3与浓H2SO4 ___
Cu与浓H2SO4,加热 ___
Cl2 浓盐酸与MnO2,加热 ___
浓盐酸与KMnO4 ___
B
C
C
A
A
C
C
H2 稀盐酸与Zn ___
CO2 CaCO3与稀盐酸 ___
NH3 NH4Cl与Ca(OH)2,加热 ___
浓氨水,加热 ___
浓氨水与CaO ___
C
C
A
B
C
2.气体的收集方法
(1)一般方法
收集方法 收集气体的类型 收集装置 可收集的气体(举例)
排水法 难溶于水或微溶于水且不与水反应 ________________等
O2、H2、NO、CO
排空气法 向上排空气法 密度_____空气且不与空气中的成分反应 _________________
_____等
向下排空气法 密度_____空气且不与空气中的成分反应 _________等
大于
小于
Cl2、SO2、NO2、
CO2
H2、NH3
(2)创新方法
①从a管进气b管出水可收集________________,如____
___等。
②若将广口瓶中的液体更换,还可以收集以下气体:
换成饱和食盐水收集_____,换成饱和碳酸氢钠溶液收集_________,换成四氯化碳(密度比水大,且与水不互溶)收集__________。
难溶于水的气体
H2、
O2
氯气
二氧化碳
HCl或NH3
3.常用的防倒吸装置
尾气处理时,有些气体要防倒吸,常见的防倒吸装置有:
实验室制备气体装置选择的基本思路
归纳总结
应用体验
1.判断下列装置是否正确。
×
×
×
应用体验
×
√
√
应用体验
2.如图为常用玻璃仪器组成的六种实验装置,均可根据不同的实验需要在其中加入不同的液体或固体试剂,请用适宜装置的字母完成下列填空:
(1)既能用于收集Cl2,又能用于收集NO的装置是____。
(2)能用于干燥CO2气体的装置是
____。
AB
AEF
应用体验
(3)在实验室制取Cl2并检验Cl2部分性质的实验中,用于除去Cl2中HCl杂质的最佳装置是___。
(4)用于尾气吸收并能防止液体倒吸入反应装置中的是_____。
(5)接在气体制备的连续实验装置中间,用于控制气流平稳的装置是__。
A
ACE
D
解答实验装置题做到“四看”
一看发生装置是否有错:①实验是否需加热。②仪器放置是否有错。③夹持仪器的位置是否有错。
二看试剂(反应物、干燥剂、尾气吸收剂等)是否符合实验原理。
三看收集方法是否有错(导管伸入的位置等)。
四看是否缺少尾气吸收装置,对于有毒气体,一定要设计尾气吸收装置,并选择适宜的吸收剂。
练后反思
返回
随堂演练 知识落实
1
2
3
1.(2023·南昌高一检测)下列是中学化学中常见气体,只能用排水法收集的是
A.Cl2 B.HCl C.SO2 D.NO
随堂演练
4
√
1
2
3
随堂演练
4
Cl2密度大于空气且Cl2与空气不反应,可溶于水,故可以用向上排空气法或者排饱和食盐水法收集氯气,不能用排水法收集,A不符合题意;
HCl密度大于空气且HCl与空气不反应,极易溶于水,故只能用向上排空气法收集HCl,不能用排水法收集,B不符合题意;
SO2密度大于空气且SO2与空气不反应,易溶于水,故只能用向上排空气法收集SO2,不能用排水法收集,C不符合题意;
NO能与空气中的O2反应转化为NO2,且不溶于水,故只能用排水法收集NO,不能用排空气法收集,D符合题意。
选项 A B C D
X中试剂 浓盐酸 双氧水 浓硫酸 浓氨水
Y中试剂 MnO2 MnO2 Cu NaOH
气体 Cl2 O2 SO2 NH3
2.(2023·云南玉溪一中高一月考)用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
随堂演练
1
2
3
4
√
1
2
3
随堂演练
浓盐酸与二氧化锰反应制氯气必须在加热条件下,且氯气可溶于水,收集氯气不能用排水法,选项A错误;
4
双氧水分解制氧气的制取装置用固液不加热装置,收集氧气可用排水法,选项B正确;
浓硫酸与铜在加热条件下反应生成二氧化硫,且SO2易溶于水,选项C错误;
氨气极易溶于水,不能用排水法收集,选项D错误。
选项 试剂 试纸或试液 现象 结论
A 浓盐酸、浓硫酸 湿润的pH试纸 变红 HCl为酸性气体
B 浓盐酸、二氧化锰 淀粉碘化钾溶液 变蓝 Cl2具有氧化性
C 浓氨水、生石灰 湿润的红色石蕊试纸 变蓝 NH3溶于水显碱性
D 亚硫酸钠、硫酸 品红溶液 褪色 SO2具有还原性
3.下列气体的制备和性质实验中,由现象得出的结论错误的是
随堂演练
1
2
3
4
√
随堂演练
1
2
3
4
浓盐酸易挥发,浓硫酸不挥发,且浓硫酸稀释放热,可制备HCl气体,盐酸可以使pH试纸变红,故A正确;
浓盐酸与二氧化锰加热可制备氯气,氯气可氧化KI生成碘,遇淀粉变蓝,故B正确;
浓氨水与CaO混合可制备氨气,氨水显碱性,因此氨气使湿润的红色石蕊试纸变蓝,故C正确;
亚硫酸钠与硫酸反应生成二氧化硫,二氧化硫可使品红溶液褪色,体现其漂白性,故D错误。
4.为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如图所示三套实验装置:
(1)写出实验室制氨气的化学方程式:________________________________
________。
随堂演练
1
2
3
4
+2H2O
随堂演练
1
2
3
4
氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,反应的化学方程式为Ca(OH)2+2NH4Cl 2NH3↑+CaCl2+2H2O。
(2)实验装置和所用样品都正确且能得到干燥氨气的是___(填“甲”“乙”或“丙”)。
随堂演练
1
2
3
4
丙
甲中没有干燥装置,得到的氨气中含有水蒸气;乙中浓硫酸能够与氨气发生反应;丙中碱石灰与氨气不反应,能够干燥氨气。
(3)检验试管里是否收集满氨气的方法是____________________________
_________________________________________________________________________________________________________________。
随堂演练
1
2
3
4
在试管口放一片湿润的红色石蕊
试纸,若试纸变蓝色,则证明氨气已经集满(或用玻璃棒蘸取浓盐酸或浓
硝酸放在试管口,若产生大量白烟,则证明氨气已经集满)
随堂演练
1
2
3
4
氨气与水反应生成一水合氨,一水合氨遇红色的石蕊试纸显蓝色,可将湿润的红色石蕊试纸放在试管口检验氨气是否已收集满;氨气和氯化氢或硝酸反应可产生大量白烟,所以可用玻璃棒蘸取浓盐酸或浓硝酸放在试管口,若产生大量白烟,可证明氨气已经收集满。
(4)上述装置中肯定收集不到氨气的是___(填“甲”“乙”或“丙”),其原因是____________________________________________________(用化学方程式表示)。
随堂演练
1
2
3
4
乙
2NH3+H2SO4===(NH4)2SO4(或NH3+H2SO4===NH4HSO4)
随堂演练
1
2
3
4
氨气为碱性气体,可与浓硫酸反应生成硫酸铵或硫酸氢铵,故乙肯定收集不到氨气。
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
题组一 氨气的制备
1.在实验室里,某学习小组设计了下列制取纯净干燥氨气的方案,下列方案简易、可行的是
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱
石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
2.某化学研究小组的同学在实验室中利用如图装置制取并收集少量干燥的NH3。下列叙述正确的是
A.试管a中的固体是NH4Cl和NaOH的混合物
B.装置b中的试剂是碱石灰
C.用塞子代替棉花,收集到的NH3纯度更高
D.用蘸有浓硫酸的玻璃棒靠近c试管口能检验NH3是否收集满
√
3.(2023·深圳高一检测)以下关于氨气的实验装置正确的是
A.图甲用于实验室制取氨气
B.图乙用于制备NaHCO3
C.图丙用于干燥氨气
D.图丁用于氨气的尾气处理
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
加热氯化铵,生成的氨气与氯化氢在试管口又化合生成氯化铵,得不到氨气,故A错误;
制备NaHCO3需要将CO2通入溶有NH3的饱和食盐水中,故B错误;
氨气会和浓硫酸反应,不能用浓硫酸干燥氨气,故C错误;
氨气极易溶于水而不溶于四氯化碳,图丁可用于氨气的尾气处理,故D正确。
4.(2023·福州八中高一质检)下列实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是
A.可利用装置甲制取大量氨
B.用装置乙收集氨气时气体应该从a口进b口出
C.装置丙中黑色固体变成红色时还原产物为铜
D.可以用装置丁吸收氨气,进行尾气处理
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
氨气比空气轻,应用向下排空气法收集,导气管短进长出,用装置乙收集氨气时,气体应该从a口进b口出,故B正确;
装置丙中氧化铜可以被还原为铜或氧化亚铜,铜、氧化亚铜都是红色固体,则还原产物不一定为铜,故C错误;
氨气极易溶于水,导管直接插入饱和食盐水中易发生倒吸,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
题组二 常见气体的制备方法比较
5.下列各装置不能达到实验目的的是
A.装置①可用于吸收多余的HCl
B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥H2
D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
HCl极易溶于水,可用水吸收,倒扣漏斗可防倒吸,故A不符合题意;
Cl2和HCl都可以与氢氧化钠溶液反应,应该使用饱和食盐水除杂,故B符合题意;
H2为中性气体,可用碱石灰干燥,故C不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
H2的密度小于空气,以短进长出的方式连接,即为向下排空气法收集,CO2、Cl2、HCl的密度比空气大,以长进短出的方式连接,即为向上排空气法收集,故D不符合题意。
6.用常见反应原理制取下列气体,实验室使用的发生装置相同的一组是
A.HCl和H2 B.CO2和HCl
C.HCl和O2 D.H2和CO2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
7.如图是实验室常见的气体制取、干燥和收集装置。若用氯酸钾和催化剂二氧化锰制取干燥的氧气,则合理的装置组合为
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
A.①⑤⑧ B.③④⑦ C.①⑤⑥ D.③⑤⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
氯酸钾在二氧化锰作催化剂、加热的条件下生成氯化钾和氧气,氯酸钾和二氧化锰为粉末状,可选①作为制取装置,可选用装置④用浓硫酸进行干燥,或选用装置⑤用碱石灰进行干燥,氧气密度比空气大,采用装置⑥向上排空气法收集,不可采用装置⑧排水法收集,得不到干燥的氧气,故合理的装置组合为①⑤⑥。
8.(2023·四川南充高一期中)关于实验装置与试剂选择,下列说法正确的是
A.装置①可用作MnO2与浓盐酸反应制Cl2的发生装置
B.用装置②吸收尾气NH3可防倒吸
C.装置③可用于验证氨气在水中的溶解性
D.装置④可用于收集NO2气体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
MnO2与浓盐酸反应制Cl2的反应需要加热,A不正确;
NH3极易溶于水,装置②中的煤油不能起到防止倒吸的作用,B不正确;
装置③中,向烧瓶内滴入水,看到气球膨胀,则表明烧瓶内气体压强减小,从而表明NH3易溶于水,所以装置③可用于验证氨气在水中的溶解性,C正确;
NO2易与水反应生成HNO3和NO,所以装置④不可用于收集NO2气体,D不正确。
9.(2023·山东新泰一中高一检测)下列装置进行的实验,能达到目的的是
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可演示NO的喷泉实验
C.用图3装置除去CO2气体中混有的少量SO2
D.用图4装置检验铁粉与水蒸气反应产生的H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
综合强化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
图中为向上排空气法,氨气的密度比空气密度小,应采取向下排空气法,则图中氨气的收集方法不合理,故A错误;
NO不溶于水,则不能演示NO的喷泉实验,故B错误;
CO2气体能与碳酸钠溶液反应生成碳酸氢钠,所以无法达到实验目的,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
对点训练
氢气是可燃性气体,氢气在空气中燃烧会发出淡蓝色火焰,所以图4装置可以检验铁粉与水蒸气反应产生的H2,故D正确。
10.NaClO2具有强氧化性,是较好的消毒剂,实验室可以用NaClO2与浓盐酸反应制取Cl2,制取装置如图所示,下列叙述一定正确的是
A.长颈漏斗可以替换仪器a
B.可用排饱和食盐水法收集Cl2
C.可通过装置乙除去HCl和H2O
D.反应中NaClO2被氧化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
浓盐酸会挥发且生成的氯气会从长颈漏斗中逸出,滴加浓盐酸不能用长颈漏斗,A错误;
氯气难溶于饱和食盐水,可用排饱和食盐水法收集Cl2,B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
装置乙净化气体时应长管进气短管出气,C错误;
NaClO2与浓盐酸反应制取Cl2,NaClO2中氯元素化合价从+3价降低到0价,被还原,D错误。
A.①②③中依次盛装酸性KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
11.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
12.(2023·开封高一期中)某课外活动小组在实验室用如图所示装置快速制取氨并验证氨的某些性质,同时收集少量纯净的氮气,请回答。
(1)写出用生石灰和浓氨水反应制取氨
的化学方程式:__________________
_______________。
NH3·H2O+CaO===
Ca(OH)2+NH3↑
生石灰和浓氨水反应生成Ca(OH)2和NH3,化学方程式:NH3·H2O+CaO
===Ca(OH)2+NH3↑。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(2)实验进行一段时间,观察到硬质玻璃管内黑色氧化铜粉末变为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管口处收集到纯净、干燥的氮气。根据这些现象,在硬质玻璃管内发生的反应说明氨具有___(填字母)。
A.碱性 B.还原性
C.氧化性 D.不稳定性
B
由题知生成物有N2,NH3失去电子,表现了NH3的还原性,故选B。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(3)洗气瓶中浓硫酸的主要作用是_______________________________
_________________,但也可能存在的安全隐患是_______________。
氨,防止污染空气
浓硫酸发生倒吸
浓硫酸具有吸水性且能和氨气反应,则洗气瓶中浓硫酸的主要作用:吸收多余的氨气,防止污染空气;防止空气中的水蒸气进入装置F。氨气被吸收可引起装置内压强减小,故可能存在的安全隐患是浓硫酸发生倒吸。
吸收空气中的水分,排除干扰;吸收
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(4)装置E的作用是____________________,
装置F的作用是__________________,
装置E中的碱石灰_____(填“能”或
“不能”)换成CaCl2。
吸收水蒸气,干燥NH3
检验是否有水生成
不能
装置E中盛放的是碱石灰,其作用是吸收NH3中的水蒸气;
装置F中盛放的是无水硫酸铜,无水硫酸铜遇水变为蓝色的五水硫酸铜,因此作用是检验反应生成了水;CaCl2能与氨气反应,则装置E中的碱石灰不能换成CaCl2。
13.Ⅰ.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中制备NH3,回答下列问题:
(1)氨气的发生装置可以选择右图
中的_____(填字母),反应的化学
方程式为____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→____→____→____→____→____(按气流方向,用小写字母表示)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
d
c
f
e
i
Ⅱ.亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5 ℃,其液体呈红褐色,遇水发生反应:2NOCl+H2O===2HCl+NO+NO2。某化学兴趣小组设计如图装置用Cl2和NO制备NOCl。回答下列相关问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(3)甲装置发生反应的离子方程式为________________________________
_______________,装置丙中的液体为_______。
+Mn2++2H2O
浓硫酸
(4)实验时,先通入Cl2,待丁中烧瓶内充满黄绿色气体时,再通入NO,这样做的目的是_________________________________。
(5)装置丁中冰盐水的作用是____________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
排尽装置中的空气,避免NO被氧化
液化亚硝酰氯,便于收集产品
(6)经分析该套装置设计上有一处明显缺陷,改进方法是______________
_________________________(用文字描述)。
(7)吸收尾气时,NOCl发生反应的化学方程式为_____________________
_______________(已知:NO+NO2+2NaOH===2NaNO2+H2O)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
在装置丁和戊
之间增加一个气体干燥装置
NOCl+2NaOH=== NaCl
+NaNO2+H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
14.叠氮化钠(NaN3)是一种重要的化工产品,可用于合成抗生素头孢菌素药物和用作汽车安全气囊的气源。实验室可通过以下流程制备叠氮化钠并测定其纯度。请回答以下问题:
Ⅰ.制备氨基钠(反应原理为2Na+2NH3 2NaNH2+H2)实验装置如图甲。
已知:氨基钠极易水解且易被空气中的氧气氧化。
(1)仪器a的名称为_________。
实验开始时,应先打开分液漏斗
使浓氨水滴入,目的是_______
_________________________________。
圆底烧瓶
将装置
内的空气排尽,防止Na、氨基钠变质
(2)B装置中的药品可选用_____
(填字母)。
A.P2O5
B.碱石灰
C.无水硫酸铜
D.无水氯化钙
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
B
氨气是碱性气体,不能使用酸性干燥剂,且氨气可以与无水氯化钙反应,故B装置中的药品可选用碱石灰。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
Ⅱ.制备NaN3。
(3)将Ⅰ中制备的NaNH2与N2O在210~220 ℃的条件下反应生成NaN3、NaOH和氨气,化学方程式为_____________________________________
_______。
+NH3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
Ⅲ.测定NaN3的纯度。
精确称量0.150 0 g NaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。
已知:2NaN3~3N2(其他产物略),反应中放出大量的热。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(4)对量气管读数时,反应前后都需要进行的操作是___________________________。
调节量气管使两侧的液面相平
对量气管读数时,需要调节量气管使两侧的液面相平,确保气体压强与外界大气压相等。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
综合强化
(5)常温下测得产生气体的体积为54.00 mL(N2的密度为1.400 g·L-1),计算NaN3样品的纯度为_______
(结果保留三位有效数字)。
78.0%
返回
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
