第五章 化工生产中的重要非金属元素 章末整合 重点突破(共45张PPT)
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 章末整合 重点突破(共45张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-10 17:16:26 | ||
图片预览







文档简介
(共45张PPT)
第五章
章末整合 重点突破
体系构建 理清脉络
重点突破 素养提升
内容索引
体系构建 理清脉络
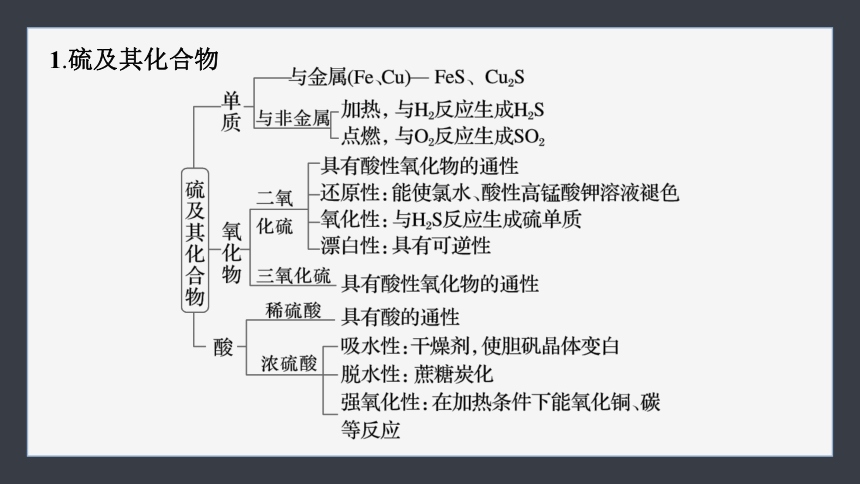
1.硫及其化合物
2.氮及其化合物
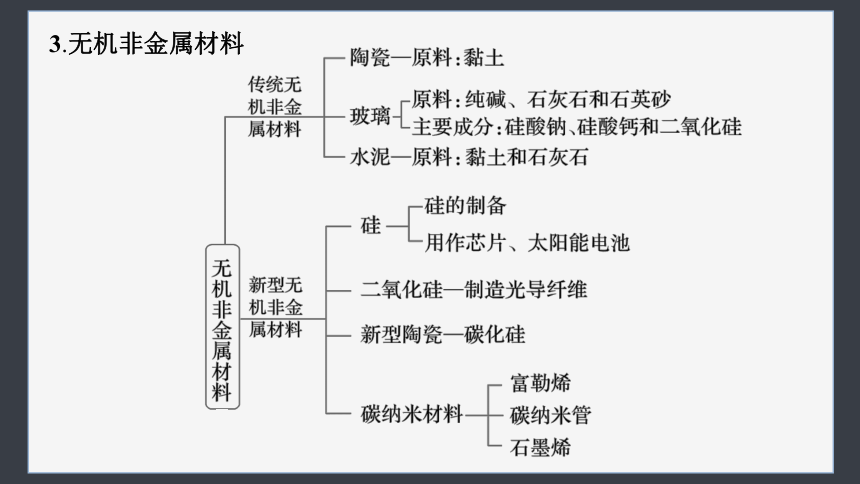
3.无机非金属材料
体验高考
1.(2023·全国乙卷,11)一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是
A 硫酸亚铁溶液出现棕黄色沉淀 6FeSO4+O2+2H2O===2Fe2(SO4)3+2Fe(OH)2↓
B 硫化钠溶液出现浑浊颜色变深 Na2S+2O2===Na2SO4
C 溴水颜色逐渐褪去 4Br2+4H2O===HBrO4+7HBr
D 胆矾表面出现白色粉末 CuSO4·5H2O===CuSO4+5H2O
√
溶液呈棕黄色是因为有Fe3+,有浑浊是产生了Fe(OH)3,因为硫酸亚铁久置后易被氧气氧化,化学方程式为 12FeSO4+3O2+6H2O=== 4Fe2(SO4)3+4Fe(OH)3↓,A错误;
硫化钠在空气中易被氧气氧化为淡黄色固体硫单质,使颜色加深,化学方程式为2Na2S+O2+2H2O===4NaOH + 2S↓,B错误;
溴水中存在平衡:Br2+H2O HBrO+HBr,HBrO见光易分解,促使该平衡正向移动,所以溴水放置太久会变质,C错误;
胆矾为CuSO4·5H2O,颜色为蓝色,如果表面失去结晶水,则变为白色的CuSO4,D正确。
体验高考
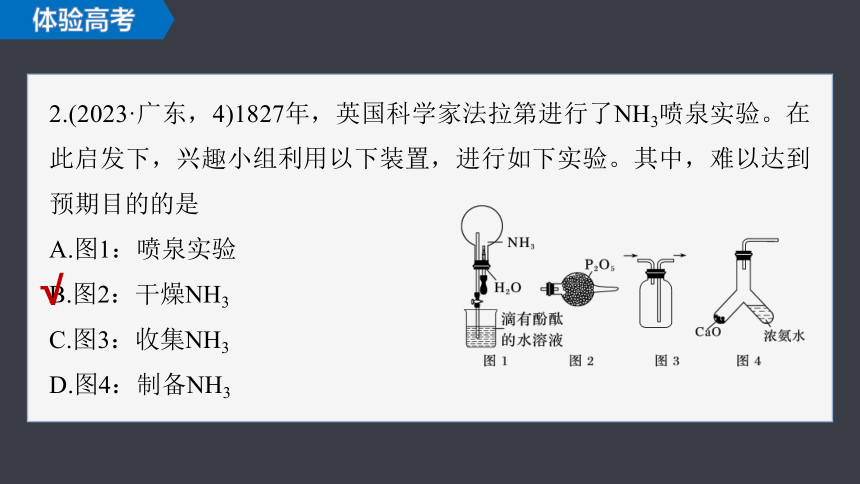
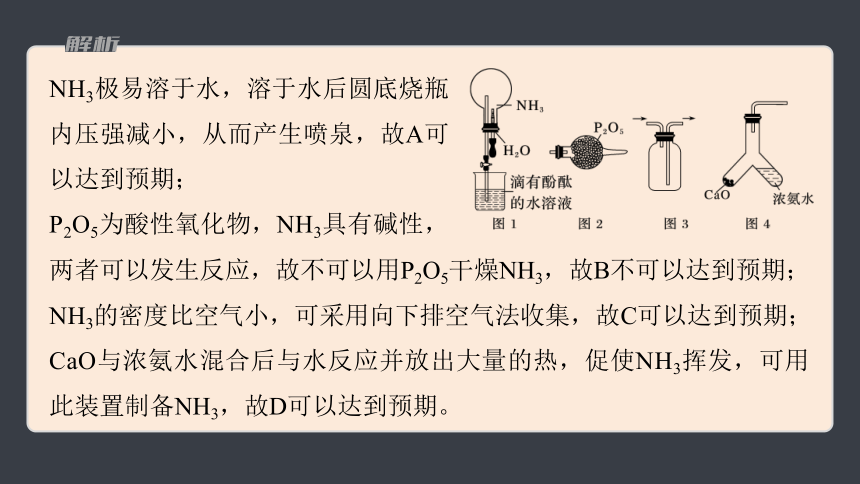
2.(2023·广东,4)1827年,英国科学家法拉第进行了NH3喷泉实验。在此启发下,兴趣小组利用以下装置,进行如下实验。其中,难以达到预期目的的是
A.图1:喷泉实验
B.图2:干燥NH3
C.图3:收集NH3
D.图4:制备NH3
√
NH3极易溶于水,溶于水后圆底烧瓶内压强减小,从而产生喷泉,故A可以达到预期;
P2O5为酸性氧化物,NH3具有碱性,
两者可以发生反应,故不可以用P2O5干燥NH3,故B不可以达到预期;
NH3的密度比空气小,可采用向下排空气法收集,故C可以达到预期;
CaO与浓氨水混合后与水反应并放出大量的热,促使NH3挥发,可用此装置制备NH3,故D可以达到预期。
体验高考
3.(2022·重庆,5)工业上用N2和H2合成NH3,NA代表阿伏加德罗常数的值,下列说法正确的是
A.消耗14 g N2生成NH3分子数为2NA
B.消耗1 mol H2,生成N—H键数为2NA
C.生成标准状况下22.4 L NH3,电子转移数为2NA
D.氧化1 mol NH3生成NO,需O2分子数为2NA
√
N2与H2合成NH3反应的化学方程式为N2+3H2 2NH3。由
化学方程式可知,消耗14g氮气生成氨气为 ×2=1 mol,即生成氨气的分子数为NA,故A错误;
由化学方程式可知,消耗1 mol氢气生成N—H键为1 mol× ×3=2 mol,
即生成的N—H键数为2NA,故B正确;
由方程式可知,生成标准状况下22.4 L氨气,反应转移电子为
×3=3 mol,即电子转移数为3NA,故C错误;
高温、高压
催化剂
由得失电子守恒可知,1 mol氨气与氧气反应生成一氧化氮,需氧气
1 mol× =1.25 mol,即需O2分子数为1.25NA,故D错误。
体验高考
4.(2021·全国甲卷,9)实验室制备下列气体的方法可行的是
选项 气体 方法
A 氨气 加热氯化铵固体
B 二氧化氮 将铝片加到冷浓硝酸中
C 硫化氢 向硫化钠固体滴加浓硫酸
D 氧气 加热氯酸钾和二氧化锰的混合物
√
氯化铵不稳定,加热易分解生成氨气和氯化氢,但两者遇冷又会化合生成氯化铵固体,所以不能用于制备氨气,A不可行;
将铝片加到冷浓硝酸中会发生钝化,不能用于制备二氧化氮,B不可行;
硫化氢为还原性气体,浓硫酸具有强氧化性,不能用浓硫酸与硫化钠固体反应制备硫化氢气体,因为该气体会与浓硫酸发生氧化还原反应,C不可行;
实验室加热氯酸钾和二氧化锰的混合物,生成氯化钾和氧气,二氧化锰作催化剂,可用此方法制备氧气,D可行。
体验高考
5.(2020·全国卷Ⅰ,9)下列气体去除杂质的方法中,不能实现目的的是
气体(杂质) 方法
A SO2(H2S) 通过酸性高锰酸钾溶液
B Cl2(HCl) 通过饱和的食盐水
C N2(O2) 通过灼热的铜丝网
D NO(NO2) 通过氢氧化钠溶液
√
酸性高锰酸钾溶液不仅能与H2S反应,也能与SO2反应,A项不能实现目的。
体验高考
6.(2021·山东,8)工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是
A.吸收过程中有气体生成
B.结晶后母液中含有NaHCO3
C.气流干燥湿料时温度不宜过高
D.中和后溶液中含Na2SO3和NaHCO3
√
根据流程图分析可知,吸收过程中有二氧化碳生成,A正确;
结晶后母液中含饱和NaHSO3和过量的二氧化硫形成的亚硫酸,
没有NaHCO3,假设产物中存在NaHCO3,则其会与生成的NaHSO3发生反应,且NaHCO3溶解度较低,若其残留于母液中,会使晶体不纯,假设不成立,B错误;
NaHSO3高温时易分解变质,所以气流干燥过程中温度不宜过高,C正确;
结合上述分析可知,中和后溶液中含Na2SO3和NaHCO3,D正确。
返回
重点突破 素养提升
突破一 S、N、Si及其化合物的转化关系
1.硫及其化合物的转化
完成下列序号表示的化学方程式或离子方程式:
③_________________;
④______________;
⑤______________;
⑥_______________________;
⑦__________________________;
⑨_________________________;
2H2S+SO2===3S+2H2O
FeS+2H+===Fe2++H2S↑
____________________________;
_________________________;
______________________;
_______________________________;
_______________________________________。
SO2+2NaOH===Na2SO3+H2O
SO2+Cl2+2H2O===H2SO4+2HCl
催化剂
△
2SO2+O2 2SO3
2.氮及其化合物的转化
完成下列序号表示的化学方程式:
①___________________;
②______________________;
NH3+HCl===NH4Cl
NH3+H2O NH3·H2O
③____________________________;
④_________________________________________;
⑤_________________________;
⑥_________________________;
高温、高压
催化剂
N2+3H2 2NH3
⑦ _____________________ ;
⑧ _____________________ ;
⑨ _________________ ;
⑩ __________________________ ;
_________________________________________ ;
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
__________________________ ;
___________________________________________。
3NO2+H2O===2HNO3+NO
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3.硅及其重要化合物之间的转化
完成下列序号表示的化学方程式:
⑤ _______________________ ;
⑥ ________________________;
⑦ _________________________;
⑧ ____________________________ ;
⑨ _____________________________________________________ ;
_________________________________________________________
________________ 。
SiO2+4HF===SiF4↑+2H2O
SiO2+2NaOH===Na2SiO3+H2O
Na2SiO3+2HCl===H2SiO3↓+2NaCl或Na2SiO3+CO2+H2O===
Na2CO3+H2SiO3↓
跟踪训练
1.(2023·山西大同一中月考)下列说法不正确的有几个
①铁与氯气反应生成氯化铁,则铁与硫反应生成硫化铁
②氨气催化氧化制备硝酸属于氮的固定
③保存氢氟酸可用玻璃瓶,但不能用玻璃塞
④氨易液化,汽化时要吸收大量的热,因此可用作制冷剂
⑤高纯硅可用于制作光导纤维
⑥硅酸钠的水溶液可以用作黏合剂和防火剂
A.3 B.4 C.5 D.6
√
①铁与氯气反应生成氯化铁,但铁与硫反应生成硫化亚铁,故错误;
②氮的固定是指将大气中游离态的氮转化为氮的化合物的过程,故错误;
③保存氢氟酸不可用玻璃瓶,也不能用玻璃塞,故错误;
④氨易液化,汽化时要吸收大量的热,因此可用作制冷剂,正确;
⑤制作光导纤维的是二氧化硅,故错误;
⑥硅酸钠的水溶液可以用作黏合剂和防火剂,正确。
跟踪训练
2.(2022·山东烟台高一期末)如图是N、S及其化合物的“价—类”二维图,下列说法正确的是
A.在一定条件下,a可将c、d还原为b
B.c′使品红褪色的原理与HClO的漂白原
理相同
C.a与浓e、a′与浓e′均能发生氧化还原反应
D.常温下,Fe与浓e和浓e′均不反应
√
根据图示,a为NH3、b为N2、c为NO、d为NO2、e为HNO3;a′为H2S、b′为S,c′为SO2,d′为H2SO3、e′为H2SO4,据此解答。a为NH3、b为N2、c为NO、d
为NO2,根据化合价以及氧化还原规律,一定条件下,a可将c、d还原为b,A正确;
c′使品红褪色的原理为与有色物质生成不稳定的无色物质,HClO的漂白原理为将有色物质氧化为无色物质,原理不相同,B错误;
氨气和浓硝酸不能发生氧化还原反应,H2S可以和浓硫酸发生氧化还原反应,C错误;
常温下,Fe遇浓硝酸和浓硫酸会发生钝化反应,阻止反应进一步进行,不是不反应,D错误。
突破二 无机框图推断题解题技巧
1.解题方法
2.常用“突破口”
(1)物质的颜色
淡黄色固体—___、______;红棕色粉末—______;
红褐色沉淀—________;蓝色沉淀—________;
黑色固体—Fe3O4、CuO等;红色溶液—Fe(SCN)3;
红棕色气体—____;黄绿色气体—____。
S
Na2O2
Fe2O3
Fe(OH)3
Cu(OH)2
NO2
Cl2
(2)常见物质检验的现象
①焰色试验:钠为_____、钾为_____(透过蓝色钴玻璃)。
②Fe2+遇碱出现沉淀颜色变化:_____________________;Fe3+遇SCN-显_____,遇碱生成_______沉淀。
③高中阶段所学的气体中溶于水显碱性的只有_____;在空气中迅速由无色变为红棕色的气体只有____。
④能与盐酸、稀硫酸作用产生有刺激性气味的无色气体,且该气体能使溴水、品红溶液、酸性高锰酸钾溶液褪色的一般为含____或_____的物质。
黄色
紫色
白色→灰绿色→红褐色
红色
红褐色
氨气
NO
(3)物质的特殊性质
①能使品红溶液褪色的气体:____(加热后品红溶液又恢复红色)、___(加热后品红溶液不恢复红色)。
②使湿润的红色石蕊试纸变蓝的气体:____。
③使湿润的淀粉 KI试纸变蓝:NO2、___、Br2、 FeCl3溶液等。
④能与SO2、Cl2、O2等气体(或其水溶液)反应析出淡黄色沉淀:H2S。
⑤在一定条件下具有漂白性的物质:Na2O2、_____、SO2、氯水、活性炭等。
⑥___可作半导体材料,_____可制作光导纤维。
⑦与水反应放出气体的物质:___、K、Na2O2等。
SO2
Cl2
NH3
Cl2
H2O2
Si
SiO2
Na
(4)熟悉重要无机物转化关系的常考形式
①“ ”
跟踪训练
1.如图为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。下列关于甲、乙、丙、丁的判断不正确的是
A.甲只具有还原性
B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性
D.丁为黄色或淡黄色固体
√
甲、乙、丙、丁分别为H2S、SO2、SO3、S。H2S中-2价的S只有还原性,但其中的H为+1价,具有氧化性,如H2S与活泼金属反应可表现出氧化性,A项错误;
SO2中的S为+4价,处于S的中间价态,C项正确;
单质S为黄色或淡黄色固体,D项正确。
跟踪训练
2.A、B、C、D均为中学化学常见的纯净物,A是单质,它们之间有如图的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:
______________________________________
__________。
漂白、防腐、作为生产硫酸的原料等(任写两个即可)
跟踪训练
(2)若B是气态氢化物,C、D是氧化物且会造成光
化学烟雾污染。B与C在一定条件下反应生成的A
是大气的主要成分,写出该反应的化学方程式:
_____________________________。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应时通入过量的一种能引起温室效应的主要气体。判断单质A的元素在周期表中的位置:_________________。
第三周期第ⅢA族
跟踪训练
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,
两种物质中除钠、氧外的元素为同一主族,且溶
液均显碱性,写出②反应的化学方程式:
________________________________,D的化学式是_______。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于刻蚀印刷铜电路板,写出该反应的离子方程式:_________________________。
Si+2NaOH+H2O===Na2SiO3+2H2↑
Na2CO3
Cu+2Fe3+===Cu2++2Fe2+
返回
本课结束
第五章
章末整合 重点突破
体系构建 理清脉络
重点突破 素养提升
内容索引
体系构建 理清脉络
1.硫及其化合物
2.氮及其化合物
3.无机非金属材料
体验高考
1.(2023·全国乙卷,11)一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是
A 硫酸亚铁溶液出现棕黄色沉淀 6FeSO4+O2+2H2O===2Fe2(SO4)3+2Fe(OH)2↓
B 硫化钠溶液出现浑浊颜色变深 Na2S+2O2===Na2SO4
C 溴水颜色逐渐褪去 4Br2+4H2O===HBrO4+7HBr
D 胆矾表面出现白色粉末 CuSO4·5H2O===CuSO4+5H2O
√
溶液呈棕黄色是因为有Fe3+,有浑浊是产生了Fe(OH)3,因为硫酸亚铁久置后易被氧气氧化,化学方程式为 12FeSO4+3O2+6H2O=== 4Fe2(SO4)3+4Fe(OH)3↓,A错误;
硫化钠在空气中易被氧气氧化为淡黄色固体硫单质,使颜色加深,化学方程式为2Na2S+O2+2H2O===4NaOH + 2S↓,B错误;
溴水中存在平衡:Br2+H2O HBrO+HBr,HBrO见光易分解,促使该平衡正向移动,所以溴水放置太久会变质,C错误;
胆矾为CuSO4·5H2O,颜色为蓝色,如果表面失去结晶水,则变为白色的CuSO4,D正确。
体验高考
2.(2023·广东,4)1827年,英国科学家法拉第进行了NH3喷泉实验。在此启发下,兴趣小组利用以下装置,进行如下实验。其中,难以达到预期目的的是
A.图1:喷泉实验
B.图2:干燥NH3
C.图3:收集NH3
D.图4:制备NH3
√
NH3极易溶于水,溶于水后圆底烧瓶内压强减小,从而产生喷泉,故A可以达到预期;
P2O5为酸性氧化物,NH3具有碱性,
两者可以发生反应,故不可以用P2O5干燥NH3,故B不可以达到预期;
NH3的密度比空气小,可采用向下排空气法收集,故C可以达到预期;
CaO与浓氨水混合后与水反应并放出大量的热,促使NH3挥发,可用此装置制备NH3,故D可以达到预期。
体验高考
3.(2022·重庆,5)工业上用N2和H2合成NH3,NA代表阿伏加德罗常数的值,下列说法正确的是
A.消耗14 g N2生成NH3分子数为2NA
B.消耗1 mol H2,生成N—H键数为2NA
C.生成标准状况下22.4 L NH3,电子转移数为2NA
D.氧化1 mol NH3生成NO,需O2分子数为2NA
√
N2与H2合成NH3反应的化学方程式为N2+3H2 2NH3。由
化学方程式可知,消耗14g氮气生成氨气为 ×2=1 mol,即生成氨气的分子数为NA,故A错误;
由化学方程式可知,消耗1 mol氢气生成N—H键为1 mol× ×3=2 mol,
即生成的N—H键数为2NA,故B正确;
由方程式可知,生成标准状况下22.4 L氨气,反应转移电子为
×3=3 mol,即电子转移数为3NA,故C错误;
高温、高压
催化剂
由得失电子守恒可知,1 mol氨气与氧气反应生成一氧化氮,需氧气
1 mol× =1.25 mol,即需O2分子数为1.25NA,故D错误。
体验高考
4.(2021·全国甲卷,9)实验室制备下列气体的方法可行的是
选项 气体 方法
A 氨气 加热氯化铵固体
B 二氧化氮 将铝片加到冷浓硝酸中
C 硫化氢 向硫化钠固体滴加浓硫酸
D 氧气 加热氯酸钾和二氧化锰的混合物
√
氯化铵不稳定,加热易分解生成氨气和氯化氢,但两者遇冷又会化合生成氯化铵固体,所以不能用于制备氨气,A不可行;
将铝片加到冷浓硝酸中会发生钝化,不能用于制备二氧化氮,B不可行;
硫化氢为还原性气体,浓硫酸具有强氧化性,不能用浓硫酸与硫化钠固体反应制备硫化氢气体,因为该气体会与浓硫酸发生氧化还原反应,C不可行;
实验室加热氯酸钾和二氧化锰的混合物,生成氯化钾和氧气,二氧化锰作催化剂,可用此方法制备氧气,D可行。
体验高考
5.(2020·全国卷Ⅰ,9)下列气体去除杂质的方法中,不能实现目的的是
气体(杂质) 方法
A SO2(H2S) 通过酸性高锰酸钾溶液
B Cl2(HCl) 通过饱和的食盐水
C N2(O2) 通过灼热的铜丝网
D NO(NO2) 通过氢氧化钠溶液
√
酸性高锰酸钾溶液不仅能与H2S反应,也能与SO2反应,A项不能实现目的。
体验高考
6.(2021·山东,8)工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是
A.吸收过程中有气体生成
B.结晶后母液中含有NaHCO3
C.气流干燥湿料时温度不宜过高
D.中和后溶液中含Na2SO3和NaHCO3
√
根据流程图分析可知,吸收过程中有二氧化碳生成,A正确;
结晶后母液中含饱和NaHSO3和过量的二氧化硫形成的亚硫酸,
没有NaHCO3,假设产物中存在NaHCO3,则其会与生成的NaHSO3发生反应,且NaHCO3溶解度较低,若其残留于母液中,会使晶体不纯,假设不成立,B错误;
NaHSO3高温时易分解变质,所以气流干燥过程中温度不宜过高,C正确;
结合上述分析可知,中和后溶液中含Na2SO3和NaHCO3,D正确。
返回
重点突破 素养提升
突破一 S、N、Si及其化合物的转化关系
1.硫及其化合物的转化
完成下列序号表示的化学方程式或离子方程式:
③_________________;
④______________;
⑤______________;
⑥_______________________;
⑦__________________________;
⑨_________________________;
2H2S+SO2===3S+2H2O
FeS+2H+===Fe2++H2S↑
____________________________;
_________________________;
______________________;
_______________________________;
_______________________________________。
SO2+2NaOH===Na2SO3+H2O
SO2+Cl2+2H2O===H2SO4+2HCl
催化剂
△
2SO2+O2 2SO3
2.氮及其化合物的转化
完成下列序号表示的化学方程式:
①___________________;
②______________________;
NH3+HCl===NH4Cl
NH3+H2O NH3·H2O
③____________________________;
④_________________________________________;
⑤_________________________;
⑥_________________________;
高温、高压
催化剂
N2+3H2 2NH3
⑦ _____________________ ;
⑧ _____________________ ;
⑨ _________________ ;
⑩ __________________________ ;
_________________________________________ ;
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
__________________________ ;
___________________________________________。
3NO2+H2O===2HNO3+NO
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3.硅及其重要化合物之间的转化
完成下列序号表示的化学方程式:
⑤ _______________________ ;
⑥ ________________________;
⑦ _________________________;
⑧ ____________________________ ;
⑨ _____________________________________________________ ;
_________________________________________________________
________________ 。
SiO2+4HF===SiF4↑+2H2O
SiO2+2NaOH===Na2SiO3+H2O
Na2SiO3+2HCl===H2SiO3↓+2NaCl或Na2SiO3+CO2+H2O===
Na2CO3+H2SiO3↓
跟踪训练
1.(2023·山西大同一中月考)下列说法不正确的有几个
①铁与氯气反应生成氯化铁,则铁与硫反应生成硫化铁
②氨气催化氧化制备硝酸属于氮的固定
③保存氢氟酸可用玻璃瓶,但不能用玻璃塞
④氨易液化,汽化时要吸收大量的热,因此可用作制冷剂
⑤高纯硅可用于制作光导纤维
⑥硅酸钠的水溶液可以用作黏合剂和防火剂
A.3 B.4 C.5 D.6
√
①铁与氯气反应生成氯化铁,但铁与硫反应生成硫化亚铁,故错误;
②氮的固定是指将大气中游离态的氮转化为氮的化合物的过程,故错误;
③保存氢氟酸不可用玻璃瓶,也不能用玻璃塞,故错误;
④氨易液化,汽化时要吸收大量的热,因此可用作制冷剂,正确;
⑤制作光导纤维的是二氧化硅,故错误;
⑥硅酸钠的水溶液可以用作黏合剂和防火剂,正确。
跟踪训练
2.(2022·山东烟台高一期末)如图是N、S及其化合物的“价—类”二维图,下列说法正确的是
A.在一定条件下,a可将c、d还原为b
B.c′使品红褪色的原理与HClO的漂白原
理相同
C.a与浓e、a′与浓e′均能发生氧化还原反应
D.常温下,Fe与浓e和浓e′均不反应
√
根据图示,a为NH3、b为N2、c为NO、d为NO2、e为HNO3;a′为H2S、b′为S,c′为SO2,d′为H2SO3、e′为H2SO4,据此解答。a为NH3、b为N2、c为NO、d
为NO2,根据化合价以及氧化还原规律,一定条件下,a可将c、d还原为b,A正确;
c′使品红褪色的原理为与有色物质生成不稳定的无色物质,HClO的漂白原理为将有色物质氧化为无色物质,原理不相同,B错误;
氨气和浓硝酸不能发生氧化还原反应,H2S可以和浓硫酸发生氧化还原反应,C错误;
常温下,Fe遇浓硝酸和浓硫酸会发生钝化反应,阻止反应进一步进行,不是不反应,D错误。
突破二 无机框图推断题解题技巧
1.解题方法
2.常用“突破口”
(1)物质的颜色
淡黄色固体—___、______;红棕色粉末—______;
红褐色沉淀—________;蓝色沉淀—________;
黑色固体—Fe3O4、CuO等;红色溶液—Fe(SCN)3;
红棕色气体—____;黄绿色气体—____。
S
Na2O2
Fe2O3
Fe(OH)3
Cu(OH)2
NO2
Cl2
(2)常见物质检验的现象
①焰色试验:钠为_____、钾为_____(透过蓝色钴玻璃)。
②Fe2+遇碱出现沉淀颜色变化:_____________________;Fe3+遇SCN-显_____,遇碱生成_______沉淀。
③高中阶段所学的气体中溶于水显碱性的只有_____;在空气中迅速由无色变为红棕色的气体只有____。
④能与盐酸、稀硫酸作用产生有刺激性气味的无色气体,且该气体能使溴水、品红溶液、酸性高锰酸钾溶液褪色的一般为含____或_____的物质。
黄色
紫色
白色→灰绿色→红褐色
红色
红褐色
氨气
NO
(3)物质的特殊性质
①能使品红溶液褪色的气体:____(加热后品红溶液又恢复红色)、___(加热后品红溶液不恢复红色)。
②使湿润的红色石蕊试纸变蓝的气体:____。
③使湿润的淀粉 KI试纸变蓝:NO2、___、Br2、 FeCl3溶液等。
④能与SO2、Cl2、O2等气体(或其水溶液)反应析出淡黄色沉淀:H2S。
⑤在一定条件下具有漂白性的物质:Na2O2、_____、SO2、氯水、活性炭等。
⑥___可作半导体材料,_____可制作光导纤维。
⑦与水反应放出气体的物质:___、K、Na2O2等。
SO2
Cl2
NH3
Cl2
H2O2
Si
SiO2
Na
(4)熟悉重要无机物转化关系的常考形式
①“ ”
跟踪训练
1.如图为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。下列关于甲、乙、丙、丁的判断不正确的是
A.甲只具有还原性
B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性
D.丁为黄色或淡黄色固体
√
甲、乙、丙、丁分别为H2S、SO2、SO3、S。H2S中-2价的S只有还原性,但其中的H为+1价,具有氧化性,如H2S与活泼金属反应可表现出氧化性,A项错误;
SO2中的S为+4价,处于S的中间价态,C项正确;
单质S为黄色或淡黄色固体,D项正确。
跟踪训练
2.A、B、C、D均为中学化学常见的纯净物,A是单质,它们之间有如图的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:
______________________________________
__________。
漂白、防腐、作为生产硫酸的原料等(任写两个即可)
跟踪训练
(2)若B是气态氢化物,C、D是氧化物且会造成光
化学烟雾污染。B与C在一定条件下反应生成的A
是大气的主要成分,写出该反应的化学方程式:
_____________________________。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应时通入过量的一种能引起温室效应的主要气体。判断单质A的元素在周期表中的位置:_________________。
第三周期第ⅢA族
跟踪训练
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,
两种物质中除钠、氧外的元素为同一主族,且溶
液均显碱性,写出②反应的化学方程式:
________________________________,D的化学式是_______。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于刻蚀印刷铜电路板,写出该反应的离子方程式:_________________________。
Si+2NaOH+H2O===Na2SiO3+2H2↑
Na2CO3
Cu+2Fe3+===Cu2++2Fe2+
返回
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
